微生物学检验(第3版)葡萄球菌微生物设计性实验共40页文档
- 格式:ppt
- 大小:3.19 MB
- 文档页数:40

青岛农业大学兽医微生物实验报告题目:葡萄球菌和链球菌的分离鉴定姓名:阿芳学院:动物科技学院专业:动物科学班级: 201X级X班学号:(201XXXXX)指导教师:任慧英完成日期 2014年3月22日葡萄球菌和链球菌的分离鉴定摘要目的:对实验提供的A、B两种细菌进行分离鉴定。
主要方法:通过对细菌的分离培养,形态的观察以及生化反应的现象等方法进行鉴定。
关键词:葡萄球菌;链球菌;分离鉴定引言1葡萄球菌是一群革兰氏阳性球菌,因常堆聚成葡萄串状,故名。
多数为非致病菌,少数可导致疾病。
葡萄球菌是最常见的化脓性球菌。
无鞭毛,无荚膜,不产生芽胞,营养要求不高,在普通培养基上生长良好,在含有血液和葡萄糖的培养基中生长更佳,需氧或兼性厌氧,少数专性厌氧。
28~38℃均能生长,致病菌最适温度为37℃,PH为4.5~9.8,最适为7.4。
在琼脂平板上形成圆形凸起,边缘整齐,表面光滑,湿润,不透明的菌落。
葡萄球菌在血琼脂平板上形成的菌落较大,有的菌株菌落周围形成明显的完全透明溶血环(β溶血),也有不发生溶血者。
多数葡萄球菌能分解葡萄糖、麦芽糖和蔗糖,产酸不产生气。
致病性菌株能分解甘露醇。
葡萄球菌在自然界中分布很广,健康禽类的皮肤、羽毛、眼睑、粘膜、肠道等都有葡萄球菌存在。
链球菌是化脓性球菌的另一类常见的细菌,常排列成链状,无芽胞,无鞭毛,有菌毛样结构,革兰氏染色阳性。
需氧或兼性厌氧,有些为厌氧菌。
营养要求较高。
普通培养基中需加有血液、血清、葡萄糖等才能生长。
最适温度37℃,最适PH7.4~7.6,血琼脂平板上形成灰白色、有乳光、表面光滑、边缘整齐、直径0.5—0.75mm的细小菌落,不同菌株有不同溶血现象。
根据在血琼脂培养基上的溶血特征可分为三种不同类型:α型溶血性链球菌又称草绿色链球菌,菌落周围出现草绿色溶血环,致病力弱。
β型溶血性链球菌产生强烈的溶血毒素,在血琼脂培养基上,可使菌落周围出现宽2~4毫米、界限分明、无色透明的溶血环,致病力强。
实验一葡萄球菌属的检验金黄色葡萄球菌(以下简称金葡菌)在食品污染病例中占据十分重要的位置,同时也是医院临床感染导致肺炎及伤口感染的主要病原菌,占医院感染病例的l0%;而抗生素的广泛应用导致了耐药菌株尤其是耐甲氧西林葡萄球菌的大量出现,使其成为与艾滋病、乙型肝炎并列的世界三大感染顽疾。
因此对金葡菌的检测研究一直以来备受重视,其研究方向主要集中在两个方面:耐甲氧西林金葡菌的检测及产致病性毒素金葡菌的检测。
传统的检测方法先做选择性培养,然后做鉴定试验,包括血浆凝固酶试验、免疫学试验、耐热核酸酶活性试验及各种糖、醇发酵试验及新生霉素敏感试验等,其优点是操作简便,所需设备简单,但一般都存在耗时长、灵敏性差等缺点,且Baird-Parker选择性培养时无法识别受热处理而损伤的菌体;凝固酶试验及耐热核酸酶试验与传统的经典方法有很好的对应性,但一些凝固酶及耐热核酸酶阴性菌同样可以产生致病性毒素,或其他少数葡萄球菌也可以产生耐热核酸酶或相似酶而导致假阳性,一定程度上限制了酶活性检测的应用;成品凝集检测试剂盒虽有很好的特异性,但在实际样品的检测时灵敏性差异明显,且成本较高。
随着分子生物学技术的广泛应用,对金葡菌的检测也从传统方法过渡到以PCR及杂交探针、基因芯片为主的现代技术手段,从基因水平更准确、灵敏地检测病原菌的存在。
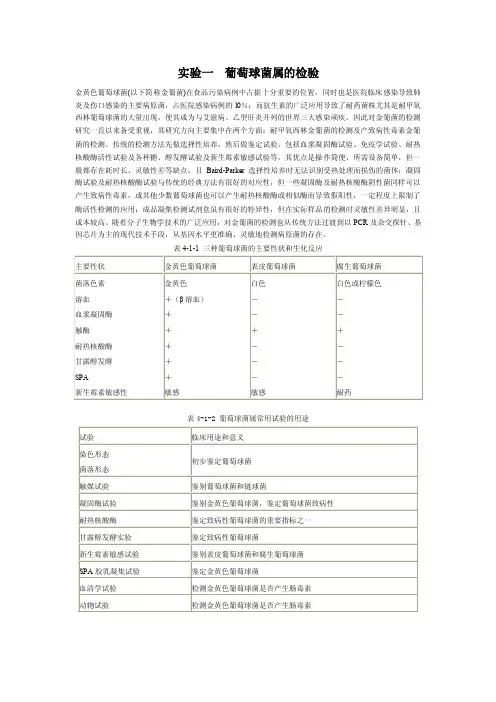
表4-1-1 三种葡萄球菌的主要性状和生化反应表4-1-2 葡萄球菌属常用试验的用途【实验目的】1. 熟悉葡萄球菌的形态、染色及培养特征。
2. 掌握葡萄球菌血浆凝固酶试验的原理、方法和临床意义。
3. 了解葡萄球菌肠毒素的测定。
【实验器材和材料】1. 菌种金黄色葡萄球菌A TCC25923、表皮葡萄球菌、腐生葡萄球菌液体培养物(接种用、新生霉素试验用、肠毒素试验用)、沸水浴加热灭活的三种菌液1滴/组(耐热核酸酶试验用)2. 培养基普通琼脂平板、血琼脂平板、甘露醇发酵管甲苯胺蓝核酸琼脂、10g/L盐水琼脂、液体培养基(肠毒素试验用)3. 试剂新鲜兔血浆或人血浆、3%H2O2、致敏胶乳试剂、新生霉素纸片、生理盐水、载玻片、小试管、革兰染色液、肠毒素血清、标准抗毒素血清4. 接种环、打孔器、尺子5. 沸水浴6. 投影仪【方法和步骤】1. 划线接种:用接种环将三种葡萄球菌分别划线接种普通平板和血琼脂平板。

1. 掌握葡萄球菌的检验方法。
2. 了解葡萄球菌的生物学特性及致病性。
3. 培养无菌操作技能,提高实验操作能力。
二、实验原理葡萄球菌是一类革兰氏阳性球菌,广泛存在于自然界及人体皮肤、黏膜等部位。
其中,金黄色葡萄球菌是引起人类感染的重要病原菌之一,可引起多种局部和全身感染。
本实验通过对葡萄球菌的分离、培养、鉴定和计数,了解其生物学特性及致病性。
三、实验材料1. 实验动物:小白鼠2. 实验仪器:显微镜、培养皿、培养箱、培养瓶、灭菌锅、试管、无菌水、葡萄球菌标准菌株等3. 实验试剂:葡萄球菌检验试剂盒、氯化钠、肉汤、胰酪胨大豆肉汤、兔血浆、细菌培养箱等四、实验方法1. 样品采集:取小白鼠血液、尿液、粪便等样品。
2. 样品处理:将样品进行无菌操作处理,制成1:10样品混悬液。
3. 分离培养:将样品混悬液接种于葡萄球菌检验试剂盒中的血平板和Baird-Parker平板,置于36±1℃培养箱中培养24小时。
4. 菌落观察:观察血平板和Baird-Parker平板上的菌落特征,记录金黄色、白色或柠檬色菌落。
5. 革兰氏染色:挑取金黄色、白色或柠檬色菌落进行革兰氏染色,观察菌体形态。
6. 血浆凝固酶试验:将金黄色葡萄球菌培养物与兔血浆混合,观察凝固现象。
7. 生化试验:进行触酶试验、葡萄糖发酵试验等,观察生化反应结果。
8. 计数:根据平板菌落数进行葡萄球菌计数。
1. 菌落观察:血平板和Baird-Parker平板上观察到金黄色、白色或柠檬色菌落。
2. 革兰氏染色:金黄色葡萄球菌呈革兰氏阳性球菌,排列成葡萄串状。
3. 血浆凝固酶试验:金黄色葡萄球菌与兔血浆混合后,出现凝固现象。
4. 生化试验:金黄色葡萄球菌触酶试验阳性,葡萄糖发酵试验阳性。
5. 计数:葡萄球菌计数为每克样品含10^6 CFU。
六、实验分析1. 金黄色葡萄球菌为革兰氏阳性球菌,排列成葡萄串状,与实验结果相符。
2. 血浆凝固酶试验阳性,表明金黄色葡萄球菌具有致病性。

竭诚为您提供优质文档/双击可除葡萄球菌实验报告篇一:微生物实验报告xxx农业大学兽医微生物学实验报告葡萄球菌和链球菌的分离鉴定姓名_________学号_________专业班级_________指导教师_________葡萄球菌和链球菌的分离鉴定摘要目的:对A.b两种菌种进行分离鉴定主要方法:通过分离培养形态观察生化试验进行鉴定关键词葡萄球菌链球菌分离鉴定引言葡萄球菌,属微球菌科葡萄球菌属,革兰氏阳性菌。
对生长环境要求不高在普通培养基上生长良好,需氧或碱性厌氧,最适培养温度为37摄氏度。
最适ph7.4.在普通培养基上形成湿润光滑隆起边缘整齐的圆形菌落。
多数菌株能分解葡萄糖乳糖麦芽糖蔗糖,产酸不产气;致病菌株可以分解甘露糖,还可以产生血浆凝固酶。
有致病性的葡萄球菌主要是金黄色葡萄球菌,致病性葡萄球菌的鉴定可通过色素颜色,溶血性,过氧化氢酶实验(触酶试验),凝固酶实验,甘露糖发酵试验等鉴定链球菌,革兰氏阳性菌,老龄菌或被吞噬的的细菌或呈现阴性。
呈圆形或卵圆形,直径为0.5~1.0微米,常呈链状或成双排列。
一般致病性链球菌的链比非致病性的链长。
个别菌株有鞭毛,有的菌株有菌毛,幼龄培养物可形成荚膜。
大多数为兼性厌氧菌,少数为厌氧菌。
致病菌对营养要求比较高,普通培养基中生长不良。
在加入血液血清葡萄糖等的培养基中生长良好。
在血琼脂平板上可长成直径约0.1~1.0mm,灰白色表面光滑,边缘整齐的小菌落.多数致病菌落可形成溶血现象.强致病菌可形成β溶血.产生α溶血环的链球菌致病性不强,为条件致病菌.γ型溶血菌落周围无溶血现象,一般不治病.1.材料与方法1.1材料1.1.1两种未知的实验菌种A菌b菌1.1.2培养基的制作材料(1)药品牛肉膏蛋白胨nacI琼脂0.1mol/L和1mol/Lnaoh溶液,0.1mol/L和1mol/LhcI溶液。
(2)仪器天平或台秤,高压蒸汽灭菌器。
(3)玻璃器材移液管试管烧杯量筒锥形瓶培养皿玻璃漏斗。



实验5 金黄色葡萄球菌的检验1 目的和要求(1)掌握金黄色葡萄球菌的检验方法(2)了解金黄色葡萄球菌各检验步骤的依据及原理2 基本原理金黄色葡萄球菌进入人体内,可引起局部的痈疾和蜂窝组织炎,还可以引起肺炎、心肌炎、骨骼炎、肾盂肾炎等系统化脓性感染,甚至可发展成败血症。
此外,食品中生长金黄色葡萄球菌是食品卫生中的一种潜在危险,因为金黄色葡萄球菌在是中会产生肠毒素,食用后将引起食物中毒,这在我国细菌性食物中毒事件中,仅次于沙门氏菌和副溶血弧菌。
因此,检验食品中金黄色葡萄球菌是实际意义。
绝大多数金黄色葡萄球菌在血琼脂平板上产生金黄色色素,菌落周围有透明的溶血圈,在厌氧条件下能分解甘露醇产酸,产生血浆凝固酶和耐热的DNA酶。
3 实验材料3.1 检样乳与乳制品(如奶粉、消毒乳)、肉制品、饮料3.2 菌种金黄色葡萄球菌、藤黄八叠球菌斜面培养物。
3.3 培养基 7.5%氯化钠肉汤、肉浸液肉汤、血琼脂平板、Baird-Parker氏培养基3.4 试剂与染色剂无菌生理盐水、兔血浆、革兰氏染色液等。
3.5 仪器与其他用具无菌吸管(1mL、5、10)、无菌试管、载玻片、接种环、酒精灯、显微镜、均质器、恒温箱等。
4 检样程序5 操作步骤5.15.1.1样品的处理称取 25 g 样品至盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌均质杯内,8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌均质袋中,用拍击式均质器拍打 1 min~2 min。
若样品为液态,吸取 25 mL 样品至盛有225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀。
5.1.2 增菌和分离培养5.1.2.1 将上述样品匀液于 36 ℃±1 ℃培养 18 h~24 h。




金黄色葡萄球菌实验报告篇一:微生物实验报告细菌微生物实验报告题目年级专业实验者学号小组成员指导老师一、实验目的脓汁和粪便标本中病原菌的检测 XX 级临床医学八年制1.了解细菌生长的基本营养条件,熟悉培养基的类型,学习并掌握培养基的原则与方法。
2.掌握无菌操作技术,掌握病原菌的分离与培养方法。
3.了解并比较细菌在固体、半固体和液体培养基的生长特征。
4.学习并掌握空气及人体细菌检测学方法。
5.掌握细菌涂片标本的制备以及革兰染色法,熟悉不同类型细菌的基本形态。
6.掌握糖发酵实验、抗菌素敏感性实验和血浆凝固酶实验的原理与方法。
7.从脓汁和粪便标本中分离培养和检测出病原体。
二、实验器材1.培养基的制备:干粉培养基、天平、蒸馏水、称量皿、药勺、锥形瓶、量筒、电炉、试管、洗耳球、试管筐、移液管、棉塞、牛皮纸、橡皮筋、手套、石棉网2.空气与人体体表细菌学检查:琼脂培养基、酒精、碘酒3.细菌的分离培养:脓汁标本、粪便标本、伊红美蓝平板、营养琼脂平板、接种环、酒精灯、打火机4.细菌的纯培养:接种环、酒精灯、打火机、中性笔、斜面培养基5.细菌的形态学检测:斜面培养物、营养肉汤、生理盐水、镜油瓶、拭镜纸、吸水纸、载玻片、显微镜、接种环、酒精灯、打火机、中性笔、革兰染色试剂、液体培养基6.细菌的生化试验:葡萄糖发酵管、乳糖发酵管、接种针、酒精灯、打火机、中性笔、菌液、营养琼脂平板、接种环、药物纸片(青霉素、庆大霉素、头孢曲松)、玻片、兔血浆、生理盐水7.细菌的血清学试验:玻片、福氏志贺菌诊断血清、生理盐水、接种环、酒精灯三、实验方法与步骤1.培养基的制备称量琼脂粉→蒸馏水→加热溶化→分装→集中放在试管筐里→罩上硫酸纸、牛皮纸→用橡皮筋扎好→放入讲台边的灭菌桶或灭菌筐内→送到高压蒸汽灭菌室(洗刷室)→灭菌2.空气与人体体表细菌学检查2.1空气的细菌学检查每组1个营养琼脂平板,选择实验楼女厕所→将平板盖打开,盖朝下放置在平板旁边→平板暴露于空气中15分钟→平板倒扣盖上→作标记→37℃温箱培养24小时→观察结果。