高考化学海水资源的开发利用
- 格式:docx
- 大小:140.35 KB
- 文档页数:14





一、海水水资源的利用1.途径:主要包括海水淡化和直接利用海水进行循环冷却等。
2.海水淡化的方法:________法、________法、________法等。
【答案】蒸馏 电渗析 离子交换二、海水中化学资源的利用海水中含量最多的为O 、H 两种元素,还有Cl 、Na 、Mg 、S 、Ca 、K 、Br 、C 、Sr 、B 、F 等11种元素,其总含量超过99%,其他为微量元素。
1.海水制盐2.海水提镁工艺流程步骤及制石灰乳:_________________________________________________________第26讲 海水资源的开发利用知识导航知识精讲反应原理 沉淀Mg 2+:________________________________________________________ 酸化,制备MgCl 2:Mg(OH)2+2HCl===MgCl 2+2H 2O 蒸发浓缩、冷却结晶、析出MgCl 2·6H 2O在氯化氢气流中使MgCl 2·6H 2O 脱水制得无水氯化镁电解法制备镁:_____________________________________________________【答案】CaCO 3=====高温CaO +CO 2↑,CaO +H 2O===Ca(OH)2 Mg 2++2OH -===Mg(OH)2↓ MgCl 2(熔融)=====电解Mg +Cl 2↑ 3.海水提溴4.海带提碘(1)海带提碘的工艺流程:氧化的方程式为:______________________________ 【答案】2H ++2I -+H 2O 2===I 2+2H 2O(2)海带中碘元素的检验三、海水资源的其他利用1.从海水中提取铀和重水,用于核能开发。
2.开发潮汐能、波浪能等新型能源。
经典例题题型一:海水资源概述【变1】海洋又被称为绿色宝库,下列关于海洋的说法正确的是A.海洋约占地球表面积的71%B.海水中元素仅为有限的十几种C.蒸馏是海水淡化的唯一方法D.海水因有腐蚀性而不能冷却循环使用【答案】A【解析】A. 海洋约占地球表面积的71%,故A正确;B.海水中的元素总计含有80多种,B项错误;C.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,C项错误;D.海水水资源的利用,主要包括海水的淡化和直接利用海水进行循环冷却等,D项错误。

第2课时海水资源的开发利用[学习目标定位] 1.知道海水淡化的意义和方法。
2.熟知从海水中提取溴、碘、金属镁的原理。
3.会写相关反应的化学方程式。
一、海水水资源的利用及溴、碘的提取1.海水水资源的利用:主要包括海水的淡化和直接利用海水进行循环冷却等。
通过从海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
其中蒸馏法的历史最久,技术和工艺也比较成熟,但成本较高。
因此,海水淡化与化工生产结合、与能源技术结合,成为海水综合利用的重要方向。
2.某同学从科普书中摘录了从海水中提取溴的方法,请仔细阅读,然后回答问题。
在海水中溴以溴化镁和溴化钠的形式存在。
经过晒盐后的卤水中,溴的含量提高了100倍左右。
只要把卤水加入反应塔中,通过氯气和水蒸气蒸馏,就可以把“溴”蒸出来。
也有借助煤油从海水中提取溴的,煤油用过之后,还可以回收。
土法提取溴可用浓盐酸作用于漂白粉或用二氧化锰氧化浓盐酸制取氯提取溴。
(1)从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。
其流程为(2)卤水中通入Cl2时发生反应的离子方程式为2Br-+Cl2===Br2+2Cl-。
(3)通过水蒸气就可把溴蒸出来的原因是溴单质易挥发。
(4)借助煤油从海水中提取溴是利用了溴易溶于有机溶剂的性质。
3.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。
从海藻中提取碘的实验流程如图所示:(1)指出提取碘的过程中有关的实验操作名称:①______;写出过程②中有关反应的化学方程式:________________________________________________________________________ ________________________________________________________________________。
(2)提取碘的过程中可选用的有机试剂为________(填字母)。


海水资源的开发利用环境保护与绿色化学1.下列有关环境问题的叙述正确的是( )A.赤潮、白色污染、绿色食品都与相关物质的颜色有关B.地震发生后,灾区急需大量消毒剂,其中SO2可用于环境消毒C.在空气质量日报中CO2含量属于空气污染指数D.我国禁止汽车使用含铅汽油,其主要原因是铅对环境有污染解析:绿色食品是指无公害、无污染的食品,与颜色无关,A错误;SO2可以消毒,但是用于环境消毒会产生新的污染,B错误;目前我国空气质量日报中CO2含量不属于空气污染指数,C错误。
答案:D2.下面化学反应原子利用率达到100%的是( )A.用NaOH溶液吸收CO2B.一定条件下,将Cl2通入浓缩的海水中,生成Br2C.乙烯聚合为聚乙烯D.NO2溶于水解析:2NaOH+CO2===Na2CO3+H2O,原子利用率不是100%,A错误;Cl2通入浓缩的海水中,生成Br2是置换反应,原子利用率不是100%,B错误;乙烯聚合为聚乙烯,原子利用率100%,C正确;3NO2+H2O===2HNO3+NO,原子利用率不是100%,D错误。
答案:C3.是指大气中直径小于或等于微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,是雾霾天气的主要原因,它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等,下列与相关的说法不正确的是( )A.大力发展电动车、减少燃油汽车的尾气排放量B.开发利用各种新能源、减少对化石燃料的依赖C.多环芳烃是强致癌物,能吸附在的表面进入人体D.含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素解析:主要来自化石燃料的燃烧,可大力发展电动车、减少燃油汽车的尾气排放量,开发新能源、减少对化石燃料的依赖,故A、B正确。
与肺癌等疾病的发生密切相关,故C正确。
砷是非金属元素,故D错误。
答案:D4.2018年世界环境日中国主题为“美国中国,我是行动者”,下列行为不利于遏制污染的是( )A.发展风能和太阳能等清洁能源,减少使用化石燃料B.扩建小型钢铁厂、水泥厂,提高钢铁、水泥的产量C.推广机动车用天然气代替汽油、柴油的“油改气工程”D.研发可降解的聚碳酸酯代替聚乙烯作一次性塑料袋的生产原料解析:小型钢铁厂、水泥厂、电厂等综合利用困难,能耗大、排放污染物多。
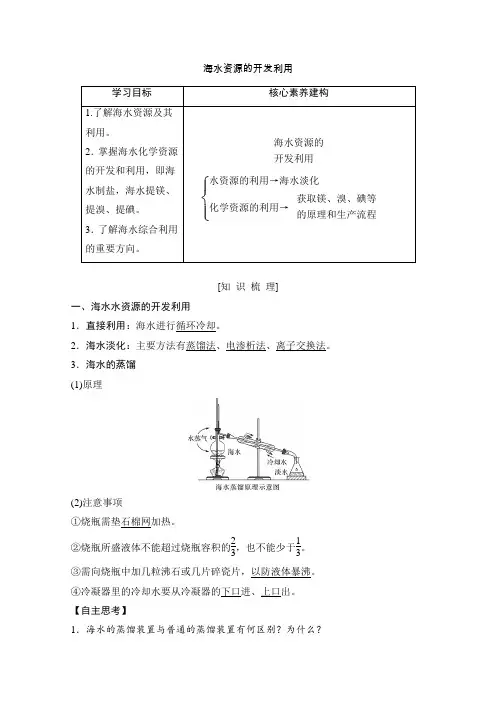
海水资源的开发利用学习目标核心素养建构1.了解海水资源及其利用。
2.掌握海水化学资源的开发和利用,即海水制盐,海水提镁、提溴、提碘。
3.了解海水综合利用的重要方向。
海水资源的开发利用⎩⎪⎨⎪⎧水资源的利用→海水淡化化学资源的利用→获取镁、溴、碘等的原理和生产流程[知识梳理]一、海水水资源的开发利用1.直接利用:海水进行循环冷却。
2.海水淡化:主要方法有蒸馏法、电渗析法、离子交换法。
3.海水的蒸馏(1)原理(2)注意事项①烧瓶需垫石棉网加热。
②烧瓶所盛液体不能超过烧瓶容积的23,也不能少于13。
③需向烧瓶中加几粒沸石或几片碎瓷片,以防液体暴沸。
④冷凝器里的冷却水要从冷凝器的下口进、上口出。
【自主思考】1.海水的蒸馏装置与普通的蒸馏装置有何区别?为什么?提示 因为海水蒸馏得到的是淡水,水的沸点为100 ℃(常压下)无需用温度计,因此可不用蒸馏烧瓶,而换为圆底烧瓶。
二、海水化学资源的开发利用1.海水中的化学资源海水中H 、O 两种元素,加上Cl 、Na 、K 、Ca 、Mg 、S 、C 、F 、B 、Br 、Sr 等11种元素的总量超过99%,其他为微量元素,共计含有80多种。
2.海水制盐海水――→日晒结晶粗盐――→提纯精盐。
3.海带提碘(1)流程:海带―→灼烧―→浸泡―→过滤――→Cl 2氧化―→提纯―→碘单质。
(2)原理:2I -+Cl 2===I 2+2Cl -。
4.海水提溴(1)过程:浓缩―→氧化―→富集―→提取。
(2)原理:2Br -+Cl 2===Br 2+2Cl -。
5.海水提镁(1)过程:浓缩――→CaO 沉淀―→过滤――→盐酸溶解―→结晶(MgCl 2·6H 2O)――→脱水MgCl 2晶体――→电解金属镁。
(2)原理:①Mg 2++2OH -===Mg(OH)2↓。
②Mg(OH)2+2HCl===MgCl 2+2H 2O 。
③MgCl 2·6H 2O=====HCl △MgCl 2+6H 2O 。
高中化学必修课---海水资源的开发利用知识讲解及巩固练习题(含答案解析)【学习目标】1、了解海水资源及其开发利用的主要方法;2、掌握从海水中提取溴和碘的化学反应原理和实验方法;3、认识开发利用海水资源所带来的环境问题和预防措施。
【要点梳理】要点一、海水的淡化水是生命之源,世界上缺水的地区越来越多,水荒目前已成为世界性的问题,是制约社会进步和经济发展的瓶颈。
海水淡化已成为获得淡水资源重要的途径。
海水利用包括海水直接利用、海水淡化和海水综合利用,以及海水农业等。
海水淡化是海水利用的重点。
要点诠释:海水淡化的方法主要有:(1)蒸馏法:把海水烧到沸腾,水蒸发为蒸汽,盐留在锅底,蒸汽冷凝为蒸馏水,即是淡水。
这种古老的海水淡化方法,消耗大量能源,产生大量锅垢,很难大量生产淡水。
现代多级闪急蒸馏淡化使古老的蒸馏法焕发了青春。
水在常规气压下,加热到100℃才沸腾成为蒸汽。
如果使适当加温的海水进入真空或接近真空的蒸馏室,便会在瞬间急速蒸发为蒸汽。
利用这一原理,做成多级闪急蒸馏海水淡化装置。
此种淡化装置可以造得比较大,真空蒸发室可以造得比较多,连接起来,成为大型海水淡化工厂。
这种淡化工厂,可以与热电厂建在一起,利用热电厂的余热加热海水。
水电联产,可以大大降低生产成本。
现行大型海水淡化厂,大多采用此法。
如果太阳能蒸发淡化法能够投入实用,古老的蒸馏淡化技术又会上一个节能的新台阶。
海水蒸馏原理示意图(2)电渗析法:使用一种特别制造的薄膜来实现。
在电力作用下,海水中盐类的阳离子穿过阳膜跑向阴极方向,不能穿过阴膜而留下来;阴离子穿过阴膜跑向阳极方向,不能穿过阳膜而留下来。
这样,盐类离子被交换走的管道中的海水就成了淡水,而盐类离子留下来的管道里的海水就成了被浓缩了的卤水。
(3)反渗透法:使用的薄膜叫“半透膜”,半透膜的性能是只让淡水通过,不让盐分通过。
如果不施加压力,用这种膜隔开咸水和淡水,淡水就自动地往咸水那边渗透。
我们通过高压泵,对海水施加压力,海水中的淡水就透过膜到淡水那边去了,因此叫做反渗透。
《海水的开发和利用》教案【教材分析】本节内容为学生从学科知识的角度将前面所学的知识和技能进行梳理、归纳和拓展,并应用所学知识来解决实际问题。
要求学生了解海水的淡化、混合物的分离与转化的方法,注重理论联系实际,进一步提高学生运用化学知识与方法解决实际问题的能力。
【教学目标】1、了解海水资源的大概情况,掌握海水淡化的三种方法,知道从海水中提取溴和碘的原理。
2、通过海水资源的综合利用的过程,了解化学方法在实际物质间转化中的作用,初步形成对低浓度物理提取的方法。
3、进一步形成资源意识、环保意识可可持续发展意识。
【教学重点】海水的淡化,从海水提取溴和碘。
【教学难点】海带中碘的提取。
【教学准备】干海带、酒精、坩埚、烧杯、蒸馏装置、酒精灯、3molL的硫酸、3%H2O2、CCl4【板书】一、海洋资源的利用〖阅读〗90页中间部分,然后回答下列问题:1、海水的总质量大约是多少?占地球总水量多少?【解析】海水总质量1.3×109亿吨,约占地球水的总质量的97%。
但海水不能饮用或灌溉。
2、海水资源的利用主要包括哪些?【解析】海水资源的利用主要包括两个方面:一是海水的淡化,二是直接利用海水进行循环冷却。
3、海水的淡化有哪些方法?各有什么优缺点?【解析】海水淡化的主要方法有三种:蒸馏法、电渗析法、离子交换法。
(1)蒸馏法历史悠久,技术和工艺比较成熟,不足是加热需要大量的能源,成本高。
(2)离子交换膜是一种功能性膜,分为阴离子交换膜和阳离子交换膜,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过,这就是离子交换膜的选择透过性。
离子交换法得到的水中仍然有某些离子,只是某些离子被除去。
优点:离子交换膜可以再生重复使用,成本低。
(3)电渗析法是在外加电场的的作用下,水溶液中的阴,阳离子会分别向阳极和阴极移动,中间再加上一种离子交换膜,就可能达到分离浓缩的目的。
优点是得到水的纯度较高。
4、海水蒸馏原理示意图中有哪些仪器?实验操作时要注意什么问题?【解析】蒸馏的主要仪器有:蒸馏烧瓶、冷凝管、温度计、酒精灯、尾接管、锥形瓶、铁架台等。
海水资源的开发利用环境保护和绿色化学一、考点、热点回顾一、海水资源的开发利用 1. 水资源的利用2. 海水化学资源的开发利用(1)氯碱工业海水―→粗盐――→精制饱和食盐水――→电解⎩⎪⎨⎪⎧阳极产物:Cl 2阴极产物:H 2、NaOH①电解NaCl 溶液:(写出化学方程式,下同)。
②产物制盐酸:H 2+Cl 2=====点燃2HCl 。
③制漂白液: 。
(2)溴的提取①工艺流程②基本步骤及主要反应a. 浓缩:海水晒盐和海水淡化的过程中Br -得到浓缩。
b. 氧化:向浓缩的海水中通入Cl 2,将Br -氧化为Br 2,反应的离子方程式为: 。
c. 富集:利用溴的挥发性,通入热空气或水蒸气,吹出的溴蒸气用SO 2吸收。
反应的化学方程式为:d. 提取:再用Cl 2将HBr 氧化得到产品溴: 。
(3)碘的提取①海带中含有碘元素的检验a. 反应原理:2H ++2I -+H 2O 2===I 2+2H 2O b. 实验步骤及证明方法②海带中提碘 a. 工艺流程干海带――→灼烧海带灰――→浸泡悬浊液――→过滤含I -的溶液――→适量Cl 2含I 2的溶液――→加CCl 4萃取、分液碘的有机溶液――→蒸馏晶体碘b. 两种原理主要的化学原理: 。
主要物理原理:单质碘用 萃取,分液后用 将碘与有机溶剂分开。
(4)海水中提取铀和重水可用于核能的开发利用。
提示:(1)海水中存在大量的NaCl ,可以通过蒸发的方法将NaCl 从海水中分离出来。
而含量较低的镁、溴、钾等必须经过化学反应才能得到。
(2)海水晒盐得到的是粗盐,含有Ca 2+、Mg 2+、SO 2-4等杂质,精制后得到NaCl 饱和溶液,精制时通常在其中依次加入过量的BaCl 2溶液,过量的NaOH 溶液和过量的Na 2CO 3溶液,过滤后,再加适量盐酸调节至中性即可。
二、环境保护和绿色化学 1. 环境污染 (1)环境问题主要是指由于人类不合理地开发和利用自然资源而造成的生态环境的破坏,以及工农业生产和人类生活所造成的环境污染。
课时2 海水资源的开发利用学习目标:1.了解海水淡化的方法,掌握海水蒸馏的原理。
2.掌握海水化学资源的开发和利用,即海水制盐、海水提溴、海水提碘。
3.树立资源环保意识及合理开发意识。
[自 主 预 习·探 新 知]1.海水水资源的利用(1)海水水资源的利用类型 海水水资源的利用主要包括:海水的淡化和直接利用海水进行循环冷却等。
(2)海水淡化的主要方法:蒸馏法、电渗析法、离子交换法。
(3)海水的蒸馏原理①主要仪器:A :圆底烧瓶;B :冷凝管;C :锥形瓶。
②冷凝水的流向:a 口进,b 口出。
③A 中加入碎瓷片的目的是防止海水暴沸。
④原理将海水加热,海水中的水分受热变成气态(其余成分因沸点较高,不易汽化,留在烧瓶中),经过冷凝管后又冷凝成液态水。
经过蒸馏冷凝得到的液态水即为淡水。
2.海水中的化学资源海水中H 、O 两种元素,加上Cl 、Na 、K 、Ca 、Mg 、S 、C 、F 、B 、Br 、Sr 等11种元素的总量超过99%,其他为微量元素,共计含有80多种元素。
3.海水制盐海水――→日晒结晶粗盐――→提纯粗盐――→制备电解烧碱―→纯碱。
4.海水中提取碘与溴 海水 ①流程:海带灼烧→浸泡→过滤→氧化→萃取→提纯→碘单提碘质②主要的化学原理:2I-+H2O2+2H+===I2+2H2O(写出离子方程式)海水提溴①方法:在预先经过酸化的浓缩海水中,用Cl2氧化溴离子使之成为溴单质②主要的化学原理:Cl2+2NaBr===Br2+2NaCl(1)从海水中提取铀和重水,铀和重水是核能开发的重要原料。
(2)潮汐能、波浪能是待开发的新型能源。
[基础自测]1.判断对错(对的打“√”,错的打“×”)。
(1)海水中含有Br2和游离态的Na、Mg、Cu()(2)加入明矾可以淡化海水()(3)“海水晒盐”化学原理是蒸馏()(4)海水中碘可以用氧化剂氧化而得到I2()(5)海带中含有碘,能使淀粉变蓝()(6)用SO2溶液吸收溴蒸气,是利用了SO2具有漂白性()【答案】(1)×(2)×(3)√(4)√(5)×(6)×2.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:【导学号:43722221】(1)请列举海水淡化的两种方法:________、________。
第2课时海水资源的开发利用[学习目标定位]1•知道海水淡化的意义和方法。
2•熟知从海水中提取溴、碘、金属镁的原理。
3•会写相关反应的化学方程式。
新知导学新知探究点点落实一、海水水资源的利用及溴、碘的提取1•海水水资源的利用:主要包括海水的淡化和直接利用海水进行循环冷却等。
通过从海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
其中蒸馏法的历史最久,技术和工艺也比较 成熟,但成本较高。
因此,海水淡化与化工生产结合、与能源技术结合,成为海水综合利用 的重要方向。
2•某同学从科普书中摘录了从海水中提取溴的方法,请仔细阅读,然后回答问题。
在海水中溴以溴化镁和溴化钠的形式存在。
经过晒盐后的卤水中, 溴的含量提高了 100倍左右。
只要把卤水加入反应塔中, 通过氯气和水蒸气蒸馏,就可以把"溴”蒸出来。
也有借助煤油从海水中提取溴的, 煤油用过之后,还可以回收。
土法提取溴可用浓盐酸作用于漂白粉 或用二氧化锰氧化浓盐酸制取氯提取溴。
(1)从海水中提取溴,一般要经过浓缩」化和提取三个步骤。
其流程为-NaCl廿-Cb 口 热空气或水蒸气石卄… 苦凶一 漠烝气⑵卤水中通入 Cl 2时发生反应的离子方程式为2Br + Cl 2===Br 2 + 2CI 。
(3) 通过水蒸气就可把溴蒸出来的原因是溴单质易挥发。
(4) 借助煤油从海水中提取溴是利用了溴易溶于有机溶剂的性质。
碘元素以离子的形式存在。
从海藻中提取碘網诲T-P潦灼烧灰海水业3•海洋植物如海带、海澡中含有丰富的碘元素, 的实验流程如图所示:藉廉①-- Sk ■悬ill(1)指出提取碘的过程中有关的实验操作名称:① ______ ;写出过程②中有关反应的化学方程式: _______________________________________________________________________________⑵提取碘的过程中可选用的有机试剂为 ____________ (填字母)。
A •酒精、四氯化碳 B.四氯化碳、苯 C •汽油、醋酸D.汽油、甘油(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、 导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是答案 ⑴过滤 2Nal + Cl 2===2NaCI + I 2 (2)B (3)漏斗、分液漏斗归纳总结■ ----------------------------- 1•海水中制取溴主要方法:空气吹出法。
海水提溴四个过程2.海带中提碘(1)海带中含有碘元素的检测(2)海带中提碘① 流程 海带一晒干、灼烧—浸泡—过滤—氧化—提纯—碘单质② 主要的化学原理: 2H + + 2「+ H 2O 2===I 2+ 2H 2O 或 Cl 2+ 2KI===2KCI + 12。
\活学活用1.溴有“海洋元素”之称,海水中溴含量为 65 mg • —1。
在实验室模拟海水中溴的提取:实验方法:将适量新制氯水加入到20 mL 富含溴离子的海水中(海水可以用0.1 mol 1的①浴解,莹许 含]-②过歳1t H"”mq )rox]1NaBr 溶液代替),把溴置换出来。
氯水中的氯气作 __________________ 剂,涉及反应的离子方 程式为 _______________________________________________________________________________ 。
得到的单质溴可以用有机 溶剂在 ___________________ (仪器)中实现萃取富集,萃取试剂用 ____________ 、苯等,得到的有机层显 ____________ 色。
答案氧化 Cl 2+ 2Br ===2CI + Br 2分液漏斗四氯化碳橙解析 把溴离子转化为溴单质时,溴离子发生氧化反应,因此需要氧化剂,氯气可以将Br-氧化为B 「2。
根据萃取的原理,要从水溶液中萃取某种溶质,所选择的萃取剂一定要和水互不相溶。
溴单质在有机溶剂中的颜色是橙色到橙红色。
理解感悟本题考查有关海水中含有溴元素的证明和提取的实验原理、 仪器,以及萃取的实验操作等。
将非金属阴离子置换为单质要用到氧化剂,将金属阳离子置换为单质要用到还原剂,常见的氧化剂有过氧化氢、新制氯水、酸性高锰酸钾溶液等。
离,D 对。
二、从海水中提取镁 海水提镁的生产流程可表示为CaCO ;( ----- * CaO —Ca(OH)^苫卤1•海水提取镁的最基本方法是往海水中加 _______________ ,得到 _________ 沉淀,将沉淀分离出 来后再加入 ________ 把它变成 __________ ;之后,经过结晶、 ____________ 、干燥、 _________ 就可得到金属镁。
答案碱氢氧化镁盐酸氯化镁过滤电解2•海水提镁要用到海滩上的贝壳。
那么,贝壳在生产流程中起什么作用?其主要成分发生了2•从海带中提取碘的实验过程中,涉及到下列操作, 其中正确的是 答案 IAL£敢岀腆的苯瀋诫 解析 物质的灼烧应该选用耐高温的坩埚, A 错;过滤操作时,向漏斗中加液要用玻璃棒引流,B 错;碘的苯溶液在上层,应由分液漏斗的上口倒出, C 错;固液分离可以用蒸馏法分D,分离淡井画收苯B 於逹碍含薄液怎样的化学变化?答案贝壳的作用是作为制备碱的基础原料,其主要成分发生的化学变化为CaCO3===== CaO+ C02f。
3•从海水中的Mg2*到金属镁,经历了哪些化学变化(用化学方程式表示)?答案MgCb+ Ca(0H)2===Mg(0H)2J + CaC"一电解人Mg(OH)2+ 2HCI===MgCI 2+ 2出0 MgCl 2(熔融)=====Mg + Cb f4•在用上述方法提镁的过程中,采取了哪些措施来提高经济效益?这对你有什么启示?答案提高经济效益的措施,一是在主要原料地(靠海处)建厂;二是同时建造盐酸厂,充分利用电解氯化镁的副产物——氯气。
这给我们的启示是,设计工业生产要从整体出发,对各个生产要素和环境保护进行综合设计,既要提高综合经济效益,又要保护环境。
r—归纳总结----------------------------------- ,MgCl 2 6H2O加热制取无水MgCl2时,要不断通入干燥的HCI气体,防止MgCl 2水解生成Mg OH 2。
活学活用3•下表是氧化镁和氯化镁的熔、沸点数据:物质氧化镁氯化镁熔点/C 2 852714沸点/C 3 600 1 412请参考以上数据分析,从海水中提取镁,正确的方法是()一 ,NaOH 电解A. 海水--- > Mg(OH)2 --- >MgHCI 、宀、亠口亠电解B. 海水--- > MgCl 2 溶液一->MgCl 2 晶体--- > Mg石灰乳灼烧电解C. 海水--- Mg(OH)2 ---- - MgO ------ MgD. 海水一一-Mg(OH)2——-MgCl 2溶液一一流MgCl 2(熔融)一一—Mg 答案D解析本题要求学生既要知道镁是由电解熔融的MgCl 2得到,还要知道实际生产中从海水提取MgCl 2的途径及原料的合理使用(用石灰乳而不用NaOH)。
4•海水提镁的主要流程如下:下列说法正确的是()①试剂M是盐酸②流程中的反应全部都是非氧化还原反应③操作b只是过滤④用海生和辰——仃般乳水晒盐后的饱和溶液加石灰乳制 Mg (OH ) 2⑤电解熔融MgCl 2比电解熔融的MgO 制金属镁更节约能量 A. ①②③④⑤ C.④⑤ 答案 D解析 电解无水氯化镁的反应属于氧化还原反应, 因此②是错误的。
③操作b 应是结晶、过滤、干燥,因此 ③是错误的。
所以答案选 D 。
过呈 I当堂检测巩固反诜1•海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是 ( )A. 利用潮汐发电是将化学能转化为电能B. 海水蒸发制海盐的过程中发生了化学变化C. 从海水中可以得到 MgCl 2,电解熔融 MgCl 2可制备MgD. 海水中含有溴元素,只需经过物理变化就可以得到溴单质 答案 C解析 A 中,潮汐发电是将潮汐能转化为电能;B 中,海水蒸发制海盐过程中只有物理变化;D 中,海水中溴元素以溴离子 (Br 「)形式存在,要得到单质溴必须发生化学变化才能实现。
2•海水淡化可采用膜分离技术。
如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化 膜进入左侧淡水池,而海水中其他各种离子不能通过淡化膜, 从而得到淡水。
对加压后右侧海水成分变化分析正确的是 ()B.②③ D.①④⑤食盐一沦和囊盐水一W_E 业 I j达标检测厂用海水进行循蚌冷却 —蒸僭法 —擁水淡化-一电灌祈祗一离子左换法日晒IT™ — — — — rA.溶质质量增加C.溶液质量不变B. 溶剂质量减小D.溶质质量分数减小答案B3•海洋约占地球表面积的71% ,对其进行开发利用的部分流程如图所示。
F列说法错误的是A. 试剂1可以选用石灰乳B. 从苦卤中提取Br2的反应的离子方程式为2Br「+ Cl 2===2C「+ B-C. 工业上,电解熔融MgO冶炼金属镁可减小能耗D. 可用BaCl2溶液除去粗盐中的SO:答案C解析煅烧贝壳得到CaO,将CaO溶于水得到石灰乳,石灰乳和镁离子反应生成氢氧化镁沉淀,试剂1廉价且原料来源广泛,A正确;氯气能将溴离子氧化为溴单质,从苦卤中提取Br2的反应的离子方程式为2Br + Cl2===2Cl + B「2,然后采用萃取的方法从溶液中获取溴,B正确;氧化镁熔点很高,氯化镁熔点较氧化镁低,电解氧化镁冶炼镁增加成本,所以工业上采用电解熔融氯化镁的方法冶炼镁,C错误;氯化钡和硫酸根离子反应生成难溶性的硫酸钡,且氯离子不是杂质离子,D正确。
4.NaCI是从海水中提取出来的一种重要物质,除食用外,它还是一种工业原料。
下列以NaCl为原料的产品(或物质)是()①烧碱②纯碱③金属钠④氯气⑤盐酸A. ①②③④⑤B.①②③④C. ①②③⑤D.①②④⑤答案A解析从海水中得到的氯化钠,可作化工原料,工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
化学方程式分别电解一电解为2NaCl + 2H2O=====2NaOH + d +出f , 2NaCI(熔融)=====2Na + Cl2 T , NaCl + NH3, △木点燃+ 出0 + CO2===NaHCO3 J + NH4CI,2NaHCO3=====Na2CO3+ CO2T + 出0 , Cb+ 出===== 2HCl。