甘肃省酒泉三中优质教案:氧族元素
- 格式:doc
- 大小:656.00 KB
- 文档页数:3
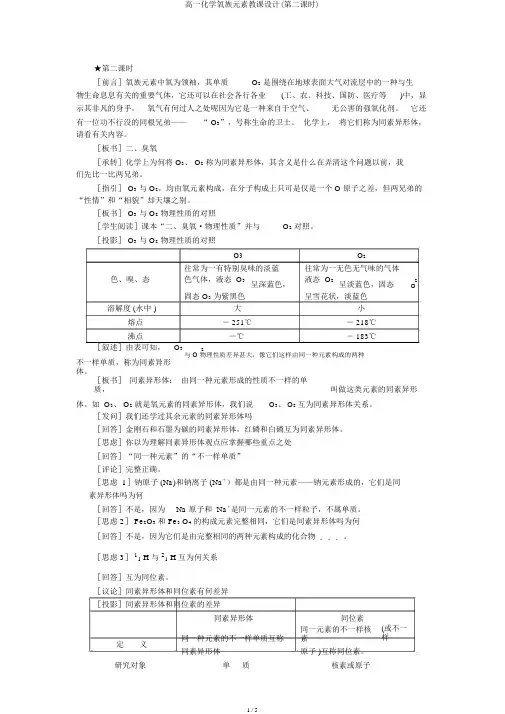
★第二课时[前言]氧族元素中氧为领袖,其单质O2是围绕在地球表面大气对流层中的一种与生物生命息息有关的重要气体,它还可以在社会各行各业(工、农、科技、国防、医疗等)中,显示其非凡的身手。
氧气有何过人之处呢因为它是一种来自于空气、无公害的强氧化剂。
它还有一位功不行没的同根兄弟——“ O3”,号称生命的卫士。
化学上,将它们称为同素异形体,请看有关内容。
[板书]二、臭氧[承转]化学上为何将 O3、 O2称为同素异形体,其含义是什么在弄清这个问题以前,我们先比一比两兄弟。
[指引] O3与 O2,均由氧元素构成,在分子构成上只可是仅是一个 O 原子之差,但两兄弟的“性情”和“相貌”却天壤之别。
[板书] O3与 O2物理性质的对照[学生阅读]课本“二、臭氧·物理性质”并与O2对照。
[投影] O3与 O2物理性质的对照O3O2往常为一有特别臭味的淡蓝往常为一无色无气味的气体色、嗅、态色气体,液态 O3呈深蓝色,液态 O2呈淡蓝色,固态2O固态 O3为紫黑色呈雪花状,淡蓝色溶解度 (水中 )大小熔点- 251℃- 218℃沸点-℃- 183℃[叙述]由表可知,O32与 O 物理性质差异甚大,像它们这样由同一种元素构成的两种不一样单质,称为同素异形体。
[板书]同素异形体:由同一种元素形成的性质不一样的单质,叫做这类元素的同素异形体。
如 O3、 O2就是氧元素的同素异形体,我们说O3、 O2互为同素异形体关系。
[发问]我们还学过其余元素的同素异形体吗[回答]金刚石和石墨为碳的同素异形体,红磷和白磷互为同素异形体。
[思虑]你以为理解同素异形体观点应掌握哪些重点之处[回答]“同一种元素”的“不一样单质”[评论]完整正确。
[思虑 1]钠原子 (Na)和钠离子 (Na+)都是由同一种元素——钠元素形成的,它们是同素异形体吗为何[回答]不是,因为Na 原子和 Na+是同一元素的不一样粒子,不属单质。
[思虑 2] Fe2O3和 Fe3 O4的构成元素完整相同,它们是同素异形体吗为何[回答]不是,因为它们是由完整相同的两种元素构成的化合物...。


课时计划化学科年月日星期一第、节[课题]:高一化学第三章硫硫酸第六节氧族元素[目的]:使学生掌握氧族元素的原子结构与其单质和化合物性质递变的规律。
[课型]:元素化合物知识课[重点]:氧族元素性质递变规律及其与原子结构的关系[教法]:比较法[复习旧课]:复习上节课所学内容,讲评作业。
[引入新课]:比较氧和硫结构的异同点,从而引入新课。
[新课]:第六节氧族元素(板书)一、氧族元素:(板书)向学生讲解氧、硫、硒、碲、钋等元素在结构和性质上有很多共同点,它们统称为氧族元素。
指导学生阅读书表氧族元素的性质,联系卤族元素的性质,进行比较学习。
二、氧族元素的性质:(板书)::::比较、、、的原子结构,结合卤素的学习,从中找出一定的规律性来学习。
通过氧族元素原子结构的特点,提出问题:氧族元素在化学性质上有什么相似性和差异性?、氧族元素的化学性质:(板书)通过原子最外层电子和化学性质的关系,比较卤素的性质,可以得出结论:氧族元素的原子最外层电子均为个,在反应中易得电子,表现出氧化性。
()化合价:(板书)氧族元素在反应中易得个电子,通常表现为价,但最外层的个电子或个电子一般也可发生偏移,生成价或价的化合物。
()气态氢化物:(板书)、和一样,也可与化合生成气态氢化物,氢化物的水溶液均显酸性,在氢化物中,它们都显价。
()最高价氧化物:(板书)、、均有二氧化物和三氧化物,在三氧化物中均显价,它们的氧化物对应的水化物均为酸。
酸性强弱:>>、氧族元素性质的递变规律:(板书)()熔点:氧<硫<硒<碲()沸点:氧<硫<硒<碲()密度:氧<硫<硒<碲()导电性:氧<硫<硒<碲()氢化物稳定性:氧>硫>硒>碲()高价含氧酸酸性:硫>硒>碲、氧族元素性质递变的原因:(板书)通过比较氧族元素和卤族元素的递变,从中得出结论:随着原子序数递增,原子半径递增,氧族元素的性质呈现递变规律。

高一化学第六章复习教案本章复习要求
1.了解氧族元素及其性质。
2.了解臭氧、过氧化氢的性质。
3.掌握二氧化硫的性质。
4.掌握硫酸的性质及硫酸根离子的鉴定。
5.常识性了解环境污染与环境保护。
教学重点:
1、氧族元素的原子结构与元素化学性质的递变规律
2、归纳总结硫及其重要化合物之间的相互转化关系。
3、硫酸根离子的检验方法。
教学难点:
硫及其重要化合物的相互转化。
课时安排:1课时
教学方法:归纳总结、练习巩固
教学过程:
一、知识点及规律:
1、氧族元素原子结构及元素性质:
2、臭氧、过氧化氢的性质。
3、硫及其重要化合物的相互转换关系:
(学生练习)
4、硫酸根离子的检验:
先加盐酸酸化(排除CO32-、SO32-、Ag+的干扰)再加BaCl2溶液。
正确的检验方法和步骤为:
将待测试液先用盐酸酸化(不宜用稀硝酸),如果试液浑浊,则静置片刻,取其清液,在其中加入BaCl2溶液,若有白色沉淀产生,则表明待测液中含有SO42-,反之则无。
如果加盐酸酸化后无浑浊现象,则在待测试液中直接加入BaCl2溶液,若产生白色沉淀,则表明待测液中含有SO42-,反之则无。
5、环境污染与环境保护:
练习:(略)。

氧族元素(第二课时)第二课时[引言]氧族元素中氧为首领,其单质02是环绕在地球表面大气对流层中的一种与生物生命息息相关的重要气体,它还能在社会各行各业(工业、农业、科技、国防、医疗等)中,显示其非凡的身手。
氧气有何过人之处呢?因为它是一种来自于空气、无公害的强氧化剂。
它还有一位功不可没的同根兄弟——“03',号称生命的卫士。
化学上,将它们称为同素异形体,请看相关内容。
[板书]一、臭氧[承转]化学上为何将03 02称为同素异形体,其含义是什么?在弄清这个问题之前,我们先比一比两兄弟。
[引导]03与02均由氧元素组成,在分子组成上只不过仅是一个0原子之差,但两兄弟的“脾气”和“外貌”却大相径庭。
[板书]1.03与02物理性质的对比[学生阅读]课本“二、臭氧?物理性质”并与02对比。
[投影]03与02物理性质的对比0302色、味、态通常为一有特殊臭味的淡蓝色气体,液态03呈深蓝色,固态03为紫黑色通常为一无色无气味的气体液态02呈淡蓝色,固态02呈雪花状,淡蓝色溶解度(水中)大小熔点—251C -218C 沸点一112 . 4C —183C [师]由上表可知,03与02的组成元素虽然相同,但物理性质却差别甚大。
化学上,我们把由同一种元素形成的不同的单质,称为这种元素的同素异形体。
[板书]同素异形体:由同一种元素形成的性质不同的单质,叫做这种元素的同素异形体。
[师]如我们刚才所学的02和03就是氧元素的同素异形体。
[问]我们以前可曾学过由同一种元素形成的不同单质吗?它们是谁?[生]有!如金刚石和石墨都由碳元素组成;红磷和白磷都由磷元素组成。
[师]很好!这也就是说,金刚石和石墨都是碳元素的同素异形体;红磷和白磷都属磷元素的同素异形体。
[问]钠原子(Na)和钠离子(Na+都是由同一种元素一一钠元素组成,它们是钠的同素异形体吗?为什么?[生]不是,因为Na和Na+是同一元素的不同粒子,不属单质。
[问]水(H20与过氧化氢(H202的组成元素完全相同,它们是同素异形体吗?为什么?[生]不是,因为它们是由完全相同的两种元素组成的两种不同的化合物。

高中化学解题诀窍讲解教案
一、教学目标:
1.了解化学解题的基本方法和技巧;
2.掌握化学解题的一般步骤;
3.提高学生解题的效率和准确性。
二、教学重点:
1.掌握化学解题的基本原理;
2.熟练运用化学解题的方法和技巧。
三、教学难点:
1.解题思路的培养;
2.解题技巧的掌握。
四、教学内容:
1.化学解题的基本原理;
2.化学解题的方法和技巧;
3.化学解题的一般步骤;
4.化学解题实例讲解。
五、教学过程:
1.导入:通过一个简单的例子引出化学解题的重要性和必要性;
2.讲解:介绍化学解题的基本原理和方法;
3.练习:让学生进行一些基本的解题练习;
4.总结:总结解题的基本步骤和技巧;
5.作业:布置相关的解题作业,以巩固学生的学习成果。
六、教学手段:
1.黑板演示;
2.多媒体教学;
3.示例讲解;
4.学生互动。
七、教学评价:
1.通过讲解和练习,检查学生对化学解题的掌握程度;
2.通过作业和课堂表现,评价学生的学习效果。
八、教学反思:
1.及时总结课堂教学中存在的问题和不足;
2.根据学生的反馈意见,调整教学策略,提高教学效果。

第一节氧族元素●教课目的1.使学生初步感觉运用元素周期律等理论知识,指导学习元素化合物知识的科学方法,进一步认识和理解“族”的特色和含义。
2.掌握氧族元素原子构造与元生性质递变的关系。
3.经过氧族元素和卤族元素相像性、差异性及其原由的比较,培育学生剖析、概括总结知识的能力。
4.经过臭氧知识的学习,对学生进行一分为二、全而看问题的辩证唯心主义思想教育,发掘教材内容,浸透环保意识。
●教课要点1.原子构造与元生性质的关系。
2.氧族元生性质的相像性和递变规律。
●教课难点氧族元素与卤族元生性质的比较。
●教课方法启迪、推测、议论、对照、概括等方法。
●教具准备投影仪、胶片、三角架、石棉网、玻璃棒、酒精灯、药匙、研钵、火柴、大试管、坩埚钳、铁粉、铜片、硫粉。
●教时安排2 课时●教课过程★第一课时[引入]请同学们默背碱金属和卤族的元素,并说明它们的原子构造特色及其在周期表中的地点。
那么在初中要点学习过的地壳含量居第一,且在实质中起着举足轻重作用的氧元素处于周期表中什么地点与之同家族的成员还有哪些它们在构造及性质上有何同样和不一样之处呢[板书]第一节氧族元素[投影]氧族元素(VIA)元素名称:氧硫硒碲(钋 )元素符号: O S Se Te(Po)核电荷数: 8 16 34 52 (84)原子构造表示图:[指引]据氧族元素所处周期表中的地点及族元素的特色,推测其原子构造的同样点和不一样点。
[师]氧族元素原子构造有何同样与不一样点[生]同样点:原子最外层都有 6 个电子。
不一样点:①核电荷数不一样;②电子层数不一样;③原子半径不一样。
[追问]从O Te,原子构造有何递变规律呢[生]从 O Te,核电荷数挨次增添,电子层数挨次增加,原子半径挨次增大。
[转引]据氧族元素原子构造特色和递变规律,再运用元素周期律理论来推测氧族元素的性质及变化。
[师]元素的化学性质主要决定于原子构造的哪些方面[生]最外层电子数和原子半径。
[追问]最外层电子数和原子半径如何决定元素的化学性质[生]最外层电子数越多,越易得电子,表现非金属性;若原子半径越小,得电子能力越强,非金属性越强。

无机化学《氧族元素》教案教学要求]1. 掌握臭氧、过氧化氢的结构和性质。
2. 掌握硫化氢的特性及硫化物的水溶性。
3. 了解掌握硫的氧化物、含氧酸及其盐的结构、一般性质及用途。
[ 教学重点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构、制备和性质[ 教学难点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构和性质[ 教学时数]6 学时[ 教学内容]1. 氧族元素的通性2. 氧及其化合物3. 硫及其化合物15-1 氧族元素的通性一、氧族元素的存在氧族元素有氧、硫、硒、碲和钋五种元素。
氧是地球上含量最多,分布最广的元素。
约占地壳总质量的46.6% 。
它遍及岩石层、水层和大气层。
在岩石层中,氧主要以氧化物和含氧酸盐的形式存在。
在海水中,氧占海水质量的89% 。
在大气层中,氧以单质状态存在,约占大气质量的23% 。
硫在地壳中的含量为0.045% ,是一种分布较广的元素。
它在自然界中以两种形态出现棗单质硫和化合态硫。
天然的硫化合物包括金属硫化物、硫酸盐和有机硫化合物三大类。
最重要的硫化物矿是黄铁矿FeS2,它是制造硫酸的重要原料。
其次是黄铜矿CuFeS2、方铅矿PbS 、闪锌矿ZnS 等。
硫酸盐矿以石膏CaSO 4· 2H 2 O 和Na2SO 4 · 10H 2 O 为最丰富。
有机硫化合物除了存在于煤和石油等沉积物中外,还广泛地存在于生物体的蛋白质、氨基酸中。
单质硫主要存在于火山附近。
二、氧族元素的基本性质氧族元素的一些基本性质性质氧硫硒碲原子序数原子量价电子构型常见氧化态815.992s 2 2p 4-2,-1,01632.063s 2 3p 4-2,0,+2,+4,+63478.964s24p 4-2,0,+2,+4,+652127.605s 2 5p 4-2,0,+2,+4,+6共价半径/pmM 2 - 离子半径/pm第一电离能/(kJ/mol)第一电子亲合能/(kJ/mol) 第二电子亲合能/(kJ/mol) 单键解离能/(kJ/mol)电负性(Pauling 标度) 661401314141-7801423.441041841000200-5902262.58117198941195-4201722.55137221869190-2951262.10三、氧族元素的电极电势氧的电势图:2.07 0.68 1.77φ A θ / V O 3 ——— O 2——— H 2 O 2 ——— H 2 O1.24 –0.08 0.87φ B θ / V O 3 ——— O 2 ——— HO 2 -——— OH –硫的电势图:2.05 0.20 0.40 0.50 0.14φ A θ / V S 2 O 82 -——— SO 4 2 -——— H 2 SO 3 ——— S 2 O 3 2 - ——— S ——— H 2 S-0.92 -0.58 -0.74 -0476φ B θ / V SO 4 2 - ——— SO 3 2 - ——— S 2 O 3 2 -——— S ——— S 2 -15-2 氧及其化合物一、单质氧自然界中的氧含有三种同位素,即16 O 、17 O 和18 O ,在普通氧中,16 O 的含量占99.76% ,17 O 占0.04% ,18 O 占0.2% 。

知识网络化在“氧族元素复习”中的应用——《氧族元素复习课》教学设计一、指导思想与理论依据(一)采用全程共振教学法1.共振现象及全程共振教学法共振原本是一个物理学概念,指两个振动频率相同的物体,当一个发生振动时,引起另一个物体振动的现象。
实际上共振不仅是物理现象,它广泛存在于人类社会生活的许多方面。
教学是教师和学生组成的共同活动过程,有交流就会产生共振。
全程共振教学法就是让学生参与教学准备、教学实施、教学反馈的全过程,通过师生相互作用,达到启发引导学生发展,教学相长的效果。
主要包括:一是情感的共振,即师生在教学过程中情感共通与共鸣,两个课堂主体同时达到积极、愉快、兴奋的心理状态,这应当是师生互动教学的最高境界。
二是认识的共振即,指教学中师生思维呼应、合拍,处于相互启发,共同创新和探索未知领域的过程。
为提高教学实效性提供有力保障。
师生共振教学结构重点着眼于教育教学过程,核心是改善教学中的人际关系。
教师与学生的关系为指导、帮助和参与互动的关系。
共振结构以四个原理为空间结构,以七个环节为时间序列,构成了一个可操作的教学结构。
四个教学原理为:师生教学同步原理;师生主客体角色互换原理;师生情感共鸣原理;师生教学互补原理。
七个教学序列结构为:创设问题情境;激发学习动机;架设探求桥梁;组织问题解决;重复知能训练;改组智能结构;知能创新应用。
2 教学设计思想——切实提高化学课堂的实效性复习课的课堂教学,提高课堂的实效性就必须把复习的主动权切实交给学生,在教学设计中应以学生所求、学生所需为基本的出发点和落脚点。
在复习中以学生研读、质疑、思悟为主体,以教师归纳、辨析、点拔为主导,培养学生的综合思维能力,提高课堂教学的质量。
因此本节课的教学思想是凸现以学生为主体、以教师为主导、以训练为主线、以思维为核心、以素质为目标。
教会学生学习非金属元素的一般方法,提高思维能力。
(二)复习课构建知识体系网络的必要性从学习心理学原理可知,学生良好的认知结构是有学生所学到的知识与自身经验所构成的心理结构。

氧族元素课程教学设计氧族元素课程教学设计教学重点:原子结构与元素性质的关系,氧族元素性质的相似性和递变规律。
教学过程:引入:环绕地球的大气中存在着维持生物生命所必需的氧气。
大家在初中已经了解了氧气的一些性质和用途。
我们也知道氧元素位于元素周期表中第二周期的ⅥA族,跟氧同族的元素还有哪些?它们又有哪些性质呢?播放ppt演示讲述:氧族元素包括氧、硫、硒、碲、钋等。
提出:让学生写出氧、硫的原子结构示意图。
再根据元素周期表结构推测其它元素的原子序数,引导学生根据核外电子排布的规律,试写其原子结构示意图。
教师展示:原子结构的图片。
提问:根据氧族元素原子结构的特点找出结构上的异同点。
小结氧族元素原子的核电荷数、电子层数及原子半径的变化规律。
教师评价:设问:分析氧族元素的原子结构及其在元素周期表中的位置,预测它们的化学性质有何相似性和递变规律?学生讨论:教师评价小结:展示:氧族元素单质的.物理性质及其相关的图片。
学生讨论:变化规律教师小结:学生讨论:从生成氢化物的难易程度和气态氢化物的稳定性来分析各元素的非金属性是怎样变化的?如果用R表示氧族元素,其氧化物化学式如何表示?最高价氧化物对应水化物的化学式如何表示?其酸性强弱的变化规律是什么?播放动画:氧族元素的化学性质过渡:氧族元素和它相邻的卤族元素的性质有哪些相似和不同呢?下面把硫、氯进行对比。
提出:让学生画出它们的原子结构示意图,讨论得出结构的相同点和不同点。
然后进一步讨论化学性质的相似与不同。
教师小结评价:此处可以展示ppt演示的相关部分。
课堂练习:1.碲元素及其化合物不可能具有的性质是()(A)碲的氧化物有和(B)碲的化合物有-2、+4、+6价(C)碲能与氢气直接化合,且比稳定(D)单质碲为银白色、导电性比硒强的固体选题目的:学习完元素周期律和元素周期表后,要提高学生运用理论解决实际问题的能力。
此题是一道有代表性的习题。
参考答案:C2.举出两个实验事实,说明氧的非金属性比氟弱:①______________________________;②_____________________________________。

氧族元素复习公开课教案--高一化学教案(共五篇)第一篇:氧族元素复习公开课教案--高一化学教案硫及其化合物张晓●教学目标知识技能:通过硫及其化合物转化关系的教学,使学生掌握H2S、SO2、H2SO4的性质、制法和用途;通过实验设计的分析与讨论,使学生对硫及其化合物知识网络化、系统化。
能力培养:以硫及其化合物的性质为载体,以实验设计为核心,训练学生对已有知识进行分析综合、归纳演绎的思维能力以及解决实际问题的能力。
科学思想:通过学生自己对实验方案的设计与讨论,培养学生严谨求实的科学态度。
科学品质:通过以学生为主体的探究式教学途径,激发学生的学习兴趣,尝试成功的喜悦,使学生更加喜爱化学。
科学方法:通过实验设计的讨论与分析,使学生领会化学科学研究的一般方法。
重点、难点硫及其化合物的相互转化关系的实验设计与评价。
硫及其化合物各代表物性质的综合运用。
●教学准备1、每台电脑上安装化学实验装置程序。
2、制作多媒体课件。
●教学过程教师活动【引言】上节课我们复习了卤族元素的知识,下面我们复习氧族元素。
在复习本部分内容时,建议以掌握S、H2S、SO2、H2SO4代表物的性质为核心,用氧化还原的观点为指导,进行研究分析。
【板书】硫及其化合物【提问】请按下表要求填入你所知道的含有硫元素的物质的化学式:通过讨论后填写下表:【提问】请根据所学的元素化合物知识,列出上面表格中的各物质之间的转化关系讨论逐步完善后得到:【板书】一.硫及其重要化合物间相互转化关系【投影】要求学生叙述各转化关系的化学方程式。
【板书】二.硫的重要化合物性质的实验设计结合上面的硫元素的知识网络图做好进行实验设计的心理准备。
【板书】1、SO2的制取及性质【思考】请设计一套实验装置制取SO2并证明SO2有氧化性、还原性和漂白性。
【提问】①该装置应包括几部分?②通过怎样的实验证明SO2有氧化性?写出反应的化学方程式。
将观察到怎样的现象。
③请根据反应原理,确定气体发生装置及所需药品。
课题2氧气(第一课时)
教学设计
一、设计理念
氧气是学生从化学视角认识具体物质及其变化规律的开始,课程内容切合“从学生熟悉的事物入手,进行科学教育”的原则,从学生已有的知识经验出发,让他们在熟悉的生活情景中感受化学的重要性。
二、教学分析
(一)学生情况分析
学生已学习“多种物质组成的空气”,知道空气中氧气约占21%,是能够支持物质燃烧的气体;在小学自然、初中生物中也已知道氧气是人类、动植物生命活动不可缺少的气体。
除此之外,“氧气还是一种怎样的气体”正是学生心中的疑问,是学生从化学视角认识氧气的心理需求和进行学习的内在动力。
(二)学习内容分析
本课时学习内容分为“认识氧气的物理性质”和“氧气的化学性质”两部分。
1、学习目标
(1)知识与技能:认识氧气的主要物理性质、化学性质。
(2)过程与方法:观察并说出木炭、铁丝、硫磺、木炭在氧气中燃烧的现象,从中归纳出氧气的化学性质。
(3)情感态度与价值观
①初步养成良好的实验习惯,树立严肃认真的科学态度。
②初步学会“观察现象——分析现象——获得结论”的科学思维方法。
2、教学重难点
重点:认识氧气主要的化学性质。
难点:通过实验探究归纳出氧气的化学性质。
三、教学策略
1、我收集有关液态氧、固态氧的图片资料,在课堂上用幻灯片的形式向学生展示,也可以要求学生利用课余时间提前预习并收集氧气的方法,让学生学会课前先知。
2、学习氧气性质应始终以学生为主体,以“动手实验——观察现象——说出现象——分析现象——获得结论”的形式。
高一化学教案氧族元素(最新版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用范文,如教学教案、合同协议、演讲致辞、条据书信、规章制度、报告资料、公文资料、党团资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical sample essays, such as teaching teaching plans, contract agreements, speeches, articles and letters, rules and regulations, report materials, official documents, party group information, essays, other sample essays, etc. I want to know Please pay attention to the different format and writing styles of sample essays!高一化学教案氧族元素高一化学教案氧族元素氧族元素一、素质教育目标(一)知识教学点1.掌握氧族元素性质的相似性和递变规律。
高一化学教案氧族元素第二课时高一化学教案氧族元素第二课时课题:氧族元素第二课时教学重点:了解同素异形体的概念,常识性介绍过氧化氢。
教学过程:复习:通过练习的形式复习上一节课的内容。
1.对氧、硫、硒、碲四种元素,下列说法中不正确的是( )(A)最外层电子数相等(B)原子半径依次增大(C)由于核电荷数增大,核对最外层电子引力也依次增大(D)阳离子的还原性依次增大2.下列关于硒的叙述中,不正确的是( )(A)硒可以跟钠组成化合物Na2Se(B)硒化氢的水溶液呈强酸性(C)亚硒酸是一种中强酸(D)硒化氢在空气中燃烧生成二氧化硒3.下列氢化物的还原性由强到弱排列顺序中,正确的是( )(A)(B)(C)(D)参考答案:C、B、A讲述:有关硫单质的物理性质和化学性质。
此处可以播放ppt它的自发性分解、性能不稳定,只能随用随生产,不适于储存和输送,这是它的缺点。
解释说明:在松树林里,空气往往格外清新,令人呼吸舒畅,原因之一就是松林中常含有微量的臭氧。
这些臭氧是松树的树脂在氧化过程中产生的。
微量的臭氧不但不臭,反而能使空气变得清新,特别是对呼吸道病人的呼吸尤为有益。
疗养院常常设在松林中,道理就在这里。
雷雨后的空气也会变得十分清新,这除了雨水将空气中的尘埃洗净以外,臭氧也起了相当的作用,原来闪电能使空气中的部分氧气转变成臭氧。
学生交流:臭氧层保护问题。
教师评价:保护地球生命的高空臭氧层面临严重的威胁。
喷气式飞机和火箭、导弹将大量废气排放到高空,部分臭氧被消耗。
如此发展下去,就会给臭氧保护伞捅开大窟窿,紫外线和宇宙辐射将长驱直入,伤害地球生灵,这为环境保护提出了严峻的课题。
然而臭氧对人类也有不利的一面。
例如,地面大气中的臭氧含量超过一定标准时,将对人体的鼻、咽、气管和肺具有刺激作用。
另外,还会加速橡胶老化、腐蚀设备、损伤植物等。
讲述:过氧化氢的物理性质。
提问:过氧化氢中的氧元素的化合价是多少,根据化合价推测它应具有的性质。
高一化学第六章复习教案
本章复习要求
1.了解氧族元素及其性质。
2.了解臭氧、过氧化氢的性质。
3.掌握二氧化硫的性质。
4.掌握硫酸的性质及硫酸根离子的鉴定。
5.常识性了解环境污染与环境保护。
教学重点:
1、氧族元素的原子结构与元素化学性质的递变规律2、归纳总结硫及其重要化合物之间的相互转化关系。
3、硫酸根离子的检验方法。
教学难点:
硫及其重要化合物的相互转化。
课时安排:1课时
教学方法:归纳总结、练习巩固
教学过程:
一、知识点及规律:
1、氧族元素原子结构及元素性质:
2、臭氧、过氧化氢的性质。
3、硫及其重要化合物的相互转换关系:
(学生练习)
4、硫酸根离子的检验:
先加盐酸酸化(排除CO32-、SO32-、Ag+的干扰)再加BaCl2溶液。
正确的检验方法和步骤为:
将待测试液先用盐酸酸化(不宜用稀硝酸),如果试液浑浊,则静置片刻,取其清液,在其中加入BaCl2溶液,若有白色沉淀产生,则表明待测液中含有SO42-,反之则无。
如果加盐酸酸化后无浑浊现象,则在待测试液中直接加入BaCl2溶液,若产生白色沉淀,则表明待测液中含有SO42-,反之则无。
5、环境污染与环境保护:
练习:(略)。