【解析】选B。根据β-氮化碳硬度超过金刚石晶体判 断,氮化碳属于原子晶体,A项正确;氮的非金属性大于 碳的非金属性,氮化碳中碳显+4价,氮显-3价,B项错误; 氮化碳的化学式为C3N4,每个碳原子与四个氮原子相连, 每个氮原子与三个碳原子相连,C项和D项正确。
3.(2019·菏泽高二检测)将SiCl4与过量的液氨反应可 生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼 烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高 温、耐磨材料,在工业上有广泛的应用。下列推断可能
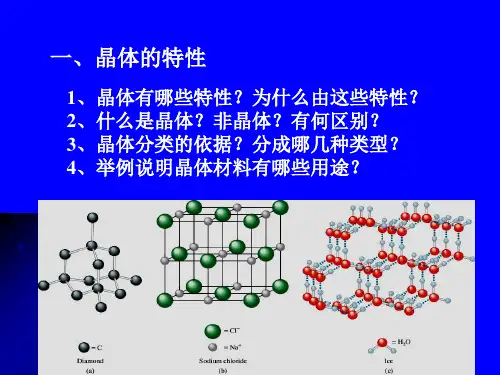
【方法规律】判断原子晶体与分子晶体类型的方法 (1)依据组成晶体的粒子和粒子间的作用判断:原子晶 体的粒子是原子,质点间的作用是共价键;分子晶体的 粒子是分子,质点间的作用是分子间作用力。 (2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔点判断:原子晶体熔、沸点高,常在 1 0断:分子晶体为非导体,但部分分子晶 体溶于水后能导电;原子晶体多数为非导体,但晶体硅、 晶体锗是半导体。
低的因素
分子晶体
原子晶体
分子间作用力的强 弱
共价键的强弱
【易错提醒】(1)分子晶体内并不一定存在共价键,如 稀有气体元素单质形成的晶体中只有范德华力,不存在 化学键,不是原子晶体。 (2)除了稀有气体外,其他分子晶体中虽然存在化学键, 但是熔、沸点较低,因为化学键存在于分子中,分子依 靠分子间的作用力形成晶体。
正确的是 ( )
A.SiCl4、Si3N4的晶体类型相同 B.Si3N4晶体是立体网状结构 C.原子晶体C3N4的熔点比Si3N4的低 D.SiCl4晶体在熔化过程中化学键断裂
【解析】选B。SiCl4是分子晶体,在熔化过程中克服的 是分子间作用力,化学键不断裂。Si3N4是原子晶体,其 晶体为立体网状结构。根据C、Si的原子半径推知C—N 键的键能比Si—N键的键能大,故C3N4的熔点比Si3N4的高。