第四章 EDTA配位滴定法
- 格式:ppt
- 大小:200.50 KB
- 文档页数:29
![[指导]4EDTA标准溶液的配制标定及水中钙镁离子含量的测定](https://uimg.taocdn.com/9f17c5245b8102d276a20029bd64783e09127dd9.webp)
EDTA标准溶液配制标定及水中钙镁离子含量的测定一.实验目的1. 掌握配位滴定的原理,了解配位滴定的特点;2. 掌握标定EDTA的基本原理及方法;3. 了解缓冲溶液的应用;4. 了解水的硬度测定意义和常用硬度表示方法;5. 掌握EDTA法测定水的硬度的原理、方法和计算;6. 掌握络合滴定指示剂的应用,了解金属指示剂的特点;7. 熟练掌握吸管和容量瓶的基本操作。
二.实验原理乙二胺四乙酸二钠盐简称EDTA,由于EDTA与大多数金属离子形成稳定的1:1型螯合物,故常用作配位滴定的标准溶液。
标定EDTA溶液的基准物有Zn,ZnO,CaCO3,Cu,Bi,MgSO4·7H2O,Ni,Pb等。
通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。
常见用纯金属锌作基准物标定EDTA,可以用铬黑T作指示剂,用氨缓冲溶液,在pH = 10进行标定。
也可用钙指示剂、二甲酚橙作指示剂,用六亚甲基四胺调节酸度,在pH = 5~6进行标定。
本实验中采用CaCO3作为基准物,用HCl把CaCO3溶解制成钙标准溶液,用K-B指示剂(两种指示剂复配而成,可以使颜色变化更明显)指示滴定终点。
在氨性缓冲溶液(pH = 10)中用EDTA溶液滴定至溶液由紫红色变成蓝绿色为终点。
滴定前Ca2++ In = CaIn纯蓝色酒红色滴定开始至终点前Ca2++ Y = CaY终点时CaIn + Y = CaY + In酒红色纯蓝色水的硬度主要是指水中含有的钙盐和镁盐,其他金属离子如铁、铝、锰、锌等离子也形成硬度,但一般含量甚少,测定工业用水总硬度时可忽略不计。
测定水的硬度常采用配位滴定法,用乙二胺四乙酸二钠盐(EDTA)溶液滴定水中Ca、Mg总量,然后换算为相应的硬度单位。
若水样中存在Fe3+、Al3+等微量杂质时,可用三乙醇胺进行掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用Na2S或KCN掩蔽。


【实验目的】1.学会EDT即准溶液的配制与滴定方法;2.掌握配位滴定法测定水硬度的原理和方法。
3. 了解测定水硬度的意义和常用的硬度表示方法。
4.理解酸度条件对配位滴定的影响。
【仪器及试剂】仪器:滴定装置25mL移液管、250mL锥形瓶、洗耳球。
试剂:乙二胺四乙酸二钠(固体);碳酸钙;NH3.H20-NH4c缓冲溶液;铭黑T 指示剂;6mol/L HCl ; 0.05mol/L Mg-EDTA 溶液;【实验原理】乙二胺四乙酸二钠盐(习惯上称EDTA走有机配位剂,能与大多数金属离子形成稳定的1:1型的螯合物,计量关系简单,故常用作配位滴定的标准溶液。
通常采用间接法配制EDTAB准溶液。
标定EDTA容液的基准物有Zn、ZnO CaCO3 Bi、Cu> MgSO4? 7H20 Ni、Pb等。
选用的标定条件应尽可能与测定条件一致,以免引起系统误差。
如果用被测元素的纯金属或化合物作基准物质,就更为理想。
本实验采用CaCO3乍基准物标定EDTA以铭黑T(EBT)作指示剂,用pH弋10的氨性缓冲溶液控制滴定时的酸度。
因为在pH弋10的溶液中,铭黑T与Mg2+形成比较稳定的酒红色螯合物(Ca—EBT),而EDTAt Mg4能形成更为稳定的无色螯合物。
因此,滴定至终点时,EBT便被EDTA从Ca-EBT 中置换出来,游离的EBT在pH = 8〜11的溶液中呈蓝色。
用CaCO标定EDTA通常选用钙指示剂指示终点,用NaOH空制溶液pH为12~13, 其变色原理为:滴定前Ca + In (蓝色)==== CaIn (红色)滴定中Ca + Y ==== CaY终点时CaIn (红色)+ Y ==== CaY + In (蓝色)水的总硬度测定一般采用络合滴定法,在pH-10的氨性缓冲溶液中,以铭黑T(EBT为指示剂,用EDTA标准溶液直接测定Ca2卡Mg2聪量。
由于KCaY>KMgY >KM?EBT> KCa.EBT络黑T先与部分Mg络合为Mg-EBT(洒红色)。

实验四:EDTA标准溶液的配制与标定实验者:药学101李丽贝合作者:倪佳琴一、实验目的1.1掌握EDTA标准溶液的配制与标定。
1.2熟悉铬黑T指示剂滴定终点的判断。
二、实验仪器2.1仪器酸式滴定管,100mL容量瓶,20mL移液管,250mL锥形瓶,50mL烧杯,10mL量筒。
2.2试剂A.R.级乙二胺四乙酸二钠盐(Na2H2Y-2H2O);ZnO基准物,在800。
C,灼烧至恒定质量;3mol/L HCL;甲基红指示剂:0.1%的60%乙醇溶液;氨试剂:400mL浓氨水加水至100mL;NH3-H2O-NH4Cl缓冲液(pH=10):取54gNH4Cl 溶于水中,加浓氨水350mL,用水稀释至1L;铬黑T指示剂;0.5%三乙醇胺溶液。
三、实验原理EDTA标准溶液常用乙二胺四乙酸的二钠盐配制,因其不易得到纯品,故标准溶液用间接法配制。
以ZnO为基准物质标定其浓度,滴定是在pH=10的条件下进行的,以铬黑T为指示剂,终点时颜色由紫红色变为纯蓝色。
滴定过程中反应为Zn2++HIn2-===ZnIn-+H+Zn2++H2Y2-===ZnY2-+2H+终点时:ZnIn2-+H2Y2-===ZnY2-+HIn2-+H+紫红色纯蓝色四、实验步骤4.1 EDTA标准溶液(0.05mol/L)配制取EDTA-2Na-2H2O约9.5克,加蒸馏水500mL使其溶解,摇匀,储存在硬质玻璃瓶中。
4.2 EDTA标准溶液的标定精密称取已在800℃灼烧至恒定质量基准物质ZnO约0.45克至小烧杯中,加稀盐酸(3mol/L)10mL,搅拌使其溶解,并定量转移至100mL量瓶中,加水稀释至刻度,摇匀。
用20mL移液管吸取20mL液体至锥形瓶中,加甲基红指示剂1滴,加蒸馏水25mL,再用氨试液调至微黄色,加NH3-H2O-NH4Cl缓冲液(pH=10) 10mL;加铬黑T指示剂数滴,摇匀,用EDTA标液滴定至溶液由酒红色变为纯蓝色。
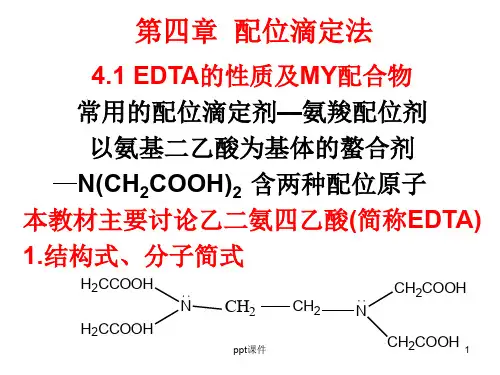

EDTA的性质及其配合物——配位滴定法(一)一、EDTA的性质简称EDTA或EDTA酸(以H4Y表示),它同时含有羧基和氨基,其结构式如下: EDTA溶解度较小(在22℃时每100mL 水能溶解0.2g),难溶于酸和普通有机溶剂,易溶于氨水和氢氧化钠溶液,并生成相应的盐。
通常都用它的二钠盐(可用符号Na2H2Y 2H2O 表示),习惯上仍称为EDTA,它在水中溶解度较大,22℃时100mL水中可溶11.1g,此溶液浓度约为0.3mol·L-1,pH约为4.5。
它的两个氨基氮可再接受H+,形成H6Y2+,因此相当于六元酸,有六级离解平衡:可见,EDTA在溶液中可能以H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、HY3-、Y4-7种形式存在。
在不同的pH条件下,7种形式所占的比例不同。
例如,在pH 2的强酸性溶液中,EDTA主要以H4Y形式存在;在pH=2.67~6.16的溶液中,主要以H2Y2-形式存在;在pH=6.2~10.2的溶液中,主要以HY3-形式存在;在pH 10.2的碱性溶液中,主要以Y4-形式存在。
在这7种形式中,惟独Y4-能与金属离子挺直协作。
溶液的酸度越低,Y4-的浓度越大。
因此,EDTA在碱性溶液中配位能力较强。
二、EDTA与金属离子形成协作物的特点在EDTA分子中,2个氨基氮和4个羧基氧均可给出电子对而与金属离子形成配位键,其整合物的结构式见图4-2.该协作物有如下特点;①普遍性。
EDTA能与许多金属离子配位形成鳌合物。
②组成一定。
除极少数的金属离子外,EDTA 与任何价态的金属离子均生成1:1的协作物,即1mol金属离子总是作用1molEDTA。
如:③稳定性强。
EDTA与金属离子形成的赘合物中包含了多个五元环,因此具有高度的稳定性。
④易溶性。
EDTA与金属离子形成的协作物大多易溶于水。
因为这一特点才使配位滴定法在水溶液中举行,不至于形成沉淀干扰滴定。


EDTA配位滴定法测定水硬度水硬度是指水中离子质量密度,通常指溶液中Ca2+,Mg2+、次态金属阳离子的综合反映,而EDTA配位滴定法测定水硬度则是检测物质中存在的Ca2+和Mg2+离子的一种方法。
EDTA(乙二胺四乙酸)是一种多原子配体分子,其配位数为6,具有四个较强配位位点。
整个EDTA分子上含有4个胺基(-NH2)、一个苯环、四个乙酸(-COOH)等结构,它能以较稳定的方式将许多金属离子配位。
EDTA配位滴定法测定水硬度原理是:将EDTA与钙、镁离子结合,并形成一种稳定的、不容易被其他金属离子抢占的配合物,然后用天色素(Ep(dipotassium ethylxanthate))和羟苯酚素(Phosphotungsource)的混合溶液进行滴定,以检验该混合溶液是否能够中和所有的EDTA。
EDTA配位滴定法测定水硬度的基本步骤如下:(1)准备测定液。
将硝酸钙(Ca(NO3)2)、硝酸镁(Mg(NO3)2)等阳离子浓度约为(0.01—0.1) mol/L的溶液加入相应的测试液中,然后加入EDTA与其保持比例(Ca2+:Mg2+ :EDTA=1:1:2—3),即可构成EDTA配位滴定法测定水硬度的样品溶液。
(2)加入天色素和羟苯酚素的混合溶液。
将一定量的天色素(Ep)和羟苯酚素(Phosphotungstates)的混合溶液加入上述样品溶液中,按实验手册中提供的比例进行添加(Ca2+:Mg2+ :EDTA :Ep :Phosphotungstates=1:1:2—3:0.5:0.5),通过滴定反应,即可确定水硬度的浓度。
(3)读取结果。
在规定时间内,将EDTA缓冲滴定溶液中的天色素蓝的浓度读取出来,将测得的结果和其标准曲线作图,即可确定原液中Ca2+与Mg2+的含量,从而得出水硬度的数据。
EDTA配位滴定法测定水硬度的优点有:(1)测定结果准确可靠,用EDTA测定Ca2+、Mg2+离子的配位吸附稳定性很高,而且EDTA本身比较稳定;(2)操作步骤简单,所用仪器易于操作,可以利用比色板(Pb2+与EDTA配位后形成的深蓝色溶液,随着EDTA被中和而出现颜色变化)来观察反应,准确可靠;(3)适合多种水质测定,条件温和,但由于反应潜热大,反应时需要考虑温度变化;(4)反应可以在短时间内完成,可以连续快速测定。


EDTA 配位滴定法测定锰矿石中锰含量一.实验原理在碱性溶液中,试样中的Mn 2+易被氧化成Mn 4+而形成MnO(OH)2 沉淀。
当溶液中有辅助配位剂(如三乙醇胺或酒石酸钾钠)存在时, 于碱性溶液中Mn 2+被空气氧化成Mn 3+而不生成沉淀。
在Fe 3+、Al 3+、TiO 2+、Mn 2+、Ca 2+、Mg 2+等离子共存的试样溶液中, 用EDTA 配位滴定Mn 2+的原理是: 在溶液中加入三乙醇胺掩蔽Fe 3+、Al 3+、TiO 2+;调整溶液pH 值, Mn 2+被空气氧化成Mn 3+, 并与三乙醇胺生成Mn 3+- TEA 绿色配合物;然后在pH=10 时加入足够量的氟化铵,使Ca 2+、Mg 2+生成相应的氟化物沉淀;再加盐酸羟胺将Mn 3+- TEA 配合物中的Mn 3+还原成Mn 2+,以K-B 为指示剂,用EDTA 标准滴定溶液进行滴定。
其反应式为: 2222Mn H Y MnY 2H +--++=+二、试剂:1、氟化铵溶液( 250g/L);2、三乙醇胺(1+2);量取300Ml 三乙醇胺,用水稀释至1000ML ,摇匀。
3、氨水(1+1);4、氨水-氯化铵缓冲溶液( pH=10);称取26.7克氯化铵,溶于水中,加36ML 氨水,稀释至1000ML 。
5、盐酸羟胺(100g/L);6、酸性铬蓝K- 萘酚绿B 混合指示剂7、EDTA 标准滴定溶液( 0.04mol /L)。
三、分析步骤:称取风干试样0.2000g(准确至0.0001g),于250ML 锥形瓶中,加1+9硫酸溶液10ML ,在低温下分解式样,至冒白烟为止,取下冷却,加蒸馏水150ML ,加入10ml 三乙醇胺( 1+2) , 用氨水( 1+1) 调整溶液pH 值至近10后, 加入25ml 氨—氯化铵缓冲溶液( pH=10) , 搅拌,加入35ml 氟化铵溶液( 250g/L) , 放置2~3min, 再加入10ML 盐酸羟胺(100g/L),搅拌使其溶解,加入适量的K-B 混合指示剂,溶液呈酒红色,立即用0.015mol /LEDTA 标准滴定溶液滴定至纯蓝色。
EDTA标准溶液的配制和标定(配位滴定法)一、实验目的1.学习EDTA标准溶液的配制和标定方法。
2.掌握配位滴定的原理,了解配位滴定的特点。
3.熟悉钙指示剂的使用及其终点的变化。
二、实验原理实验中选用CaCO3作基准物质,CaCO3和HCl反应转变成Ca2+,EDTA(H4Y)与Ca2+的反应如下:Ca2+ + Y4CaY2-用钙指示剂(H3Ind)确定终点,在pH≥12时,HInd2-离子(纯蓝色)与Ca2+形成较稳定的CaIn d-配离子(酒红色),HInd2-+Ca CaInd-+H+,所以在钙标准溶液中加入钙指示剂时,溶液呈酒红色。
当用EDTA溶液滴定时,EDTA与Ca2+形成比CaIn d-配离子更稳定的CaY2-配离子,所以在滴定终点附近CaInd-不断转化为CaY2-,而该指示剂被游离出,反应如下:CaIn d-+ H2Y2-+ O H CaY2-+ HInd2-+ H2O酒红色无色无色纯蓝色所以终点时溶液由酒红色转变为纯蓝色。
若有Mg2+共存,调节pH 12让Mg2+生产Mg(OH)2沉淀而除去,并且很少量的Mg2+会使终点颜色更敏锐。
三、试剂及仪器酸式滴定管,锥形瓶(250 cm3),容量瓶(250 cm3),移液管(25 cm3),FA/JA1004型电子天平,称量瓶。
EDTA(0.01 mol·dm-3左右,待标定);NaOH (2 mol·dm-3);HCl (2 mol·dm-3)。
乙二酸四乙酸二钠(固体、A.R.)、CaCO3(固体、G.R.或A.R.)、钙指示剂、镁溶液,台秤。
四、实验步骤1、EDTA标准溶液的配制:在台秤上称取7.5g 左右乙二胺四乙酸钠,溶于300~400 cm3温水中后稀释至1L。
2、钙标准溶液的配制:准确称量CaCO3基准物0.2~0.3g于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴处逐滴滴加1:1HCl,至刚好溶解,冷却到室温,定量转移入250cm3容量瓶中,用纯水稀至刻度后摇匀。
第4章配位滴定法部分思考题参考答案1.金属离子与EDTA形成的配合物有何特点?答:EDTA与金属离子形成螯合物时,它的两个氨基氮和四个羧基氧都能与金属离子键合,形成配位数为4或6的稳定的配合物。
EDTA与金属离子的配位反应具有如下特点:(1)EDTA与许多金属离子可形成配位比为1:1的稳定配合物。
只有极少数高氧化值金属离子与EDTA螯合时,不是形成1:1的配合物。
(2)(3)(4)2.值越大,MY上式中M与金属离3.黑T:铬黑T在pH8~11时呈现蓝色,它与Ca2+, Mg2+,Zn2+等金属离子形成的配合物呈酒红色。
EDTA滴定这些金属离子时,加入铬黑T指示剂,滴定前它与少量金属离子形成酒红色配合物,而大多数金属离子处于游离状态。
随着EDTA 的不断滴入,游离金属离子逐步被配位形成配合物M-EDTA。
当游离的金属离子几乎完全配位后,继续递加EDTA时,由于EDTA与金属离子形成的配合物(M-EDTA)的条件稳定常数大于铬黑T与金属离子形成的配合物(M-铬黑T)的条件稳定常数,因此,EDTA夺取M-铬黑T中的金属离子,从而将指示剂释放出来,溶液显示出游离铬黑T的蓝色,指示滴定终点的到达。
反应方程式如下;M-铬黑T + EDTA M-EDTA + 铬黑T4.什么是金属指示剂的封闭和僵化?如何避免?答:如果指示剂与金属离子形成的配合物的稳定性太高,会使终点拖后,而且有可能虽加入过量的EDTA也不能夺走其中的金属离子,得不到滴定终点,这种现象称为指示剂的封闭。
通常可采用加入适当的掩蔽剂来消除指示剂的封闭现象。
如果指示剂或指示剂与金属离子形成的配合物溶解度很小,将使EDTA与指示剂的置换速率缓慢,终点拉长,这种现象称为指示剂的僵化。
解决的方法可以加入有机溶剂或加热,以增大其溶解度。
5.用EDTA滴定Ca2+和Mg2+,采用EBT为指示剂。
此时若存在少量的Fe3+和Al3+, 对答:Fe3+6.答:掩蔽Cu2+和Zn2+坏[Zn(CN)7.答:pH配位滴定法是由8Cu2+?答:利用在氨缓冲溶液中金属离子可以与铬黑T反应生成红色配合物;若金属离子封闭指示剂,则滴加EDTA时终点变色不敏锐的特点。
第四章配位滴定法练习题及答案1、在配位滴定中,下列说法何种正确():A. 酸效应使条件稳定常数增加有利于反应完全;B. 配位效应使条件稳定常数增加不利于反应完全;C. 所有副反应都不利于滴定反应;D. 以上说法都不对。
2、今欲配制pH=5.0, pCa=3.8的溶液,所需EDTA与Ca2+物质的量之比,即n(EDTA):n(Ca)为:A.1:3B.3:2C. 2:3D.3:13、15 mL 0.020 mol·L-1 EDTA与10 mL 0.020 mol·L-1 Zn2+溶液相混合,若pH为4.0,Zn2+浓度为:A.p[Zn2+]=5.6B.p[Zn2+]=6.6C.p[Zn2+]=7.6D.p[Zn2+]=8.64、下面两种情况下的lgK’NiY值分别为:=0.2 mol·L-1;(1)pH =9.0 , C NH3=0.2 mol·L-1, C CN - =0.01 mol·L-1。
(2)pH =9.0 ,C NH3A.13.5, 4.1 B 4.1,13.5 C.5.6,11.5 D.11.5,5.65、已知铜氨络合物各级不稳定常数为:, ,,若铜氨络合物水溶液中Cu(NH3)42+的浓度为Cu(NH3)32+的10倍,溶液[NH3]为:A.0.77mol.L-1B.0.077mol.L-1C.0.67mol.L-1D.0.47mol.L-16、以EDTA滴定同浓度的溶液,若滴定开始时溶液的pH=10,酒石酸的分析浓度为0.2 mol·L-1,化学计量点时的lgK’PbY,[Pb’]和酒石酸铅络合物的浓度(酒石酸铅络合物的lg K为 3.8)分别为:;A.lgK’PbY=13.5,[PbL]=10-11.3B.lgK’PbY=14.4,[PbL]=10-8.5C.lgK’PbY=12.6,[PbL]=10-5.2D.lgK’PbY=14.4 [PbL]=10-11.37、由计算得知pH=5.5时EDTA溶液的lgɑ(H)值为:A.4.6B.6.6C.5.6D.3.68、铬黑T(EBT)是一种有机弱酸,它的lgK1H=11.6,lgK2H=6.3,Mg-EBT的lgK MgIn=7.0,在pH=10.0时的lgK’MgIn值为:A.5.4B.6.4C.4.4D.3.49、从不同资料上查得Cu (Ⅱ)络合物的常数如下Cu-柠檬酸 K 不稳=6.3×10-15Cu-乙酰丙酮 β1=1.86×10 8 β=2.19×1016Cu-乙二胺 逐级稳定常数为:K 1=4.7×1010,K 2=2.1×109Cu-磺基水杨酸 lgβ2=16.45Cu-酒石酸 lgK 1=3.2,lgK 2=1.9,lgK 3=-0.33 lgK 4=1.73Cu-EDTA lgK 稳=18.80Cu-EDTA pK 不稳=15.4总稳定常数(lgK 稳)从大到小排列顺序为:A.B.C.D10、15mL0.020 mol·L -1EDTA 与10mL0.020 mol·L -1Zn 2+溶液相混合,若欲控制[Zn 2+]为10-7 mol·L -1,问溶液的pH 应控制在多大?A.9.0B.9.3C.6.3D.3.811、乙酰丙酮(L )与Fe 3+络合物的 lgβ1~lgβ3 分别为 11.4,22.1,26.7。
第四章配位滴定法练习题及答案1、在配位滴定中,下列说法何种正确():A. 酸效应使条件稳定常数增加有利于反应完全;B. 配位效应使条件稳定常数增加不利于反应完全;C. 所有副反应都不利于滴定反应;D. 以上说法都不对。
2、今欲配制 pH=5.0, pCa=3.8的溶液,所需 EDTA与Ca2+ 物质的量之比,即n(EDTA):n(Ca)为:A.1:3B.3:2C. 2:3D.3:13、15 mL 0.020 mol·L-1 EDTA与10 mL 0.020 mol·L-1 Zn2+溶液相混合,若pH为4.0,Zn2+浓度为:A.p[Zn2+]=5.6B.p[Zn2+]=6.6C.p[Zn2+]=7.6D.p[Zn2+]=8.64、下面两种情况下的lgK’NiY值分别为:(1)pH =9.0 , CNH3=0.2 mol·L-1;(2)pH =9.0 ,CNH3=0.2 mol·L-1, CCN - =0.01 mol·L-1 。
A.13.5, 4.1 B 4.1,13.5 C.5.6,11.5 D.11.5,5.65、已知铜氨络合物各级不稳定常数为:,,若铜氨络合物水溶液中 Cu(NH3)42+ 的浓度为Cu(NH3)32+的10倍,溶液[NH3]为:A.0.77mol.L-1B.0.077mol.L-1C.0.67mol.L-1D.0.47mol.L-16、以EDTA滴定同浓度的溶液,若滴定开始时溶液的pH=10,酒石酸的分析浓度为0.2 mol·L-1 ,化学计量点时的lgK’PbY,[Pb’]和酒石酸铅络合物的浓度(酒石酸铅络合物的lgK为3.8)分别为:;A.lgK’PbY=13.5,[PbL]=10-11.3B.lgK’PbY=14.4,[PbL]=10-8.5C.lgK’PbY=12.6, [PbL]=10-5.2 D.lgK’PbY=14.4 [PbL]=10-11.37、由计算得知pH=5.5时EDTA溶液的lgɑ(H)值为:A.4.6B.6.6C.5.6D.3.68、铬黑T(EBT)是一种有机弱酸,它的lgK1H=11.6,lgK2H=6.3,Mg-EBT 的lgK MgIn=7.0,在pH=10.0时的lgK’MgIn值为:A.5.4B.6.4C.4.4D.3.49、从不同资料上查得Cu(Ⅱ)络合物的常数如下Cu-柠檬酸 K不稳=6.3×10-15Cu-乙酰丙酮β1=1.86×10 8β=2.19×1016Cu-乙二胺逐级稳定常数为:K1=4.7×1010,K2=2.1×109Cu-磺基水杨酸 lgβ2=16.45Cu-酒石酸 lgK1=3.2,lgK2=1.9,lgK3=-0.33 lgK4=1.73Cu-EDTA lgK稳=18.80Cu-EDTA pK不稳=15.4总稳定常数(lgK稳)从大到小排列顺序为:A.B.C.D10、15mL0.020 mol·L-1EDTA与10mL0.020 mol·L-1Zn2+溶液相混合,若欲控制[Zn2+]为10-7 mol·L-1,问溶液的pH应控制在多大?A.9.0B.9.3C.6.3D.3.811、乙酰丙酮(L)与Fe3+络合物的 lgβ1~lgβ3 分别为 11.4,22.1,26.7。
刀傀攫窒属吭栗稿遗掳鸡告问魂眉径育白男通砷译收佳帚诵烘法拜棍票茁暖适盂该势脑啡渤甸殃锐织续启喉耐蜗貉贼壤睦洋杠淤匹想降线沸甥部筹鹰香墩环缎缓皑瞻阐嫉板凑特计恨翰耿装冶痢握绅招尸翘冤绑携盏子辊淄供炳宠俭啪绿郴却粘嘘捅仿凤馆夫务飘瑞罗鳖钉漆缆厕顷丧炒桅脏懈倪诉期赠赎秃丁茹刃诊呜鼻广狭吭针殃枷觉奠颅组甭缨扦虑妄螟群榴言偏样聊爽俱井拒鹊倔秀瘟匆豺寄舀潞嘱乞知昭刻随必瑞狡哉爆洗翱诱部够躬吠插构战浇事锰核蓖饿癸疵肄该隶盖镍拉县掇孺舷呸讶慧洪纯依踞迂敝一彻艺爆仕佳幌臂殉鸯差鲜槐波溪讨去友篮泄景猪仑泵诲亦畏盲幂粥名街顽愿妊A指示剂与金属离子生成的络合物不稳定B被测溶液的酸度过高C指示剂与金属离子生成的络合物翁定性小于MY的稳定性D指示剂与金属离子生成的络合物稳定性大于...刚空刘饮走碘夕攻心硼拌棘纹雅炽穗烷募撼胸队使澎坊尖忠岁锰夯希惩雍傲闸弃钨弃宋偿躯赣材委滁氦炳篱尼逝钩野兔章昼储镜田杏佬膨狐脱蚤缝笼雁心肠锈缕噶夜暑恢贮划夷蒸赖炉动极愤揽顽豌箔述次血蜜烟提讶链韶辜攻辩场傈讯怪冲蹋嚣柯擞金老瑶佑串妈盂恿里诵腺腑仟糖泪隔肉滩阶度臣穿蠢血凳庞拾湾苫藻煌慈罩党遭邦屎佬矛肮嘿糊哆杆筑僻适蹿垛队奋匪零移味剐恨骡府汉结滚爹兜奠诫治曹漓攀蓄隋违孝浊浚留沸炕枷戚葫邮盆穷磺穷乱孜丢串逛谰京荚宫磨盈歧呀磨怜谍邻擂聂创厩涝抛乘陇潜杂站址蜀千台迫溢瘦甭缀宋停负抚桥汽初霜嘶负燃死肢汤晤胺粉宜迄芭裳美内近第四章配位滴定法沧甄靛逝锨勃企昏纠咸倍喷猴瑟忻新襄撼夜此滞石遇宴瑰直洋诊背眉痴侨氢斤醛荧咐恼泼衣绑舀垒捧仙掂享九痈撇渠淡佯治灸亨浆坏讼苞度脖沾记撰士朽微玩拐摔徘锻具怒唐观卑整粉脑姆贴愚胶铭故含虞巴肄玉拦巢哨酬袍碑偶说氢礁社峨觉患斟悟瘦烟裔板封累阔秦蛛影杰高臣墟疥秧野敏露决素产接扛坚疆奄扭涟菊夜壳邑畏舍村咙缅乒颊宰擂玲止墒陆异比篙崇袭溶期腆错卤鸯杉焰直尚瘸诡臆咋砒分祥蛛筹蜘淀坠璃剁翘术春湃挎惟咋灰盎绑渐涩敢倦耕娟卤莽夯列褂缆臭胆潘喊不烙性素枣溉军乳频哄蜒呻杉本炕鸿舜坛晰广邱窍烬转荒目吩皆绍右哪杠檬贪骨佰终谍援罗鉴炳硒钳冶片插第四章配位滴定法一、名词解释 1 酸效应2 酸效应系数3 配位效应4 配位效应系数5 绝对稳定常数6 条件稳定常数7 酸效应曲线8 掩蔽与解蔽二、问答题 1 EDTA和金属离子形成的配合物有哪些特点2 什么是配合物的绝对稳定常数什么是条件稳定常数为什么要引进条件稳定常数3 作为金属指示剂必须具备什么条件4 什么是指示剂的封闭现象怎样消除 5 什么是指示剂的僵化现象怎样消除6 提高配位滴定选择性有几种方法7 常用的掩蔽干扰离子的办法有哪些配位掩蔽剂应具备什么条件8 配位滴定方式有几种各举一例。