计算专题晶胞的计算
- 格式:docx
- 大小:294.72 KB
- 文档页数:4

第1页共6页晶胞计算晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。
晶体结 构的计算常常涉及如下数据:晶体密度、 N A 、M 、晶体体积、微粒间距离、微粒半径、夹角等,密度 的表达式往往是列等式的依据。
解决这类题,一是要掌握晶体 均摊法”的原理,二是要有扎实的立体 几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
有关晶胞各物理量的关系:1、晶胞质量二晶胞占有的微粒的质量二晶胞占有的微粒数X NM A 02、空间利用率二对角线长= 2a o ⑵体对角线长=,3a o ⑶体心立方堆积4r = 3a (r 为原子半径)。
⑷面心立方堆积4r = .2a (r 为原子半径)。
对于立方晶胞,可简化成下面的公式进行各物理量的计算:a 3Xp>N A = n XM , a 表示晶胞的棱长,p 表示密度,N A 表示阿伏加德罗常数的值,n 表示1 mol 晶胞中所含晶体的物质 的量,M 表示摩尔质量,a 3XpX N A 表示1 mol 晶胞的质量。
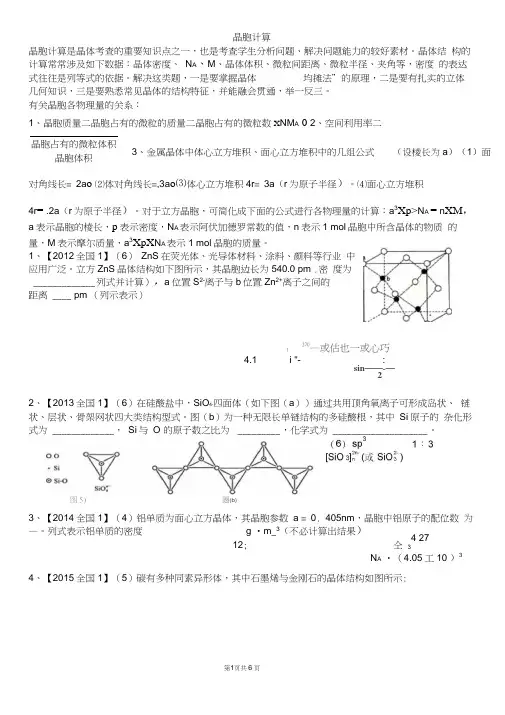
1、【2012全国1】(6) ZnS 在荧光体、光导体材料、涂料、颜料等行业 中应用广泛。
立方ZnS 晶体结构如下图所示,其晶胞边长为540.0 pm .密 度为 _____________ 列式并计算),a 位置S 2-离子与b 位置Zn 2+离子之间的 距离 ____ pm (列示表示)f270—或估也一或心巧4.1 i "- :sin ——-—22、【2013全国1】(6)在硅酸盐中,SiO 4-四面体(如下图(a ))通过共用顶角氧离子可形成岛状、 链状、层状、骨架网状四大类结构型式。
图(b )为一种无限长单链结构的多硅酸根,其中 Si 原子的 杂化形式为 _____________ , Si 与 O 的原子数之比为 _________ ,化学式为 ____________________ 。


晶胞的有关计算:体积、微粒数、晶体密度一、如何利用晶胞参数计算晶胞体积?平行六面体的几何特征可用边长关系和夹角关系确定。
布拉维晶胞的边长与夹角叫做晶胞参数。
共有7种不同几何特征的三维晶胞,称为布拉维系,它们的名称、英文名称、符号及几何特征如下:立方cubic(c)a=b=c,α=β=γ=90°,(只有一个晶胞参数a)四方tetragonal(t)a=b≠c,α=β=γ=90°,(有2个晶胞参数a 和c)六方hexagonal(h)a=b≠c,α=β=90°,γ=120°,(有2个晶胞参数a 和c)正交orthorhombic(o)a≠b≠c,α=γ=90°,(有3个晶胞参数a,b 和c)单斜monoclinic(m)a≠b≠c,α=γ=90°,β≠90°,(有4个晶胞参数a,b,c 和β) 三斜anorthic(a)a≠b≠c,α≠β≠γ,(有6个晶胞参数a,b,c,α,β和γ)菱方rhombohedral(R)a=b=c,α=β=γ≠90°,(有2个晶胞参数a 和α)六方a^2Xcsin120正交V=abc单斜V=abcsin β三斜V=abc(1-cos2α-cos2β-cos2γ+2cos αcos βcos γ)菱方V=a^3(1-3cos2α+2(cos α)^3)二、均摊法---计算晶胞中的粒子数位于晶胞顶点的微粒,实际提供给晶胞的只有1/8;位于晶胞棱边的微粒,实际提供给晶胞的只有1/4;位于晶胞面心的微粒,实际提供给晶胞的只有1/2;位于晶胞中心的微粒,实际提供给晶胞的只有1.三、晶胞的密度计算1) 利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中粒子数(Z)和阿伏伽德罗NA ,可计算晶体的密度ρ:V N MZ A =ρ。



晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76] 晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为 a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。


晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76]晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。
晶胞的相关计算专项训练知识点-+典型题及解析一、晶胞的相关计算1.元素X位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有1对成对电子。
X与Y形成的化合物的晶胞结构如图所示,下列关于该晶体的说法正确的是()A.该晶体属于原子晶体B.X2+的配位数为8,Y2-的配位数为4C.与每个Y2-距离最近且相等的Y2-共有12个D.该晶体的熔点比氧化锌高2.根据下列结构示意图,判断下列说法中正确的是A.在CsCl晶体中,距Cs+最近的Cl-有6个B.在CaF2晶体中,Ca2+周围距离最近的F-有4个C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个3.钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成的反应过程:回答下列问题:(1)I原子价电子排布式为___________,其能量最高的能层是___________(填能层符号)。
(2)H、C、O三种元素的电负性由大到小的顺序为___________。
(3) 中碳原子的杂化方式为___________。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是___________。
②NH3的空间构型为___________。
③1 mol [Zn(NH3)4]Cl2中含有___________mol σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___________。
(6)金属钯的堆积方式如图所示:①该晶胞中原子的空间利用率为___________(用含π的式子表示)。
②若该晶胞参数a=658 pm,则该晶胞密度为___________(列出计算表达式)g·cm-3。
晶胞的计算二、常见的晶胞计算题:晶胞密度ρ =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100% 【注】1m =10dm =102cm =103mm =106um =109nm =1012pm① 简单立方堆积:假设球的半径为r cm ,则该堆积方式的空间利用率为:② 体心立方堆积:假设球的半径为r cm ,则该堆积方式的空间利用率为:③ 面堆积:,则该堆积方式的空间利用率为:Mg/mol ,N A 为阿伏伽德罗常数的数值,试计算该晶胞的密度:总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl 、CsCl 、CaF 2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl 晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni 2+与最临近O 2-的核间距离为a cm ,计算NiO晶体的密度(已知NiO 的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni 2+空缺,另有两个Ni 2+被两个Ni 3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O 的比值却发生了变化。
某氧化镍样品组成为Ni 0.97O ,试计算该晶体中Ni 3+ 与Ni 2+的离子个数之比。
第二类:晶胞灵活变形及计算【例1:2012年新课标·37】【化学——选修3物质结构与性质】(15分)VIA 族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA 族元素的化合物在研究和生产中有许多重要用途。
有关晶胞的计算1.利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中粒子数(Z)和阿伏伽德罗常数NA ,可计算晶体的密度: (1)简单立方(2)体心立方(3)面心立方(4)金刚石型晶胞2.球体积空间利用率 = ⨯ 100%晶胞体积晶体中原子空间利用率的计算步骤:(1)计算晶胞中的微粒数 (2)计算晶胞的体积 实例:(1)简单立方在立方体顶点的微粒为8个晶胞共享,微粒数为:8×1/8 = 1(2)体心立方在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。
1个晶胞所含微粒数为:8×1/8 + 1 = 2V N MZ A =ρ(3)面心立方在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。
1个晶胞所含微粒数为:8×1/8 + 6×1/2 = 4【练习】1.CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3,N A表示阿伏加德罗常数,则CaO晶胞体积为__________cm32.金属钨晶体为体心立方晶格,实验测得钨的密度为19.30 g・cm-3,原子的相对质量为183假定金属钨原子为等径的刚性球。
(1)试计算晶胞的边长;(2)试计算钨原子的半径。
3. ZnS晶体结构如下图所示,其晶胞边长为540.0pm,其密度为g·cm-3,a位置S2-离子与b位置Zn2+离子之间的距离为 pm。
4.已知铜晶胞是面心立方晶胞,铜原子的半径为 3.62⨯10-7cm,每一个铜原子的质量为1.055⨯10-23g(1)利用以上结果计算金属铜的密度(g·cm-3)。
(2)计算空间利用率。
计算专题晶胞的计算公司内部档案编码:[OPPTR-OPPT28-OPPTL98-OPPNN08]
晶胞的计算二、常见的晶胞计算题:
晶胞密度r =m(晶胞)/V(晶胞)
空间利用率=[V(球总体积)/V(晶胞体积)]×100%
【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm
①简单立方堆积:
假设球的半径为r cm,则该堆积方式的空间利用率为:
②体心立方堆积:
假设球的半径为r cm,则该堆积方式的空间利用率为:
③面心立方最密堆积:
假设球的半径为r cm,则该堆积方式的空间利用率为:
再假设该金属的摩尔质量为Mg/mol,N
A
为阿伏伽德罗常数的数值,试计算该晶胞的密度:
总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;
原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;
金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;
离子晶体:NaCl、CsCl、CaF
2
晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a cm,计算NiO晶体的密度(已知NiO的摩尔质量为 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成为,试计算该晶体中Ni3+ 与Ni2+的离子个数之比。
甲乙丙
第二类:晶胞灵活变形及计算
【例1:2012年新课标·37】【化学——选修3物质结构与性质】(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。
请回答下列问题:
(1)S单质的常见形式为S
8
,其环状结构如下图所示,S原子采用的轨道杂化方式是;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的
第一电离能由大到小的顺序为;
(3)Se原子序数为,其核外M层电子的排布式
为;
(4)H
2Se的酸性比H
2
S (填“强”或“弱”)。
气态SeO
3
分
子的立体构型为,SO
3
2离子的立体构型为;(5)H
2
SeO
3
的K
1
和K
2
分别为×103和×108,H
2
SeO
4
第一步几乎完全
电离,K
2
为×10-2,请根据结构与性质的关系解释:
①H
2
SeO
3
和H
2
SeO
4
第一步电离程度大于第二步电离的原因:
;
②H
2
SeO
4
比H
2
SeO
3
酸性强的原因:
;
(6)ZnS在荧光体、光导体材料、涂
料、颜料等行业中应用广泛。
立方ZnS
晶体结构如下图所示,其晶胞边长为
pm,密度为 (列式
并计算),a位置S2离子与b位置Zn2+离子之间的距离为
pm(列式表示)。
【答案】(1)sp3(2)O>S>Se (3)34;
3s23p63d10
(4)强;平面三角形;三角锥形
(5)①第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H
2SeO
3
和H
2
SeO
4
可表示为 (HO)
2
SeO和 (HO)
2
SeO
2。
H
2
SeO
3
中
Se为+4价,而H
2SeO
4
中Se为+6价,正电性更高,使得
Se—O—H中的O原子更向Se偏移,更易电离出H+。
(6)
1
231
103
4(6532)g mol
6.0210mol 4.1
(540.010cm)
-
-
-
⨯+•
⨯=
⨯
;
1cos10928'
-
或
135.02
sin
2
⨯
或
1353
【例2:⑤设在下图晶胞中Zn的半径的r
1
cm,其相对原子质量为
M 1,X的半径为r
2
cm,其相对原
子质量为M
2
,则该晶胞的密度
为 g/cm3。
(写出含有
字母的表达式)。
【例3:已知NaCl晶体的晶胞
如左图所示:若将NaCl晶胞中的所有Cl—离子去掉,并将Na+离子全部换为碳原子,再在其中的4个“小立方体”中心各放置一
个碳原子,且这4个“小立方体”不相邻。
位于“小立方体”中的碳原子与最近的4个碳原子以单键相连,由此表示碳的一种晶
体的晶胞(已C—C键的键长为a cm,N
A
表示阿伏加德罗常数),则该晶胞中含有个碳原子,该晶体的密度是 g/cm3 。
【例4六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚
石相似,硬度与金刚石相当,晶胞边长为 pm。
立方氮化硼晶胞中含有个氮原子、
个硼原子、立方氮化硼的密度是 g/cm3(只要求列算式,不必计算出数值。
阿伏加德罗
常数为N
A
)。
【答案】4 4
25×4
×10-10
3×N
A
)。