高一化学摩尔知识点总结.doc
- 格式:doc
- 大小:14.02 KB
- 文档页数:3

高一化学气体摩尔体积知识点
嘿,同学们!今天咱就来聊聊高一化学超级重要的气体摩尔体积这个知识点呀!比如说咱平常吹气球,那气球能吹多大,和气体摩尔体积可大有关系呢!
你想啊,气体摩尔体积就好像是气体们的一个“小团体标准”。
咱可以把气体想象成一群调皮的小精灵,它们到处乱跑,占的空间也不太一样。
但有了气体摩尔体积,咱就有个统一的标准来衡量它们啦。
就好比不同的小精灵都有了自己的“帮会规则”一样!比如,在标准状况下,1 摩尔任何气体所占的体积都约是升呢。
你说神奇不神奇?
咱再想想看哦,为啥同样是 1 摩尔的氧气和 1 摩尔的氢气,它们体积差不多呢?这就是气体摩尔体积在起作用呀!这就像是不同班级的同学,都要遵守学校的统一规定一样。
所以呀,大家一定要好好理解这个知识点,它可是在好多化学问题里都超级重要的呢!咱得把这个“小精灵帮会规则”搞得清清楚楚的,才能在化学的世界里畅游无阻呀!结论就是:气体摩尔体积是高一化学中超关键的知识点,一定要掌握好哟!。

高一化学必背知识点要点高一化学必背知识点要点化学计量①物质的量定义:表示一定数目微粒的集合体符号n 单位摩尔符号 mol阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。
用NA表示。
约为6.02x1023微粒与物质的量公式:n=②摩尔质量:单位物质的量的物质所具有的质量用M表示单位:g/mol 数值上等于该物质的分子量质量与物质的量公式:n=③气体摩尔体积:物质的聚集状态(1) 影响物质体积大小的因素有:①微粒数目;②微粒大小;③微粒之间的距离。
(2) 对于固态或液态物质,影响其体积的主要因素是微粒的数目和微粒的大小; 对于气态物质,影响其体积的主要因素是微粒的数目和微粒间距离。
(3) 对于一定量的气体,影响其体积的因素是温度和压强。
温度一定,压强越大,气体体积越小,压强越小,气体体积越大; 压强一定,温度越高,气体体积越大,温度越低,气体体积越小。
(1)气体摩尔体积单位物质的量的气体所占的体积叫做气体摩尔体积。
气体摩尔体积的符号为Vm,单位为L·mol-1,气体摩尔体积的表达公式:n=在标准状况下(0℃,101kPa),气体摩尔体积Vm≈22.4 L·mol-1也就是说1mol任何气体的体积都约为22.4L。
这里的气体可以是单一气体,也可以是混合气体。
由此也可以推知在标准状况下气体的密度是用气体的摩尔质量除以Vm,即由此也可推得:M=ρ·Vm(2)阿伏加德罗定律 1.内容:在同温同压下,相同体积的任何气体都含有相同数目的分子。
适用范围:适用于相同条件下任何气体不同表述:①若T、P、V相同,则N(或n)相同;②若T、P、n相同,则V相同。
⑤物质的量浓度:单位体积溶液中所含溶质B的物质的量。
符号CB 单位:mol/l公式:CB=nB/V nB=CB×V V=nB/CB溶液稀释规律 C(浓)×V(浓)=C(稀)×V(稀)⑥ 溶液的配置(l)配制溶质质量分数一定的溶液计算:算出所需溶质和水的质量。
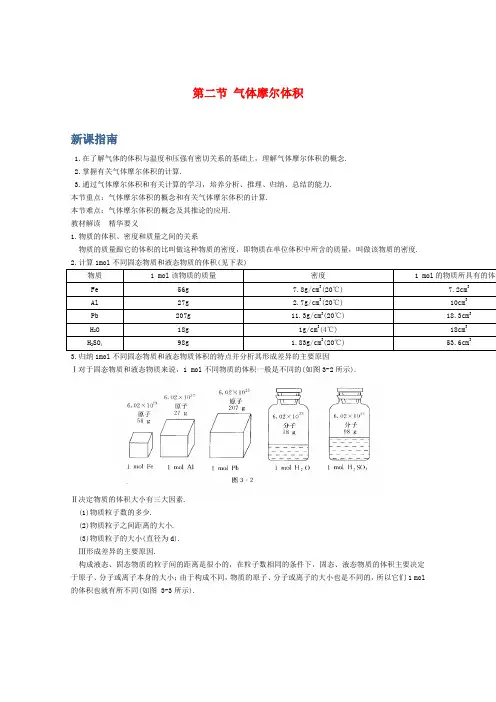
第二节气体摩尔体积新课指南1.在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念.2.掌握有关气体摩尔体积的计算.3.通过气体摩尔体积和有关计算的学习,培养分析、推理、归纳、总结的能力.本节重点:气体摩尔体积的概念和有关气体摩尔体积的计算.本节难点:气体摩尔体积的概念及其推论的应用.教材解读精华要义1.物质的体积、密度和质量之间的关系物质的质量跟它的体积的比叫做这种物质的密度,即物质在单位体积中所含的质量,叫做该物质的密度.2.计算1mol不同固态物质和液态物质的体积(见下表)物质 1 mol该物质的质量密度 1 mol的物质所具有的体积Fe 56g 7.8g/cm3(20℃) 7.2cm3Al 27g 2.7g/cm3(20℃) 10cm3Pb 207g 11.3g/cm3(20℃) 18.3cm3H2O 18g 1g/cm3(4℃) 18cm3H2SO498g 1.83g/cm3(20℃) 53.6cm33.归纳1mol不同固态物质和液态物质体积的特点并分析其形成差异的主要原因Ⅰ对于固态物质和液态物质来说,1 mol不同物质的体积一般是不同的(如图3-2所示).Ⅱ决定物质的体积大小有三大因素.(1)物质粒子数的多少.(2)物质粒子之间距离的大小.(3)物质粒子的大小(直径为d).Ⅲ形成差异的主要原因.构成液态、固态物质的粒子间的距离是很小的,在粒子数相同的条件下,固态、液态物质的体积主要决定于原子、分子或离子本身的大小;由于构成不同,物质的原子、分子或离子的大小也是不同的,所以它们1 mol的体积也就有所不同(如图 3-3所示).知识详解知识点1 气体摩尔体积(重点、难点)Ⅰ决定气体体积大小的主要因素(1)决定气体所含有的分子数(或气体的物质的量).在一定温度,一定压强下,气体中所含的分子数目(或物质的量)越多,气体的体积就越大.(2)分子的直径和分子之间的距离.一般来说,气体分子的直径约为0.4 nm,而分子之间的距离则约为4 nm,即分子之间的距离约是分子直径的10倍.因此,当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小(如图3-4所示).思维拓展如图3-5与图3-6所示,讨论气体分子之间的距离受哪些因素的影响?是怎样影响的?点拨受温度和压强的影响。

高一化学必修一物质的量知识点总结高一化学必修一物质的量知识点总结高一的学生在学习必修一的化学课本时,会碰见很多理论性的知识概念,你知道物质的量是什么吗?关于物质的量这个内容我们需要掌握哪些知识点呢?下面是店铺为大家整理的高一化学必修一知识点,希望对大家有用!高一化学必修一物质的量知识点总结1一、物质的量的单位——摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量 ( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.(3)注意事项A 选用与欲配制溶液体积相同的容量瓶.B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)高一化学必修一物质的量知识点总结2胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。

必修一第一章 一、物质的量:1、“物质的量”是国际单位制中的基本的物理量之一,用n 表示2、意义:把一定数目的微观粒子与宏观可称量的物质联系起来,它表示的是物质中所含粒子的多少-分子、原子、离子、质子、电子。
3.注意:“物质的量”是一个物理量的全称,是一个专有名词,不能当成物质的数量或质量来理解,不得随意增减。
二、摩尔——物质的量的单位 1、摩尔是“物质的量”的单位。
1摩尔:含有与0.012Kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
它表示的是物质中微粒的个数与阿伏加德罗常数的比值。
2、阿伏加德罗常数(N A ) 单位:mol -1(/ mol )数值:0.012kg 12C 中所含12C 原子的个数(kgkg2610993.1012.0-⨯)近似值:6.02×1023mol -1(6.02×1023/ mol )3、适用范围:只适用于微观粒子,不能应用于宏观物质。
(分子、原子、离子、质子、中子、电子),在使用时必须标明微观粒子的种类,如1molH 、1molH+。
不能用摩尔数代替物质的量。
三、摩尔质量如何由物体质量求出微观粒子个数呢?物质质量−→−?物质的量−−−→−⨯AN粒子个数 单个粒子质量很难称量,但大量粒子总质量可称量。
(分子质量约10-26~10-25kg ,若有阿伏加德罗常数个粒子总质量约为10-3~10-2kg ,即1g ~10g ) 1、摩尔质量:单位物质的量的物质所具有的质量。
即每摩尔粒子所具有的质量,用M 表示 2、单位:()()mol kg molkg mol g mol g //,11--⋅⋅或3、摩尔质量的数值,等于该粒子的相对质量。
即:H 2O 分子量为18,H 2O 的摩尔质量为18g/mol4、相关计算 例题1.1 mol 水分子中含有约个水分子(6.02×1023)0.5mol O 2中含有约 个O 2分子(3.01×1023)2 mol H +中含有约个H +(1.204×1024)2. 在反应X+2Y=R+2M 中,已知R 和M 的摩尔质量之比为22:9,当1.6克X 与Y 完全反应后,生成4.4克R ,则在此反应中Y 和M 的质量之比为( ) A 、16:9B 、23:9C 、32:9D 、46:93. 下列说法中不正确的是:A 、摩尔是基本物理量之一B 、1mol 氯分子的质量是71gC 、0.5mol 硫酸的质量是49gD 、0.006kg 碳原子的物质的量是0.5mol4. 下列说法正确的是:A 、6.02×1023就是阿伏加德罗常数 B 、1mol Cl 2含有2N A 个氯原子 C 、摩尔既可表示质量,又可以表示数量D 、32g O 2所含O 2的摩尔数是1mol第二章 元素与物质世界 第一节 元素与物质的分类 §1、元素与物质的关系元素:是含有相同核电荷数或质子数一类原子的总称。

下载最新免费模拟卷,到公众号:一枚试卷君第15讲物质的量的单位——摩尔课前引入一、物质的量1.意义:国际单位制中7个基本物理量之一,它表示含有一定数目粒子的集合体。
2. 符号:n3. 单位:摩尔,简称摩,符号为mol资料卡片——国际单位制(SI )的7个基本物理量及单位二、微粒间的数量关系 1. 分子和原子/离子的数量关系1 mol CO 2含_________mol C ,含_________mol O2 mol CO 2含_________mol C ,含_________mol O n mol CO 2含_________mol C ,含_________mol O n mol A x B y 中含_______mol A ,含_______mol B 【答案】1,2 ; 2,4; n ,2n ; nx ,ny 2. 微粒中的质子数、中子数、电子数你知道一滴水里含有的水分子数是多少吗?1个水分子的质量约是3×10-26 kg 滴水(以20滴水为1mL 计)中大约有1.67×1021个水分子,如果10亿人来数1滴水里的水子,每人每分钟数100个,日夜不停,需要3万多年才能数完。
11 10 12 11 10 79 10 10 9 10 8 30 32 30 资料卡片——物质的量及其标准的由来三、阿伏伽德罗常数1. 定义:1mol 任何粒子含有的粒子数叫做阿伏加德罗常数。
2. 数值:1 mol 任何粒子所含的粒子数与0.012 kg 12C 中所含碳原子数相等,即N A 约等于6.02×1023 mol -1。
3. 符号:N A4. 单位:mol -1(每摩尔)5. 表达式:N A ≈6.02×1023mol -16. 计算公式:N =n · N A (其中n 表示物质的量,N A 表示阿伏加德罗常数,N 表示粒子数) 及时小练——填写下表【答案】6.02 × 1023 1.204 × 1024 3 mol 1.5 mol四、摩尔质量1. 定义:单位物质的量的物质所具有的质量。

高一化学必修一物质的量知识点总结高一化学必修一物质的量知识点总结高一的学生在学习必修一的化学课本时,会碰见很多理论性的知识概念,你知道物质的量是什么吗?关于物质的量这个内容我们需要掌握哪些知识点呢?下面是店铺为大家整理的高一化学必修一知识点,希望对大家有用!高一化学必修一物质的量知识点总结1一、物质的量的单位——摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量 ( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.(3)注意事项A 选用与欲配制溶液体积相同的容量瓶.B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)高一化学必修一物质的量知识点总结2胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。

第二知气体摩体知知网气体摩体:位物的量的气体所占的体叫做气体摩体[ 在准状况下(STP)1 mol任何气体所占体22. 4L) 。
其位L/mol 。
注意:(1)l mo1 只适用于气体 ( 任何气体 ) ,不适用于固体或液体,只有气体在同温同下才占有相同体;气体(2) 准状况(273K , 1. 0lXl05Pa) ,因在一特定状况下,得的1mol 任何气体所占的体摩22. 4 L ;体(3) 22.4L 近似。
知网阿伏加德定律:在同温同下,同体的任何气体所含的分子数相同。
一定律理解要明确:(1)适用范气体 ( 任何气体 ) ,混合气体同适用;阿氏(2) “五同”中只要有“三同”,另外两同必然“同”;定律(3) 气体摩体是阿氏定律的特例。
(1) 同温、同、同体的气体,其量之比等于其摩量之比,公式m1/m2=M1 /M2;阿氏同温、同体下 , 其之比等于其物的量之比,公式p1/p 2=n1/n 2 ;(2)定律/ ρ2= M1/M2( 有若干推,者自推 ) 。
(3) 同温、同、气体的密度之比等于其摩量之比,公式ρ1推平均混合物的平均摩量(M ) 等于混合物的量(m总 ) 和混合物中各物的物的量的和(n 总 ) 之比,公式摩量M =m总 /n 总=(n 1 M1+n2M2 +⋯ )/(n1 +n2+⋯ )学法建1.“有比才会有”,比物在气、液、固三种不同物下的体影响因素中的主要矛盾,主要影响因素有三条:(1)粒子数的多少; (2)粒子本身的大小; (3)粒子与粒子之的平均距离。
2.固体或液体粒子之的距离相于粒子本身的大小小到可以忽略;气体粒子距离在通常情况下其本身直径的10 倍,气体体主要取决于气体粒子平均距离,而气体粒子平均距离取决于其所在温度、。
3.气体摩体温度与的函数。
温度、一定,气体摩体的数即定。
例如在0℃、 1.01 ×105Pa下,V m= 22.4 L/mol 。
4.阿伏加德定律的核心分子距离与粒子数或分子数、温度、的关系;阿伏加德定律表不同的数学表达式,不是不同的数学而已,如下式:V1 n1 M 11(T、P 不)V 2 n2 M 2 2潜能开[例 1]下列叙述中,不正确的是()A.在准状况下, 1 molH2 O 体是 22. 4 LB.在准状况下,0.5mol H2、0.5 mol N2 成的混合气体的体22. 41。

高一化学摩尔定律公式
摩尔定律是描述气体在一定条件下,压力、体积和温度之间的定量关系。
根据摩尔定律,当压力和温度保持不变时,一定量的气体的体积与其物质的摩尔数成正比。
摩尔定律可以用数学公式表示为:
V = nRT/P
其中,V表示气体的体积(单位为升),n表示气体的摩尔数,R为气体常数(8.314 J·mol-1·K-1),T表示气体的温度(单
位为开尔文),P表示气体的压力(单位为帕斯卡)。
根据摩尔定律公式,我们可以推导出以下关系式:
1. 当温度保持不变时,气体的体积与其摩尔数成正比。
2. 当物质的量和温度保持不变时,气体的体积与压力成反比。
3. 当物质的量和压力保持不变时,气体的体积与温度成正比。
摩尔定律公式的应用范围包括理想气体和高度稀薄的气体,且在相对较低的压力和温度条件下成立。
其实际适用性可能会受到气体分子之间相互作用和理想气体假设的影响。
总之,摩尔定律公式可以帮助我们计算和预测气体在不同条件下的体积变化,对于研究气体行为和进行相关实验具有重要意义。


高一化学气体摩尔体积【本讲主要内容】气体摩尔体积【知识掌握】 【知识点精析】一. 决定物质体积的因素:1. 物质体积取决于三个因素⎪⎩⎪⎨⎧微粒间的平均距离微粒本身大小微粒数目2. 影响物质体积的因素:温度、压强(改变微粒的平均间距)3. 液体、固体的体积:主要由微粒本身大小决定4. 气体的体积:主要由微粒间的平均距离决定(分子间距>>分子直径)二. 摩尔体积:1. 摩尔体积:单位物质的量的物质占有的体积。
即每摩尔物质占有的体积。
2. 决定摩尔体积的因素⎩⎨⎧微粒间的平均距离微粒本身大小影响因素:温度和压强(改变分子间距)3. 固态和液态物质的摩尔体积:主要由微粒本身大小决定。
因此不同的固体或液体物质在同一条件下摩尔体积不同。
4. 气体的摩尔体积:单位物质的量的气体所占有的体积,即每摩尔气体物质占有的体积。
用V m 表示单位:()131--⋅⋅molmmolL①由于气体分子间距远大于分子直径,气体摩尔体积主要由气体分子间距决定。
②分子间距受温度和压强影响,因此必须说明所处的条件。
一般常用的是标准状况下的气体摩尔体积:标况下,任何气体的摩尔体积都约为22.4L/mol 。
注意:①0℃,1个标准大气压(1atm ,含101325Pa )为标准状况,若条件改变,气体摩尔体积相应也改变。
②只适用于气态物质。
③适用于纯净物气体,也适用于互不反应的气态混合物。
原因:在标准状况下,不同气体分子间距是相等的。
三. 阿伏加德罗定律:(“四同”定律)1. 内容:在相同的温度下和压强下,相同体积的气体中含有相同数目的分子。
*注意:(1)只适用于气体物质,因为在相同的温度和压强下,不同气体的分子平均间距是相等的,而分子本身直径因远小于分子的平均间距而忽略不计。
固体和液体中分子的直径大于分子间距,体积大小主要由分子本身大小决定。
(2)阿伏加德罗定律适用于任何温度和压强条件下,而标况下气体的摩尔体积22.4L/mol 只适用于0℃,1atm 时,只是阿伏加德罗定律的一个特定情况。
高一化学气体摩尔体积知识点讲解在高一化学中,我们学习了很多关于气体的知识,其中涉及到摩尔体积的概念与计算方法。
摩尔体积是指在相同条件下,1摩尔气体所占有的体积。
本文将为大家详细介绍气体摩尔体积的概念、计算方法以及与其他气体性质的关系。
一、摩尔体积的概念摩尔体积是指在相同条件下,相同物质的气体具有相同的体积。
根据化学气体的理想气体状态方程PV=nRT(其中P为气体压强,V为气体体积,n为气体物质的摩尔数,R为气体常数,T为气体的绝对温度),当温度、压强和气体物质的数量都相同时,气体的体积也是相同的。
这就是摩尔体积的概念。
二、摩尔体积的计算方法气体摩尔体积的计算方法可以通过气体的摩尔数与体积之间的关系来进行计算。
当已知气体的摩尔数时,可以利用以下公式来计算气体的摩尔体积:摩尔体积(V)= 气体体积(V)/ 气体摩尔数(n)举个例子,假设有1 mol氧气,其体积为22.4 L,那么这1 mol 氧气的摩尔体积就等于22.4 L/mol。
需要注意的是,在计算摩尔体积时要注意单位的换算。
通常情况下,气体的摩尔体积的单位是L/mol,而气体的体积一般使用L 作为单位。
三、摩尔体积与其他气体性质的关系摩尔体积与其他气体性质之间存在一定的关系。
下面我们将介绍摩尔体积与气体温度、压强以及气体状态之间的关系。
1. 摩尔体积与温度的关系:根据热力学理论,摩尔体积与气体的温度成正比。
当温度升高时,气体分子的平均动能增加,分子之间的相互作用力减弱,气体的体积也会增大。
2. 摩尔体积与压强的关系:根据理想气体状态方程PV=nRT可以得出,摩尔体积与气体的压强成反比。
在常温下,当压强增大时,气体分子之间的相互作用力增大,气体分子间的距离减小,从而使得气体的体积减小。
3. 摩尔体积与气体状态的关系:不同气体的摩尔体积在相同条件下是相等的。
这是由于不同气体的摩尔体积与气体状态方程PV=nRT中的气体常数R有关。
根据理想气体状态方程可知,气体常数R与摩尔体积呈正比,因此不同气体的摩尔体积相同。
高一化学摩尔知识点摩尔知识点1.物质的量n是表示含有一定数目粒子的集体的物理量。
2.摩尔mol:把所含6.02×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02x1023mol-1叫作阿伏加德罗常数。
4.物质的量=物质所不含微粒数目/阿伏加德罗常数n=n/na5.摩尔质量m1定义:单位物质的量的物质所具有的质量叫摩尔质量.2单位:g/mol 或g..mol-13数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量n=m/m高一化学摩尔练习题一、课堂练习1、下列物质中含分子数最多的是a.标准状况之下134.4l氨气b.55gco2c.标准状况下90ml水d.6.02×1024个氢分子2、以下描述中恰当的就是a.1mol任何纯净物都含有相同的原子数b.1molo2中约含有6.02×1023个氧分子c.1mol氢中所含2mol电子d.阿伏加德罗常数就是6.02×1023mol-13、05惠州硫有多种同素异形体,某单质硫的分子由x个硫原子组成,取nmol该单质,在足量o2中完全燃烧,生成8nmolso2,关于该单质的说法不正确的是a.该硫的分子式为s8b.相对分子质量为256gc.摩尔质量为256gmol-1d.1mol该硫单质完全燃烧需8molo24、14.2克硫酸钠的物质的量就是______摩尔,其中所含_________摩尔钠离子,所含_______个氧原子,含硫元素_______克.5、1.7克氢氧根离子含___________个质子,含________摩电子6、以下观点恰当的就是na则表示阿伏加德罗常数1、常温常压下,1mol氮气含有na个氮分子2、标准状况下,以任一比例混合的甲烷和丙烷混合气体22.4l,含有的气体的分子数约为na个3、标准状况下,22.4lno和11.2l氧气混合,气体的分子总数约为1.5na个4、将no2和n2o4分子共na个降温至标准状况下,其体积为22.4l5、常温下,18g重水所含中子数为10na个6、常温常压下,1mol氦气所含的核外电子数为4na7、常温常压下,任何金属和酸反应,若生成2g氢气,则有2na电子发生转移8、标准状况下,1l辛烷全然冷却后,所分解成气态产物的分子数为8/22.4na9、31g白磷分子中,含有的共价单键数目是na个10、1l1moll-1的氯化铁溶液中铁离子的数目为na111molsio2晶体中含有4na个si─o键12含0.01molh2o2的水溶液跟mno2充份促进作用,反应过程中迁移的电子总数0.01na13在标准状况下,2.24l二氧化碳与二氧化硫混合气中所含分子数为0.1na1464g的铜出现水解还原成反应,一定丧失2na个电子15常温常压下,100ml0.5mol/l的乙酸溶液中,所含有的乙酸的分子数小于0.05na16常温常压下,1mol碳烯∶ch2含有电子总数为8na171mol苯分子中含有的碳碳双键数为3na18标准状况下,22.4lco2和co混合气体中所含的碳原子数约为na192.9g2caso4h2o含有的结晶水分子数为0.02na20210g的98%的浓h2so4中所不含的氧原子数为4na7、下列两种气体的分子数一定相等的是a.质量成正比、密度左右的n2和c2h6b.等体积等密度的co和c2h4c.等温等体积的o2和n2d.等压等体积的n2和co28、在标准状况下,ag气体a与bg气体b的分子数相同,则与此有关的以下观点中不恰当的就是a.气体a与气体b的摩尔质量之比为a:bb.相同状况下,同体积的气体a与气体b的质量之比是a:bc.质量相同的气体a与气体b的分子数之比为b:ad.同温同压下,气体a与气体b的密度之比是b:a9、同温同压下,对于等体积的一氧化氮14n18o和一氧化碳13c18o气体,下列说法正确的是:a.含相同的分子数和原子数b.含相同的分子数和电子数c.含相同的质子和中子数d.所含分子数和质量均不相同10、同温同压下两个体积相同的容器,一个盛nh3气体,另一个盛n2和h2的混合气体,两瓶气体一定存有相同的a.质量b.原子总数c.质子总数d.分子总数二、课后练习1、下列叙述正确的是a、物质的量浓度相同的溶液中所含溶质的微粒数相同b、氢氧根离子的摩尔质量是17克c、在标准状下,1摩so3的体积约22.4再升.d、0.1摩hcl气体约含6.02x1022个hcl分子2、摩尔就是a、国际单位制的一个基本物理量b、表示物质质量的单位c、计量微观粒子物质的量的单位d、则表示6.02×1023个粒子的集体3、8克氧气中含氧原子的物质的量是a、0.25摩b、0.5摩c、1摩d.、2摩4、全国高考题以na表示阿伏加德罗常数,下列说法正确的是a.53g碳酸钠中不含na个co32–b.0.1moloh–含na个电子c.1.8g重水d2o中含na个中子d.标准状况下11.2l臭氧中含na个氧原子5、64℃时,25滴水为aml,则1滴水中所含的水分子数为6、对于1mol二氧化碳描述正确的是a、其密度就是1.96g/lb、其摩尔质量就是44gc、它的体积约为22.4ld、所含原子个数是阿佛加德罗常数的3倍7、设na则表示阿伏加德罗常数,以下描述恰当的就是:a.常温常压下,11.2氧气所含氧原子数为nab.1.8g重水d2o中不含na个中子c.12gc60所含电子数为6nad.铜与硫反应中,1mol铜丧失的电子数为2na8、设na代表阿伏加德罗常数,下列说法中正确的是a.100ml1mol/l的碳酸钠溶液中所含co32-为0.1nab.常温、常压下,0.5mol臭氧中含有氧原子为1.5nac.标准状况下,1molno2气体与水反应分解成no3-为nad.78gna2o2中含有o2-为2na9、依照阿伏加德罗定律,以下描述恰当的就是a.同温同压下两种气体的体积之比等于摩尔质量之比b.同温同压下两种气体的物质的量之比等同于密度之比c.同温同压下两种气体的摩尔质量之比等于密度之比d.同温同体积下两种气体的物质的量之比等同于应力的静电力10、若有相同质量的二氧化硫和三氧化硫,下列关系正确的是a.氧原子数比为2:3b.分子数比为1:1c.氧元素质量比为5:6d.体积比为5:411、某密封容器的质量为50g,当它装进co2气体时,质量为58.8g,如果装配ch4,其质量应属a.3.2gb.58.8gc.22.4gd.53.2g12、92某温度下,在体积一定的密封容器中适度的nh3气和cl2气恰好全然反应.若反应产物只有n2气和nh4cl固,则反应前后容器中应力比应吻合于:d11:713、乙炔和乙烯的混合气体全然冷却时,所须要氧气的体积就是原混合气体的2.7倍,则该混合气体与足量的h2发生加成反应时,消耗h2的体积是原混合气体体积的a.1.6倍b.1.8倍c.1.4倍d.1.2倍14、19世纪,化学家对氧化锆的化学式有争议.经测定锆的相对原子质量为91,其氯化物蒸气的密度是同溶、同压下h2密度的116-117倍,试判断与氯化物价态相同的氧化锆的化学式a.zrob.zr2oc.zr2o3d.zro215、14分在25℃,101kpa条件下,将15lo2通入10lco和h2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.1若余下气体的体积就是15l,则原co和h2的混合气中vco=l,vh2=l.2若余下气体的体积为al,则原co和h2的混合气中vco︰vh2=.3若余下气体的体积为al,则a的值域范围就是.16、9分某校化学小组学生进行“气体相对分子质量的测定”的实验.操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量.数据见下表已换算成标准状况下的数值.气体abcdef烧瓶和气体的总质量g48.408248.408248.408248.382248.434248.8762未知标准状况下,烧瓶的容积为0.293l,烧瓶和空气的总质量就是48.4212g.空气的平均值相对分子质量为29.a、b、c、d、e、f就是中学常用的气体.1上述六种气体中,能够使品红溶液褪色的是写化学式.2e的相对分子质量就是.3实验室制取少量d的化学方程式是.4a、b、c可能的化学式是.17、7分成了测量某烷样品丁烷,并含少量丙烷等气态烃的平均值相对分子质量,设计了下面的实验:○1取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量得到质量m1.○2往锥形瓶中灌入潮湿的该烷烃样品,纳不好胶塞,精确秤;重复操作方式,直至前后2次秤结果基本相同,获得质量m2.○3往锥形瓶内加满水,塞好胶塞,称量得到质量m3.已知实验时的温度为tk,压强pkpa,水的密度ρ水g/l,空气平均相对分子质量29.0,空气的密度ρ空气g/l,回答下列问题:1本实验的理论依据就是具体内容表明_____________________________________________________________________________________________________________________.2步骤○2中为什么必须重复操作方式,直至后2次秤结果基本相同?请问:_________________________________________________________________________________________.3具体内容表明本实验中怎样努力做到每次测量都就是在相同体积下展开的?请问:_______________________________________________________________________________________. 4本实验搜集气体样品的操作方式,可以采用的方法就是填上图中标号__________. 5锥形瓶内空气的质量m空气是_______________________________________.6瓶中样品的质量m样品就是___________________________________________.7由实验测得该烷烃的平均相对分子质量是______________________________.[567三空均列举算式]15、15,52a-10:20-a31016共9分,每空2分,最后一问3分1so22303cac2+2h2ocaoh2+c2h2↑4n2、co、c2h4写对一个给1分17、1根据阿伏加德罗定律,同温、同压下,2种同体积的相同气体的质量之比等同于它们的相对分子质量之比.1分后2为了保证瓶内的空气完全被排出,并充满了样品气.1分3第一次秤前,锥形瓶塞紧胶塞后,在瓶口处的胶塞上搞一记号,以后每次测量,胶塞插进瓶口的边线都以此为准.1分后4d1分5[m3-m1/ρ水-ρ空气]×ρ空气1分后6m2-m1+m空气[或答:m2-m1+m3-m1/ρ水-ρ空气×ρ空气]1分729.0×m样品/m空气[或请问:29.0×m2-m1/m空气+29.0;或答:29.0×m2-m1/m3-m1×ρ水-ρ空气/ρ空气+29.0]1分。
高一摩尔定律知识点摩尔定律(Mole's Law)是描述气体分子在一定条件下的压强、体积和温度之间的关系的定律。
它在化学领域被广泛应用,为我们理解和计算气体反应提供了重要的依据。
在高一化学学习中,我们需要掌握摩尔定律的相关知识。
1. 摩尔定律的表述摩尔定律可以分为两个部分:波义耳-马略特定律和查理定律。
1.1 波意耳-马略特定律(Boyle's Law)波意耳-马略特定律又称为气体压缩定律,它表明在恒定的温度下,气体的体积与其压强成反比。
即当气体的压强增加时,其体积减小;压强减小时,体积增加。
数学表示为:P₁V₁ = P₂V₂其中,P₁和V₁是气体的初始压强和初始体积,P₂和V₂是气体的终点压强和终点体积。
1.2 查理定律(Charles's Law)查理定律又称为气体膨胀定律,它表明在恒定的压强下,气体的体积与其温度成正比。
即当气体的温度增加时,其体积也增加;温度减小时,体积也减小。
数学表示为:V₁/T₁ = V₂/T₂其中,V₁和T₁是气体的初始体积和初始温度,V₂和T₂是气体的终点体积和终点温度。
2. 摩尔定律的应用摩尔定律可以通过简单的计算来帮助我们理解和预测气体反应中的各种参数变化。
下面是一些常见的应用情况:2.1 压强和体积的关系当我们改变气体的压强时,可以利用波意耳-马略特定律计算出气体的体积变化。
例如,将一定量的气体从一个容器中挤入较小的容器,根据定律可知压强增加,体积减小。
2.2 温度和体积的关系当我们改变气体的温度时,可以利用查理定律计算出气体的体积变化。
例如,将一定量的气体加热,根据定律可以计算出体积的增加量。
3. 摩尔定律的限制条件在应用摩尔定律时,需要满足一些限制条件,才能得到准确的结果。
3.1 理想气体条件摩尔定律适用于理想气体,即分子之间没有相互作用力,体积可以忽略不计。
实际气体会受到分子间吸引力和体积的影响,所以摩尔定律只是近似成立。
3.2 恒定的温度与压强在应用摩尔定律时,需要保持温度和压强恒定。
高一化学必修一学问点汇总第一章一、物质的量: 1、“物质的量”是国际单位制中的基本的物理量之一,用n 表示2、意义:把肯定数目的微观粒子与宏观可称量的物质联系起来,它表示的是物质中所含粒子的多少-分子、原子、离子、质子、电子。
3.留意:“物质的量”是一个物理量的全称,是一个专出名词,不能当成物质的数量或质量来理解,不得随意增减。
二、摩尔——物质的量的单位1、摩尔是“物质的量”的单位。
1摩尔:含有与0.012Kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
它表示的是物质中微粒的个数与阿伏加德罗常数的比值。
=粒子数目物质的量阿伏加德罗常数 AN Nn =2、阿伏加德罗常数(N A )单位:mol -1(/ mol )数值:0.012kg 12C 中所含12C 原子的个数(kgkg2610993.1012.0-⨯) 近似值:6.02×1023mol -1 (6.02×1023/ mol )3、适用范围:只适用于微观粒子,不能应用于宏观物质。
(分子、原子、离子、质子、中子、电子),在运用时必需标明微观粒子的种类,如1molH 、1molH+。
不能用摩尔数代替物质的量。
三、摩尔质量如何由物体质量求出微观粒子个数呢?物质质量−→−物质的量−−−→−⨯AN粒子个数 单个粒子质量很难称量,但大量粒子总质量可称量。
(分子质量约10-26~10-25kg ,若有阿伏加德罗常数个粒子总质量约为10-3~10-2kg ,即1g ~10g ) 1、摩尔质量:单位物质的量的物质所具有的质量。
即每摩尔粒子所具有的质量,用M 表示m M n==物质质量摩尔质量粒子物质的量2、单位:()()mol kg mol kg mol g mol g //,11--⋅⋅或3、摩尔质量的数值,等于该粒子的相对质量。
即:H 2O 分子量为18,H 2O 的摩尔质量为18g/mol4、相关计算例题1.1 mol 水分子中含有约 个水分子(6.02×1023) 0.5mol O 2中含有约 个O 2分子(3.01×1023)2 mol H +中含有约 个H +(1.204×1024)2. 在反应X+2Y=R+2M 中,已知R 和M 的摩尔质量之比为22:9,当1.6克X 与Y 完全反应后,生成4.4克R ,则在此反应中Y 和M 的质量之比为( ) A 、16:9 B 、23:9 C 、32:9 D 、46:93. 下列说法中不正确的是:A 、摩尔是基本物理量之一B 、1mol 氯分子的质量是71gC 、0.5mol 硫酸的质量是49gD 、0.006kg 碳原子的物质的量是0.5mol 4. 下列说法正确的是:A 、6.02×1023就是阿伏加德罗常数B 、1mol Cl 2含有2N A 个氯原子C 、摩尔既可表示质量,又可以表示数量D 、32g O 2所含O 2的摩尔数是1mol其次章 元素与物质世界 第一节 元素与物质的分类 §1、元素与物质的关系元素:是含有相同核电荷数或质子数一类原子的总称。
高一化学必修一知识点要点:气体摩尔体积高一化学必修一知识点要点:气体摩尔体积
气体摩尔体积(Vm)
(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.
(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下, Vm = 22.4 L/mol
化学不像语数英,化学知识相对比较零散,需要学生对课本知识进行归纳总结,建立一个相对完整的知识体系。
不管学生在高二是选择文科还是理科,星火教育网小编希望同学们能够认真学习化学知识,坚持课前预习、课中认真听讲、课后及时复习的良好的学习习惯,努力提高自己的学习效率和质量,争取在每一次考试中都能发挥出自己最佳的水平,取得理想的成绩。
同学们是不是有着聪明的头脑呢?接下来,高一化学必修一知识点要点来供同学们练习从而巩固自己所学过的
知识,大家一定要认真做哦,更多练习高一化学知识点
高一化学必修一知识重点精选:氯离子的检验 17年高一化学必修一知识点:一氧化氮和二氧化氮。
高一化学摩尔知识点总结
摩尔(mole),简称摩,旧称克分子、克原子,是国际单位制7个基本单位之一,表示物质的量,符号为mol。
那么知识点你掌握了多少呢?接下来我为你整理了高一化学摩尔知识点,一起来看看吧。
高一化学摩尔知识点
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)
(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.
(2)单位:g/mol 或 g..mol-1
(3)数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
高一化学摩尔在试验中的应用
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L
(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.
b.配制溶液 1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.
(3)注意事项
A 选用与欲配制溶液体积相同的容量瓶.
B 使用前必须检查是否漏水.
C 不能在容量瓶内直接溶解.
D 溶解完的溶液等冷却至室温时再转移.
E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)
高一化学摩尔化学方程式
化学方程式可以表示反应物和生成物之间的物质的量之比和质量之比。
例如:2H+O=(点燃)=2HO
系数之比2∶1∶2
微粒数之比2∶1∶2
物质的量之比2∶1∶2
质量之比4∶32∶36
从以上分析可知,化学方程式中各物质的系数之比就是它们之间的物质的量之比。
运用这个原理就可以根据化学方程式进行各物质的量的有关计算。
一种碳原子(C)质量的十二分之一,是国际相对原子质量(式量)的基准。
现知12gC中含6.0221367×10个碳原子。
这个数叫阿伏加德罗数,所以也可以说,包含阿伏加德罗数个基本微粒的物质的量就是1mol。
例如1mol 氧分子中含6.0221367×10个氧分子,其质量为31.9988g。
1mol氢离子中含6.0221367×10个氢离子,其质量为1.00794g。
在化学计算中,取近似值6.02×10个。