卤代烃亲核取代反应历程
- 格式:ppt
- 大小:414.00 KB
- 文档页数:8


.
精品 卤代烃的取代反应
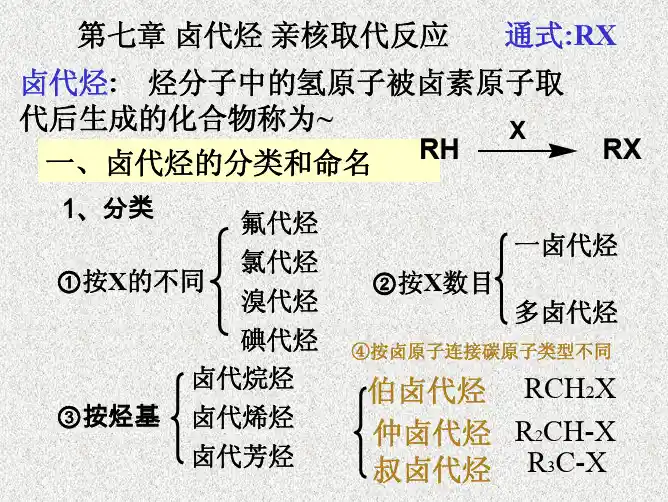
卤代烃中卤原子易被其它基团取代,所以是有机合成中的重要是间体之一,常用R —Br ,碘代烃因价格高而较少使用。
⑴羟基取代
⑵烷氧基取代 R —X + R ’ONa → ROR ’ + NaX
⑶氰基取代 R —X +NaCN → RCN + NaX
这一反应是有机合成中增长碳链的方法之一。
生成时RCN 在H +或OH —催化作用下生成
RCOOH ,碱性条件下还原可生成RCH 2NH 2。
⑷氨基取代 R —X + NH 3(过量) → RNH 2 + HX
此反应若卤代烃过量则还可生成R 2NH 或R 3N 。
注:上述反应特点:①为负离子如OH —、CN —,②有孤对电子的分子如NH 3,它们进攻RX
的
X C δδ:-+,的带正电部分,叫做亲核试剂,这种取代反应叫亲核取代,用SN 表示。
通式为X
R δδ:-++Z :(亲核试剂)→ R :Z + X —。
⑸与AgNO 3醇溶液生成卤化银沉淀
RX + AgNO 3
R O
NO 2+ ⑹卤素置换
RCl(RBr)+NaI 丙酮RI
如有侵权请联系告知删除,感谢你们的配合!。


卤代烃的取代反应
卤代烃中卤原子易被其它基团取代,所以是有机合成中的重要是间体之一,常用R —Br ,碘代烃因价格高而较少使用。
⑴羟基取代
⑵烷氧基取代 R —X + R ’ONa → ROR ’ + NaX
⑶氰基取代 R —X +NaCN → RCN + NaX
这一反应是有机合成中增长碳链的方法之一。
生成时RCN 在H +或OH —催化作用下生
成RCOOH ,碱性条件下还原可生成RCH 2NH 2。
⑷氨基取代 R —X + NH 3(过量) → RNH 2 + HX
此反应若卤代烃过量则还可生成R 2NH 或R 3N 。
注:上述反应特点:①为负离子如OH —、CN —,②有孤对电子的分子如NH 3,它们进
攻RX 的
X C δδ:-+,的带正电部分,叫做亲核试剂,这种取代反应叫亲核取代,用SN 表示。
通式为X R δδ:-+
+Z :(亲核试剂)→ R :Z + X —。
⑸与AgNO 3醇溶液生成卤化银沉淀
RX + AgNO
3R O NO 2+ ⑹卤素置换
RCl(RBr)+NaI 丙酮
RI。

卤代烃经sn2历程反应得到的构型翻转产物
摘要:
1.卤代烃和SN2 反应简介
2.构型翻转产物的概念
3.卤代烃经SN2 历程反应得到的构型翻转产物的具体例子
4.构型翻转产物的性质和应用
正文:
卤代烃是一类有机化合物,它们的分子中含有卤素原子(如氯、溴或碘)。
卤代烃在有机化学中具有广泛的应用,其中一个重要的反应是SN2 反应。
SN2 反应是一种亲核取代反应,它发生在卤代烃与亲核试剂(如醇、胺等)之间。
在这个反应过程中,亲核试剂会进攻卤代烃,将其中的卤素原子替换掉,生成新的有机化合物。
在SN2 反应中,有时候会发生构型翻转现象。
所谓构型翻转,是指反应产物的立体化学构型与反应物相比发生了翻转。
这种现象通常发生在反应过程中,亲核试剂与卤代烃的反应位点相邻的碳原子上有一个氢原子。
在这种情况下,反应产物的构型会与反应物的构型相反。
卤代烃经SN2 历程反应得到的构型翻转产物有很多具体的例子。
例如,当1-氯-2-甲基丙烷与甲醇发生SN2 反应时,会生成1-甲基-2-丙醇,这是一个构型翻转产物。
另一个例子是2-氯-2-甲基丁烷与乙醇发生SN2 反应,生成2-甲基-2-丁醇,这也是一个构型翻转产物。
构型翻转产物具有很多有趣的性质,这些性质使得它们在有机化学中有着广泛的应用。
例如,构型翻转产物通常具有不同的物理和化学性质,这使得它
们在材料科学和生物学中有着特定的应用。
此外,构型翻转产物还可以作为有机合成的中间体,用于合成更复杂的有机化合物。
总之,卤代烃经SN2 历程反应得到的构型翻转产物是一类具有独特性质和应用的有机化合物。

卤代烃亲核取代和消除反应机理亲核取代反应历程卤代烃的亲核取代反应是⼀类重要反应,由于这类反应可⽤于各种官能团的转变,在有机合成中具有⼴泛的⽤途,因此,对其反应历程的研究也就⽐较重要。
在亲核取代反应中,研究最多的是卤代烃的⽔解,在反应的动⼒学、⽴体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动⼒学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进⾏的,即双分⼦亲核取代反应(S N 2反应)和单分⼦亲核取代反应(S N 1反应)。
⼀、双分⼦亲核取代反应(S N 2反应)实验证明:伯卤代烃的⽔解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为⽔解速率,k 为⽔解常数。
因为RCH 2Br 的⽔解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分⼦亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背⾯进攻中⼼碳原⼦。
当亲核试剂与中⼼碳原⼦之间逐渐成键时,离去基团与中⼼碳原⼦之间的键逐渐断裂,新键的形成和旧键的断裂是同步进⾏的协同过程,其反应过程如下所⽰。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可⽤反应进程-势能曲线图表⽰如下:S N 2反应进程中的能量变化3.S N 2反应的⽴体化学:背⾯进攻和构型翻转。
(1)背⾯进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同⼀边或离去基团的背⾯进攻中⼼碳原⼦(C δ+)。
若从离去基团的同⼀边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升⾼,不利于反应的进⾏。
若从离去基团的背⾯进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进⾏。
(2)构型翻转:在S N 2反应中,中⼼碳原⼦由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中⼼碳原⼦的两边,且与中⼼碳原⼦处在同⼀直线上,中⼼碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu⼦与它上⾯的其他三个基团处于同⼀平⾯内。


卤代烃的亲核取代反应亲核取代反应是有机化学中一种重要的反应类型,其中卤代烃作为反应物参与。
这类反应是通过亲核试剂与卤代烃之间的反应来实现,产物通常是新生成的化学键。
在本文中,我们将详细探讨卤代烃的亲核取代反应及其应用。
一、亲核取代反应简介亲核取代反应是一种通过亲核试剂攻击含有可离子性卤素的有机化合物的取代反应。
在这种反应中,亲核试剂以亲核性离子或亲核中心作为活性试剂,攻击卤代烃中的卤素离子,从而将卤素离子取代为新的官能团或基团。
这种取代反应的产物往往具有更加活泼和活性的性质。
二、亲核试剂的选择在亲核取代反应中,选择合适的亲核试剂非常重要。
常见的亲核试剂包括碱(如氢氧化钠、氢氧化钾)、醇类、胺类、硫醇、卤代醇和卤代胺等。
亲核试剂的选择应根据反应的需求以及亲核试剂的性质来确定。
三、亲核取代反应的机理亲核取代反应的机理主要有两种类型:亲核取代SN2反应和亲核取代SN1反应。
1. SN2反应机理:在SN2反应中,亲核试剂以一个步骤进攻卤代烃的碳中心,同时将离去基团踢出。
这种反应机理通常发生在较低的温度下,并且是一种立体选择性反应。
2. SN1反应机理:在SN1反应中,卤代烃首先发生解离,形成卤素离子和一个碳阳离子中间体。
随后,亲核试剂攻击碳阳离子,生成产物。
这种反应机理常发生在较高的温度下,并且不具有立体选择性。
四、亲核取代反应的应用1. 制备醇类化合物:通过亲核取代反应,可以将卤代烃与醇反应,生成醇类化合物。
这种反应常用于有机合成中,特别是制备醇类溶剂或中间体。
2. 制备胺类化合物:亲核取代反应对于合成胺类化合物也非常常见。
卤代烃与胺反应,可以得到相应的胺化合物,该反应广泛用于制备医药和农药中的胺类化合物。
3. 制备酯类化合物:通过卤代烃与醇类反应,可以得到酯类化合物。
这种反应常用于合成食品添加剂、香料以及某些有机合成反应的催化剂。
4. 制备硫醚化合物:卤代烃与硫醇反应,可以生成硫醚化合物。
硫醚是一类重要的有机溶剂和催化剂,具有广泛的应用。

六, 卤代烃的亲核取代反应、消除反应及和金属的反应卤代烃的亲和取代和消除是有机化学中的难点,希望同学们能比较仔细地阅读本部分内容。
这里有一些内容和一般的教科书中介绍的有所不同。
6-1 卤代烃的亲核取代反应,S N1和S N2在有机化学反应中,常常把反应物分为底物和试剂。
在讨论卤代烃的反应中,卤代烃就是底物。
本节主要讨论卤代烷作为底物的取代反应。
卤代烷就是烷烃中的一个氢为卤素取代的“结构为RX(R=烷基,X=卤素)的化合物,又称为烷基卤[化物],P5。
”取代反应就是“分子中某一原子或基团被另一原子或基团替换的基元或分步反应,P86。
”卤代烷的亲核取代反应就是富电子的或带负电荷的试剂把卤代烃中卤素取代下来的反应。
这个反应在合成中非常有用。
例如:RX + Na+ -OH −→ROH + Na+X-RX + Na+ -OR’−→ROR’ + Na+X-制醚的重要方法,称为Williamson醚合成法RX + Na+ -CN −→RCN + Na+X-制腈的重要方法RX + Na+ -C≡CH −→RC≡CH + Na+X-把炔键引入分子从上面的几个反应来看,钠离子没有在反应中起作用,起作用的是-OH、-OR、-CN、-C≡CH等负离子。
是这些负离子把卤素负离子取代了下来。
在这个反应中卤代烷中的卤素是带着一对电子成为卤素负离子离去的,叫做离去基团。
如果把带负电荷的亲核试剂写成Nu-而把离去基团写成-L。
那么卤代烷的亲核取代反应就可以拓展为:R-L + Nu-−→RNu + L-这实际上可看成是一个广义的酸碱反应。
只要是带负电荷的亲核试剂Nu-的碱性比取代下来的离去基团L-的碱性强,这种反应就能发生。
亲核试剂可以是:HO-、RO-、CN-、HC≡C-、RCOO-、CH3COC-HCOOC2H5(以后会知道这就是乙酰乙酸乙酯的合成法)、C2H5OOCC-HCOOC2H5(丙二酸二乙酯合成法)……如果把上面的氧原子换成硫原子,又是一批亲核试剂。
亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。
卤代烃亲核取代反应机理演示一、卤代烃亲核取代反应简介卤代烃亲核取代反应是一类重要的有机化学反应,其机理主要是由亲核试剂攻击卤代烃而产生的。
在该反应中,卤素原子可以被氢、羟基、氨基等亲核试剂所取代,从而形成新的化合物。
这种反应通常需要在有机溶剂中进行,并需要适当的温度和时间。
二、卤代烃亲核取代反应机理1. 亲核试剂的攻击在卤代烃亲核取代反应中,首先需要有一个具有强亲核性质的试剂来攻击卤素原子。
这个试剂通常是一个带有负电荷或富电子密度的分子,例如羟基离子、氨基离子等。
当这些试剂接近到卤素原子附近时,它们会攻击卤素原子上的δ+电荷,从而形成一个共价键。
2. 形成中间体在经过第一步后,形成了一个新的分子,其中一个原子与卤素原子共享了一个电对。
这个中间体通常不稳定,并且容易发生进一步反应。
在某些情况下,这个中间体可以通过脱离卤素原子上的卤素离子来稳定下来。
在其他情况下,这个中间体可以被其他试剂攻击,从而形成更加复杂的化合物。
3. 形成新化合物在经过第二步后,形成了一个新的化合物。
这个新化合物通常是一个取代了卤素原子的分子。
在某些情况下,这个新分子可能会继续发生反应,并形成其他类型的分子。
三、卤代烃亲核取代反应实例1. 羟基离子与卤代烃反应羟基离子是一种强亲核试剂,在有机化学中广泛应用。
当羟基离子接近到卤素原子附近时,它会攻击卤素原子上的δ+电荷,并形成一个共价键。
随后,羟基离子会从卤素原子上脱离出来,并形成一个新的醇分子。
2. 氨基离子与卤代烃反应氨基离子也是一种常见的亲核试剂,在有机化学中广泛应用。
当氨基离子接近到卤素原子附近时,它会攻击卤素原子上的δ+电荷,并形成一个共价键。
随后,氨基离子会从卤素原子上脱离出来,并形成一个新的胺分子。
四、总结卤代烃亲核取代反应是一种重要的有机化学反应,其机理主要是由亲核试剂攻击卤素原子而产生的。
在该反应中,卤素原子可以被氢、羟基、氨基等亲核试剂所取代,从而形成新的化合物。