热力学第二定律复习题
- 格式:doc
- 大小:611.00 KB
- 文档页数:35

第三章 热力学第二定律一、选择题1、恒温恒压可逆相变过程中等于零的量是:A.U ∆;B.H ∆;C.G ∆;D.S ∆。
2、根据熵增大原理:A.隔离系统的熵永不减小;B.绝热系统的熵永不减小;C.系统和环境的熵的和永不减小; D 以上三者都对。
3、纯物质由液态蒸发为气态后其标准摩尔熵:A.增大;B.减小;C.不变;D.因物质种类不知所以不能确定。
4、理想气体的物质的量为n ,从始态A (P 1,V 1,T 1)变到末态B (P 2,V 2,T 2),其熵变的计算公式可用:( )A. ΔS = nRln(P 1/P 2) +⎰21T T p )T /dT C ( B. ΔS = nRln(P 1/P 2)-⎰21T T p )T /dT C ( C. ΔS = nRln(V 1/V 2)+ ⎰21T T p )T /dT C ( D. ΔS = nRln(V 1/V 2)-⎰21T T p )T /dT C ( 5、在标准压力P θ下,383.15K 的水变为同温下的蒸汽,吸热Q p 。
对于该相变过程,以下哪个关系式不能成立?( )A ΔG <0B ΔH=Q pC ΔS 隔离<0D ΔS 隔离>06、ΔG =0 的过程应满足的条件是(A) 等温等压且非体积功为零的可逆过程(B) 等温等压且非体积功为零的过程(C) 等温等容且非体积功为零的过程(D) 可逆绝热过程7、在一定温度下,发生变化的孤立体系,其总熵(A )不变 (B) 可能增大或减小 (C) 总是减小 (D)总是增大8、关于吉布斯函数G , 下面的说法中不正确的是(A) ΔG≤W'在做非体积功的各种热力学过程中都成立(B) 在等温等压且不做非体积功的条件下, 对于各种可能的变动, 系统在平衡态的吉氏函数最小(C) 在等温等压且不做非体积功时, 吉氏函数增加的过程不可能发生(D) 在等温等压下,一个系统的吉氏函数减少值大于非体积功的过程不可能发生9、关于热力学第二定律下列哪种说法是错误的(A) 热不能自动从低温流向高温(B) 不可能从单一热源吸热做功而无其它变化(C) 第二类永动机是造不成的(D) 热不可能全部转化为功10、关于克劳修斯-克拉佩龙方程下列说法错误的是(A) 该方程仅适用于液-气平衡(B) 该方程既适用于液-气平衡又适用于固-气平衡(C) 该方程假定气体的体积远大于液体或固体的体积(D) 该方程假定与固相或液相平衡的气体为理想气体11、关于熵的说法正确的是(A) 每单位温度的改变所交换的热为熵(B) 可逆过程熵变为零(C) 不可逆过程熵将增加(D) 熵与系统的微观状态数有关12、氢气进行不可逆循环(A)ΔU>0 (B) ΔS=0 (C) ΔS>0 (D) ΔS<013、下述过程,体系的ΔG何者为零?(A) 理想气体的等温膨胀(B) 孤立体系的任意过程(C) 在100℃,101325Pa下1mol水蒸发成水汽(D) 绝热可逆过程14、关于熵的性质, 下面的说法中不正确的是(A) 环境的熵变与过程有关(B) 某些自发过程中可以为系统创造出熵(C) 熵变等于过程的热温商(D) 系统的熵等于系统内各部分熵之和15、根据热力学第一定律,在一循环过程中()(A) 功与热可以完全相互转换(B) 功与热都不能完全相互转换(C) 功可以完全转变为热,热不能完全转变为功(D) 功不能完全转变为热,热可以完全转变为功16、在下列过程中, ΔG=ΔA的是(A) 液体等温蒸发(B) 气体绝热可逆膨胀(C) 理想气体在等温下混合(D) 等温等压下的化学反应17、在绝热恒容的系统中,H2和Cl2反应化合成HCl。

物理化学-课后答案-热力学第二定律-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第三章 热力学第二定律【复习题】【1】指出下列公式的适用范围。
(1)min ln BB BS Rnx ∆=-∑;(2)12222111lnln ln ln P v p T V T S nR C nR C p T V T ∆=+=+; (3)dU TdS pdV =-; (4)G Vdp ∆=⎰(5),,S A G ∆∆∆作为判据时必须满足的条件。
【解】 (1)封闭体系平衡态,理想气体的等温混合,混合前后每种气体单独存在时的压力都相等,且等于混合后气体的总压力。
(2)非等温过程中熵的变化过程,对一定量的理想气体由状态A (P 1、V 1、T 1)改变到状态A (P 2、V 2、T 2)时,可由两种可逆过程的加和而求得。
(3)均相单组分(或组成一定的多组分)封闭体系,非体积功为0的任何过程;或组成可变的多相多组分封闭体系,非体积功为0的可逆过程。
(4)非体积功为0,组成不变的均相封闭体系的等温过程。
(5)S ∆:封闭体系的绝热过程,可判定过程的可逆与否; 隔离体系,可判定过程的自发与平衡。
A ∆:封闭体系非体积功为0的等温等容过程,可判断过程的平衡与否; G ∆:封闭体系非体积功为0的等温等压过程,可判断过程的平衡与否;【2】判断下列说法是否正确,并说明原因。
(1)不可逆过程一定是自发的,而自发过程一定是不可逆的; (2)凡熵增加过程都是自发过程; (3)不可逆过程的熵永不减少;(4)系统达平衡时,熵值最大,Gibbs 自由能最小;(5)当某系统的热力学能和体积恒定时,S ∆<0的过程不可能发生;(6)某系统从始态经过一个绝热不可逆过程到达终态,先在要在相同的始、终态之间设计一个绝热可逆过程;(7)在一个绝热系统中,发生了一个不可逆过程,系统从状态1变到了状态2,不论用什么方法,系统再也回不到原来状态了;(8)理想气体的等温膨胀过程,0U ∆=,系统所吸的热全部变成了功,这与Kelvin 的说法不符;(9)冷冻机可以从低温热源吸热放给高温热源,这与Clausius 的说法不符; (10)p C 恒大于V C 。

第三章 热力学第二定律一、思考题1. 自发过程一定是不可逆的,所以不可逆过程一定是自发的。
这说法对吗?答: 前半句是对的,后半句却错了。
因为不可逆过程不一定是自发的,如不可逆压缩过程。
2. 空调、冰箱不是可以把热从低温热源吸出、放给高温热源吗,这是否与第二定律矛盾呢?答: 不矛盾。
Claususe 说的是“不可能把热从低温物体传到高温物体,而不引起其他变化”。
而冷冻机系列,环境作了电功,却得到了热。
热变为功是个不可逆过程,所以环境发生了变化。
3. 能否说系统达平衡时熵值最大,Gibbs 自由能最小?答:不能一概而论,这样说要有前提,即:绝热系统或隔离系统达平衡时,熵值最大。
等温、等压、不作非膨胀功,系统达平衡时,Gibbs 自由能最小。
4. 某系统从始态出发,经一个绝热不可逆过程到达终态。
为了计算熵值,能否设计一个绝热可逆过程来计算?答:不可能。
若从同一始态出发,绝热可逆和绝热不可逆两个过程的终态绝不会相同。
反之,若有相同的终态,两个过程绝不会有相同的始态,所以只有设计除绝热以外的其他可逆过程,才能有相同的始、终态。
5. 对处于绝热瓶中的气体进行不可逆压缩,过程的熵变一定大于零,这种说法对吗? 答: 说法正确。
根据Claususe 不等式TQS d d ≥,绝热钢瓶发生不可逆压缩过程,则0d >S 。
6. 相变过程的熵变可以用公式H ST∆∆=来计算,这种说法对吗?答:说法不正确,只有在等温等压的可逆相变且非体积功等于零的条件,相变过程的熵变可以用公式THS ∆=∆来计算。
7. 是否,m p C 恒大于 ,m V C ?答:对气体和绝大部分物质是如此。
但有例外,4摄氏度时的水,它的,m p C 等于,m V C 。
8. 将压力为101.3 kPa ,温度为268.2 K 的过冷液体苯,凝固成同温、同压的固体苯。
已知苯的凝固点温度为278.7 K ,如何设计可逆过程?答:可以将苯等压可逆变温到苯的凝固点278.7 K :9. 下列过程中,Q ,W ,ΔU ,ΔH ,ΔS ,ΔG 和ΔA 的数值哪些为零?哪些的绝对值相等?(1)理想气体真空膨胀; (2)实际气体绝热可逆膨胀; (3)水在冰点结成冰;(4)理想气体等温可逆膨胀;(5)H 2(g )和O 2(g )在绝热钢瓶中生成水;(6)等温等压且不做非膨胀功的条件下,下列化学反应达到平衡:H 2(g )+ Cl 2(g )(g )答: (1)0Q WU H ==∆=∆=(2)0, R Q S U W =∆=∆= (3)e 0, , P G H Q A W ∆=∆=∆= (4)e 0, =, U H Q W G A ∆=∆=-∆=∆ (5)e = 0V U Q W ∆==(6)0=W,H U Q ∆=∆=,0=∆=∆G A10. 298 K 时,一个箱子的一边是1 mol N 2 (100 kPa),另一边是2 mol N 2 (200 kPa ),中间用隔板分开。

1第三章 热力学第二定律练习题(A )一.选择题1.封闭系统中W’=0时的等温等压化学反应,可用_______式来计算系统的熵变。
A .ΔS =Q TB .ΔS =HTΔ C .ΔS =H GTΔ−Δ D .ΔS =21ln V nR V2.一定量的理想气体经一恒温不可逆压缩过程,则有_____ A .ΔG >ΔA B .ΔG =ΔA C .ΔG <ΔA D .不能确定 3.在一定的温度下,任何系统的吉布斯函数之值均随压力增加而 _____。
A .增大B .不变C .减小D .增减不定4.某非缔合液体在正常沸点时其摩尔气化熵为88J ·mol -1·K -1,其气化热为 22kJ ·mol -1,则其正常沸点最接近于_____。
A .773KB .500KC .250KD .373K5.下列各关系式中 _____是不正确的。
A .()pGS T ∂∂=− B .()TGV p ∂∂= C .2()[]V A U T T T ∂∂=− D .([]p GH T T T∂∂=−二.填空题1.在 的条件下,才可使用ΔG ≤0来判断一个过程是否可逆? 2.系统经可逆循环后,ΔS ____0;经不可逆循环后,ΔS ____ 0。
(填<、>或=) 3. ______系统中,平衡状态的熵值一定是最大值。
4. 一定量的理想气体在300K 由A 态等温变化到B 态,此过程系统吸热1000J ,ΔS =10J ·K -1,据此可判断此过程为_______过程。
5.下列过程中ΔU 、ΔH 、ΔS 、ΔA 或ΔG 何者为零。
(1) 理想气体自由膨胀过程_______。
(2) H 2(g )和Cl 2(g )在绝热的刚性容器中反应生成HCl (g )的过程_______。
(3) 在0℃、101.325kPa 时,水结成冰的相变过程_______。
三.计算题1.初始状态为25℃、100 kPa 、1dm 3的O 2(g ),在外压恒定为10 kPa 的条件下,膨胀到体积为原来的10倍,试计算终态的温度及此过程的ΔH 和ΔS 。

第三章热力学第二定律第三章热力学第二定律一、选择题1.从A 态到B 态可沿两条等温膨胀途径进行,一条可逆,一条不可逆,试判断哪个关系式成立 ( )(A). ΔS 可逆>ΔS 不可逆 (B). W 可逆> W 不可逆(C). Q 可逆> Q 不可逆 (D). (Q+W) 可逆> (Q+W) 不可逆2.热力学基本方程 dG= -SdT+Vdp 可适用于下列哪个过程?A.298K p θ的水的蒸发过程B.理想气体向真空膨胀过程C.电解水制取氢气D.N 2+3H 2→2NH 3未达平衡3. 373K ,1×105Pa 下,有1mol H 2O (l)与373K 的大热源相接触,并使其向真空器皿中蒸发变为373K ,1×105Pa 的H 2O (g),可以用来判断该过程方向的是( )(A) ΔG ;(B) ΔS sys ; (C) Q/T ;(D) ΔS iso 。
4.在等温等压下,将1molN 2与1mol O 2混合,假定两者均为理想气体,混合过程中不发生变化的一组状态函数为()(A) U H V , (B) S H G , (C) V G H , (D) F H S5.对1mol 理想气体,其T V S )(为() (A) –R/V (B) R/P (C) P/T (D) R/V 26.单原子分子理想气体的Cv,m = (3/2)R ,温度由T 1变到T 2时,等容过程系统的熵变(ΔS)v 与等压过程系统的熵变(ΔS)P 之比是()(A) 1:1 (B) 2:1 (C) 3:5 (D) 5:37.从热力学基本方程可导出T PG )(等于() (A)P T G )(?? (B)V S U )(?? (C)T V )A (?? (D)S P H )(??8. 1mol 101.3kPa 某单原子理想气体,反抗外压10.13kPa 作不可逆绝热膨胀,则()A 、ΔS=0,ΔH=0B 、ΔS>0,ΔH ﹤0C 、ΔS<0,ΔH>0D 、ΔS>0,ΔH>09.熵是混乱度的量度,下列说法中不正确的是()A. 同一种物质的Sm (g )>Sm (l )>Sm (s )B.同种物质温度越高熵值越大C. 分子内含有原子数越多熵值越大D.0K 时任何纯物质的熵值都等于零10.25℃时,将11.2升O 2与11.2升N 2混合成11.2升的混合气体,该过程()A 、ΔS >0 ΔG <0B 、ΔS <0 ΔG <0C 、ΔS=0 ΔG=0D 、ΔS=0 ΔG <011.25℃时,将11.2升O 2与11.2升N 2混合成22.4升的混合气体,该过程()A 、ΔS >0 ΔG <0B 、ΔS <0 ΔG <0C 、ΔS=0 ΔG=0D 、ΔS=0 ΔG <012.热力学第二定律表述不正确的是()A 、一切自发过程都是热力学不可逆过程B 、不可能将热从低温物体传递到高温物体C 、第二类永动机是不可能造成的D 、不可能从单一热源吸热,使热全部转化为功而不引起其他变化13. -5℃,1.013×105Pa 时,H 2O(s)→H 2O(l),其体系熵变为( )(A)ΔS<0;(B)ΔS>0;(C )ΔS =0; (D)无法确定。

可编辑修改精选全文完整版四、概念题(一) 填空题1.在高温热源T 1和低温热源T 2之间的卡诺循环, 其热温熵之和()1212Q Q T T +=。
循环过程的热机效率()η=。
2.任一不可逆循环过程的热温熵之和可以表示为()0Q T δ⎛⎫ ⎪⎝⎭⎰不可逆。
3.在绝热密闭的刚性容器中发生某一化学反应,此过程的()sys 0S ∆;()amb0S ∆。
4.系统经可逆循环后,S ∆( )0, 经不可逆循环后S ∆( )。
(填>,=,<)。
5.某一系统在与环境300K 大热源接触下经历一不可逆循环过程,系统从环境得到10kJ 的功,则系统与环境交换的热()Q =;()sys S ∆=;()amb S ∆=。
6.下列过程的△U 、△H 、△S 、△G 何者为零?⑴ 理想气体自由膨胀( );⑵ H 2(g )和Cl 2(g )在绝热的刚性容器中反应生成HCl (g )的过程( );⑶ 在0 ℃、101.325 kPa 下水结成冰的相变过程( )。
⑷ 一定量真实气体绝热可逆膨胀过程( )。
⑸ 实际气体节流膨胀过程( )。
7.一定量理想气体与300K 大热源接触做等温膨胀,吸热Q =600kJ,对外所做功为可逆功的40%,则系统的熵变()S ∆=。
8. 1 mol O 2(p 1,V 1,T 1)和1 mol N 2(p 1,V 1,T 1)混合后,总压为2 p 1,总体积为V 1,温度为T 1,此过程的△S ( )0(填>,<或=,O 2和N 2均可看作理想气体)。
9.热力学第三定律用公式表示为:()()*m S =。
10. 根据 d G =-S d T+V d p 可知任一化学反应的(1)r m ΔTG p ⎛⎫∂= ⎪∂⎝⎭( ); (2)r m ΔPG T ∂⎛⎫= ⎪∂⎝⎭( ); (3)r m ΔPV T ∂⎛⎫= ⎪∂⎝⎭( )。
11.某理想气体在500 K 、100 kPa 时,其m TS p ⎛⎫∂= ⎪∂⎝⎭ ( )(要求填入具体数值和单位)。

二、热力学第二定律(601题)一、选择题( 共152题)1. 1 分(0624)理想气体绝热向真空膨胀,则:( )(A) ΔS = 0,W = 0 (B) ΔH = 0,ΔU = 0(C) ΔG = 0,ΔH = 0 (D) ΔU = 0,ΔG = 02. 1 分(0671)熵变?S是:(1) 不可逆过程热温商之和(2) 可逆过程热温商之和(3) 与过程无关的状态函数(4) 与过程有关的状态函数以上正确的是:( )(A) 1,2 (B) 2,3 (C) 2 (D) 43. 2 分(0675)理想气体在等温条件下反抗恒定外压膨胀,该变化过程中体系的熵变∆S体及环境的熵变∆S环应为:()(A) ∆S体>0,∆S环=0 (B)∆S体<0,∆S环=0(C) ∆S体>0,∆S环<0 (D)∆S体<0,∆S环>04. 2 分(0693)下列四种表述:(1) 等温等压下的可逆相变过程中,体系的熵变ΔS =ΔH相变/T相变(2) 体系经历一自发过程总有d S > 0(3) 自发过程的方向就是混乱度增加的方向(4) 在绝热可逆过程中,体系的熵变为零两者都不正确者为:( )(A) (1),(2) (B) (3),(4)(C) (2),(3) (D) (1),(4)5. 2 分(0694)有三个大热源,其温度T3>T2>T1,现有一热机在下面两种不同情况下工作:(1) 从T3热源吸取Q热量循环一周对外作功W1,放给T1热源热量为(Q-W1)(2) T3热源先将Q热量传给T2热源,热机从T2热源吸取Q热量循环一周, 对外作功W2,放给T1热源(Q-W2) 的热量则上述两过程中功的大小为:( )(A) W1> W2(B) W1= W2(C) W1< W2(D) W1≥W26. 1 分(0695)求任一不可逆绝热过程的熵变ΔS时,可以通过以下哪个途径求得?( )(A) 始终态相同的可逆绝热过程(B) 始终态相同的可逆恒温过程(C) 始终态相同的可逆非绝热过程(D) (B) 和(C) 均可理想气体经可逆与不可逆两种绝热过程:( )(A) 可以从同一始态出发达到同一终态(B) 从同一始态出发,不可能达到同一终态(C) 不能断定(A)、(B) 中哪一种正确(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定8. 1 分(0699)对于孤立体系中发生的实际过程,下列各式中不正确的是:( )(A) W = 0 (B) Q = 0 (C) ΔS > 0 (D) ΔH = 09. 2 分(0705)理想气体从状态I 经自由膨胀到状态II,可用哪个热力学判据来判断该过程的自发性?( )(A) ΔH(B) ΔG(C) ΔS(D) ΔU10. 2 分(0733)p∃,100℃下,1mol H2O(l)与100℃大热源接触,使水在真空容器中汽化为101.325 kPa 的H2O(g),设此过程的功为W,吸热为Q,终态压力为p,体积为V,用它们分别表示ΔU,ΔH,ΔS,ΔG,ΔF,下列答案哪个是正确的?( )11. 1 分(0739)对实际气体的节流膨胀过程,有( )(A) ΔH = 0 (B) ΔS = 0 (C) ΔG = 0 (D) ΔU = 012. 1 分(0742)H2和O2在绝热钢瓶中生成水的过程:( )(A) ΔH = 0 (B) ΔU = 0 (C) ΔS = 0 (D) ΔG = 013. 1 分(0744)选择正确答案,将其标号字母填入括号内。

第三章热力学第二定律一、判断说明题:1. 什么是自发过程?实际过程一定是自发过程?答:体系不需要外界对其作非体积功就可能发生的过程叫自发性过程,或者体系在理论上或实际上能向外界做非体积功的过程叫自发过程。
实际过程不一定是自发性过程,如电解水就是不具有自发性的过程。
2. 为什么热力学第二定律也可表达为:“一切实际过程都是热力学不可逆的”?答:热力学第二定律的经典表述法,实际上涉及的是热与功转化的实际过程的不可逆性。
导使过程的不可逆性都相互关联,如果功与热的转化过程是可逆的,那么所有的实际过程发生后都不会留下痕迹,那也成为可逆的了,这样便推翻了热力学第二定律,也否定了热功转化的不可逆性,则“实际过程都是不可逆的”也不成立。
因而可用“一切实际过程都是不可逆的”来表述热力学第二定律。
3. 可逆过程的热温商与熵变是否相等,为什么? 不可过程的热温商与熵变是否相等?答:可逆过程的热温商即等于熵变。
即ΔS=Q R/T(或ΔS=∫δQ R /T )。
不可逆过程热温商与熵变不等,其原因在于可逆过程的 Q R 大于 Q Ir ,问题实质是不可逆过程熵变由两部分来源,一个是热温商,另一个是内摩擦等不可逆因素造成的。
因此,不可逆过程熵变大于热温商。
由于熵是状态函数,熵变不论过程可逆与否,一旦始终态确定, 则ΔS 值是一定的。
4. 为什么说ΔS A →B -∑B A δQ /T ≥0,式是过程方向的共同判据? 为什么说它也是过程不可逆程度的判据?答:ΔS A →B -∑A B δQ /T ≥0,由于实际过程是不可逆的,该式指出了实际过程只能沿ΔS A →B -∑B A δQ /T 大于零的方向进行;而 ΔS A →B -∑A B δQ /T 小于零的过程是不可能发生的。
因而(2-11)式可作为过程方向的共同判据。
但不是自发过程方向的判据.(ΔS-∑δQ /T ) 的差值越大则实际过程的不可逆程度越大,因此又是不可逆程度的判据。
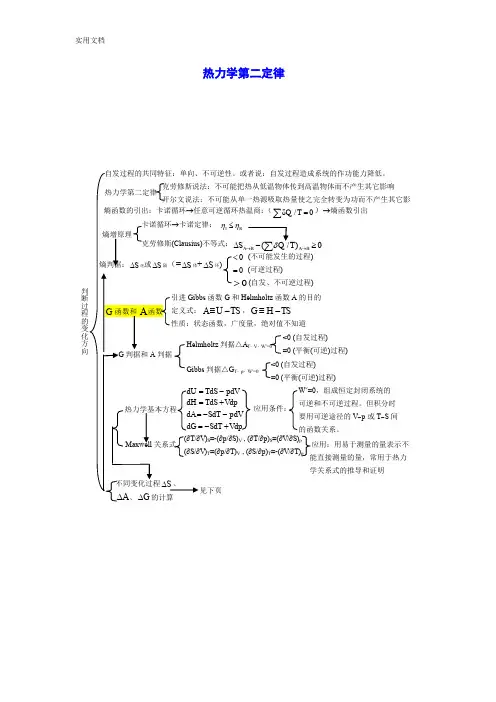
热力学第二定律(r δ/0Q T =∑)→熵函数引出 0< (不可能发生的过程) 0= (可逆过程)0>(自发、不可逆过程)S ∆环)I R ηη≤ 不等式:)0A B iA BS →→∆≥函数G 和Helmholtz 函数A 的目的A U TS ≡-,G H TS ≡-d d d d d d d d T S p VT S V p S T p V S T V p -+---+ W ' =0,组成恒定封闭系统的 可逆和不可逆过程。
但积分时要用可逆途径的V ~p 或T ~S 间 的函数关系。
应用条件: V )S =-(∂p /∂S )V , (∂T /∂p )S =(∂V /∂S )pV )T =(∂p /∂T )V , (∂S /∂p )T =-(∂V /∂T )p应用:用易于测量的量表示不能直接测量的量,常用于热力学关系式的推导和证明<0 (自发过程) =0 (平衡(可逆)过程)判据△A T ,V ,W ’=0判据△G T ,p ,W ’=0<0 (自发过程) =0 (平衡(可逆)过程)基本计算公式/()/rS Q T dU W Tδδ∆==-⎰⎰, △S环=-Q体/T环△A=△U-△(TS) ,d A=-S d T-p d V△G=△H-△(TS) ,d G=-S d T-V d p不同变化过程△S、△A、△G 的计算简单pVT变化(常压下)凝聚相及实际气体恒温:△S =-Q r/T;△A T≈0 ,△G T≈V△p≈0(仅对凝聚相)△A=△U-△(TS),△G=△H-△(TS); △A≈△G恒压变温21,(/)Tp mTS nC T dT∆=⎰nC p,m ln(T2/T1)C p,m=常数恒容变温21,(/)TV mTS nC T dT∆=⎰nC V,m ln(T2/T1)C V,m=常数△A=△U-△(TS),△G=△H-△(TS); △A≈△G理想气体△A、△G的计算恒温:△A T=△G T=nRT ln(p2/p1)=- nRT ln(V2/V1)变温:△A=△U-△(TS),△G=△H-△(TS)计算△S△S=nC V,m ln(T2/T1)+nR ln(V2/V1)= nC p,m ln(T2/T1)-nR ln(p2/p1)= nC V,m ln(p2/p1)+ nC p,m ln(V2/V1)纯物质两相平衡时T~p关系g↔l或s两相平衡时T~p关系任意两相平衡T~p关系:m md/d/p T T V Hββαα=∆∆(Clapeyron方程)微分式:vap m2d lndHpT RT∆=(C-C方程)定积分式:ln(p2/p1)=-△vap H m/R(1/T2-1/T1)不定积分式:ln p=-△vap H m/RT+C恒压相变化不可逆:设计始、末态相同的可逆过程计S=△H/T;△G=0;△A≈0(凝聚态间相变)=-△n(g)RT (g↔l或s)化学变化标准摩尔生成Gibbs函数r m,BG∆定义r m B m,BBS Sν∆=∑,r m B f m,BBH Hν∆=∆∑,r m r m r mG H T S∆=∆-∆或r m B f m,BG Gν∆=∆∑G-H方程(∂△G/∂T)p=(△G-△H)/T或[∂(△G/T)/∂T]p=-△H/T2(∂△A/∂T)V=(△A-△U)/T或[∂(△A/T)/∂T]V=-△U/T2积分式:2r m0()//ln1/21/6G T T H T IR a T bT cT∆=∆+-∆-∆-∆应用:利用G-H方程的积分式,可通过已知T1时的△G(T1)或△A(T1)求T2时的△G(T2)或△A(T2)微分式热力学第三定律及其物理意义规定熵、标准摩尔熵定义任一物质标准摩尔熵的计算一、选择题1. 体系经历一个正的卡诺循环后,试判断下列哪一种说法是错误的? (a ) 体系本身没有任何变化(b ) 再沿反方向经历一个可逆的卡诺循环,最后体系和环境都没有任何变化 (c ) 体系复原了,但环境并未复原 (d ) 体系和环境都没有任何变化(答案) d (什么叫卡诺循环?以理想气体为工作物质,从高温(T h )热源吸收(Q h )的热量,一部分通过理想热机用来对外做功(Wr )另一部分(Qc)的热量放给低温(Tc)热源。

第一章 热力学第一定律一、选择题1-A; 2-C; 3-A; 4-D; 5-B; 6-D; 7-A; 8-D; 9-A; 10-D; 11-B; 12-B; 13- A; 14-C; 15-C; 16-B; 17-C;1.下述说法中,哪一种正确(a )(A)热容C 不是状态函数; (B)热容C 与途径无关;(C)恒压热容C p 不是状态函数;(D)恒容热容C V 不是状态函数。
2.对于内能是体系状态的单值函数概念,错误理解是(c )(A) 体系处于一定的状态,具有一定的内能;(B) 对应于某一状态,内能只能有一数值不能有两个以上的数值;(C) 状态发生变化,内能也一定跟着变化;(D) 对应于一个内能值,可以有多个状态。
3.某高压容器中盛有可能的气体是O 2 ,Ar, CO 2, NH 3中的一种,在298K 时由5dm3绝热可逆膨胀到6dm3,温度降低21K ,则容器中的气体( a )(A) O 2 (B) Ar (C) CO 2 (D) NH 34.戊烷的标准摩尔燃烧焓为-3520kJ·mol -1,CO 2(g)和H 2O(l)标准摩尔生成焓分别为-395 kJ·mol -1和-286 kJ·mol -1,则戊烷的标准摩尔生成焓为( d )(A) 2839 kJ·mol -1 (B) -2839 kJ·mol -1 (C) 171 kJ·mol -1 (D) -171 kJ·mol -15.已知反应)()(21)(222g O H g O g H =+的标准摩尔反应焓为)(T H m r θ∆,下列说法中不正确的是( b )。
(A).)(T H m r θ∆是H 2O(g)的标准摩尔生成焓 (B). )(T H m r θ∆是H 2O(g)的标准摩尔燃烧焓 (C). )(T H m r θ∆是负值 (D). )(T H m r θ∆与反应的θm r U ∆数值相等 6.在指定的条件下与物质数量无关的一组物理量是( d )(A) T , P, n (B) U m , C p, C V(C) ΔH, ΔU, Δξ (D) V m , ΔH f,m (B), ΔH c,m (B)7.实际气体的节流膨胀过程中,下列那一组的描述是正确的( a )(A) Q=0 ΔH=0 ΔP< 0 ΔT≠0 (B) Q=0 ΔH<0 ΔP> 0 ΔT>0(C) Q>0 ΔH=0 ΔP< 0 ΔT<0 (D) Q<0 ΔH=0 ΔP< 0 ΔT≠08.已知反应 H 2(g) + 1/2O 2(g) →H 2O(l)的热效应为ΔH ,下面说法中不正确的是( d )(A) ΔH 是H 2O(l)的生成热 (B) ΔH 是H 2(g)的燃烧热(C) ΔH 与反应 的ΔU 的数量不等 (D) ΔH 与ΔH θ数值相等9.为判断某气体能否液化,需考察在该条件下的( a )(A) μJ-T> 0 (B) μJ-T< 0 (C) μJ-T = 0 (D) 不必考虑μJ-T的数值10.某气体的状态方程为PV=RT+bP(b>0),1mol该气体经等温等压压缩后其内能变化为(d )(A) ΔU>0 (B) ΔU <0 (C) ΔU =0 (D) 该过程本身不能实现11.均相纯物质在相同温度下C V > C P的情况是( b )(A) (∂P/∂T)V<0 (B) (∂V/∂T)P<0(C) (∂P/∂V)T<0 (D) 不可能出现C V>C P12.理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力,则其终态的温度,体积和体系的焓变必定是( b )(A) T可逆> T不可逆, V可逆> V不可逆, ΔH可逆>ΔH不可逆(B) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆<ΔH不可逆(C) T可逆< T不可逆, V可逆> V不可逆, ΔH可逆<ΔH不可逆(D) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆>ΔH不可逆13.1mol、373K、1atm下的水经下列两个不同过程达到373K、1atm下的水汽:(1)等温可逆蒸发,(2)真空蒸发。

热力学第二定律(习题)一、选择题1.关于热力学第一定律和热力学第二定律,下列论述正确的是().A.热力学第一定律指出内能能够与其他形式的能相互转化,而热力学第二定律则指出内能不可能完全转化为其他形式的能,故这两条定律是相互矛盾的B.内能能够转化为其他形式的能,只是会产生其他阻碍,故两条定律并不矛盾C.两条定律差不多上有关能量的转化规律,它们不但不矛盾,而且没有本质区别D.事实上,能量守恒定律差不多包含了热力学第一定律和热力学第二定律2.以下哪个现象不违抗热力学第二定律().A.一杯热茶在打开盖后,茶会自动变得更热B.没有漏气、没有摩擦的理想热机,其效率可能是100%C.桶中浑浊的泥水在静置一段时刻后,泥沙下沉,上面的水变清,泥、水自动分离D.热量自发地从低温物体传到高温物体3.下列关于能量耗散的说法,正确的是().A.能量耗散使能的总量减少,违抗了能量守恒定律B.能量耗散是指耗散在环境中的内能再也不能被人类利用C.各种形式的能量向内能的转化,是能够自动全额发生的D.能量耗散导致能量品质的降低4.关于能源,以下说法中正确的是().A.煤、石油、天然气等燃料的化学能实际上是太阳能转化而成的B.能源的利用过程,实质上是能的转化和转移的过程C.到目前为止,人类所利用的所有能源实际上差不多上太阳能转化而成的D.核能和地热能来自地球本身5.当前世界上日益严峻的环境问题要紧源于().A.温室效应B.厄尔尼诺现象C.人类对环境的污染和破坏D.火山喷发和地震6.下列叙述中不正确的是().A.市区禁止摩托车通行是为了提高城区空气质量B.无氟冰箱的使用会使臭氧层受到不同程度的破坏C.大气中CO2含量的增多是引起温室效应的要紧缘故D.“白色污染”是当前环境爱护亟待解决的问题之一7.如图所示为电冰箱的工作原理图.压缩机工作时,强迫制冷剂在冰箱内外的管道中不断循环.那么,下列说法中正确的是().A.在冰箱内的管道中,制冷剂迅速膨胀并吸取热量B.在冰箱外的管道中,制冷剂迅速膨胀并放出热量C.在冰箱内的管道中,制冷剂被剧烈压缩并吸取热量D.在冰箱内的管道中,制冷剂被剧烈压缩并放出热量8.下面关于热力学第二定律微观意义的说法正确的是().A.从微观的角度看,热力学第二定律是一个统计规律B.一切自然过程总是沿着分子热运动无序性减小的方向进行C.有的自然过程沿着分子热运动无序性增人的方向进行,有的自然过程沿着分子热运动无序性减小的方向进行D.在任何自然过程中,一个孤立系统的总熵可不能减小9.第二类永动机不可能制成,这是因为().A.违抗了能量守恒定律B.热量总是从高温物体传递到低温物体C.机械能不能全部转变为内能D.内能不能全部转化为机械能,同时不引起其他变化10.装有浑浊黄河水的杯子置于与它温度相同的绝热容器中,过一段时问,泥沙沉淀,则杯中水温将().A.升高B.不变C.下降D.无法确定二、填空题11.热量会自动地从________传给________,但可不能自发地从_____ ___传给________,这说明:热传导的过程是有________的,那个过程能够向一个方向自发地进行,然而向相反的方向不能________地进行,要实现相反方向的过程,必须有________,因而产生________或引起________.12.依照热力学定律和分子动理论,可知理想气体在温度升高时,内能(填:不变、增大、减小);第二类永动机不可能制成的要紧缘故是违抗了13.只要确定了________,符合那个________的就叫做有序,有序和无序是相对的.无序意味着各处都一样,没有差别,而有序则相反.14.假如一个“宏观态”对应的“微观态”比较多,就说那个“宏观态”是比较________.三、解答题15.依照你对熵增加原理的说明,举出一些系统从有序变为无序的例子.16.有一座瀑布的高度是50 m,流量为12 m3/s,打算在瀑布底部利用水流能发电,设在瀑布顶处水流速率与从发电机处水轮机内流出速率相等,且水流能有65%被利用,求安装的发电机功率最多多大?(g取10 m/s2)17.水能是可再生能源,可连续地利用它来发电,为人类提供“清洁”的能源,若一水力发电站水库的平均流量为Q(m3/s),落差为h,发电效率为 ,则全年发电量(kW·h)是多少?(g取10m/s2)【答案与解析】一、选择题1.【答案】B【解析】热力学第一定律和热力学第二定律并不矛盾,机械能和内能的转化具有方向性,故B选项正确.2.【答案】C【解析】茶可不能自发地变得更热,选项A错误;不管什么样的热机,效率永久可不能达到100%,选项B错误;热量可不能自发地从低温物体传到高温物体,选项D错误。
热力学第二定律WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】二、热力学第二定律(601题)一、选择题 ( 共152题 )1. 1 分 (0624)理想气体绝热向真空膨胀,则: ( )(A) ΔS = 0,W = 0 (B) ΔH = 0,ΔU = 0(C) ΔG = 0,ΔH = 0 (D) ΔU = 0,ΔG = 02. 1 分 (0671)熵变?S是:(1) 不可逆过程热温商之和(2) 可逆过程热温商之和(3) 与过程无关的状态函数(4) 与过程有关的状态函数以上正确的是:( )(A) 1,2 (B) 2,3 (C) 2 (D) 43. 2 分 (0675)理想气体在等温条件下反抗恒定外压膨胀,该变化过程中体系的熵变∆S体及环境的熵变∆S环应为:()(A) ∆S体>0,∆S环=0 (B)∆S体<0,∆S环=0(C) ∆S体>0,∆S环<0 (D)∆S体<0,∆S环>04. 2 分 (0693)下列四种表述:(1) 等温等压下的可逆相变过程中,体系的熵变ΔS =ΔH相变/T相变(2) 体系经历一自发过程总有 d S > 0(3) 自发过程的方向就是混乱度增加的方向(4) 在绝热可逆过程中,体系的熵变为零两者都不正确者为: ( )(A) (1),(2) (B) (3),(4)(C) (2),(3) (D) (1),(4)5. 2 分 (0694)有三个大热源,其温度T3>T2>T1,现有一热机在下面两种不同情况下工作:(1) 从T3热源吸取Q热量循环一周对外作功W1,放给T1热源热量为(Q-W1)(2) T3热源先将Q热量传给T2热源,热机从T2热源吸取Q热量循环一周, 对外作功W2,放给T1热源 (Q-W2) 的热量则上述两过程中功的大小为: ( )(A) W1> W2 (B) W1= W2 (C) W1< W2 (D) W1≥W26. 1 分 (0695)求任一不可逆绝热过程的熵变ΔS时,可以通过以下哪个途径求得? ( )(A) 始终态相同的可逆绝热过程(B) 始终态相同的可逆恒温过程(C) 始终态相同的可逆非绝热过程(D) (B) 和 (C) 均可7. 2 分 (0696)理想气体经可逆与不可逆两种绝热过程: ( )(A) 可以从同一始态出发达到同一终态(B) 从同一始态出发,不可能达到同一终态(C) 不能断定 (A)、(B) 中哪一种正确(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定8. 1 分 (0699)对于孤立体系中发生的实际过程,下列各式中不正确的是: ( )(A) W = 0 (B) Q = 0 (C) ΔS > 0 (D) ΔH = 09. 2 分 (0705)理想气体从状态 I 经自由膨胀到状态 II,可用哪个热力学判据来判断该过程的自发性? ( )(A) ΔH (B) ΔG (C) ΔS (D) ΔU10. 2 分 (0733)p ,100℃下,1mol H2O(l)与 100℃大热源接触,使水在真空容器中汽化为 kPa 的H2O(g),设此过程的功为W,吸热为Q,终态压力为p,体积为V,用它们分别表示ΔU,ΔH,ΔS,ΔG,ΔF,下列答案哪个是正确的?( )11. 1 分 (0739)对实际气体的节流膨胀过程,有 ( )(A) ΔH = 0 (B) ΔS = 0 (C) ΔG = 0 (D) ΔU = 012. 1 分 (0742)H2和 O2在绝热钢瓶中生成水的过程: ( )(A) ΔH = 0 (B) ΔU = 0 (C) ΔS = 0 (D) ΔG = 013. 1 分 (0744)选择正确答案,将其标号字母填入括号内。
第二章热力学第二定律(习题)第二章热力学第二定律一、填空题1、可逆循环的热温商之和等于,在工作于温度为T1与T2两热源间的所有热机中,只有热机的效率最高,它的效率值可达η= 。
2、历史上曾提出过两类永动机。
第一类永动机指的是就能做功的机器。
因为它违反了定律,所在造不出来。
第二类永动机指的是,它并不违反定律,但它违反了定律,故也是造不出来的。
3、熵是系统的状态函数,按性质的分类,熵属于性质。
在隔离系统中,一切可能发生的宏观过程都是过程,均向着系统的熵值的方向进行。
直至平衡时,熵值达到此条件下的为止。
在隔离系统中绝不会发生熵值的过程。
4、从熵的物理意义上看,它是量度系统的函数。
当物质由它的固态变到液态,再变到气态时,它的熵值应是的。
而当温度降低时,物质的熵值应是的。
热力学第三定律的内容是。
5、下列各公式的适用条件分别是:对亥氏函数判据公式△A≤0,是。
对吉氏函数判据公式△G≤0,是。
对热力学基本方程式,如dG=-SdT+Vdp等,是。
6、热力学第一定律△U=Q+W的适用条件是;热力学第二定律△S≥0作判据时的适用条件是;热力学第三定律S(0K)=0的适用条件是。
7、理想气体的恒温过程为恒的过程;所有气体的节流膨胀为恒过程;所有系统的可逆绝热过程为恒;所有恒温恒压下的可逆相变过程为恒的过程。
8、理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到相同的终态压力,则终态的温度T可逆 T 不可逆,终态的体积V可逆 V不可逆(填入>、<或=)。
9、对于U、H、S、F和G等热力学量,(1)在绝热定容反应器中反应,过程中不变的量是。
(2)在373K和101325Pa下,液体水气化过程中不变的量是。
(3)气体绝热可逆膨胀过程中不变的量是。
(4)理想气体节流膨胀过程中不变的量是。
10、理想气体等温向真空膨胀,体积由V1变到V2,其△U ,△S 。
11、实际气体绝热自由膨胀,其△U 0,△S 0。
12、在、、的条件下,系统的自发变化总是朝着吉布期函数的方向进行的,直到系统达到平衡。
第五章 热力学第二定律一、选择题1 制冷循环工质从低温热源吸热q 2,向高温热源放热q 1,其制冷系数等于AA . 212q q q - B . 211q q q - C . 221q q q - D .121q q q - 2.供暖循环工质从低温热源吸热q 2, 向高温热源放热q 1,其热泵系数等于 BA .212q q q - B . 211q q q - C .221q q q - D .121q q q - 3.卡诺制冷循环的高温热源为温度T 0环境,低温热源温度为T 1,其制冷系数εc = AA .101T T T -B .100T T T -C .1- 10T TD .1-01T T 4.卡诺供暖循环的冷源温度为T 0环境,热源温度为T 1,其热泵系数COP = AA .011T T T -B .010T T T -C .1-10T TD .1-01T T 5.制冷系数ε的取值范围为DA .大于1B .大于1或等于1C .小于1D .大于1, 等于1或小于16.热泵系数COP 的取值范围为AA .大于1B .小于1或等于1C .小于1D .大于1,等于1或小于17.可逆循环的热效率与不可逆循环的热效率相比, DA .前者高于后者B .两者相等C .前者低于后者D .前者可以高于、等于、低于后者8.在两个恒温热源T 1和T 2之间(T 1> T 2),概括性卡诺循环的热效率与卡诺循环的热效率相比, BA .前者高于后者B .两者相等C .前者低于后者D .前者可以高于、等于、低于后者9.多热源可逆循环工质的最高温度为T 1,最低温度为T 2,平均吸热为1T ,平均放热温度为2T ,则其循环热效率为BA .1-12T TB .1-12T TC .1- 2211T T T T --D .1- 1122T T T T --10. 对于可逆循环,⎰T q δ B D A .>0 B .=0C .<0D .=⎰ds 11. 不可逆循环的⎰T q δ C A .>0 B .=0C .<0D .≤0 12. 热力学第二定律指出C DA .能量的总量保持守恒B .第一类永动机不可能成功C .热不能全部变为有用功D .单热源热机不可能成功13. 理想气体经可逆定容过程从T 1升高到T 2,其平均吸热温度12T = AA .(T 2-T 1)/ln 12T T B .C v (T 2-T 1)/ln 12T T C .(T 2-T 1)/ C v ln 12T T D .221T T + 14. 1~A ~2为不可逆过程,1~B ~2为可逆过程,则C DA .⎰21A Tqδ>⎰21B T q δ B .⎰21A T q δ=⎰21B T q δ C .⎰21A T q δ<⎰21B T q δ D .⎰21A ds = ⎰21B ds 15. 自然现象的进行属于BCDA..................................................................................................... 可逆过程B.不可逆过程C.具有方向性过程D.自发过程16. 克劳休斯关于热力学第二定律的表述说明CDA.热不能从低温物体传向高温物体B.热只能从高温物体传向低温物体C.热从低温物体传向高温物体需要补偿条件D.热只能自发地从高温物体传向低温物体17. 对卡诺循环的分析可得到的结论有: ABDA.提高高温热源温度降低低温热源温度可提高热效率B.单热源热机是不可能实现的C.在相同温限下,一切不可逆循环的热效率都低于可逆循环D.在相同温限下,一切可逆循环的热效率均相同18. 卡诺循环是B CA.由两个等温过程和两个绝热过程组成的循环B.热效率最高的循环C. 热源与冷源熵变之和为零的循环D.输出功最大的循环19. 卡诺定理指出: ABCDA.在相同的高温热源和低温热源间工作的一切可逆机的热效率均相同B.在相同高温热源和低温热源间工作的一切不可逆机的热效率必小于可逆机的热效率C.单热源热机是不可能成功的D.提高T1降低T2可以提高t20. A是可逆机,B是不可逆机。
热力学第二定律练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、热力学第二定律的克劳修斯说法是:热从低温物体传给高温物体是不可能的( )2、组成可变的均相系统的热力学基本方程d G=-S d T+V d p+∑=1BBμd n B,既适用于封闭系统也适用于敞开系统。
()3、处在对应状态的两种不同气体,各自对于理想气体行为的偏离程度相同。
( )。
4、热力学第三定律的普朗克说法是:纯物质完美晶体在0 K 时的熵值为零。
( )5、隔离系统的熵是守恒的。
()6、一定量理想气体的熵只是温度的函数。
()7、绝热过程都是定熵过程。
()8、一个系统从始态到终态,只有进行可逆过程才有熵变。
()9、定温定压且无非体积功条件下,一切吸热且熵减少的反应,均不能自发发生。
( )10、系统经历一个不可逆循环过程,其熵变> 0。
()11、系统由状态1经定温、定压过程变化到状态2,非体积功W’<0,且有W’>∆G和∆G<0,则此状态变化一定能发生。
()12、绝热不可逆膨胀过程中∆S >0,则其相反的过程即绝热不可逆压缩过程中∆S <0。
()13、克-克方程适用于纯物质的任何两相平衡。
()14、对于一定的始终态,可逆过程的熵变小于不可逆过程的熵变。
()15、如果一个化学反应的∆r H不随温度变化,则其∆r S也不随温度变化,()16、一定温度下的乙醇水溶液,可应用克—克方程式计算其饱和蒸气压。
()17、只要始、终状态一定,不管由始态到终态进行的过程是否可逆,熵变就一定。
()18、在多相系统中于一定的T,p下物质有从化学势较高的相自发向化学势较低的相转移的趋势。
()19、在-10℃,101.325 kPa下过冷的H2O ( l )凝结为冰是一个不可逆过程,故此过程的熵变大于零。
()20、气体经不可逆绝热膨胀后,因为Q = 0,故其熵变等于零。
()21、理想气体的熵变公式∆S nCVVnCpp p V=⎛⎝⎫⎭⎪+⎛⎝⎫⎭⎪,,ln lnm m2121只适用于可逆过程。
热力学第二定律试题(一)填空题(每题2分)1.气体经绝热不可逆膨胀,?S 0;气体经绝热不可逆压缩,?S 0。
(填>、<、=,下同)2. 1mol单原子理想气体从P1、V1、T1等容冷却到P2、V1、T2,则该过程的?U 0,?S 0,W 0。
3.理想气体的等温可逆膨胀过程中,?S 0,?G 0,??U 0,?H 0。
(填>、<、=)4.1mol液态水在373K、P0下汽化为水蒸气,则?S 0,?G 0,?U 0,?H 0。
(填>、<、=)5.热力学第二定律告诉我们只有过程的热温商才与体系的熵变相等,而不可逆过程的热温商体系的熵变。
6.在等温等压,不作其它功的条件下,自发过程总是超着吉布斯自由能的方向进行,直到自由能改变量为零就达到了态。
(二)单项选择题(每题1分)7.根据热力学第二定律的表述,下列说法错误的是()(A) 第二类永动机服从能量守恒原理 (B) 热不能全部转化为功而不引起其他变化(C) 热不能全部转化为功 (D) 从第一定律的角度看,第二类永动机允许存在8.关于自发过程方向性的说法错误的是()(A) 功可以自发的全部转变成热,但热却不能全部转化为功而不留下其它变化(B) 一切自发过程都是不可逆过程 (C) 一切不可逆过程都是自发过程(D) 功转变成热和其它过程一样具有方向性9.工作在393K和293K的两个大热源的卡诺热机,其效率为()(A) 83% (B) 25% (C) 100% (D) 20%10.在可逆循环过程中,体系热温商之和是()(A) 大于零 (B) 小于零 (C) 等于零 (D) 不能确定11.理想气体等温可逆膨胀过程,()(A) 内能增加 (B) 熵不变 (C) 熵增加 (D) 内能减少12.某体系在始态A和终态B之间有两条途径:可逆Ⅰ和不可逆Ⅱ,此时有()(A) SA =SB(B) QⅠ/T = QⅡ/T (C) ?SⅠ=?SⅡ(D) ?SⅠ=⎰T Q IIδ13.下列说法错误的是()(A) 孤立体系发生的任意过程总是向熵增大的方向进行(B) 体系在可逆过程中的热温商等于体系熵变 (C) 不可逆循环过程的热温商小于熵变(D) 体系发生某一变化时的熵变等于该过程的热温商14.热力学第二定律的表达式为dS≥?Q/T环,则()(A) 始、终态相同时,不可逆过程的熵变小于可逆过程的熵变(B) 如果发生某一过程,体系的熵变与热温商相等,则该过程为不可逆过程(C) 对于孤立体系,dS≥0 (D) 在某些情况,可能有dS≤?Q/T环15.300K时,1mol理想气体由A态等温膨胀到B态,吸热1.00KJ,所作的功为A到B等温可逆膨胀功的1/3,则体系的?S为()(A) 3.33J·K-1(B) 10.0 J·K-1(C) 1.11J·K-1 (D) -3.33 J·K-116.2mol单原子理想气体,等压由300K升温至600K,其?S为()(A) 3.47 J·K-1 (B) -14.4 J·K-1(C) 12.5 J·K-1 (D) 28.8 J·K-117.在标准压力时,苯的沸点为353.15K,1molC6H6(l)完全汽化为同温同压下的苯蒸气。
P199复习题1、指出下列公式的适用范围:(1)∑-=∆BB B mix x n R S ln :理想气体或理想溶液的等温、等压混合过程。
(2)22,,121121ln ln T T p m V mT T nC nC p V S nR dT nR dT p T V T ⎛⎫⎛⎫∆=+=+ ⎪ ⎪⎝⎭⎝⎭⎰⎰:理想气体的物质的量一定从T 1,p 1,V 1到T 2,p 2,V 2的过程。
(3)dU=TdS -pdV :单组分均相封闭系统只做体积功的过程。
(4)G Vdp ∆=⎰:单组分均相封闭系统只做体积功的等温过程。
(5)S ∆、A ∆、G ∆作为判据时必须满足的条件:熵判据:用于隔离系统或绝热系统:dS U ,V ,Wf =0≥0。
亥姆霍兹自由能判据:在等温容下不作其它功的条件下,过程总是沿着A 降低的方向进行,直到A 不再改变,即dA =0时便达到该条件下的平衡态。
吉布斯自由能判据:等温等压下不作其它功的条件下,过程总是沿着G 降低的方向进行,直到G 不再改变,即dG =0时便达到该条件下的平衡态。
2、判断下列说法是否正确,并说明原因:(1)不可逆过程一定是自发的,而自发过程一定是不可逆的。
答:前半句错。
自发过程一定是不可逆的,而并不是所有的不可逆过程都是自发的。
对有些不可逆过程通过对其做功,可使它自发进行。
(2)凡是熵增加的过程都是自发过程。
答:错。
熵判据用于隔离系统或绝热系统:dS U ,V ,Wf =0≥0。
(3)不可逆过程的熵永不减少。
答:错。
对于隔离系统或绝热系统中发生的不可逆过程的熵永不减少。
(4)系统达到平衡时,熵值最大,Gibbs 自由能最小。
答:错。
在隔离系统或绝热系统中,系统达到平衡时,熵值最大。
在等温等压下不作其它功的系统中,系统达到平衡时,Gibbs 自由能最小。
(5)当某系统的热力学能和体积恒定时,0S ∆<的过程不可能发生。
答:错。
对于隔离系统或绝热系统热力学能和体积恒定时,0S ∆<的过程不可能发生。
热力学第二定律(r δ/0Q T =∑)→熵函数引出 0< (不可能发生的过程) 0= (可逆过程)0>(自发、不可逆过程)S ∆环)I R ηη≤ 不等式:)0A B iA BS →→∆≥函数G 和Helmholtz 函数A 的目的A U TS ≡-,G H TS ≡-d d d d d d d d T S p VT S V p S T p V S T V p -+---+ W ' =0,组成恒定封闭系统的 可逆和不可逆过程。
但积分时要用可逆途径的V ~p 或T ~S 间 的函数关系。
应用条件: V )S =-(∂p /∂S )V , (∂T /∂p )S =(∂V /∂S )pV )T =(∂p /∂T )V , (∂S /∂p )T =-(∂V /∂T )p应用:用易于测量的量表示不能直接测量的量,常用于热力学关系式的推导和证明<0 (自发过程) =0 (平衡(可逆)过程)判据△A T ,V ,W ’=0判据△G T ,p ,W ’=0<0 (自发过程) =0 (平衡(可逆)过程)基本计算公式/()/rS Q T dU W Tδδ∆==-⎰⎰, △S环=-Q体/T环△A=△U-△(TS) ,d A=-S d T-p d V△G=△H-△(TS) ,d G=-S d T-V d p不同变化过程△S、△A、△G 的计算简单pVT变化(常压下)凝聚相及实际气体恒温:△S =-Q r/T;△A T≈0 ,△G T≈V△p≈0(仅对凝聚相)△A=△U-△(TS),△G=△H-△(TS); △A≈△G恒压变温21,(/)Tp mTS nC T dT∆=⎰nC p,m ln(T2/T1)C p,m=常数恒容变温21,(/)TV mTS nC T dT∆=⎰nC V,m ln(T2/T1)C V,m=常数△A=△U-△(TS),△G=△H-△(TS); △A≈△G理想气体△A、△G的计算恒温:△A T=△G T=nRT ln(p2/p1)=- nRT ln(V2/V1)变温:△A=△U-△(TS),△G=△H-△(TS)计算△S△S=nC V,m ln(T2/T1)+nR ln(V2/V1)= nC p,m ln(T2/T1)-nR ln(p2/p1)= nC V,m ln(p2/p1)+ nC p,m ln(V2/V1)纯物质两相平衡时T~p关系g↔l或s两相平衡时T~p关系任意两相平衡T~p关系:m md/d/p T T V Hββαα=∆∆(Clapeyron方程)微分式:vap m2d lndHpT RT∆=(C-C方程)定积分式:ln(p2/p1)=-△vap H m/R(1/T2-1/T1)不定积分式:ln p=-△vap H m/RT+C恒压相变化不可逆:设计始、末态相同的可逆过程计S=△H/T;△G=0;△A≈0(凝聚态间相变)=-△n(g)RT (g↔l或s)化学变化标准摩尔生成Gibbs函数r m,BG∆定义r m B m,BBS Sν∆=∑,r m B f m,BBH Hν∆=∆∑,r m r m r mG H T S∆=∆-∆或r m B f m,BG Gν∆=∆∑G-H方程(∂△G/∂T)p=(△G-△H)/T或[∂(△G/T)/∂T]p=-△H/T2(∂△A/∂T)V=(△A-△U)/T或[∂(△A/T)/∂T]V=-△U/T2积分式:2r m0()//ln1/21/6G T T H T IR a T bT cT∆=∆+-∆-∆-∆应用:利用G-H方程的积分式,可通过已知T1时的△G(T1)或△A(T1)求T2时的△G(T2)或△A(T2)微分式热力学第三定律及其物理意义规定熵、标准摩尔熵定义任一物质标准摩尔熵的计算一、选择题1.体系经历一个正的卡诺循环后,试判断下列哪一种说法是错误的?(a)体系本身没有任何变化(b)再沿反方向经历一个可逆的卡诺循环,最后体系和环境都没有任何变化(c)体系复原了,但环境并未复原(d)体系和环境都没有任何变化(答案) d (什么叫卡诺循环?以理想气体为工作物质,从高温(T h)热源吸收(Q h)的热量,一部分通过理想热机用来对外做功(Wr)另一部分(Qc)的热量放给低温(Tc)热源。
这种循环称为卡诺循环。
P102)2.一卡诺热机在两个不同温热源之间运转, 当工作物质为气体时, 热机效率为42%, 若改用液体工作物质, 则其效率应当(a)减少(b)增加(c)不变(d)无法判断(答案) c (卡诺定律的推论?P109-110)3.在pV图上,卡诺循环所包围的面积代表了(a) 循环过程的∑Q(b) 循环过程的自由能变化∑∆G(c) 循环过程的熵变∑∆S(d) 循环过程的焓变∑∆H(答案) a4. 当低温热源的温度趋近于0K 时,卡诺热机的效率(a )趋近于1 (b )趋于无限大(c )趋于0 (d )大于其它可逆热机效率(答案) a (卡诺热机效率h c hc h 1R T T T TT η=--=,卡诺定律?P 108)(所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆机的效率最大。
I R ηη<)5. 关于热力学第二定律下列哪种说法是错误的(a ) 热不能自动从低温流向高温(b ) 不可能从单一热源吸热做功而无其它变化 (c ) 第二类永动机是造不成的 (d ) 热不可能全部转化为功(答案) d (P 107热力学第二定律的开尔文说法和克劳修斯说法) 6. 关于熵的说法正确的是(a ) 每单位温度的改变所交换的热为熵 (b ) 可逆过程熵变为零 (c ) 不可逆过程熵将增加 (d ) 熵与系统的微观状态数有关(答案) d (熵函数的定义P 110-111), BB A R A()Q S S S T δ-=∆=⎰, R d ()QS Tδ=7. 熵变∆S 是: (1) 不可逆过程热温商之和 (2) 可逆过程热温商之和 (3) 与过程无关的状态函数 (4) 与过程有关的状态函数 以上正确的是(a ) 1,2 (b ) 2,3 (c ) 2 (d ) 4(答案) b (熵函数的定义和性质P 110-111),A B A B i()0QS T →→δ∆-≥∑8.任意的可逆循环过程,体系的熵变(a)一定为零 (b)一定大于零 (c)一定为负 (d)是温度的函数(答案) a9.封闭体系经过一循环过程后,则(a ) 体系的熵增加 (b ) U = 0(c ) Q = 0 (d ) 体系的T 、P 都不变(答案) d (什么叫过程函数,什么叫状态函数,状态函数的性质)10.在始末态一定的热力学过程中(a )过程热为定值 (b )可逆热温商为定值 (c )热容为定值 (d )热力学能U 为定值(答案) b11.对于不做非体积功的隔离体系,熵判据为 (a )(d S )T,U ≥0 (b )(d S )p,U ≥0 (c )(d S )U,p ≥0 (d )(d S )U,V ≥0 (答案) d(熵熵判据P 113)>0 不可逆过程dS ad 或 dS iso (=dS sys +dS sur ) =0 可逆过程或平衡状态 <0 不可能发生的过程.11. 在一定速度下发生变化的孤立体系,其总熵的变化是什么?(a) 不变 (b) 可能增大或减小 (c) 总是增大 (d) 总是减小(答案) c (熵增原理P 113-114),A B A B i()0QST→→δ∆-≥∑在绝热条件下,趋向于平衡的过程使体系的熵增加。
或者说在绝热条件下,不可能发生熵减少的过程。
12. 263K的过冷水凝结成263K的冰,则(a)∆S < 0 (b)∆S > 0(c)∆S = 0 (d)无法确定(答案) a12. 根据熵的统计意义可以判断下列过程中何者的熵值增大?(a) 水蒸气冷却成水(b) 石灰石分解生成石灰(c) 乙烯聚合成聚乙烯(d) 理想气体绝热可逆膨胀(答案) b13. 对理想气体等温可逆过程,其计算熵变的公式是:(a) ∆S=-nRT ln(p1/p2)(b) ∆S=nRT ln(V1/V2)(c) ∆S=nR ln(p2/p1)(d) ∆S=nR ln(V2/V1)(答案) d14. 环境的熵变等于 (a)Q T δ体环(b) Q T δ-体环(c)Q T δ体 (d) Q T δ-环环(答案) b15. 室温下,10p 的理想气体节流膨胀至 5p 的过程有 (1) W > 0 (2) T 1> T 2 (3) Q = 0 (4) ∆S > 0 其正确的答案应是:(a) (3),(4) (b) (2),(3) (c) (1),(3) (d) (1),(2)(答案) a因为绝热,所以Q = 0由于理想气体节流膨胀后 T 不变 又W = -p 1V 1+ p 2V 2= nRT 2- nRT 1= 0因此d S = (d U + p d V ) /T = C V d T /T + p d V /T = nR d V /V22,11ln lnv m T V S nC nR T V ∆=+ 21.12ln lnp m T p S nC nR T p ∆=+故()()21211/d ln 0V V S nR V V nR VV ∆==>⎰ (因V 2> V 1)16. 物质的量为n 的理想气体从T 1, p 1, V 1变化到T 2, p 2, V 2,下列哪个公式不适用 (设C V , m 为常数)?(a) ΔS = nC p ,ln(T 1/T 2) + nR ln(p 2/p 1) (b) ΔS = nC V ln(p 2/p 1) + nC p ,m ln(V 2/V 1)(c) ΔS = nC V ,ln(T 2/T 1) + nR ln(V 2/V 1) (d) ΔS = nC p ,ln(T 2/T 1) + nR ln(p 1/p 2)(答案) a17. 纯液体在正常相变点凝固,则下列量减小的是(a)S (b)G (c)蒸汽压 (d)凝固热(答案) a22,11ln lnv m T V S nC nR T V ∆=+ 21.12ln lnp m T p S nC nR T p ∆=+ 22,,11ln lnv m p m p V S nC nC p V ∆=+18. 经一循环过程回到始态,则不一定为零的是(a) ∆G (b) ∆S (c) ∆U (d) Q(答案) d ( 因为U ,G、S皆是状态函数,所以为(d )19. 封闭体系中,若某过程的R A W ∆=,应满足的条件是 (a )等温、可逆过程 (b )等容、可逆过程(c )等温等压、可逆过程 (d )等温等容、可逆过程(答案) a (亥姆霍兹函数的定义和性质P 129-130) <W (Irreversible process) ΔA T=W (reversible process )20. 理想气体绝热向真空膨胀,则(a) ΔS = 0,W = 0 (b) ΔH = 0,ΔU = 0 (c) ΔG = 0,ΔH = 0 (d) ΔU = 0,ΔG = 0(答案) b21. 氮气进行绝热可逆膨胀(a )∆U =0 (b )∆S =0(c )∆A =0 (d )∆G =0(答案) b22. 等容等熵条件下,过程自发进行时,下列关系肯定成立的是(a) ∆G < 0 (b) ∆A < 0 (c) ∆H < 0 (d) ∆U < 0(答案) d 在恒熵恒容时 ,0S V U <⎛⎫∆≤ ⎪⎝⎭自发=平衡。