材料物理化学第四章2
- 格式:ppt
- 大小:1.52 MB
- 文档页数:85


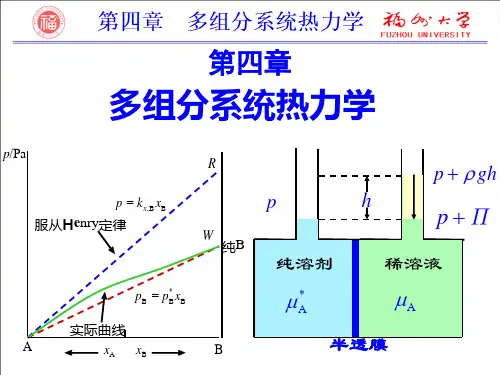




第四章多组分系统热力学4.1有溶剂A与溶质B形成一定组成的溶液。
此溶液中B的浓度为c B,质量摩尔浓度为b B,此溶液的密度为。
以M A,M B分别代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数x B表示时,试导出x B与c B,x B与b B之间的关系。
解:根据各组成表示的定义4.2D-果糖溶于水(A)中形成的某溶液,质量分数,此溶液在20℃时的密度。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为4.3在25℃,1 kg水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度b B介于和之间时,溶液的总体积求:(1) 把水(A )和醋酸(B )的偏摩尔体积分别表示成b B 的函数关系。
(2)时水和醋酸的偏摩尔体积。
解:根据定义当时4.4 60℃时甲醇的饱和蒸气压是84.4 kPa ,乙醇的饱和蒸气压是47.0 kPa 。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60℃时此混合物的平衡蒸气组成,以摩尔分数表示。
解:甲醇的摩尔分数为58980049465004232500423250....x B =+=4.5 80℃时纯苯的蒸气压为100 kPa ,纯甲苯的蒸气压为38.7 kPa 。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80℃时气相中苯的摩尔分数,求液相的组成。
解:4.6在18℃,气体压力101.352 kPa下,1 dm3的水中能溶解O2 0.045 g,能溶解N2 0.02 g。
现将1 dm3被202.65 kPa空气所饱和了的水溶液加热至沸腾,赶出所溶解的O2和N2,并干燥之,求此干燥气体在101.325 kPa,18℃下的体积及其组成。
设空气为理想气体混合物。
其组成体积分数为:,解:显然问题的关键是求出O2和N2的亨利常数。
4.7 20℃下HCl 溶于苯中达平衡,气相中HCl 的分压为101.325 kPa 时,溶液中HCl 的摩尔分数为0.0425。



材料物理化学-第四章晶体的点缺陷与线缺陷第四章晶体结构缺陷晶体缺陷的产⽣与晶体的⽣长条件,晶体中原⼦的热运动以及对晶体的加⼯⼯艺等有关。
事实上,任何晶体即使在绝对零度都含有缺陷,⾃然界中理想晶体是不存在的。
既然存在着对称性的缺陷,平移操作不能复制全部格点,那么空间点阵的概念似乎不能⽤到含有缺陷的晶体中,亦即晶体理论的基⽯不再牢固。
但缺陷的存在只是晶体中局部的破坏。
作为⼀种统计,⼀种近似,⼀种⼏何模型,缺陷存在的⽐例毕竟只是⼀个很⼩的量(这指的是通常的情况),从占有原⼦百分数来说,晶体中的缺陷在数量上是微不⾜道的。
因此,整体上看,可以认为⼀般晶体是近乎完整的。
因⽽对于实际晶体中存在的缺陷可以⽤确切的⼏何图形来描述,这⼀点⾮常重要。
它是我们今后讨论缺陷形态的基本出发点。
事实上,把晶体看成近乎完整的并不是⼀种凭空的假设,⼤量的实验事实(X射线及电⼦衍射实验提供了⾜够的实验证据)都⽀持这种近乎理想的对称性。
当然不能否认,当缺陷⽐例过⾼以致于这种“完整性”⽆论从实验或从理论上都不复存在时,此时的固体便不能⽤空间点阵来描述,也不能被称之为晶体。
这便是材料中的另⼀⼤类别:⾮晶态固体。
对⾮晶固体和晶体,⽆论在原⼦结构理论上或是材料学家对它们完美性追求的哲学思想上都存在着很⼤差异,有兴趣的同学可以对此作进⼀步的理解。
缺陷是晶体理论中最重要的内容之⼀。
晶体的⽣长、性能以及加⼯等⽆⼀不与缺陷紧密相关。
因为正是这千分之⼀、万分之⼀的缺陷,对晶体的性能产⽣了不容⼩视的作⽤。
这种影响⽆论在微观或宏观上都具有相当的重要性。
4.1热⼒学平衡态点缺陷4.1.1 热缺陷的基本类型点缺陷形成的热⼒学平衡当晶体的温度⾼于绝对零度时,晶格内原⼦吸收能量,在其平衡位置附近温度越⾼,热振动幅度加⼤,原⼦的平均动能随之增加。
热振动的原⼦在某⼀瞬间可以获得较⼤的能量,挣脱周围质点的作⽤,离开平衡位置,进⼊到晶格内的其它位置,⽽在原来的平衡格点位置上留下空位。