江苏科技大学08-09第二学期物理化学A卷试题
- 格式:doc
- 大小:242.00 KB
- 文档页数:6
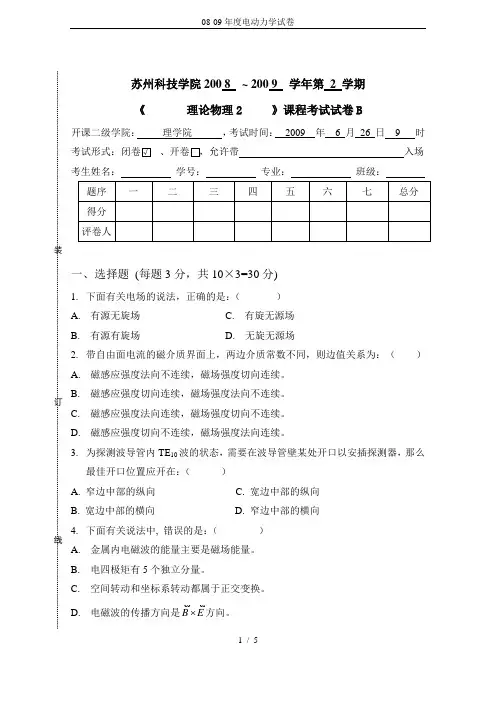
苏州科技学院200 8 ~ 200 9 学年第 2 学期 《 理论物理2 》课程考试试卷B开课二级学院: 理学院 ,考试时间: 2009 年 6 月 26 日 9 时考试形式:闭卷√ 、开卷 ,允许带 入场考生姓名: 学号: 专业: 班级:一、选择题 (每题3分,共10×3=30分)1. 下面有关电场的说法,正确的是:( ) A. 有源无旋场 C. 有旋无源场 B. 有源有旋场 D. 无旋无源场2. 带自由面电流的磁介质界面上,两边介质常数不同,则边值关系为:( ) A. 磁感应强度法向不连续,磁场强度切向连续。
B. 磁感应强度切向连续,磁场强度法向不连续。
C. 磁感应强度法向连续,磁场强度切向不连续。
D. 磁感应强度切向不连续,磁场强度法向连续。
3. 为探测波导管内TE 10波的状态,需要在波导管壁某处开口以安插探测器,那么最佳开口位置应开在:( )A. 窄边中部的纵向 C. 宽边中部的纵向B. 宽边中部的横向 D. 窄边中部的横向 4. 下面有关说法中, 错误的是:( ) A. 金属内电磁波的能量主要是磁场能量。
B. 电四极矩有5个独立分量。
C. 空间转动和坐标系转动都属于正交变换。
D. 电磁波的传播方向是E B方向。
5. 下面有关说法中,错误的是:( ) A. 电场和磁场是一种物质的两个方面。
B. 量子力学中描述磁场的物理量是失势A 。
C. 超导体可看作是磁化率是-1的导体。
D. 一个小电流线圈可以看作由一对正负磁荷组成的磁偶极子。
6. 下面有关说法中,错误的是:( ) A. 在绝缘介质中,磁场的能量等于电场的能量。
B. 理想导体表面,电场线与界面正交,磁感应线与界面相切。
C. 推迟势反映了电磁作用具有一定的传播速度。
D. 电偶极辐射沿轴线方向辐射最强。
7. 下面有关说法,正确的是:( )A. 标量的梯度的旋度为零。
C. 标量的梯度的散度为零。
B. 矢量的散度的旋度为零。
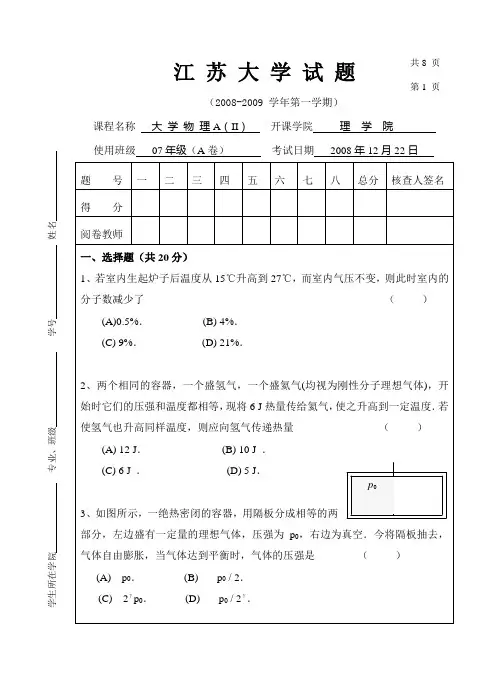
江 苏 大 学 试 题(2008-2009 学年第一学期)课程名称 大 学 物 理A (II ) 开课学院 理 学 院使用班级 07年级(A 卷) 考试日期 2008年12月22日一、选择题(共20分)1、若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数减少了 ( ) (A)0.5%. (B) 4%.(C) 9%. (D) 21%.2、两个相同的容器,一个盛氢气,一个盛氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等,现将6 J 热量传给氦气,使之升高到一定温度.若使氢气也升高同样温度,则应向氢气传递热量 ( ) (A) 12 J . (B) 10 J . (C) 6 J . (D) 5 J .3、如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是 ( ) (A) p 0. (B)p 0 / 2. (C) 2γp 0. (D)p 0 / 2γ.p 0江苏大学试题第2页江苏大学试题第3 页3、(1) 在单缝夫琅禾费衍射实验中,垂直入射的光有两种波长,λ1=400nm,λ2=760nm(1nm=109m)。
已知单缝宽度a=1.0102cm,透镜焦距f=50cm。
求两种光第一级衍射明纹中心之间的距离。
(2) 若用光栅常数d=1.0103cm的光栅替换单缝,其他条件和上一问相同,求两种光第一级主极大之间的距离。
4、质量为m e的电子被电势差U12=100kV的电场加速,如果考虑相对论效应,试计算其德布罗意波的波长。
若不用相对论计算,则相对误差是多少?(电子静止质量m e=9.11⨯10-31kg,普朗克常量h=6.63⨯10-34J⋅s,基本电荷e=1.60⨯10-19C)。
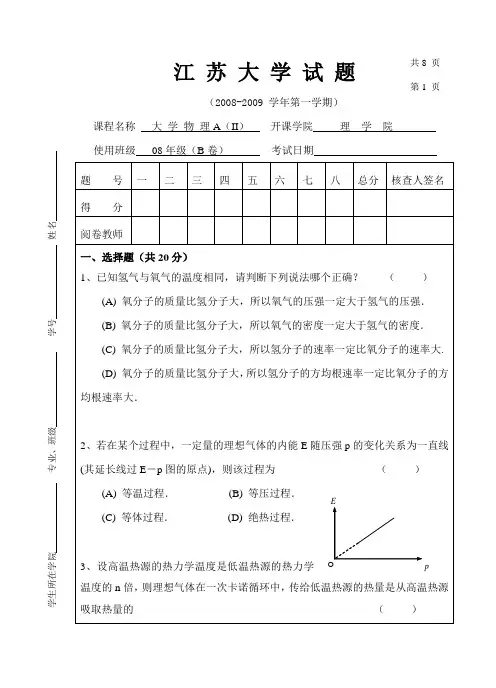
江 苏 大 学 试 题(2008-2009 学年第一学期)课程名称 大 学 物 理A (II ) 开课学院 理 学 院使用班级 08年级(B 卷) 考试日期 题 号 一 二 三 四 五 六 七 八 总分 核查人签名 得 分 阅卷教师一、选择题(共20分)1、已知氢气与氧气的温度相同,请判断下列说法哪个正确? ( )(A) 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强. (B) 氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度. (C) 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大.(D) 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大.2、若在某个过程中,一定量的理想气体的内能E 随压强p 的变化关系为一直线(其延长线过E -p 图的原点),则该过程为 ( )(A) 等温过程. (B) 等压过程.(C) 等体过程. (D) 绝热过程.3、设高温热源的热力学温度是低温热源的热力学温度的n 倍,则理想气体在一次卡诺循环中,传给低温热源的热量是从高温热源吸取热量的 ( )共8 页 第1 页学生所在学院 专业、班级 学号 姓名EpO江苏大学试题第2页(A) n倍.(B) n-1倍.(C) 1/n倍.(D) 1/n n+倍.4、两个质点各自作简谐振动,它们的振幅相同、周期相同.第一个质点的振动方程为1cos()x A tωα=+。
当第一个质点从相对于其平衡位置的正位移处回到平衡位置时,第二个质点正在最大正位移处.则第二个质点的振动方程为()(A)21 cos(π)2x A tωα=++.(B)21 cos(π)2x A tωα=+-.(C)23 cos(π)2x A tωα=+-.(D)2cos()x A tωα=++π.5、若一平面简谐波的表达式为cos()y A Bt Cx=-,式中A、B、C为正值常量,则(A) 波速为C.(B) 周期为1/B.()(C) 波长为2π/C.(D) 角频率为2π/B.6、一机车汽笛频率为750 Hz,机车以时速90公里远离静止的观察者.观察者听到的声音的频率是(设空气中声速为340 m/s).()(A) 810 Hz.(B) 699 Hz.(C) 805 Hz.(D) 695 Hz.7、把双缝干涉实验装置放在折射率为n的水中,两缝间距离为d,双缝到屏的距离为D (D >>d),所用单色光在真空中的波长为λ,则屏上干涉条纹中相邻的明纹之间的距离是()(A) Dλ/ (nd).(B) nλD/d.(C) dλ/ (nD).(D) λD / (2nd).8、在迈克耳孙干涉仪的一支光路中,放入一片折射率为n的透明介质薄膜后,测出江 苏 大 学 试 题 第 3 页两束光的光程差的改变量为一个波长λ,则薄膜的厚度是 ( ) (A) λ/ 2. (B) λ/ (2n).(C) λ/ n . (D)()21n λ-.9、氢原子光谱的巴耳末系中波长最大的谱线用1λ表示,其次大波长用2λ表示,则它们的比值1λ/2λ为: ( ) (A) 20/27. (B) 9/8. (C) 27/20. (D) 16/9.10、将波函数在空间各点的振幅同时增大D 倍,则粒子在空间的分布概率将 (A) 增大D 2倍. (B) 增大2D 倍. ( ) (C) 增大D 倍. . (D) 不变.二、填空题(共36分)1、某理想气体在温度为27℃和压强为1.0×10-2 atm 情况下,密度为 11.3 g/m 3,则这气体的摩尔质量M mol =____________.(普适气体常量R =8.31 J ·mol -1·K -1)2、在相同温度下,氢分子与氧分子的平均平动动能的比值为______________. 方均根速率的比值为__________.3、熵是______________________________________的定量量度.若一定量的理想气体经历一个等温膨胀过程,它的熵将________________________.(填入:增加,减少,不变)4、一弹簧振子系统具有1.0 J 的振动能量,0.10 m 的振幅和1.0 m/s 的最大速率,则弹簧的劲度系数为___________,振子的振动频率为_________.学生所在学院 专业、班级 学号 姓名江苏大学试题第 4 页5、已知一平面简谐波沿x轴正向传播,振动周期T = 0.5 s,波长λ= 10 m,振幅A = 0.1 m.当t = 0时波源振动的位移恰好为正的最大值.若波源处为原点.则沿波传播方向距离波源为12λ处的振动方程为y = __________________.当12t T=时.x = λ/4处质点的振动速度为______________________.6、双缝干涉实验中,若双缝间距由d变为d',使屏上原第10级明纹中心变为第5级明纹中心,则dd:';若在其中一缝后加一透明媒质薄片,使原光线光程增加λ5.2,则此时屏中心处为第级纹。


材料化学考试A卷及答案————————————————————————————————作者:————————————————————————————————日期:学院 专业 班级 学号 姓名 密封线内不要答题 密封线内不要答题江 苏 科 技 大 学 2008 -2009学年 第二学期材料化学A课程试题 ( A )卷一、选择题(本大题共18小题,共20分) 1. 理想液态混合物的通性是A. Δmix V = 0 Δmix H = 0 Δmix S > 0 Δmix G > 0B. Δmix V = 0 Δmix H = 0 Δmix S > 0 Δmix G < 0C. Δmix V > 0 Δmix H > 0 Δmix S > 0 Δmix G < 0D. Δmix V = 0 Δmix H = 0 Δmix S = 0 Δmix G = 02.下列偏微分属于偏摩尔量的是 ,属于化学势的是A. BC n n P T B n H ≠⎪⎪⎭⎫ ⎝⎛∂∂,, B. B C n n V T B n G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, C. B C n n V S B n U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, D. BC n n P T B n A ≠⎪⎪⎭⎫ ⎝⎛∂∂,, E. BC n n P T B n G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, F. ,,C BB T V n n A n ≠⎛⎫∂ ⎪∂⎝⎭3. 在同一温度压力下,一定量某物质的熵值 A. S (气) > S (液) > S (固) B. S (气) < S (液) < S (固) C. S (气) = S (液) = S (固) D. S (气) > S (液) = S (固)4. 克拉贝龙-克劳修斯方程式可用于 和 A. 固 气两相平衡 B. 固 液两相平衡 C. 固固两相平衡 D. 液气两相平衡5. 下列叙述中违反平衡移动原理的是A. 升高温度,平衡向吸热方向移动B. 增加压力,平衡向体积减小的方向移动C. 降低压力,平衡向减小分子数的方向移动D. 增加反应物浓度,平衡向产物浓度增加的方向移动6. 光气 COCl 2 热分解的总反应为: COCl 2 −→−CO+Cl 2 该反应分以下三步完成: Cl 2 2Cl 快速平衡 Cl +COCl 2 −→−CO +Cl 3 慢 Cl 3 Cl 2 +Cl 快速平衡总反应的速率方程为:﹣d c (COCl 2) /d t == kc (COCl 2) ·{c (Cl 2)}12此总反应为 A. 1.5级反应,双分子反应 B. 1.5级反应,不存在反应分子数 C. 1.5级反应,单分子反应D. 不存在反应级数与反应分子数题号 一 二 三 四 五 六 七 八 总分 得分7. 对于只作膨胀功的封闭系统Tp G ⎪⎪⎭⎫ ⎝⎛∂∂的值为 A. 大于零 B. 小于零 C. 等于零 D. 不能确定8. 指出关于亨利定律的下列几点说明中,错误的是 A. 溶质在气相和在溶剂中的分子状态必须相同 B. 溶质必须是非挥发性溶质C. 温度愈高或压力愈低,溶液愈稀,亨利定律愈准确D. 对于混合气体,在总压力不太大时,亨利定律能分别适用于每一种气体,与其它气体的分压力无关9. 电解质溶液的电导率随浓度变化的规律为 A. 随浓度增大而单调地增大 B. 随浓度增大而单调地减小 C. 随浓度增大而先增大后减小 D. 随浓度增大而先减小后增大10. 基元反应 A −→−2Y ,k A 是与A 的消耗速率相对应的速率常数,则有A. d d Y A A c t k c =B. d d Y c t = 2k A c AC. d d Y c t = 12k A c A D. d d Y c t =k A c A 211. 25℃时,电池Pt|H 2(10 kPa)|HCl(b )| H 2(100 kPa)|Pt 的电动势E 为 A. 2×0.059 V B. -0.059 V C. 0.0295 V D. -0.029512. 在一定温度和压力下α,β任意两相平衡时,两相中下述物理量相等的是 A. 摩尔吉布斯函数 B. 摩尔热力学能 C. 摩尔焓 D. 摩尔熵 13. 温度T ,压力p 时理想气体反应:①2H 2O (g) == 2H 2(g) + O 2(g) K 1 ; ② CO 2(g) == CO (g) +21O 2 (g) K 2 ;则反应: ③ CO (g) + H 2O (g) = CO 2 (g) + H 2 (g) 的K 3应为A. K 3 = K 1/ K2B. K 3 = K 1-K2C. K 3) =K 1O / K 214. 标准氢电极是指A. Pt | H 2(p (H 2)=100 kPa) | OH -(a =1)B. Pt | H 2(p (H 2)=100 kPa) | H +(a =10-7)C. Pt | H 2(p (H 2)=100 kPa) | H +(a =1)15. 温度T 时,由化合物的标准摩尔燃烧焓求化学反应 0 = νB BB ∑的标准摩尔反应焓的公式为A. ∆r H (T ) == -∆B∑c H (B, 相态, T )B. ∆r H (T ) == -νB B∑∆c H (B, 相态, T )C. ∆r H (T ) == νB B∑∆c H(B, 相态, T )D. ∆r H (T ) ==∆B∑c H(B, 相态, T )16. 已知铜的相对原子质量为63.54,用0.5F 电量可从CuSO 4溶液中沉淀出多少克铜? A. 64 g B. 16 g C. 32 g D. 127 g17. 弯曲液面所产生的附加压力A. 一定等于零B. 一定不等于零C. 一定大于零D. 一定小于零 18. 憎液固体表面不为液体润湿,其接触角为 A. θ = 0o B. θ > 90o C. θ < 90o D. θ 为任意角二、填空题(本大题共计5小题,共11分,每空1分)19. 当稀溶液中所含溶质为不挥发性溶质以及凝固时析出纯溶剂,则此稀溶液的依数性质有: ___; ; ; 。

(勤奋、求是、创新、奉献)2008~ 2009学年第 二 学期考试试卷主考教师: 陈燕青学院 化学化工学院 班级 __________ 姓名 __________学号 ___________《物理化学(一)》课程试卷A 参考答案与评分标准一、选择题(本题共10小题,每小题2分,共20分)1、 若298 K 时,反应N O g N O g 2422()()=的-1r m 5398J mol G ∆=⋅$,则当p (N 2O 4)=p (NO 2)=1 kPa 时,反应将 ( A )(A)向生成N 2O 4方向进行 (B)向生成NO 2方向进行 (C)反应恰好达到平衡 (D)不能判断其进行的方向2、石墨的燃烧热 ( B )(A) 等于CO 生成热 (B) 等于CO 2生成热(C) 等于金刚石燃烧热 (D) 等于零3、 某绝热封闭体系在接受了环境所做的功之后,其温度: ( A )(A) 一定升高 (B) 一定降低 (C) 一定不变 (D) 不一定改变4、液态苯在一绝热刚性的氧弹中燃烧,其化学反应为:C 6H 6(l)+7.5O 2(g)=6CO 2(g)+3H 2O(g),则下面表示准确的是 ( B )(A )ΔU=0,ΔH<0,Q=0 (B )ΔU=0,ΔH>0,W=0 (C )ΔU=0,ΔH=0,Q=0 (D )ΔU ≠ 0,ΔH ≠ 0,Q=05、 在270K 和大气压力下,一定量的过冷水凝结为同温同压下的冰,则系统和环境的熵变分别为 ( B )(A) ΔS sys <0,ΔS sur <0 (B) ΔS sys <0,ΔS sur >0 (C) ΔS sys >0,ΔS sur <0 (D) ΔS sys >0,ΔS sur >0 6、下列偏微分中,能称为偏摩尔量的是 ( A )(A) )(,,B C n p T B C n V ≠⎪⎪⎭⎫⎝⎛∂∂ (B) )(,,B C n p S B C n H ≠⎪⎪⎭⎫⎝⎛∂∂ (C) )(,,B C n V p B C n G ≠⎪⎪⎭⎫⎝⎛∂∂ (D) )(,,B C n H T B C n S ≠⎪⎪⎭⎫⎝⎛∂∂7、已知反应3O 2(g)=2O 3(g),在298 K 时Θ∆m r H =-280 J·mol -1,则对该反应有利的条件是 ( C )(A) 升温、加压 (B) 升温、降压 (C) 降温、加压 (D) 降温、降压8、 在某反应条件下,反应)()(21)(322g SO g O g SO =+的标准平衡常数Θ1K =0.54。

大学化学专业《大学物理(二)》期末考试试题A卷含答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、设作用在质量为1kg的物体上的力F=6t+3(SI).如果物体在这一力的作用下,由静止开始沿直线运动,在0到 2.0 s的时间间隔内,这个力作用在物体上的冲量大小I=__________________。
2、在热力学中,“作功”和“传递热量”有着本质的区别,“作功”是通过__________来完成的; “传递热量”是通过___________来完成的。
3、某一波长的X光经物质散射后,其散射光中包含波长________和波长________的两种成分,其中_________的散射成分称为康普顿散射。
4、同一种理想气体的定压摩尔热容大于定容摩尔热容,其原因是_______________________________________________。
5、如图所示,轴沿水平方向,轴竖直向下,在时刻将质量为的质点由a处静止释放,让它自由下落,则在任意时刻,质点所受的对点的力矩=________ ;在任意时刻,质点对原点的角动量=_____________。
6、长为、质量为的均质杆可绕通过杆一端的水平光滑固定轴转动,转动惯量为,开始时杆竖直下垂,如图所示。
现有一质量为的子弹以水平速度射入杆上点,并嵌在杆中. ,则子弹射入后瞬间杆的角速度___________。
7、四根辐条的金属轮子在均匀磁场中转动,转轴与平行,轮子和辐条都是导体,辐条长为R,轮子转速为n,则轮子中心O与轮边缘b之间的感应电动势为______________,电势最高点是在______________处。
8、均匀细棒质量为,长度为,则对于通过棒的一端与棒垂直的轴的转动惯量为_____,对于通过棒的中点与棒垂直的轴的转动惯量_____。

苏州科技学院二00八年攻读硕士学位研究生入学考试试题学科、专业:应用化学试题编号:819试题名称:物理化学二、计算题:(共100分)9、(15分)苯在正常沸点353K下的∆vap H mӨ=30.77kJ·mol-1,今将353K及pӨ下的1mol C6H6(l)向真空等温汽化为同温同压的苯蒸气(设为理想气体)。
(1)求算在此过程中苯吸收的热量Q与做的功W;(2)求苯的摩尔汽化熵∆vap S mӨ及摩尔汽化吉布斯自由能∆vap G mӨ;(3)求环境的熵变∆S环;(4)应用有关原理判断上述过程是否为不可逆过程?10、(10分)300℃时,有1mol理想气体作定温膨胀,起始压力p1=1×106Pa,终态体积V2 =10dm-3。
计算该过程的ΔU、ΔH、ΔS、ΔA和ΔG。
11、(15分)在413.15K时,纯C6H5Cl和纯C6H5Br的蒸气压分别为125.238kPa和66.104kPa。
假定两液体组成理想溶液。
若有一混合液,在413.15K,101.325kPa下沸腾,试求该溶液的组成,以及在此情况下液面上蒸气的组成。
12、(15分)若将1mol H2和3mol I2引入一容积为V,温度为T的烧瓶中,当达到平衡时得到x mol的HI,此后再引入2mol H2,新达平衡后得到2x mol的HI。
(1)写出K p,K c,K x,K m之间的关系;(2)求该温度下的K p。
13、(15分)CO2的固态和液态的蒸气压分别由以下两个方程给出:lg(p s/p a)=11.986–1360K/Tlg(p l/p a)=9.729–874K/T计算:(1)二氧化碳三相点的温度和压力;(2)二氧化碳在三相点的熔化热和熔化熵。
14、(15分)试设计一个电池,使其中进行下述反应:Fe2+(a1)+Ag+(a3)ΩAg(s)+Fe3+(a2)(1)写出电池表示式;(2)计算25o C时,上述电池反应的KӨ;(设活度系数均为1)。

、填空题(每小题3分,共30分)得分评卷人2010-2011修/盛第 二 修朝《物理化法》他修京 08 被 专业 驰%修号 得合主考教师: 石谦 试卷类型:(A 卷)题号一 二三 总分 复核人得分 阅卷人1、 298K,以1.0A 电流电解含Ag+溶液,析出1.0 molAg (s ),需时间为 小时。
2、 若CdCh 溶液的离子强度与KC1溶液的离子强度相等,则KC1溶液的浓度应为CdCl 2 溶液的 倍。
3、用同一个电导池分别测定浓度为0.01 mol/kg 和0.1 mol/kg 的两种电解质溶液,其 电阻值分别为1500Q 和500Q ,则它们的摩尔电导率之比为。
4、 质量摩尔浓度为m,平均活度系数为Y 土的Na 2SO 4的活度为。
5、 25°C 时,反应2H 2S+SO 2=3S+2H 2O 达到平衡时,其平衡常数是。
oo(%/财=0.1心,中S °2/S =O .45V )6、 已知(p (Cu 2+/Cu ) =0.337 V ,甲(Cu7Cu ) = 0.521 V ,则(p (Cu 2+/Cu +)^ V 。
7、 电极Pt I Cl 2(p°) I Cr (a ))的还原电极电势的Nemst 方程为。
(A)a(KCl) =a(ZnSO4) (C) y±(KCl)=Y(ZnSO) (B)a±(KCl) =a±(ZnSO4) (D) m±(KCl)=m(ZnSO)5、下列电池中,哪个不是可逆电池:(A) ZnlZnSO4IICuSO4l Cu Pt,H2(g)l HCl(aq)l AgCl.Ag (B)ZnlH2SO4IICuSO4l Cu Pb,PbSO4l H2SO4I PbSO,PbO8、反应物反应掉3/4的时间是半衰期的3倍,则该反应级数为级反应;反应物反应掉3/4的时间是半衰期的2倍,则该反应级数为级反应;反应物反应掉3/4的时间是半衰期的1.5倍,则该反应级数为级反应。

物理化学试题一、单项选择题(每小题2分,共30分)1、下面说法错误的是(A)系统的同一状态可具有不同的体积(B)系统的不同状态可具有相同的体积(C)系统的状态改变了,可能所有的状态函数都要发生改变(D)系统的某一状态改变了,其状态必定发生改变2、理想气体经可逆与不可逆两种绝热过程,则(A)可以从同一始态出发达到同一终态。
(B)不可以达到同一终态。
(C)不能确定以上A、B中哪一种正确。
(D)可以达到同一终态,视绝热膨胀还是绝热压缩而定3、下述说法何者确……………………………………………( )(A)水的生成热即是氧气的燃烧热(B)水蒸汽的生成热即是氧气的燃烧热(C)水的生成热即是氢气的燃烧热(D)水蒸汽的生成热即是氢气的燃烧热4、反应2A+B=C中,反应物A从6mol变到2mol,则反应进度为(A)1mol (B)-2mol (C)4mol (D)2mol5、苯和甲苯在恒温恒压条件下混合形成理想液体混合物,其△mix S… ( )(A) >0 (B) <0 (C) =0 (D) 0第 2 页 共 9 页6、在刚性的密闭容器中,有下列理想气体反应达到平衡A(g)+2 B(g)⇔C(g),若在恒温下加入一定惰性气体,则平衡将(A) 向右移动 (B) 向左移动 (C) 不移动 (D) 无法确定 7、 纯水的凝固点为T f *,沸点为T b *,食盐稀溶液的凝固点为T f ,沸点为T b 则(A) T f *>T f ,T b *<T b (B) T f *<T f ,T b *>T b (C) T f *>T f ,T b *>T b (D) T f *<T f ,T b *<T b 8、反应A=2B 在温度T 时的速率方程为B B A dc dt k c =,则此反应的半衰期为(A) ln2/k B (B) 21n2/k B (C) k B ln2 (D) 2k B ln2 9、下列各式哪一个是对化学势的正确表示(A)C n ,p ,T BB n U ⎪⎪⎭⎫ ⎝⎛∂∂=μ (B)C n ,p ,T B B n G ⎪⎪⎭⎫⎝⎛∂∂=μ(C)C n ,V ,S BB n A⎪⎪⎭⎫⎝⎛∂∂=μ (D)C n ,V ,S B B n H ⎪⎪⎭⎫⎝⎛∂∂=μ10、在讨论稀溶液的蒸气压降低规律时,溶质必须是 (A) 挥发性物质 (B) 电解质(C) 非挥发性物质 (D) 气体物质11、在732K 时反应NH 4Cl(s) = NH 3(g) + HCl(g)的△r G m 为-20.8kJ·mol -1,△r H m 为154kJ·mol -1,则反应的△r S m 为(A)239J·K -1·mol -1 (B) 0.239J·K -1·mol -1 (C) 182J·K -1·mol -1 (D) 0.182J·K -1·mol -112、已知温度为T 时反应H 2O(g) = H 2(g)+1/2O 2(g) 的K 1和反应第 3 页 共 9 页CO 2(g) = CO(g)+1/2 O 2 (g)的K 2,则反应CO(g)+H 2O(g)=CO 2(g)+H 2(g)的K 为(A) K =K 1+K 2 (B) K =K 1×K 2 (C) K =K 1/K 2 (D) K =K 2/K 1 13、在相图上,当系统处于下列哪一点时只存在一个相(A)恒沸点 (B) 熔点 (C) 临界点 (D) 低共熔点 14、一球形肥皂泡半径为r ,肥皂水溶液的表面张力为σ,则泡内的附加压力为(A)2p rσ∆= (B)4p rσ∆=(C)2p r σ∆=(D)4p r σ∆=15、在α、β两相中都含有A 和B 两种物质,当达到相平衡时 (A)()()B μαμα=A (B) ()()A μαμβ=A(C)()()B μβμβ=A (D) ()()B μαμβ=A二、填空题(每小题2分,共10分)1、理想气体在定温下向真空膨胀, ΔU 0,ΔH 0,W 0,ΔS 0 (填>、< 或 = 符号)2、已知18℃时,Ba(OH)2、BaCl 2、NH 4Cl 溶液的极限摩尔电导率分别为22.8810-⨯、21.20310-⨯、21.29810-⨯21S m mol-⋅⋅,那么18℃时NH 4OH 的m∞Λ= 。

大学化学专业《大学物理(下册)》开学考试试卷A卷含答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、两列简谐波发生干涉的条件是_______________,_______________,_______________。
2、已知质点的运动方程为,式中r的单位为m,t的单位为s。
则质点的运动轨迹方程,由t=0到t=2s内质点的位移矢量______m。
3、一束光线入射到单轴晶体后,成为两束光线,沿着不同方向折射.这样的现象称为双折射现象.其中一束折射光称为寻常光,它______________定律;另一束光线称为非常光,它___________定律。
4、在热力学中,“作功”和“传递热量”有着本质的区别,“作功”是通过__________来完成的; “传递热量”是通过___________来完成的。
5、静电场中有一质子(带电荷) 沿图示路径从a点经c点移动到b点时,电场力作功J.则当质子从b点沿另一路径回到a点过程中,电场力作功A=___________;若设a点电势为零,则b点电势=_________。
6、刚体绕定轴转动时,刚体的角加速度与它所受的合外力矩成______,与刚体本身的转动惯量成反比。
(填“正比”或“反比”)。
7、二质点的质量分别为、. 当它们之间的距离由a缩短到b时,万有引力所做的功为____________。
8、在主量子数n=2,自旋磁量子数的量子态中,能够填充的最大电子数是______________。
9、一平面余弦波沿Ox轴正方向传播,波动表达式为,则x = -处质点的振动方程是_____;若以x =处为新的坐标轴原点,且此坐标轴指向与波的传播方向相反,则对此新的坐标轴,该波的波动表达式是_________________________。
江苏科技大学2021-2021学年第二学期大学物理1课程试题(A卷)江苏科技大学 2021 - 2021 学年第二学期专业学号姓名大学物理1题号得分一、选择题(共30分,每题2分) 1、一质点在做圆周运动时,则有:()(A)切向加速度一定改变,法向加速度也改变(B)切向加速度可能不变,法向加速度一定改变(C)切向加速度可能不变,法向加速度不变(D)切向加速度一定改变,法向加速度不变一二三 1 2 课程试题(A卷)3 4 5 总分 2、如图所示,质量为m的物体用平行于斜面的细线连接并置于光滑水平面上,斜面与水平面夹角为?,若斜面向左做加速运动,当物体刚脱离斜面时,它的加速度的大小为()(A)gsin? (B)gcos? (C)gtan? (D)gcot?3、一物体沿着固定圆弧形光滑轨道由静止下滑,在下滑过程中,则()(A)它的加速度方向永远指向圆心,其速率保持不变(B)它受到的轨道的作用力大小不断增加(C)它受到的合外力方向永远指向圆心(D)它受到的轨道作用力永远指向圆心,其速率保持不变4、对质点组有以下说法:(1)质点组总动量的改变与内力无关(2)质点组总动能的改变与内力无关(3)质点组机械能的改变与保守内力无关下列对上述说法判断正确的是: ()(A)只有(1)是正确的(B)(1)、(2)是正确的. (C)(1)、(3)是正确的(D)(2)(3)是正确的5、均匀细棒OA可绕通过其一端O而与棒垂直的水平固定光滑轴转动。
今使棒从水平位置由静止开始自由下落,在棒摆到竖直位置过程中,下列说法正确的是( )(A) 角速度从小到大,角加速度不变. (B) 角速度从小到大,角加速度从小到大 (C) 角速度从小到大,角加速度从大到小. (D) 角速度不变,角加速度为零.6、一小球在光滑水平面上做匀速圆周运动,在运动过程中,小球相对于圆心的()(A)角动量守恒,动量守恒(B)角动量不守恒,动量守恒(C)角动量守恒,动量不守恒(D)角动量不守恒,动量不守恒7、按照相对论时空观,判断下列叙述中正确的是()(A)在一个惯性系中,两个同时的事件,在另一个惯性系中一定是同时事件(B)在一个惯性系中,两个同时的事件,在另一个惯性系中一定是不同时事件(C)在一个惯性系中,两个同时又同地的事件,在另一个惯性系中一定是同时事件(D)在一个惯性系中,两个同时又同地的事件,在另一个惯性系中不一定是同时事件8、一质子静止时质量为m0,将其在加速器中,当速度达到v?0.5c时,其质量m为()(A)m?m0 (B)m?2m0 3(C)m?3m0(D)不能确定 29、下列说法正确的是: ()(A)闭合曲面上各点电场强度都为零时,曲面内一定没有电荷. (B)闭合曲面上各点电场强度都为零时,曲面内电荷的代数和必为零. (C)闭合曲面的电通量为零时,曲面上各点的电场强度必为零.(D)闭合曲面的电通量不为零时,曲面上任意一点的电场强度都不可能为零10、下列几个说法中正确的是()(A) 电场中某点场强的方向,就是将点电荷放在该点所受电场力方向; (B) 在以点电荷为中心的球面上,由该点电荷所产生的场强处处相同;???(C) 场强方向可由E?F定出,其中q为试验电荷的电荷量,q可正可负,F为试验电q荷所受的电场力; (D) 以上说法都不正确; 11、将一个带正电的带电体A从远处移到一个不带电的导体B附近,导体B的电势将() (A)升高;(B)降低; (C)不发生改变; (D)无法确定12、一个半径为R的半球面如图放在均匀磁场中,RθenB通过半球面的磁通量为()(A)2?RB (B)?RB (C)2?RBcos? (D)?RBcos?13、在磁感强度为B 的均匀磁场中,有一圆形载流导线, a、b、c是其上三个长度相等的电流元,则它们所受安培力大小的关系为:()(A)Fa?Fb?Fc (B)Fa?Fb?Fc (C)Fb?Fa?Fc (D)Fb?Fc?Fa14、一根无限长直导线载有电流I,一矩形线圈位于导线平面内沿垂直于载流导线方向以恒定速率运动,则() I (A)线圈中无感应电流(B)线圈中感应电流为顺时针方向(C)线圈中感应电流为逆时针方向(D)线圈中感应电流方向无法确定v15、对静电场和感应电场,下列说法正确的是()(A)静电场和感应电场都是由电荷产生的(B)静电场和感应电场都是保守场(C)静电场是保守场,其电场线是闭合的(D)感应电场是由变化的磁场所激发的,其电场线是闭合的二填空题 (共22分,每空2分)1、质点在oxy平面内运动,其运动方程r?2ti?(19?2t)j,则其速度矢量2222abBc??2?vvv? m/s,加速度矢量a? m/s2,轨迹方程为。
大学化学专业《大学物理(二)》开学考试试卷A卷含答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、如图,在双缝干涉实验中,若把一厚度为e、折射率为n的薄云母片覆盖在缝上,中央明条纹将向__________移动;覆盖云母片后,两束相干光至原中央明纹O处的光程差为_________________。
2、若静电场的某个区域电势等于恒量,则该区域的电场强度为_______________,若电势随空间坐标作线性变化,则该区域的电场强度分布为 _______________。
3、真空中有一半径为R均匀带正电的细圆环,其电荷线密度为λ,则电荷在圆心处产生的电场强度的大小为____。
4、一圆盘正绕垂直于盘面的水平光滑固定轴O转动,如图射来两个质量相同,速度大小相同,方向相反并在一条直线上的子弹,子弹射入圆盘并留在盘内,则子弹射入后的瞬间,圆盘的角速度_____。
5、质量为m的物体和一个轻弹簧组成弹簧振子,其固有振动周期为T.当它作振幅为A的自由简谐振动时,其振动能量E=__________。
6、一质量为0.2kg的弹簧振子, 周期为2s,此振动系统的劲度系数k为_______ N/m。
7、刚体绕定轴转动时,刚体的角加速度与它所受的合外力矩成______,与刚体本身的转动惯量成反比。
(填“正比”或“反比”)。
8、长为的匀质细杆,可绕过其端点的水平轴在竖直平面内自由转动。
如果将细杆置与水平位置,然后让其由静止开始自由下摆,则开始转动的瞬间,细杆的角加速度为_____,细杆转动到竖直位置时角加速度为_____。
9、质量为M的物体A静止于水平面上,它与平面之间的滑动摩擦系数为μ,另一质量为的小球B以沿水平方向向右的速度与物体A发生完全非弹性碰撞.则碰后它们在水平方向滑过的距离L=__________。
学 专业 班级 学号 姓名 密封线内不要答题 密封线内不要答题江 苏 科 技 大 学 2008 -2009学年 第二学期物理化学A课程试题 ( A )卷一、选择题(本大题共18小题,共20分) 1. 理想液态混合物的通性是A. Δmix V = 0 Δmix H = 0 Δmix S > 0 Δmix G > 0B. Δmix V = 0 Δmix H = 0 Δmix S > 0 Δmix G < 0C. Δmix V > 0 Δmix H > 0 Δmix S > 0 Δmix G < 0D. Δmix V = 0 Δmix H = 0 Δmix S = 0 Δmix G = 02.下列偏微分属于偏摩尔量的是 ,属于化学势的是A. BC n n P T B n H ≠⎪⎪⎭⎫ ⎝⎛∂∂,, B. B C n n V T B n G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, C. B C n n V S B n U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, D. BC n n P T B n A ≠⎪⎪⎭⎫ ⎝⎛∂∂,, E. BC n n P T B n G ≠⎪⎪⎭⎫ ⎝⎛∂∂,, F. ,,C BB T V n n A n ≠⎛⎫∂ ⎪∂⎝⎭3. 在同一温度压力下,一定量某物质的熵值 A. S (气) > S (液) > S (固) B. S (气) < S (液) < S (固) C. S (气) = S (液) = S (固) D. S (气) > S (液) = S (固)4. 克拉贝龙-克劳修斯方程式可用于 和 A. 固 气两相平衡 B. 固 液两相平衡 C. 固固两相平衡 D. 液气两相平衡5. 下列叙述中违反平衡移动原理的是A. 升高温度,平衡向吸热方向移动B. 增加压力,平衡向体积减小的方向移动C. 降低压力,平衡向减小分子数的方向移动D. 增加反应物浓度,平衡向产物浓度增加的方向移动6. 光气 COCl 2 热分解的总反应为: COCl 2 −→−CO+Cl 2 该反应分以下三步完成: Cl 2 2Cl 快速平衡 Cl +COCl 2 −→−CO +Cl 3 慢 Cl 3 Cl 2 +Cl 快速平衡总反应的速率方程为:﹣d c (COCl 2) /d t == kc (COCl 2) ·{c (Cl 2)}12此总反应为 A. 1.5级反应,双分子反应 B. 1.5级反应,不存在反应分子数 C. 1.5级反应,单分子反应D. 不存在反应级数与反应分子数7. 对于只作膨胀功的封闭系统Tp G ⎪⎪⎭⎫ ⎝⎛∂∂的值为 A. 大于零 B. 小于零 C. 等于零 D. 不能确定8. 指出关于亨利定律的下列几点说明中,错误的是 A. 溶质在气相和在溶剂中的分子状态必须相同 B. 溶质必须是非挥发性溶质C. 温度愈高或压力愈低,溶液愈稀,亨利定律愈准确D. 对于混合气体,在总压力不太大时,亨利定律能分别适用于每一种气体,与其它气体的分压力无关9. 电解质溶液的电导率随浓度变化的规律为 A. 随浓度增大而单调地增大 B. 随浓度增大而单调地减小 C. 随浓度增大而先增大后减小 D. 随浓度增大而先减小后增大10. 基元反应 A −→−2Y ,k A 是与A 的消耗速率相对应的速率常数,则有A. d d Y A A c t k c =B. d d Y c t = 2k A c AC. d d Y c t = 12k A c A D. d d Y c t =k A c A 211. 25℃时,电池Pt|H 2(10 kPa)|HCl(b )| H 2(100 kPa)|Pt 的电动势E 为 A. 2×0.059 V B. -0.059 V C. 0.0295 V D. -0.029512. 在一定温度和压力下α,β任意两相平衡时,两相中下述物理量相等的是 A. 摩尔吉布斯函数 B. 摩尔热力学能 C. 摩尔焓 D. 摩尔熵 13. 温度T ,压力p 时理想气体反应:①2H 2O (g) == 2H 2(g) + O 2(g) K 1 ; ② CO 2(g) == CO (g) +21O 2 (g) K 2 ;则反应: ③ CO (g) + H 2O (g) = CO 2 (g) + H 2 (g) 的K 3应为A. K 3 = K 1/ K 2 B. K 3 = K 1-K 2 C. K 3) =K 1O / K 214. 标准氢电极是指A. Pt | H 2(p (H 2)=100 kPa) | OH -(a =1)B. Pt | H 2(p (H 2)=100 kPa) | H +(a =10-7)C. Pt | H 2(p (H 2)=100 kPa) | H +(a =1)15. 温度T 时,由化合物的标准摩尔燃烧焓求化学反应 0 = νB BB ∑的标准摩尔反应焓的公式为A. ∆r H (T ) == -∆B∑c H (B, 相态, T )B. ∆r H (T ) == -νB B∑∆c H (B, 相态, T )C. ∆r H (T ) == νB B∑∆c H(B, 相态, T )D. ∆r H (T ) ==∆B∑c H(B, 相态, T )16. 已知铜的相对原子质量为63.54,用0.5F 电量可从CuSO 4溶液中沉淀出多少克铜? A. 64 g B. 16 g C. 32 g D. 127 g17. 弯曲液面所产生的附加压力A. 一定等于零B. 一定不等于零C. 一定大于零D. 一定小于零 18. 憎液固体表面不为液体润湿,其接触角为 A. θ = 0o B. θ > 90o C. θ < 90o D. θ 为任意角二、填空题(本大题共计5小题,共11分,每空1分)19. 当稀溶液中所含溶质为不挥发性溶质以及凝固时析出纯溶剂,则此稀溶液的依数性质有: ___; ; ; 。
20. 指出在真空中(1)CaCO 3(s)部分分解的自由度数F =_______(2)NH 4Cl(s)部分分解的自由度F =_______。
21. 等温等压下影响表面吉布斯函数的因素是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽和⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
k 1 Y22. 平行反应 A ,反应1和反应2的指前因子相同,活化能分别为100 kJ ·mol -1 k 2 Z和70 kJ ·mol -1,当反应在1000 K 进行时,两个反应的反应速率常数之比kk 12= 。
23. 写出离子强度的定义式I = 。
若某溶液中含KCl 0.1mol •kg -1,BaCl 2 0.2 mol •kg -1,该溶液的离子强度I = 。
三、是非题(本大题共10小题,每小题1分)24. 组成可变的均相系统的热力学基本方程 d G =-S d T +V d p +∑BBμd n B ,既适用于封闭系统也适用于敞开系统。
是不是? ( )25. 化学反应的标准平衡常数只是温度的函数。
是不是?( ) 26. 质量作用定律不能适用于非基元反应。
是不是?( )27. 若反应I 的活化能小于反应II 的,则相同温度下反应I 的反应速率常数一定大于反应II的,是不是?( )28. 反应级数不可能为负值。
是不是?( )29. 不可能用简单精馏的方法将二组分恒沸混合物分离为两个纯组分。
是不是? ( ) 30. 某反应,若其反应速率方程式为υA =κA c A 2c B ,则当c B,0>>c A,0时,反应速率方程可约化为假二级反应。
是不是?( )31. 物质的量为n 的理想气体,由T 1,p 1绝热膨胀到T 2,p 2,该过程的焓变化∆H n C T p T T =⎰,m d 12。
对吗?( )32. 因为Q p = ∆H ,Q V = ∆U ,而焓与热力学能是状态函数,所以Q p 与Q V 也是状态函数。
对吗?( )33. 氢电极的标准电极电势在任何温度下都等于零。
是不是?( ) 四、简答题(本大题共2小题,每小题6分) 34.下图为二元凝聚态的相图: ⑴指出各区域的稳定相;⑵画出从a 至d 的冷却曲线并描述冷却过程的相变化情况。
t/℃ 101.325kPaa15 26 3 4dA xB B35. 纯液体、溶液和固体各采用什么方式来降低表面吉布斯函数以达到稳定状态?五、计算题(本大题共47分,共计4小题。
)36.(12分)气相反应A Y+Z为一级反应。
400 K时将气体A引入一抽空的密闭容器中。
开始反应15 min后,测得系统总压力为34.7 kPa。
反应终了时,测得系统总压力为65.6 kPa。
又500 K时测得该反应的半衰期为0.44 min。
试求:(1)反应速率常数及半衰期;(2)反应经历1h后的总压力;(3)反应的活化能。
37.(10分)有一原电池Ag | AgCl(s) | Cl-(a=1)||Cu2+(a=0.01)| Cu。
(1)写出上述原电池的反应式;(2)计算该原电池在25℃时的电动势E;(3)25℃时,原电池反应的吉布斯函数变( r G m)和平衡常数K各为多少?已知:E(Cu2+|Cu) = 0.3402 V,E(Cl-|AgCl|Ag) =0.2223 V, 1 F=96485 C·mol-1。
38.(10分)反应MCO3(s)== MO(s) + CO2(g) (M为某金属)有关数据如下:p,m p,m(1) 求该反应∆r G(T)与T的关系;(2) 该系统温度为127 ℃,总压力为101325 Pa,CO2的摩尔分数为y(CO2)=0.01,系统中MCO3(s) 能否分解为MO(s) 和CO2(g);(3) 为防止MCO3(s)在上述系统中分解,则系统温度应低于多少?(B,298 K) / kJ(B,298 K) / J39.(15分) 将1 mol 某单原子理想气体,从p 1 = 500 kPa ,T 1 = 400 K ,V 1 = 6.6512 ⨯ 10-3 m 3的始态,先绝热可逆膨胀到p 2 = 300 kPa ,然后再绝热,反抗恒定的外压p (环)压缩到V 3 = V 1,p 3 = p (环)的终态。
求题给过程的∆U ,∆H ,∆S ,Q ,W 及p (环)各为若干?39.(15分) 解:1,1221,772,552p mV m RC p T p T C R γγγ-⎛⎫⎛⎫==== ⎪ ⎪⎝⎭⎝⎭或 T T p p R C p 2121=(/)/,m==400353260804K K (/).. (2分) 因 W 2 = ∆U 2,m 323323322()()(/)V nC T T p V V p V nRT p --=-=-即3,m 23322()(/)V V nC T p V nRT p nR--=- 又因V 3=V 1,所以1,m 23122()(/)V VnC T p V nRT p nR --=-故 ,m 23122...535.7k Pa 2.5/V s u r n C T p p V nRT p ====- (2分) T 3 = p 3V B / nR = 428.56 K (1分)∆S = nC V ,m ln ( T 3 / T 1 )= [1.5 ⨯ 8.314 ⨯ ln ( 428.56 / 400 ) ] J ·K -1=0.8601 J ·K -1 (2分) ∆H = nC p.,m ∆T = 1×2.5R×(T 3-T 1) =….= 593.6 J (2分) ∆U = nC v,.m ∆T = 1×1.5R×(T 3-T 1) =….= 356.2 J (2分) ∆U = Q + W (2分) Q = 0, W = ∆U = 356.2 J (2分)。