化学选修4化学反应与原理第一章化学反应与能量知识总结详细版
- 格式:docx
- 大小:61.18 KB
- 文档页数:3

高中化学选修4《化学反应原理》第1
章化学反应与能量转化思维导图.doc
本文介绍了思维导图作为一种终极的思维工具,可以帮助人们整理和记忆信息,提高研究效率。
同时,本文还利用思维导图整理了高中化学《化学反应原理》第一章的基础知识。
化学反应与能量转化是化学学科中的基础知识之一。
其中,1-1节介绍了化学反应的热效应,即反应过程中能量的转化。
化学反应可以放热或吸热,这取决于反应物的能量和反应产物的能量之间的差异。
在反应中,能量的转化可以通过热量计等仪器来测量。
1-2节介绍了电能转化为化学能,即电解。
电解是一种将
电能转化为化学能的过程,可以将离子化合物分解成原子或离子。
在电解中,电流通过电解质溶液,导致离子发生氧化还原反应,从而在电极上产生化学反应。
在电解中,产生的化学反应与电流密切相关。
1-3节介绍了化学能转化为电能,即电池。
电池是一种将
化学能转化为电能的装置,可以将化学反应中产生的能量转化为电能。
电池的工作原理是利用化学反应产生电势差,使电子在电路中流动,从而产生电流。
电池的种类很多,例如原电池、干电池、锂离子电池等。
总之,化学反应与能量转化是化学学科的重要内容,理解其中的原理和机制对于研究化学非常重要。
思维导图作为一种有效的研究工具,可以帮助我们更好地整理和记忆知识,提高研究效率。


第一章化学反应与能量一、化学键与化学反应中能量变化的关系(教材1页、教辅4~5页)1、化学反应的本质化学反应的特征是有新物质的生成,涉及到反应物的化学键断裂,生成物的化学键的形成,而化学键的断裂要吸收能量,化学键的生成要放出能量,使得化学反应中就有了能量的变化。
物质中的原子之间是通过化学键相结合的(有效碰撞)2、化学反应中能量变化的原因在相同条件下,各物质的能量不相同;能量不能再生,也不会消失,只发生形式的转化或传递物质具有的能量越低越稳定,参加化学反应时,化学键断裂就需要吸收更多的能量;反之,物质具有的能量越高越不稳定,参加化学反应时,化学键断裂需要吸收的能量低。
(物质具有的能量大小与化学键的能量大小刚好相反)物质所具有的能量与物质的状态有关:固体(s)、液体(l)、气体(g)、溶液(aq)某种物质从固体转变为液体、再转变为气体是需要吸收能量的,因此对于同种物质,气体所具有的能量最高,固体最低。
在说一个反应的能量变化时,一定要说明物质(反应物和生成物)的状态。
3、化学反应中能量变化形式化学反应都有新物质的生成,同时伴有能量变化;能量变化可表现为热能、光能、电能、声能、功等,通常表现为热能的变化二、常见的放热反应和吸热反应类型㈠、放热反应1、定义:放出热量的化学反应2、能量变化:E反应物的总能量>E生成物的总能量3、类型:①酸碱中和反应②可燃物的燃烧反应(所有的燃烧反应)③金属单质与酸的反应④绝大部分化合反应⑤铝热反应类型⑥炸药的爆炸,如NH4NO3、TNT(三硝基甲苯)等的爆炸⑦氧化钙溶于水、强调:①固体氢氧化钠等溶于水通常理解为物理变化(生成水合离子时放热)②浓H 2SO 4溶于水是一个有争议的问题: 9H 2SO 4·SO 3(生成水合离子时放热)SO 3+H 2O=H 2SO 4是化学变化,但溶液中的溶质主要是H 2SO 4,做题时揣摩题意㈡、吸热反应:1、定义:吸收热量的化学反应2、能量变化:E 反应物的总能量< E 生成物的总能量3、类型: ①铵盐与强碱的反应 NH 4Cl +Ca(OH)2、 NH 4Cl +Ba(OH)2·8H 2O②C 和CO 2的反应,C 与H 2O 在高温下反应,N 2与O 2在放电条件下反应③加热分解的反应(绝大部分分解反应),如KClO 3、KMnO 4、H 2O 2④盐的水解(实质是酸碱中和的逆反应)⑤ H 2+CuO强调:①铵盐溶于水(CH 3COONH 4溶于水)②弱电解质的电离:通常认为电离过程只有化学键的断裂,没有化学键的生成,故不认为是―反应‖三、焓变 反应热 在化学反应过程中同时存在着物质变化和能量的变化,而且二者均符合守恒定律(质量守恒定律、能量守恒定律)在化学反应中,能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主。



选修4 化学反应原理1—4章知识点总结第一章化学反应与能量一、反应热焓变1、定义:化学反应过程中放出或吸收的热量叫做化学反应的反应热.在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。
2、符号:△H3、单位:kJ·mol-14、规定:吸热反应:△H > 0 或者值为“+”,放热反应:△H < 0 或者值为“-”常见的放热反应和吸热反应放热反应吸热反应燃料的燃烧C+CO2, H2+CuO酸碱中和反应C+H2O金属与酸Ba(OH)2.8H2O+NH4Cl大多数化合反应CaCO3高温分解大多数分解反应小结:1、化学键断裂,吸收能量;化学键生成,放出能量2、反应物总能量大于生成物总能量,放热反应,体系能量降低,△H为“-”或小于0反应物总能量小于生成物总能量,吸热反应,体系能量升高,△H为“+”或大于03、反应热数值上等于生成物分子形成时所释放的总能量与反应物分子断裂时所吸收的总能量之差二、热化学方程式1.概念:表示化学反应中放出或吸收的热量的化学方程式.2.意义:既能表示化学反应中的物质变化,又能表示化学反应中的能量变化.[总结]书写热化学方程式注意事项:(1)反应物和生成物要标明其聚集状态,用g、l、s分别代表气态、液态、固态。
(2)方程式右端用△H 标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
(3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
(4)对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比,当化学反应逆向进行时,数值不变,符号相反。
三、盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关。
总结规律:若多步化学反应相加可得到新的化学反应,则新反应的反应热即为上述多步反应的反应热之和。
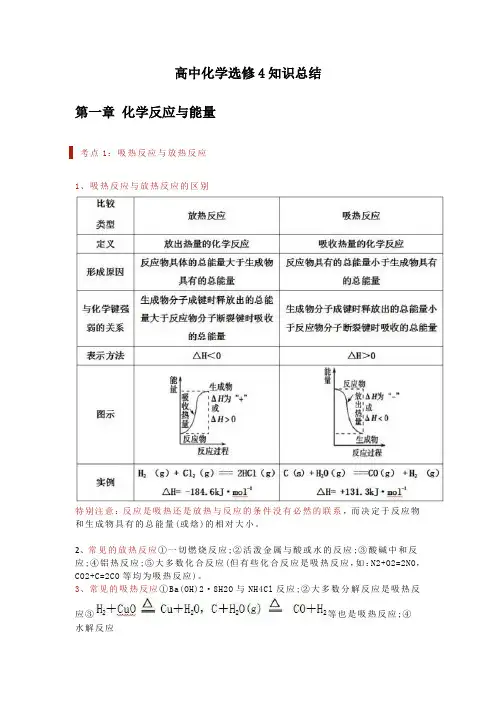
高中化学选修4知识总结第一章化学反应与能量考点1:吸热反应与放热反应1、吸热反应与放热反应的区别特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应①一切燃烧反应;②活泼金属与酸或水的反应;③酸碱中和反应;④铝热反应;⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应①Ba(OH)2·8H2O与NH4Cl反应;②大多数分解反应是吸热反应③等也是吸热反应;④水解反应考点2:反应热计算的依据1.根据热化学方程式计算反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算ΔH=E生成物-E反应物。
3.根据键能计算ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
第二章化学反应速率与化学平衡考点1:化学反应速率1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。
表达式:___________ 。
其常用的单位是__________ 、或__________ 。
2、影响化学反应速率的因素1)内因(主要因素)反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)3、理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞①活化分子:能够发生有效碰撞的分子。
②活化能:如图图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。


选修4知识点汇总一、焓变反应热1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H (2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热放出热量的化学反应。
(放热>吸热)△H 为“-”或△H<0吸收热量的化学反应。
(吸热>放热)△H为“+”或△H>0☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH) 2•8H2O与NH4Cl ②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等二、热化学方程式书写化学方程式注意要点:①热化学方程式必须标出能量变化。
②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)③热化学反应方程式要指明反应时的温度和压强。
④热化学方程式中的化学计量数可以是整数,也可以是分数⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变例:CH4 (g) + 2O2 (g) = CO2 (g) + 2H2O (l) ΔH=-890.3 kJ/mol三、燃烧热1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
燃烧热的单位用kJ/mol表示。
※注意以下几点:①研究条件:25℃,101kPa ②反应程度:完全燃烧,产物是稳定的氧化物。
(C→CO2,S→SO2,H→H2O,只能在氧气中燃烧。
)③燃烧物的物质的量:1mol④研究内容:放出的热量。
(ΔH<0,单位kJ/mol)四、中和热(常考选择:判断热化学方程式是否正确)1.概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。
2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq) +OH-(aq) =H2O(l) ,ΔH=-57.3kJ/mol3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。

化学必修四知识点概括【篇一:化学必修四知识点概括】高中化学选修4知识点总结第1章、化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成,化学反应过程中伴随着能量的释放或吸收.一、化学反应的热效应1、化学反应的反应热(1)反应热的概念:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热.用符号q表示.(2)反应热与吸热反应、放热反应的关系.q>0时,反应为吸热反应;q<0时,反应为放热反应.(3)反应热的测定测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下:q=-c(t2-t1)式中c表示体系的热容,t1、t2分别表示反应前和反应后体系的温度.实验室经常测定中和反应的反应热.2、化学反应的焓变(1)反应焓变(3)反应焓变与吸热反应,放热反应的关系:(4)反应焓变与热化学方程式:书写热化学方程式应注意以下几点:①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq).3、反应焓变的计算(1)盖斯定律对于一个化学反应,无论是一步完成,还是分几步完成,其反应焓变一样,这一规律称为盖斯定律.(2)利用盖斯定律进行反应焓变的计算.对任意反应:aa+bb=cc+dd二、电能转化为化学能——电解1、电解的原理(1)电解的概念:在直流电作用下,电解质在两上电极上分别发生氧化反应和还原反应的过程叫做电解.电能转化为化学能的装置叫做电解池.(2)电极反应:以电解熔融的nacl为例:阳极:与电源正极相连的电极称为阳极,阳极发生氧化反应:2cl-→cl2↑+2e-.阴极:与电源负极相连的电极称为阴极,阴极发生还原反应:na++e-→na.总方程式:2nacl(熔)2na+cl2↑的应用(1)电解食盐水制备烧碱、氯气和氢气.阳极:2cl-→cl2+2e-阴极:2h++e-→h2↑总反应:2nacl+2h2o2naoh+h2↑+cl2↑(2)铜的电解精炼.粗铜(含zn、ni、fe、ag、au、pt)为阳极,精铜为阴极,cuso4溶液为电解质溶液.阳极反应:cu→cu2++2e-,还发生几个副反应zn→zn2++2e-;ni→ni2++2e-fe→fe2++2e-au、ag、pt等不反应,沉积在电解池底部形成阳极泥.阴极反应:cu2++2e-→cu(3)电镀:以铁表面镀铜为例待镀金属fe为阴极,镀层金属cu为阳极,cuso4溶液为电解质溶液.阳极反应:cu→cu2++2e-阴极反应: cu2++2e-→cu三、化学能转化为电能——电池1、原电池的工作原理(1)原电池的概念:把化学能转变为电能的装置称为原电池.(2)cu-zn原电池的工作原理:如图为cu-zn原电池,其中zn为负极,cu为正极,构成闭合回路后的现象是:zn片逐渐溶解,cu片上有气泡产生,电流计指针发生偏转.该原电池反应原理为:zn失电子,负极反应为:zn→zn2++2e-;cu得电子,正极反应为:2h++2e-→h2.电子定向移动形成电流.总反应为:zn+cuso4=znso4+cu.(3)原电池的电能若两种金属做电极,活泼金属为负极,不活泼金属为正极;若一种金属和一种非金属做电极,金属为负极,非金属为正极.2、化学电源(1)锌锰干电池负极反应:zn→zn2++2e-;正极反应:2nh4++2e-→2nh3+h2;(2)铅蓄电池负极反应:pb+so42-pbso4+2e-正极反应:pbo2+4h++so42-+2e-pbso4+2h2o放电时总反应:pb+pbo2+2h2so4=2pbso4+2h2o.充电时总反应:2pbso4+2h2o=pb+pbo2+2h2so4.(3)氢氧燃料电池负极反应:2h2+4oh-→4h2o+4e-正极反应:o2+2h2o+4e-→4oh-电池总反应:2h2+o2=2h2o3、金属的腐蚀与防护(1)金属腐蚀金属表面与周围物质发生化学反应或因电化学作用而遭到破坏的过程称为金属腐蚀.(2)金属腐蚀的电化学原理.生铁中含有碳,遇有雨水可形成原电池,铁为负极,电极反应为:fe→fe2++2e-.水膜中溶解的氧气被还原,正极反应为:o2+2h2o +4e-→4oh-,该腐蚀为“吸氧腐蚀”,总反应为:2fe+o2+2h2o=2fe(oh)2,fe(oh)2又立即被氧化:4fe(oh)2+2h2o+o2=4fe(oh)3,fe(oh)3分解转化为铁锈.若水膜在酸度较高的环境下,正极反应为:2h++2e-→h2↑,该腐蚀称为“析氢腐蚀”.(3)金属的防护金属处于干燥的环境下,或在金属表面刷油漆、陶瓷、沥青、塑料及电镀一层耐腐蚀性强的金属防护层,破坏原电池形成的条件.从而达到对金属的防护;也可以利用原电池原理,采用牺牲阳极保护法.也可以利用电解原理,采用外加电流阴极保护法.第2章、化学反应的方向、限度与速率(1、2节)原电池的反应都是自发进行的反应,电解池的反应很多不是自发进行的,如何判定反应是否自发进行呢?一、化学反应的方向1、反应焓变与反应方向2、反应熵变与反应方向3、焓变与熵变对反应方向的共同影响二、化学反应的限度1、化学平衡常数(1)对达到平衡的可逆反应,生成物浓度的系数次方的乘积与反应物浓度的系数次方的乘积之比为一常数,该常数称为化学平衡常数,用符号k表示 .(2)平衡常数k的大小反映了化学反应可能进行的程度(即反应限度),平衡常数越大,说明反应可以进行得越完全.(3)平衡常数表达式与化学方程式的书写方式有关.对于给定的可逆反应,正逆反应的平衡常数互为倒数.(4)借助平衡常数,可以判断反应是否到平衡状态:当反应的浓度商qc 与平衡常数kc相等时,说明反应达到平衡状态.2、反应的平衡转化率(1)平衡转化率是用转化的反应物的浓度与该反应物初始浓度的比值来表示.如反应物a的平衡转化率的表达式为:(2)平衡正向移动不一定使反应物的平衡转化率提高.提高一种反应物的浓度,可使另一反应物的平衡转化率提高.(3)平衡常数与反应物的平衡转化率之间可以相互计算.3、反应条件对化学平衡的影响(1)温度的影响升高温度使化学平衡向吸热方向移动;降低温度使化学平衡向放热方向移动.温度对化学平衡的影响是通过改变平衡常数实现的.(2)浓度的影响增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;增大反应物浓度或减小生成物浓度,平衡向正反应方向移动.温度一定时,改变浓度能引起平衡移动,但平衡常数不变.化工生产中,常通过增加某一价廉易得的反应物浓度,来提高另一昂贵的反应物的转化率.(3)压强的影响(4)勒夏特列原理由温度、浓度、压强对平衡移动的影响可得出勒夏特列原理:如果改变影响平衡的一个条件(浓度、压强、温度等)平衡向能够减弱这种改变的方向移动.【例题分析】例1、已知下列热化学方程式:写出feo(s)被co还原成fe和co2的热化学方程式 .解析:依据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的.我们可从题目中所给的有关方程式进行分析:从方程式(3)与方程式(1)可以看出有我们需要的有关物质,但方程式(3)必须通过方程式(2)有关物质才能和方程式(1)结合在一起.例2、熔融盐燃料电池具有高的发电效率,因而得到重视,可用li2co3和na2co3的熔融盐混合物作用电解质,co为阳极燃气,空气与co2的混合气体为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:阳极反应式:2co+2co32-→4co2+4e-阴极反应式:;总电池反应式: .解析:作为燃料电池,总的效果就是把燃料进行燃烧.本题中co为还原剂,空气中o2为氧化剂,电池总反应式为:2co+o2=2co2.用总反应式减去电池负极(即题目指的阳极)反应式,就可得到电池正极(即题目指的阴极)反应式:o2+2co2+4e-=2co32- .答案:o2+2co2+4e-=2co32-;2co+o2=2co2例3、下列有关反应的方向说法中正确的是( )a、放热的自发过程都是熵值减小的过程.b、吸热的自发过程常常是熵值增加的过程.c、水自发地从高处流向低处,是趋向能量最低状态的倾向.d、只根据焓变来判断化学反应的方向是可以的.答案:bc.化学反应原理复习(二)【知识讲解】第2章、第3、4节一、化学反应的速率1、化学反应是怎样进行的(1)基元反应:能够一步完成的反应称为基元反应,大多数化学反应都是分几步完成的.(2)反应历程:平时写的化学方程式是由几个基元反应组成的总反应.总反应中用基元反应构成的反应序列称为反应历程,又称反应机理. (3)不同反应的反应历程不同.同一反应在不同条件下的反应历程也可能不同,反应历程的差别又造成了反应速率的不同.2、化学反应速率(1)概念:单位时间内反应物的减小量或生成物的增加量可以表示反应的快慢,即反应的速率,用符号v表示.(2)表达式:(3)特点对某一具体反应,用不同物质表示化学反应速率时所得的数值可能不同,但各物质表示的化学反应速率之比等于化学方程式中各物质的系数之比.3、浓度对反应速率的影响(1)反应速率常数(k)反应速率常数(k)表示单位浓度下的化学反应速率,通常,反应速率常数越大,反应进行得越快.反应速率常数与浓度无关,受温度、催化剂、固体表面性质等因素的影响.(2)浓度对反应速率的影响增大反应物浓度,正反应速率增大,减小反应物浓度,正反应速率减小.增大生成物浓度,逆反应速率增大,减小生成物浓度,逆反应速率减小.(3)压强对反应速率的影响压强只影响气体,对只涉及固体、液体的反应,压强的改变对反应速率几乎无影响.压强对反应速率的影响,实际上是浓度对反应速率的影响,因为压强的改变是通过改变容器容积引起的.压缩容器容积,气体压强增大,气体物质的浓度都增大,正、逆反应速率都增加;增大容器容积,气体压强减小;气体物质的浓度都减小,正、逆反应速率都减小.4、温度对化学反应速率的影响(1)经验公式阿伦尼乌斯总结出了反应速率常数与温度之间关系的经验公式:式中a为比例系数,e为自然对数的底,r为摩尔气体常数量,ea为活化能.由公式知,当ea>0时,升高温度,反应速率常数增大,化学反应速率也随之增大.可知,温度对化学反应速率的影响与活化能有关.(2)活化能ea.活化能ea是活化分子的平均能量与反应物分子平均能量之差.不同反应的活化能不同,有的相差很大.活化能 ea值越大,改变温度对反应速率的影响越大.5、催化剂对化学反应速率的影响(1)催化剂对化学反应速率影响的规律:催化剂大多能加快反应速率,原因是催化剂能通过参加反应,改变反应历程,降低反应的活化能来有效提高反应速率.(2)催化剂的特点:催化剂能加快反应速率而在反应前后本身的质量和化学性质不变.催化剂具有选择性.催化剂不能改变化学反应的平衡常数,不引起化学平衡的移动,不能改变平衡转化率.二、化学反应条件的优化——工业合成氨1、合成氨反应的限度合成氨反应是一个放热反应,同时也是气体物质的量减小的熵减反应,故降低温度、增大压强将有利于化学平衡向生成氨的方向移动.2、合成氨反应的速率(1)高压既有利于平衡向生成氨的方向移动,又使反应速率加快,但高压对设备的要求也高,故压强不能特别大.(2)反应过程中将氨从混合气中分离出去,能保持较高的反应速率.(3)温度越高,反应速率进行得越快,但温度过高,平衡向氨分解的方向移动,不利于氨的合成.(4)加入催化剂能大幅度加快反应速率.3、合成氨的适宜条件第3章、物质在水溶液中的行为一、水溶液1、水的电离h2oh++oh-2、溶液的酸碱度3、电解质在水溶液中的存在形态(1)强电解质强电解质是在稀的水溶液中完全电离的电解质,强电解质在溶液中以离子形式存在,主要包括强酸、强碱和绝大多数盐,书写电离方程式时用“=”表示.(2)弱电解质在水溶液中部分电离的电解质,在水溶液中主要以分子形态存在,少部分以离子形态存在,存在电离平衡,主要包括弱酸、弱碱、水及极少数盐,书写电离方程式时用“ ”表示.二、弱电解质的电离及盐类水解1、弱电解质的电离平衡.(1)电离平衡常数在一定条件下达到电离平衡时,弱电解质电离形成的各种离子浓度的乘积与溶液中未电离的分子浓度之比为一常数,叫电离平衡常数.弱酸的电离平衡常数越大,达到电离平衡时,电离出的h+越多.多元弱酸分步电离,且每步电离都有各自的电离平衡常数,以第一步电离为主.(2)影响电离平衡的因素,以ch3coohch3coo-+h+为例.加水、加冰醋酸,加碱、升温,使ch3cooh的电离平衡正向移动,加入ch3coona固体,加入浓盐酸,降温使ch3cooh电离平衡逆向移动. 2、盐类水解(1)水解实质盐溶于水后电离出的离子与水电离的h+或oh-结合生成弱酸或弱碱,从而打破水的电离平衡,使水继续电离,称为盐类水解.(2)水解类型及规律①强酸弱碱盐水解显酸性.②强碱弱酸盐水解显碱性.ch3coona+h2och3cooh+naoh③强酸强碱盐不水解.④弱酸弱碱盐双水解.al2s3+6h2o=2al(oh)3↓+3h2s↑(3)水解平衡的移动加热、加水可以促进盐的水解,加入酸或碱能抑止盐的水解,另外,弱酸根阴离子与弱碱阳离子相混合时相互促进水解.三、沉淀溶解平衡1、沉淀溶解平衡与溶度积(1)概念当固体溶于水时,固体溶于水的速率和离子结合为固体的速率相等时,固体的溶解与沉淀的生成达到平衡状态,称为沉淀溶解平衡.其平衡常数叫做溶度积常数,简称溶度积,用ksp表示.pbi2(s)pb2+(aq)+2i-(aq)(2)溶度积ksp的特点ksp只与难溶电解质的性质和温度有关,与沉淀的量无关,且溶液中离子浓度的变化能引起平衡移动,但并不改变溶度积.ksp反映了难溶电解质在水中的溶解能力.2、沉淀溶解平衡的应用(1)沉淀的溶解与生成根据浓度商qc与溶度积ksp的大小比较,规则如下:qc=ksp时,处于沉淀溶解平衡状态.qc>ksp时,溶液中的离子结合为沉淀至平衡.qc<ksp时,体系中若有足量固体,固体溶解至平衡.(2)沉淀的转化根据溶度积的大小,可以将溶度积大的沉淀可转化为溶度积更小的沉淀,这叫做沉淀的转化.沉淀转化实质为沉淀溶解平衡的移动.四、离子反应1、离子反应发生的条件(1)生成沉淀既有溶液中的离子直接结合为沉淀,又有沉淀的转化.(2)生成弱电解质主要是h+与弱酸根生成弱酸,或oh-与弱碱阳离子生成弱碱,或h+与oh-生成h2o.(3)生成气体生成弱酸时,很多弱酸能分解生成气体.(4)发生氧化还原反应强氧化性的离子与强还原性离子易发生氧化还原反应,且大多在酸性条件下发生.2、离子反应能否进行的理论判据(1)根据焓变与熵变判据(2)根据平衡常数判据离子反应的平衡常数很大时,表明反应的趋势很大.3、离子反应的应用(1)判断溶液中离子能否大量共存相互间能发生反应的离子不能大量共存,注意题目中的隐含条件. (2)用于物质的定性检验根据离子的特性反应,主要是沉淀的颜色或气体的生成,定性检验特征性离子.(3)用于离子的定量计算常见的有酸碱中和滴定法、氧化还原滴定法.(4)生活中常见的离子反应.硬水的形成及软化涉及到的离子反应较多,主要有:ca2+、mg2+的形成.caco3+co2+h2o=ca2++2hco3-mgco3+co2+h2o=mg2++2hco3-加热煮沸法降低水的硬度:ca2++2hco3-caco3↓+co2↑+h2omg2++2hco3-mgco3↓+co2↑+h2o或加入na2co3软化硬水:。

高三化学《化学反应原理》知识清单第一章化学反应与能量变化一、焓变、反应热要点一:反应热(焓变)的概念及表示方法化学反应过程中所释放或吸收的能量,都可以用热量来描述,叫做反应热,又称焓变,符号为ΔH,单位为kJ/mol,规定放热反应的ΔH为“—”,吸热反应的ΔH为“+”。
特别提醒:(1)描述此概念时,无论是用“反应热”、“焓变”或“ ΔH”表示,其后所用的数值必须带“+”或“—”。
(2)单位是kJ/mol,而不是kJ,热量的单位是kJ。
(3)在比较大小时,所带“+”“—”符号均参入比较。
要点二:放热反应和吸热反应1.放热反应的ΔH为“—”或ΔH<0 ;吸热反应的ΔH为“+”或ΔH >0 ∆H=E(生成物的总能量)-E(反应物的总能量)∆H=E(反应物的键能)- E(生成物的键能)2.常见的放热反应和吸热反应①放热反应:活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应。
②吸热反应:多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳的反应3.需要加热的反应,不一定是吸热反应;不需要加热的反应,不一定是放热反应4.通过反应是放热还是吸热,可用来比较反应物和生成物的相对稳定性。
如C(石墨,s) C(金刚石,s)△H3= +1.9kJ/mol,该反应为吸热反应,金刚石的能量高,石墨比金属石稳定。
二、热化学方程式的书写书写热化学方程式时,除了遵循化学方程式的书写要求外,还要注意以下几点:1.反应物和生成物的聚集状态不同,反应热的数值和符号可能不同,因此必须注明反应物和生成物的聚集状态,用s、l、g分别表示固体、液体和气体,而不标“↓、↑”。
2.△H只能写在热化学方程式的右边,用空格隔开,△H值“—” 表示放热反应,△H 值“+”表示吸热反应;单位为“kJ/mol”。
3.△H的值要与热化学方程式中化学式前面的化学计量数相对应,如果化学计量数加倍,△H也要加倍。
普通高中化学
(山东科学技术出版社)
化学反应原理(第1章化学反应与能量转化)
思维导图
史学强
2014年10月18日
你是否发现笔记记得越多,思维也越混乱?你是否经常为琐事缠身而苦无分身之术?你是否总是感叹一天的时间太少?思维导图来了!它可以“解救”你!
思维导图是一种终极思维工具,由英国“记忆之父”东尼·博赞发明,并在全球得到广泛推广,已成为21世纪风靡全球思维工具,到目前已被世界上2.5亿人所使用。
思维导图注重开发人的左、右脑,运用线条、符号、词汇和图像,把一长串枯燥的信息变成彩色的、容易记忆的、有高度组织性的图,它绘制起来非常简单,而且十分有趣!它可以帮助人们改善思维,提高记忆力和办事效率。
关键词:高中化学化学反应原理电解池盖斯定律反应热原电池史学强
本资料利用思维导图整理高中化学《化学反应原理》第一章章中每一节基础知识,可以帮助大家增强记忆、改善思维、提高化学学习效率!
化学反应与能量转化
1-1化学反应的热效应
1-2电能转化为化学能——电解
1-3化学能转化为电能——电池。
化学选修4化学反应与原理
第一章化学反应与能量
一、焓变反应热
1.反应热:化学反应过程中所放出或吸收的热量,任何化学反应都有反应热,因为任何化学反应都会存在热量变化,即要么吸热要么放热。
反应热可以分为(燃烧热、中和热、溶解热)
2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应.符号:△H.单位:kJ/mol ,即:恒压下:焓变=反应热,都可用ΔH表示,单位都是kJ/mol。
3.产生原因:化学键断裂——吸热化学键形成——放热
放出热量的化学反应。
(放热>吸热) △H 为“-”或△H <0
吸收热量的化学反应。
(吸热>放热)△H 为“+”或△H >0
也可以利用计算△H来判断是吸热还是放热。
△H=生成物所具有的总能量-反应物所具有的总能量=反应物的总键能(E断)-生成物的总键能(E成)
☆常见的放热反应:①所有的燃烧反应②所有的酸碱中和反应③大多数的化合△
反应(特殊:C+CO22CO是吸热反应)④金属与水或酸的反应⑤生石灰(氧化钙)和水反应⑥铝热反应等
☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl②大多数的分解反应③水解反应☆区分是现象(物理变化)还是反应(生成新物质是化学变化),一般铵盐溶解是吸热现象,别的物质溶于水是放热。
注意:放热反应不一定需要加热,吸热反应也不一定都需要加热。
4.能量与键能的关系:物质具有的能量越低,物质越稳定,能量和键能成反比。
5.同种物质不同状态时所具有的能量:气态>液态>固态
6.常温是指25℃,101KPa.标况是指0℃,101℃.
7.比较△H时必须连同符号一起比较。
二、热化学方程式
书写化学方程式注意要点:
①热化学方程式必须标出能量变化,即反应热△H,△H对应的正负号都不能省。
②热化学方程式中必须标明反应物和生成物的聚集状态(s,l, g分别表示固态,液态,气态,水溶液中溶质用aq表示)
③热化学反应方程式不标条件,除非题中特别指出反应时的温度和压强。
④热化学方程式中的化学计量数表示物质的量,不表示个数和体积,可以是整数,也可以是分数
⑤各物质系数加倍,△H 加倍,即:△H 和计量数成比例;反应逆向进行,△H 改变符号,数值不变。
6.表示意义:物质的量—物质—状态—吸收或放出*热量。
三、中和热
1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H 2O ,这时的反应热叫中和热。
2.强酸与强碱的中和反应其实质是H +和OH -
反应,其热化学方程式为:
H +(aq) +OH -(aq) =H 2O(l) ΔH=-57.3kJ/mol
3.弱酸或弱碱电离要吸收热量,所以它们参加中和反
应时的中和热小于57.3kJ/mol 。
4.中和热的测定实验:看课本装置图
(1)①装置(如图)
②计算公式
ΔH =-(m 碱+m 酸)·c ·(t 2-t 1)n
kJ ·mol -1 t 1——起始温度,t 2——终止温度,n ——生成水的物质的量。
(2)注意事项
①泡沫塑料板、碎泡沫塑料(或纸条)及环形玻璃搅拌棒的作用是保温隔热,减少实验过程中的热量损失。
②为保证酸完全中和,采取的措施是使碱稍过量。
(如果酸和碱的物质的量相同,中和热会偏小),一般中和热为57.3kJ/mol 。
(3)若用弱酸或弱碱做实验,放出的热量会偏小,中和热会偏小。
(4)若用浓溶液做实验,放出的热量会偏大,中和热会偏大。
(5)在试验中,增大酸和碱的用量,放出的热量会增多但中和热保持不变。
四、燃烧热、能源
1.概念: 101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物(二氧化碳、二氧化硫、液态水H 2O )时所放出的热量。
燃烧热的单位用kJ/mol 表示。
※注意以下几点:
①研究条件:101 kPa
②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1 mol
④研究内容:放出的热量。
(ΔH<0,单位kJ/mol )
2.燃烧热和中和热的表示方法都是有ΔH 时才有负号。
3.石墨和金刚石的燃烧热不同。
不同的物质燃烧热不同。
4.能源
五、盖斯定律
1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。
如图表示始态到终态的反应热。
则ΔH =ΔH 1+ΔH 2=ΔH 3+ΔH 4+ΔH 5。
方法:目标方程式与已知方程一般同向相加,反向相减,再把系数化成一致即可。