高考化学二轮复习知识点专题解析6---温度、催化剂对化学平衡移动的影响
- 格式:pdf
- 大小:328.21 KB
- 文档页数:14

化学平衡的移动与平衡条件的改变的影响化学平衡是指在闭合系统中,反应物与生成物之间的物质浓度或者摩尔数达到稳定的状态。
在这个平衡状态下,反应速率的前后相互抵消,使得物质的浓度或者摩尔数保持不变。
然而,当外界条件发生改变时,平衡条件会受到影响,进而导致平衡移动或者改变。
本文将探讨化学平衡的移动以及平衡条件的改变对平衡系统的影响。
一、温度对平衡的移动和平衡条件的改变的影响在化学反应中,温度是一项重要的外界条件,它对平衡移动和平衡条件的改变产生重要影响。
根据Le Chatelier原理,当温度升高时,平衡系统会倾向于消耗热量,反应朝向吸热方向移动。
相反,当温度降低时,平衡系统会倾向于生成热量,反应朝向放热方向移动。
温度对平衡常数的影响也不可忽视。
一般来说,当温度升高时,平衡常数会增大,反应朝正向进行。
这是因为在吸热的条件下,平衡系统会通过吸收热量以抵消外界温度升高对平衡的影响。
相反,当温度降低时,平衡常数会减小,反应朝反向进行。
这是因为在放热的条件下,平衡系统会通过释放热量以抵消外界温度降低对平衡的影响。
二、压力对平衡的移动和平衡条件的改变的影响压力是另一个影响化学平衡的外界条件。
在气体反应中,压力的改变可以导致平衡系统移动以减少压力的影响。
根据Le Chatelier原理,当压力增加时,平衡系统会倾向于通过减少物质的摩尔数来减少压力。
相反,当压力降低时,平衡系统会倾向于通过增加物质的摩尔数来增加压力。
压力对平衡常数的影响主要体现在气体反应中。
根据物态平衡原理,气体摩尔数在平衡时与其分压成正比。
因此,当压力升高时,平衡常数会减小,反应朝反向进行。
当压力降低时,平衡常数会增大,反应朝正向进行。
三、物质浓度对平衡的移动和平衡条件的改变的影响物质浓度是化学平衡的另一个重要因素。
当某个物质的浓度发生变化时,平衡系统会倾向于移动以减少这种变化。
根据Le Chatelier原理,当某物质浓度增加时,平衡系统会倾向于消耗该物质。

第三节化学平衡第3课时影响化学平衡移动的因素(二)温度、催化剂对化学平衡移动的影响学习目标1.理解外界条件(温度、催化剂)对化学平衡的影响。
(重点)2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。
(难点)基础知识梳理温度、催化剂对化学平衡的影响一.温度对化学平衡的影响1.温度对v-放、v-吸的影响规律升温,v-放、v-吸均,但v-吸增大程度大;降温,v-放、v-吸均减小,但v-吸减小程度大。
2.温度对化学平衡移动的影响规律当其他条件不变时:温度升高,平衡向方向移动;温度降低,平衡向方向移动。
二.催化剂对化学平衡的影响及勒夏特列原理1.催化剂对化学平衡的影响(1)规律:当其他条件不变时,催化剂改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的。
(2)v--t图象:2.勒夏特列原理如果改变影响平衡的一个条件(如浓度、压强或温度),则平衡将向着能够这种改变的方向移动。
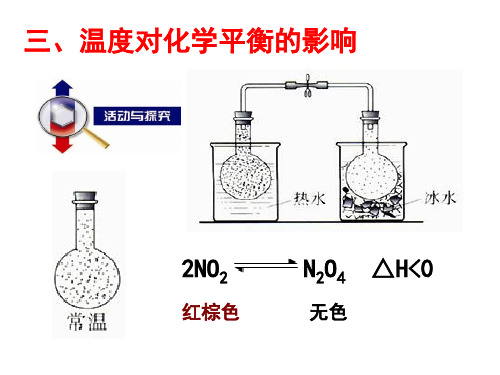
课堂互动探究[思考探究]盛有NO2气体的圆底烧瓶中存在下列平衡:2NO2(g)N2O4(g)ΔH<0红棕色无色将NO2球浸泡在热水、冰水中,装置如下图:问题思考:(1)该实验中用两个导管连通的烧瓶,其设计意图是什么?(2)甲烧瓶内气体的颜色将如何变化?原因是什么?(3)乙烧瓶内气体的颜色将如何变化?原因是什么?(4)通过上述实验,你能得出温度对化学平衡有什么影响规律?(5)某同学用注射器收集一定量NO2气体,注入甲中的烧瓶中,发现颜色先变深,后又变浅,原因是什么?归纳总结1.从v--t图像认识温度对化学平衡的影响化学平衡a A+b B c C+d D ΔH>0温度改变升温降温速率变化v--正、v-逆同时增大,且v-′正>v-′逆v-正、v-逆同时减小,且v-′逆>v-′正移动方向正向移动逆向移动速率与时间的图像规律在其他条件不变的情况下,升高温度,平衡向吸热反应的方向移动;降低温度,平衡向放热反应的方向移动2.催化剂对化学平衡的影响当其他条件不变时:催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。

第二节化学平衡第4课时温度、催化剂对化学平衡移动的影响一、选择题1、下列说法中正确的是()A、温度可以影响任意可逆反应的化学平衡状态B、催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率C、升高温度,反应速率加快,化学平衡正向移动D、对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大答案:A2、反应:A(g)+3B(g)2C(g) ΔH<0,达平衡后,将反应体系的温度降低,下列叙述中正确的是( )A.正反应速率增大,逆反应速率减小,平衡向右移动B.正反应速率减小,逆反应速率增大,平衡向左移动C.正反应速率和逆反应速率都减小,平衡向右移动D.正反应速率和逆反应速率都减小,平衡向左移动答案 C3、对于反应:2A(g)+B(g)2C(g) ΔH<0,当温度升高时,平衡向逆反应方向移动,其原因是( )A.正反应速率增大,逆反应速率减小B.逆反应速率增大,正反应速率减小C.正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率增大的程度D.正、逆反应速率均增大,而且增大的程度一样答案 C4、下列事实不能用勒夏特列原理解释的是( )A.光照新制的氯水时,溶液的pH逐渐减小B.加催化剂,使N2和H2在一定条件下转化为NH3C.可用浓氨水和氢氧化钠固体快速制氨D.增大压强,有利于SO2与O2反应生成SO3答案 B5、已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。
与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。
下列说法错误的是( )A.上述过程中,A烧瓶内正、逆反应速率均加快B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大C .上述过程中,A 、B 烧瓶内气体密度均保持不变D .反应2NO 2(g) N 2O 4(g)的逆反应为放热反应答案 D6、将H 2(g)和Br 2(g)充入恒容密闭容器,恒温下发生反应:H 2(g)+Br 2(g)2HBr(g)ΔH <0,平衡时Br 2(g)的转化率为a ;若初始条件相同,绝热下进行上述反应,平衡时Br 2(g)的转化率为b 。

第4课时温度、催化剂对化学平衡移动的影响学习目标1. 通过温度对可逆反应速率的影响,理解并掌握温度影响化学平衡移动的规律。
2. 了解催化剂影响化学反应速率的实质,并进一步探讨对化学平衡的影响,从而了解催化剂在化工生产中的应用。
分点突破1 温度对化学平衡的影响基础2SO2(g)+O2(g)2SO3(g)ΔH<0条件降低温度升高温度平衡移动的方向平衡向反应方向移动平衡向反应方向移动结论升高温度,化学平衡向着方向移动;降低温度,化学平衡向着方向移动[特别提醒]任何化学反应都伴随着能量的变化(放热或吸热),因此,改变温度,化学平衡一定发生移动。
探究已知:2NO2(g)N2O4(g)ΔH=-56.9 kJ·mol-1,探究改变反应温度对化学平衡的影响。
[问题思考]1.圆底烧瓶A中气体的颜色如何变化?其原因是什么?2.圆底烧瓶B中气体的颜色如何变化?其原因是什么?归纳1.在其他条件不变的情况下,温度对化学平衡的影响(1)升高温度,平衡向吸热的方向移动。
(2)降低温度,平衡向放热的方向移动。
2.平衡移动图像(v-t图)(1)若a A+b B c C+d DΔH<0(2)若a A+b B c C+d DΔH>0演练1.反应A(g)+3B(g)2C(g)ΔH<0达平衡后,将反应体系的温度降低,下列叙述中正确的是()A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动C.正反应速率和逆反应速率都减小,平衡向正反应方向移动D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动2.在一密闭烧瓶中,在25 ℃时存在着平衡:2NO2N2O4(正反应放热)。
把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是()①颜色②平均相对分子质量③质量④压强⑤密度A.①和③B.②和④C.④和⑤D.③和⑤分点突破2 催化剂与化学平衡勒夏特列原理基础1.催化剂与化学平衡(1)催化剂对化学平衡的影响因为催化剂能同等程度的改变正、逆反应的化学反应速率,所以加入催化剂只能改变,化学平衡移动。

2021年高考化学专题复习:温度催化剂对化学平衡的影响1.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)ΔH<0。
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是()A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高2.在A(g)+B(g)C(g)ΔH<0的反应中,如图所示,能正确表示反应速率(纵坐标)与温度(横坐标)关系的是()3.体积完全相同的两个容器A和B,已知A装有SO2和O2各1 g,B装有SO2和O2各2 g,在相同温度下反应达到平衡时,A中SO2的转化率为a%,B中SO2的转化率为b%,则A、B两容器中SO2转化率的关系正确的是()A.a%>b%B.a%=b%C.a%<b%D.2a%=b%4.某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)2NO2(g),在其他条件相同时,测得实验数据如下表:根据表中数据,下列说法正确的是()A.升高温度,反应速率加快B.增大压强,反应速率变慢C.在1.0×105 Pa、90 ℃条件下,当转化率为98%时反应已达平衡表示,则在8.0×105 Pa、30 ℃条件下, D.若进入反应塔的混合气体为a mol,反应速率以v=-ΔnΔt转化率从50%增至90%时段NO的反应速率为4amol·s-13705.已知可逆反应A2(?)+B2(?)2AB(?),当温度和压强改变时,n(AB)的变化如下图,下列叙述正确的是()A.A2、B2及AB均为气体,ΔH<0B.AB为气体,A2、B2至少有一种为非气体,ΔH<0C.AB为气体,A2、B2有一种为非气体,ΔH>0D.AB为固体,A2、B2有一种为非气体,ΔH>06.(双选)(2019江苏卷)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如下图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
化学平衡移动规律总结化学反应是物质转化的过程,而化学平衡则是在反应物和生成物浓度达到一定比例时的状态。
化学平衡的移动规律是指在一定条件下,平衡位置如何随着外界条件的改变而发生变化的规律。
下面将从温度、压力、浓度和催化剂四个方面来总结化学平衡的移动规律。
一、温度影响在化学反应中,温度的改变会影响反应物和生成物的速率以及平衡位置。
根据Le Chatelier定律,当温度升高时,反应速率会增加。
对于吸热反应,升高温度会使平衡位置向右移动,生成物浓度增加;而对于放热反应,升高温度会使平衡位置向左移动,生成物浓度减少。
二、压力影响在气相反应中,压力的改变对平衡位置有一定影响。
根据Le Chatelier定律,当压力增加时,平衡位置会向反应物浓度较小的一侧移动,以减少压力。
对于反应物和生成物摩尔数相等的反应,压力的改变不会影响平衡位置。
而对于摩尔数不相等的反应,压力的增加会使平衡位置向摩尔数较小的一侧移动。
三、浓度影响在溶液中的反应中,溶液浓度的改变会导致平衡位置的移动。
根据Le Chatelier定律,当浓度增加时,平衡位置会向生成物浓度较小的一侧移动,以减少浓度差。
而当浓度减少时,平衡位置会向生成物浓度较大的一侧移动,以增加浓度差。
四、催化剂影响催化剂可以加速化学反应的速率,但不参与反应。
催化剂的加入不会改变平衡位置,因为它同样影响反应物和生成物的速率。
催化剂提供了一个更低的活化能路径,使反应更容易进行,但并不改变反应的平衡位置。
化学平衡的移动规律可以通过调节温度、压力和浓度来实现。
根据Le Chatelier定律,当这些条件发生改变时,平衡位置会向着减少影响的一侧移动,以达到新的平衡状态。
催化剂的加入可以提高反应速率,但不会改变平衡位置。
这些规律的理解和应用对于理解和控制化学反应过程具有重要意义。
高中化学平衡移动知识点总结化学是一门基础的自然科学。
在学习过程中,学生普遍感到化学“一听就懂,一学就会,一做就错”。
究其原因关键在于基本功不扎实。
化学知识点多而零碎,学习过程中若不能融会贯通,尤其是一些“特殊”之处,往往致使解题陷人“山重水复”之境。
为了理解、巩固和掌握这些知识,消除盲点。
今天给同学们准备了化学平衡相关知识点的总结,看完大家要多多记笔记,以后慢慢消化哦~一、化学平衡的移动01化学平衡的移动(1)定义达到平衡状态的反应体系,条件改变,引起平衡状态被破坏的过程。
(2)化学平衡移动的过程02影响化学平衡移动的因素(1)温度:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
(2)浓度:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
(3)压强:对于反应前后总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
(4)催化剂:由于催化剂能同时同等程度地增大或减小正反应速率和逆反应速率,故其对化学平衡的移动无影响。
03勒夏特列原理在密闭体系中,如果改变影响化学平衡的一个条件(如温度、压强或浓度等),平衡就向能够减弱这种改变的方向移动。
二、外界条件对化学平衡移动的影响01外界条件的变化对速率的影响和平衡移动方向的判断在一定条件下,浓度、压强、温度、催化剂等外界因素会影响可逆反应的速率,但平衡不一定发生移动,只有当v正≠v逆时,平衡才会发生移动。
对于反应mA(g)+nB(g)pC(g)+qD(g),分析如下:02浓度、压强和温度对平衡移动影响的几种特殊情况(1)改变固体或纯液体的量,对平衡无影响。
(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
(3)对于反应前后气体体积无变化的反应,如H2(g)+I2(g)2HI(g),压强的改变对平衡无影响。