第三讲-免疫球蛋白-2018
- 格式:ppt
- 大小:7.30 MB
- 文档页数:86

第三章免疫球蛋白免疫球蛋白(Ig):具有Ab活性或化学结构与Ab相似的球蛋白。
*抗体(Ab):有效Ag刺激BC使之分化增殖为浆C,产生能与相应Ag特异性结合的球蛋白。
Ag→BC→浆C→抗体(都是)免疫球蛋白(Ig):IgG、M、A、D、E免疫球蛋白不一定都是抗体1、存在:血清、组织液、外分泌液、某些淋巴C表面,如BC。
2、血清电泳:γ区、延伸至β、α2区。
3、性质:A、不耐热、需低温保存,对蛋白酶敏感。
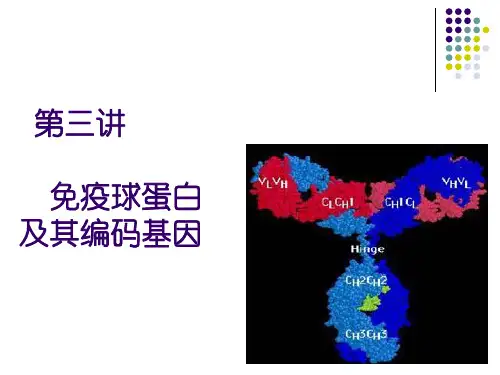
B、可被中性盐类沉淀:免疫血清50%(NH4)2SO4→Ig一、Ig的基本结构:(结合图7)(一)重链和轻链:各一对、由—S-S—相连、呈“T”或“Y”形。
两个末端:氨基端(N端)、羧基端(c端)。
(二)可变区和恒定区:1、可变区(V区):位于N端,高变区(HVR):在V区内,L链和H链各有三个HYR,是抗体与抗原结合部位。
*Ig的高变区(结构)与抗原结合部位(功能) 均在HVRIg独特型抗原决定簇(该区抗原性)2、恒定区(C区):位于C端。
(三)绞链区:在CH1与CH2之间,含脯氨酸较多,可自由转动,有助Ab与抗原决定簇结合、使Ig变构(“T”→Y)、暴露其上的补体C1q结合点,激活补体。
此区对蛋白酶敏感。
(四)Ig的水解片段:IgG木瓜蛋白酶→2Fab段与抗原结合1Fc段有多种生物功能IgG胃蛋白酶→F(ab')2段;→2F(ab')段pFc'段:小分子多肽、无免疫原性*在制备免疫制剂、疾病防治上有实际意义,如马血清抗毒素在胃蛋白酶作用下除去大部分Fc段、降低其(Fc段)免疫原性,减少血清过敏反应发生丙种球蛋白→胃蛋白酶作用后→静脉注射丙种球蛋白(五)J链和分泌片:1、J链:由合成IgA或IgM的浆C产生。
作用:稳定多聚体结构及参与体内运转。
2、分泌片(SP):由粘膜上皮C合成。
作用:保护slgA免受蛋白酶的水解,介导多聚IgA向黏膜上皮外输送。
二、Ig的抗原性(自学):三、Ig的生物学功能:(一)特异性结合抗原:(二)激活补体:(三)通过与细胞FcR结合发挥生物学效应:1、调理(促吞噬)作用:细菌等颗粒性Ag+IgG→通过其IgG的Fc段与吞噬C表面FcR结合→促进吞噬细菌等Ag 2、ADCC(发挥抗体依赖细胞介导的细胞毒作用):带有相应Ag的靶C(如病毒感染c、肿瘤c)+IgG促进对靶C的杀伤↓通过IgG的Fc段与NKC、巨噬C等细胞表面FcR结合3、介导I型超敏反应(四)中和作用: 1、抗毒素+游离外毒素→毒性中和2、中和Ab十V→可改变V表面结构,使其失去致病性(五)通过胎盘与黏膜(选择性传递): 1、母体IgG通过胎盘→胎儿2、SIgA通过粘膜→呼吸道、消化道(六)免疫调节:对IR具有正、负调节作用,如IgG的反馈调节作用;独特型网络的调节作用。




免疫球蛋白免疫球蛋白由两条相同的轻链和两条相同的重链所组成,是一类重要的免疫效应分子;由高等动物免疫系统淋巴细胞产生的蛋白质,经抗原的诱导可以转化为抗体。
因结构不同可分为IgG、IgA、IgM、IgD和IgE 5种,多数为丙种球蛋白。
可溶性免疫球蛋白存在于体液中,参与体液免疫;膜型免疫球蛋白是B淋巴细胞抗原受体。
折叠编辑本段主要结构Ig 分子的基本结构是由四肽链组成的,即由二条相同的分子量较小的轻链(L 链)和二条相同的分子量较大的重链(H 链)组成的。
L 链与H链是由二硫键连接形成一个四肽链分子,称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。
现已知5 种免疫球蛋白中IgG、IgA 和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2 和CH3)共四个功能区。
IgM和IgE 的H链各有一个可变区(VH)和四个恒定区(CHl、CH2、CH3 和CH4)共五个功能区。
VL和VH 是与抗原结合的部位,单体由一对L链和一对H链组成的基本结构,只有2 个与抗原结合的位点,如IgG、IgD、IgE、血清型IgA;双体由J链连接的两个单体,有4 个与抗原结合的位点,如分泌型IgA (SIgA),所以SigA 结合抗原的亲合力要比血清型IgA 高。
五聚体由J 链和二硫键连接五个单体,如IgM。
五聚体IgM 理论上应为10 个与抗原结合的位点,但实际上由于立体构型的空间位阻,—般只有5 个结合点可结合。
H和L链上都有可变区,同类重链和同型轻链的近N端约110个氨基酸序列的变化很大,其他部分的氨基酸序列相对恒定,据此可将轻链和重链区分为可变区(V)和恒定区(C)。
VH和VI。
各有3个区域的氨基酸组成和排列顺序高度变化,称为高变区(HVR)或互补决定区(CDR),分别为CDRl、CDR2和CDR3。
CDR以外区域的氨基酸组成和排列顺序相对不易变化,称为骨架区(FR)。
VH和VI。
各有113和107个氨基酸残基,组成4个FR(分别为FRl、FR2、FR3和FR4)和3个CDRs。




第一部分导入语敌人就是各种各样的抗原,而最终清除抗原的机制是相当复杂的,需要调动免疫系统各种成分来参与,今天这堂课我们就来学习抗体和的相关知识,看看它们在清除抗原的战斗中发挥了怎样的作用……第二部分:教学内容第4章免疫球蛋白第一节免疫球蛋白的概念一、定义:(一)免疫球蛋白(Ig):指具有抗体活性或化学结构与抗体相似的球蛋白。
(二)抗体(Ab):指机体免疫细胞被抗原激活后,由B细胞合成与分泌的一类能与相应抗原特异性结合的具有免疫功能的球蛋白。
二、区别:抗体都是免疫球蛋白,而免疫球蛋白并不都是抗体。
如:骨髓瘤蛋白化学结构与抗体相似,但无抗体活性。
三、Ig的存在形式(一)分泌型(secreted Ig, sIg)存在血清和组织液中。
即为Ab。
(二)膜型(membrane Ig, mIg)存在于B细胞膜上,即为BCR。
四、Ig的理化性质属球蛋白,在电泳图谱上大部分抗体活性在 球蛋白区,具有异质性。
第二节免疫球蛋白的结构一、基本结构和其他结构* 由两条相同的重链和两条相同的轻链通过二硫键连接而成的四肽链分子。
(一)重链与轻链11.重链(heavy chain, H链):约450-550氨基酸,分为5种:γ、μ、α、δ、ε。
其组成相应的五类Ig:IgG、IgM、IgA、IgD、IgE。
2.轻链(light chain, L链):约210个氨基酸,分为κ和λ两种,据此Ig分为κ和λ两型;(二)可变区和恒定区1.可变区(variable region,V区):位于Ig分子的N端、轻链1/2和重链1/4或1/5处;其氨基酸序列随Ig针对的抗原特异性变化而变化,是抗体与抗原特异性结合的部位。
V区可进一步分为超变区(或者互补决定区)和骨架区。
* 超变区(hypervariable region, HVR):在VL和VH中,某些特定位置的氨基酸残基的排列顺序高度可变,此为HVR。
轻、重链各有3个HVR。
超变区乃抗体与抗原表位(AD)特异性(互补)结合的位置,又称为互补决定区(complementarity-determining region, CDR)。
