中级无机化学唐宗薰版课后习题第四章答案
- 格式:pdf
- 大小:85.03 KB
- 文档页数:3

中级无机化学选论课后练习题含答案1. 硝酸铜在水溶液中的电离方程式是什么?硝酸铜在水溶液中的电离方程式如下所示:Cu(NO3)2 → Cu2+ (aq) + 2 NO3- (aq)2. 硝酸铜水溶液的颜色是什么?硝酸铜水溶液的颜色为蓝色。
3. 制备硝酸铜的方法是什么?制备硝酸铜的方法是将铜与硝酸反应,得到硝酸铜:Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O4. 铁在盐酸中溶解的方程式是什么?铁在盐酸中溶解的方程式如下所示:Fe + 2 HCl → FeCl2 + H25. 氯化铜加入氢氧化钠水溶液的反应结果是什么?氯化铜加入氢氧化钠水溶液会产生蓝色沉淀,化学方程式如下所示:CuCl2 + 2 NaOH → Cu(OH)2 ↓ + 2 NaCl6. 碘化钠加入水中的反应结果是什么?碘化钠加入水会使水变黄,化学方程式如下所示:N + H2O → Na+ (aq) + I- (aq) + H2O7. 氧气在室温下可以被什么元素直接氧化?在室温下,氧气可以被铜直接氧化。
8. 恒量的氧气和碳单质的化学反应生成什么?恒量的氧气和碳单质的化学反应会生成二氧化碳。
C + O2 → CO29. 氯气和钠的反应式是什么?氯气和钠的反应式如下所示:Cl2 + 2 Na → 2 NaCl10. 氟气和钾的反应式是什么?氟气和钾的反应式如下所示:2 K + F2 → 2 KF11. 氢氧化镁的化学式是什么?氢氧化镁的化学式是 Mg(OH)2。
12. 硝酸铵的化学式是什么?硝酸铵的化学式是 NH4NO3。
13. 过氧化钠的化学式是什么?过氧化钠的化学式是 Na2O2。
答案:1.Cu(NO3)2 → Cu2+ (aq) + 2 NO3- (aq)2.蓝色3.Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O4.Fe + 2 HCl → FeCl2 + H25.CuCl2 + 2 NaOH → Cu(OH)2 ↓ + 2 NaCl6.N + H2O → Na+ (aq) + I- (aq) + H2O7.铜8.C + O2 → CO29.Cl2 + 2 Na → 2 NaCl10. 2 K + F2 → 2 KF11.Mg(OH)212.NH4NO313.Na2O2。
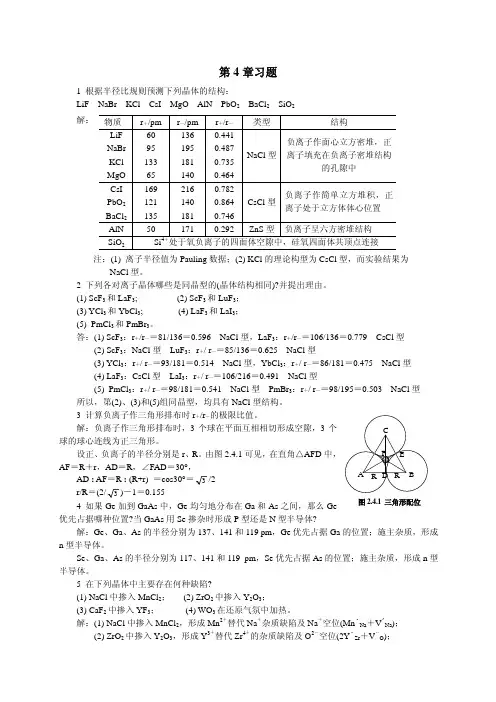
第4章习题1 根据半径比规则预测下列晶体的结构:LiF NaBr KCl CsI MgO AlN PbO 2 BaCl 2 SiO 2解:注:(1) 离子半径值为Pauling 数据;(2) KCl 的理论构型为CsCl 型,而实验结果为NaCl 型。
2 下列各对离子晶体哪些是同晶型的(晶体结构相同)?并提出理由。
(1) ScF 3和LaF 3; (2) ScF 3和LuF 3;(3) YCl 3和YbCl 3; (4) LaF 3和LaI 3;(5) PmCl 3和PmBr 3。
答:(1) ScF 3:r +/r —=81/136=0.596 NaCl 型,LaF 3:r +/r —=106/136=0.779 CsCl 型(2) ScF 3:NaCl 型 LuF 3:r +/ r —=85/136=0.625 NaCl 型(3) YCl 3:r +/ r —=93/181=0.514 NaCl 型,YbCl 3:r +/ r —=86/181=0.475 NaCl 型(4) LaF 3:CsCl 型 LaI 3:r +/ r —=106/216=0.491 NaCl 型(5) PmCl 3:r +/ r —=98/181=0.541 NaCl 型 PmBr 3:r +/ r —=98/195=0.503 NaCl 型 所以,第(2)、(3)和(5)组同晶型,均具有NaCl 型结构。
3 计算负离子作三角形排布时r +/r -的极限比值。
解:负离子作三角形排布时,3个球在平面互相相切形成空隙,3个球的球心连线为正三角形。
设正、负离子的半径分别是r 、R 。
由图2.4.1可见,在直角△AFD 中,AF =R +r ,AD =R ,∠FAD =30°, AD : AF =R : (R+r) =cos30°=3/2r/R =(2/3)-1=0.1554 如果Ge 加到GaAs 中,Ge 均匀地分布在Ga 和As 之间,那么Ge优先占据哪种位置?当GaAs 用Se 掺杂时形成P 型还是N 型半导体?解:Ge 、Ga 、As 的半径分别为137、141和119 pm ,Ge 优先占据Ga 的位置;施主杂质,形成n 型半导体。


无机化学习题参考答案第一章1.4.解:〔1〕H 2O 22C〔2〕S 2O 32- 3v C 〔3〕N 2O (N -N -O 方式) v C ∞〔4〕Hg 2Cl 2h D ∞〔5〕H 2C=C=CH 2 2d D 〔6〕UOF 4 C 5v 〔7〕BF 4-d T 〔8〕SClF 54v C〔9〕反-Pt(NH 3)2Cl 22h D〔10〕PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
〔BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃〕2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和〔6配位〕,失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
〔只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用复原氯化法制备,这就不是脱水方法了〕。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期〔分裂能小〕第六周期〔分裂能大〕P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型〔两种构型〕 只有一种结构 〔P 代表PPh 3〕2.2 解 〔1〕MA 2B 4〔2〕MA 3B 3M A ABB M ABA BM ABAB M A AA Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。

无机化学习题参考答案(II) 1.4.解:(1)H2O22C(2)S2O32-3vC(3)N2O (N-N-O方式)vC∞(4)Hg2Cl2hD∞(5)H2C=C=CH22dD(6)UOF4C5v(7)BF4-dT(8)SClF54vC(9)反-Pt(NH3)2Cl22hD(10)PtCl3(C2H4)-2vC1.B(CH3)3和BCl3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl3易水解;B(CH3)3不溶于水,在空气中易燃)2.BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
(该题可参考史启桢等翻译的"无机化学",作者Shriver等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在?配位饱和(6配位),失去Lewis酸性4. 吸水后失效的AlCl3有什么方法可以脱水?因为Al3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl,NH4Cl,SOCl2等气氛下加热脱水。
(只能加强热生成 Al2O3后,用高温下用加C和Cl2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni2+ d8组态Pt2+ d8组态第四周期(分裂能小)第六周期(分裂能大)trans cis 四面体构型平面四方形构型(两种构型)只有一种结构(P代表PPh3)2.2 解(1)MA2B4(2)MA3B3trans cis fac(面式) mer(经式)D 4h C 2v C 3v C 2vμ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+trans cis Co(en)(NH 3)2Cl 2+trans(1) trans(2) cis 2.4 Co(en)33+Ru(bipy)32+手性分子D 3D 3PtCl(dien)+dien HNCH 2CH 2CH 2NH 2NH 2CH 2基本上为平面分子,无手性2.5 (1) 分别用BaCl 2溶液滴入,有白色沉液出现的为[Co(NH 3)5Br]SO 4,或分别加入AgNO 3溶液,产生浅黄色沉淀的为[Co(NH 3)5SO 4]Br 。

中级无机化学习题答案。
子原氧基羟非同相有应断判值aKp据根)1( 答解7为约5加增值aKp-4OP2H 2为约值aKp 子原氧基羟非个一4OP3H 2 。
21为约aKp-24OPH案答考参题习后课章一第碱斯易路是些哪酸斯易路是些哪中物合化列下.1 2lCnS 2)3ON(gH OC 2OC 2lCeB 3HP -4HB2lCnS 2)3ON(gH OC 2OC 2lCeB 酸斯易路答解2lCnS OC 3HP 碱斯易路碱轭共和酸轭共的种物列下出写.2-4OSH IH O2H 2HN 2HN碱轭共酸轭共答解-2HN +4HN 3HN-2HN 3HN -2HN -HO +O3H O2H-I IH -24OS 4OS2H -4OSH。
由理明说并强较性酸个一哪中对各列下.3+3]6)O2H(aG[和+3]6)O2H(lA[ )b( +2]6)O2H(eF[和+3]6)O2H(eF[ )a( 4OlCH和3OlCH )d( 4)HO(eG和4)HO(iS )c( 4OS2H和4OP3H )f( 4OnMH和4OrC2H )e(+2]6)O2H(eF[和+3]6)O2H(eF[ )a( 答解大力能子电引吸高荷电子离心中者前性酸斯易路解离易+H 大力能化极的O对高荷电子离心中者前性酸子质+3]6)O2H(aG[和+3]6)O2H(lA[)b(低量能道轨d 小径半子离心中者前性酸斯易路解离易+H 大力能化极的O对小径半子离心中者前性酸子质4)HO(eG和4)HO(iS )c(低量能道轨d 小径半子离心中者前性酸斯易路解离易+H 大力能化极的O对小径半子离心中者前性酸子质4OS2H和4OP3H )f( 4OnMH和4OrC2H )e( 4OlCH和3OlCH )d( 。
强越性酸多子原氧基羟非者后为均则规gniluaP 用应.4构结的)0.2=aKp(2OP3H 和)08.1=aKp(3OP3H、)21.2=aKp(4OP3H断判)1( 。

中级无机化学项斯芬 姚光庆 编著 北京大学出版社第一章1.4.解:1) H 2O 2C 22(2)S 2O 32C3v3) N 2O (N N O 方式 ) C v(4)Hg 2Cl 2 D h5)H 2C=C=CH 2 D2d(6)UOF 4 C 5v7) BF 4T d(8)SClF 5C 4v9) 反 -Pt (NH 3)2Cl 2D2h(10)PtCl 3(C 2H 4)C2v第二章2.1 解:transP 代表 PPh 3)2.2 解 1)MA 2B 4Ni 2+d 8 组态 Pt 2+ d 8 组态第四周期 分裂能小) 第六周期(分裂能大)ClNi PClClP Cl Cl Pt PP Cl P P Pt C C l l四面体构型 平面四方形构型(两种构型)BM BA B M A BAMAAA MBcis只有一种结构 2)MA 3B 3Co(en)2(NH 3)Cl 2+trans cis fac(面式) mer(经式) D 4h=00 C 2vC 3vC 2v2.3 Co(en)2Cl 2+ D 2hC 2 光活异构体 C 2trans Co(en)(NH 3)2Cl 2+ Cl Cl NH 3 NH 3cisCl NH 3trans(1) trans(2) 2.4 Co(en)33+ D 3PtCl(dien)+Ru(bipy)32+D 3H 3cis手性分子CH 2 CH 2 NH 2HNCH 2 CH 2 NH 2dien基本上为平面分子 ,无手性2.5 (1) 分别用 BaCl 2 溶液滴入,有白色沉液出现的为 [Co(NH 3)5Br]SO 4,或分别加入 AgNO 3溶液,产生浅黄色沉淀的为 [Co(NH 3)5SO 4]Br 。
(2) 等物质量的异构体中分别加入过量 AgNO 3,产生少量沉淀( 1molAgCl ↓) 的为前者(摩尔比为 2:1),产生大量沉淀( 2molAgCl ↓)的为后者。


(叶芬霞)无机化学教材习题解答第一章习题一、填空题1.稀溶液的依数性包括蒸气压下降,沸点升高,凝固点降低,渗透现象2.引起溶胶聚沉的诸多因素中,最重要的是电解质的聚沉作用3.在15℃和97kPa压力下,15g氮气所占有的体积为13升。
4.在20℃和97kPa压力下,0.842g某气体的体积是0.400L,这气体的摩尔质量是52.89gmol-15.试比较下列溶液的沸点:0.1molL-1蔗糖水溶液=0.1molL-1NaCl水溶液=0.1molL-1Na2SO4水溶液。
6.试比较下列溶液的凝固点:0.1molL-1蔗糖水溶液=0.1molL-1甲醇水溶液=0.1molL-1苯甲醇水溶液。
7.试比较下列溶液的渗透压:0.1molL-1蔗糖水溶液=0.1molL-1NaCl水溶液=0.1molL-1Na2SO4水溶液。
二、选择题1.下列溶液性质中哪一种不是依数性?(D)A.凝固点B.沸点C.渗透压D.颜色2.在容易聚沉的溶胶中加入适量的大分子物质溶液,以使溶胶的稳定性大大增加,这叫做什么作用?(B)A.敏化作用B.保护作用C.加聚作用D.聚沉作用3.等体积:0.1molL-1KI和:0.1molL-1AgNO3溶液混合制成的AgI溶胶,下列电解质中,聚沉能力最强的是(C)A.Na2SO4B.MgSO4C.FeCl3D.K3[Fe(CN)6]4.溶胶的基本特征之一是(D)A.热力学上和动力学上皆稳定的系统B.热力学上和动力学上皆不稳定的系统C.热力学上稳定而动力学上不稳定的系统D.热力学上不稳定和动力学上稳定的系统5.25℃时,0.01molkg-1的糖水的渗透压为∏1,而0.01molkg-1的尿素水溶液的渗透压为∏2,则(C)A.∏1∏2C.∏1=∏2D.无法确定6.当AgNO3的稀溶液与KI的稀溶液作用时,若AgNO3过量时,此溶胶(B)A.不带电B.带正电C.带负电D.无法确定7.加入下列哪一种溶液,能使A2S3胶体溶液凝聚最快(A)A.Al2(SO4)2B.CaCl2C.Na3PO4D.MgCl2 8.当不挥发性溶质溶于溶剂形成稀溶液后,则(A)A.溶剂蒸气压降低B.溶液的蒸气压升高C.溶液的蒸气压不变D.溶液的蒸气压可能升高也可能降低三、是非题1.真实气体在低温高压下可以近似地看作理想气体。
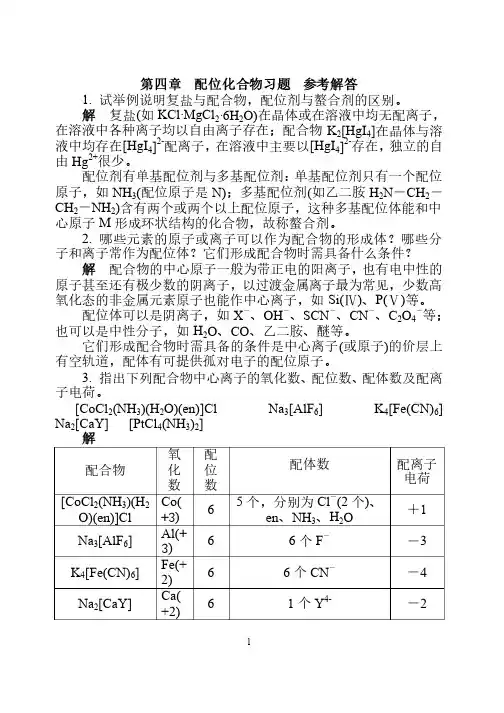
1 第四章 配位化合物习题 参考解答 1. 试举例说明复盐与配合物,配位剂与螯合剂的区别。
试举例说明复盐与配合物,配位剂与螯合剂的区别。
解 复盐(如KCl·KCl·MgCl MgCl 2·6H 2O)在晶体或在溶液中均无配离子,在溶液中各种离子均以自由离子存在;配合物K 2[HgI 4]在晶体与溶液中均存在[HgI 4]2-配离子,在溶液中主要以[HgI 4]2-存在,独立的自由Hg 2+很少。
很少。
配位剂有单基配位剂与多基配位剂:单基配位剂只有一个配位原子,如NH 3(配位原子是N);多基配位剂(如乙二胺H 2N -CH 2-CH 2-NH 2)含有两个或两个以上配位原子,这种多基配位体能和中心原子M 形成环状结构的化合物,故称螯合剂。
形成环状结构的化合物,故称螯合剂。
2. 哪些元素的原子或离子可以作为配合物的形成体?哪些分子和离子常作为配位体?它们形成配合物时需具备什么条件?子和离子常作为配位体?它们形成配合物时需具备什么条件?解 配合物的中心原子一般为带正电的阳离子,也有电中性的原子甚至还有极少数的阴离子,原子甚至还有极少数的阴离子,以过渡金属离子最为常见,少数高以过渡金属离子最为常见,少数高氧化态的非金属元素原子也能作中心离子,如Si(Ⅳ)、P(Ⅴ)等。
等。
配位体可以是阴离子,如X -、OH -、SCN -、CN -、C 2O 4-等;也可以是中性分子,如H 2O 、CO 、乙二胺、醚等。
、乙二胺、醚等。
它们形成配合物时需具备的条件是中心离子(或原子)的价层上有空轨道,配体有可提供孤对电子的配位原子。
有空轨道,配体有可提供孤对电子的配位原子。
3. 指出下列配合物中心离子的氧化数、配位数、配体数及配离子电荷。
子电荷。
[CoCl 2(NH 3)(H 2O)(en)]Cl Na 3[AlF 6] K 4[Fe(CN)6] Na 2[CaY] [PtCl 4(NH 3)2] 解 配合物配合物 氧化数 配位数配体数配体数 配离子电荷电荷 [CoCl 2(NH 3)(H 2O)(en)]Cl Co(+3) 6 5个,分别为Cl -(2个)、en 、NH 3、H 2O +1 Na 3[AlF 6] Al(+3) 6 6个F - -3 K 4[Fe(CN)6] Fe(+2) 6 6个CN - -4 Na 2[CaY] Ca(+2) 6 1个Y 4- -2 2 [PtCl 4(NH 3)2] Pt(+4) 6 6个,4个Cl -,2个NH 3 0 4. 命名下列配合物,指出中心离子的氧化数和配位数。

第3章习题1 请解释为什么在大多数情况下固体间的反应都很慢?怎样才能加快反应速率?答:固相反应是复相反应,反应主要在界面间进行,反应速率由离子的相间扩散所决定,并且固体物质接触面积相对较小,混合不均匀,碰撞几率小,因而大多数情况下反应很慢。
通过充分破碎和研磨,或通过各种化学途径制备粒度细、比表面大、表面活性高的反应物原料,或提高反应温度等均可加快反应速率。
2 化学转移反应适合提纯具有什么特点的金属?你能举例说明吗?答:化学转移反应适合提纯熔点高,在高温下难以挥发的金属。
如金属钛的提纯。
钛的熔点高达1 933±10 K,沸点是3 560 K,高温下难挥发,但钛和碘在低温下能够形成TiI4,在高温下TiI4又容易分解,所以可以采用化学转移反应提纯钛。
3 低温合成适用哪类物质的合成?常用的制冷浴有哪些?答:用于低温合成的化合物主要是一些易挥发的化合物,例如,C3O2、CNCl、HCN、PH3、(CN)2、稀有气体化合物等。
常用的制冷浴有冰盐共熔体系、干冰浴和液氮。
4 高温合成包括哪些类型?答:高温合成主要包括以下类型:高温下的固相合成反应;高温下的固-气合成反应;高温下的化学转移反应;高温熔炼和合金制备;高温下的相变合成;高温熔盐电解;等离子体激光、聚焦等作用下的超高温合成;高温下的单晶生长和区域熔融提纯等。
5 彩色三基色稀土荧光粉是如何制备的?分别举例予以说明。
答:彩色电视机的显像屏是由红、蓝、绿(三基色)三种颜色的荧光粉组成的。
红粉Y2O2S : Eu的制备方法用稀HNO3或稀HCl溶解质量比为1 : (0.062~0.07)的Y2O3和Eu2O3的混合稀土氧化物,用去离子水稀释到每1 mL含Y2O3大约10 mg,再用稀氨水调节pH值到2~3,并加热到80 ℃。
慢慢加入过量的草酸溶液,直至沉淀完毕,使沉淀静置几小时后抽滤,水洗至中性。
其反应过程如下:Y2O3+ Eu2O3+H+—→Y3++ Eu3++H2OY3++ Eu3++H2C2O4—→ (Y, Eu)2(C2O4)3·xH2O将草酸钇铕(Y, Eu)2(C2O4)3·xH2O于120 ℃下烘干脱水,再于800~1 000 ℃下灼烧1 h,便得到制备红粉的原料(Y, Eu)2O3:(Y, Eu)2(C2O4)3·xH2O —→ (Y, Eu)2O3+CO2↑+ CO↑+ xH2O↑然后,将质量比为100 : 30 : 30 : 5的(Y, Eu)2O3: S : Na2CO3: K3PO4(作助熔剂)混磨均匀,装入石英管中压紧,覆盖适量的硫磺及次料,加盖盖严,于1 150~1 250 ℃下恒温1~2 h,高温出炉,冷至室温。
第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。
第1章习题1 已知在Cl 3P -O -SbCl 5中P -O -Sb 的键角为165°,写出P 、O 、Sb 的杂化态。
解:P :sp 3,3条Cl -P σ键;1对孤对电子;O :sp 3,6个价电子配成3对孤对电子占据3条sp 3轨道;空出1条轨道接受来自P 的孤对电子;Sb :sp 3d 2,5条Cl -P σ键;1条空轨道接受来自O 的孤对电子;在氧上有两对孤对电子,P -O -Sb 呈165°,而不是小于119°27’,是因为空间效应的影响。
2 写出下列分子或离子的几何构型:解:F 2SeO :sp 3,三角锥; SnCl 2:sp 2,V 形;I 3-(I -I 2):sp 3d ,直线形; IO 2F 2-:sp 3d ,变形四面体。
3 下列各对分子中哪一个的键长长?为什么?哪一个的键角大?为什么?解:根据r AB =r A +r B -c|χA -χB |,可见,键长决定于参与成键的两个原子的半径之和及电负性之差,半径越大,键长越长,电负性差值越大,键长越短。
在CH 4、NH 3对中,键长:C -H >N -H ,原因是r(C)>r(N),△χ(N 与H)又比△χ(C 与H)差得大;键角:∠HCH >∠HNH ,原因是在N 上有1对孤电子对,受孤电子对的影响,键角变小。
在OF 2、OCl 2对中,键长:O -F <O -Cl ,原因是r(Cl)>r(F),而△χ(O 与F)又比△χ(O 与Cl)差得大;键角:∠FOF <∠ClOCl ,原因是电负性F >Cl ,成键电子将偏向F ,从而降低成键电子对间的斥力,键角变小。
在NH 3、NF 3对中,键长:N -H <N -F ,原因是r(F)>r(H),尽管是△χ(N 与H)<△χ(NF),但△χ(N 与H)同△χ(N 与F)相差并不太多;键角:∠FNF <∠HNH ,原因是电负性χ(F)>χ(H),成键电子将偏向F ,从而降低成键电子对间的斥力,键角变小。
第四章氧化和还原1、在下列两种物质中,分别按Mn,N元素的氧化值由低到高的顺序将各物质进行排列:(1)MnO, MnSO4, KMnO4, MnO(OH), K2MnO4, Mn(2) N2, NO2, N2O5, N2O, NH3, N2H42、指出下列反应中的氧化剂,还原剂以及它们相应的还原,氧化产物。
(1)SO2+ I2 + 2H2O →H2SO4 + 2HI(2)SnCl2 + 2HgCl2→SnCl4 + Hg2Cl2(3) 3I2 + 6NaOH →5NaI + NaIO3 + 3H2O3、用氧化值法配平下列氧化还原反应方程式:(1)Cu + H2SO4 (浓)→CuSO4 + SO2 + H2O(2)KMnO4 + S →MnO2 + K2SO4(3) As2S3+ HNO3 + H2O →H3AsO4 + H2SO4 + NO(4) (NH4)2Cr2O7→N2 + Cr2O3 + H2O(5) P4 + NaOH →PH3+ NaH2PO24、用离子-电子法配平下列氧化还原反应方程式:(1)Cr2O72-+ SO32+ + H+→Cr3+ + SO42-(2) PbO2(s) + Cl- + H+→Pb2+ (实际是PbCl42-) + Cl2(3) H2S + I2→I- + S(4) CrO2- + H2O2 + OH-→CrO42-(5) ClO3- + S2-→Cl- + S + OH-(6) KMnO4+ FeSO4+ H2SO4→MnSO4+ Fe2(SO4)3+ K2SO4 + H2O(7) KI + KIO3 + H2SO4→I2+ K2SO4(8) Ca(OH)2 + Cl2→Ca(ClO) 2 + CaCl2(9) Fe(OH)2 + H2O2→Fe(OH)3(10) Al + NO3-→[Al(OH) 4] - + NH3(11) ClO- + Fe(OH)3→Cl- + FeO42-(12) P + CuSO4→Cu3P + H3PO4 + H2SO45、把镁片和铁片分别放入浓度均为1 mol .L-1的镁盐和亚铁盐的溶液中,并组成一个原电池。
中级无机化学项斯芬习题问题1请简要介绍无机化学的定义和研究内容。
无机化学是研究无机物质的合成、性质、结构、反应和应用的科学。
它研究的对象主要是不含碳-氢键的化合物。
无机化学的研究内容包括无机物的合成方法、物理性质、化学性质、结构与构型、反应机理以及无机化合物在能源、环境保护、材料科学等方面的应用。
问题2请列举无机化学中常用的实验方法。
•X射线衍射:用于测定晶体结构。
•紫外光谱:用于测定化合物的电子结构和化学键类型。
•红外光谱:用于测定化合物的键型。
•原子吸收光谱:用于测定溶液中金属元素的含量。
•质谱法:用于确定化合物的分子量。
•核磁共振(NMR):用于测定分子结构和配位方式。
•热重分析:用于测定物质的质量变化与温度变化的关系。
•发光分析:用于测定金属离子的含量。
问题3请简述无机化学中配位化合物的概念和性质。
配位化合物是指金属离子与一个或多个配体通过配位键形成的化合物。
配位化合物具有以下特点:•配位化合物具有比金属离子更高的稳定性。
•配位化合物的形成能力与金属离子的电子组态有关。
•配位化合物的性质受到配体的选择和比例的影响。
•配位化合物可以通过配位键的形成和断裂来进行反应。
问题4请解释晶体结构中的晶胞和晶体结构的空间群概念。
晶胞是晶体中的最小可重复单元,用来描述整个晶体的结构。
晶胞可以通过平移、旋转、镜面反射等操作构成整个晶体结构。
空间群是描述晶胞内所有能够保持整体不变的操作的集合。
空间群可以通过晶体中的原子位置和晶格常数来确定,并且决定了晶体的对称性和形状。
问题5请简要介绍铁的不同氧化态及其相关性质。
铁可以存在多种氧化态,包括+2、+3和+6。
不同氧化态的铁具有不同的性质:•Fe2+是铁的最稳定氧化态,具有较强的还原性。
•Fe3+是常见的氧化态,具有较强的氧化性。
•Fe6+是非常不稳定的氧化态,只在特殊条件下存在。
不同氧化态的铁在生物体内具有不同的功能,如Fe2+参与呼吸过程中的电子传递,Fe3+参与氧气的运输和储存。
第4章习题
1 根据半径比规则预测下列晶体的结构:
LiF NaBr KCl CsI MgO AlN PbO 2 BaCl 2 SiO 2
解:
注:(1) 离子半径值为Pauling 数据;(2) KCl 的理论构型为CsCl 型,而实验结果为
NaCl 型。
2 下列各对离子晶体哪些是同晶型的(晶体结构相同)?并提出理由。
(1) ScF 3和LaF 3; (2) ScF 3和LuF 3;
(3) YCl 3和YbCl 3; (4) LaF 3和LaI 3;
(5) PmCl 3和PmBr 3。
答:(1) ScF 3:r +/r —=81/136=0.596 NaCl 型,LaF 3:r +/r —=106/136=0.779 CsCl 型
(2) ScF 3:NaCl 型 LuF 3:r +/ r —=85/136=0.625 NaCl 型
(3) YCl 3:r +/ r —=93/181=0.514 NaCl 型,YbCl 3:r +/ r —=86/181=0.475 NaCl 型
(4) LaF 3:CsCl 型 LaI 3:r +/ r —=106/216=0.491 NaCl 型
(5) PmCl 3:r +/ r —=98/181=0.541 NaCl 型 PmBr 3:r +/ r —=98/195=0.503 NaCl 型 所以,第(2)、(3)和(5)组同晶型,均具有NaCl 型结构。
3 计算负离子作三角形排布时r +/r -的极限比值。
解:负离子作三角形排布时,3个球在平面互相相切形成空隙,3个球的球心连线为正三角形。
设正、负离子的半径分别是r 、R 。
由图2.4.1可见,在直角△AFD 中,AF =R +r ,AD =R ,∠FAD =30°, AD : AF =R : (R+r) =cos30°=3/2
r/R =(2/3)-1=0.155
4 如果Ge 加到GaAs 中,Ge 均匀地分布在Ga 和As 之间,那么Ge
优先占据哪种位置?当GaAs 用Se 掺杂时形成P 型还是N 型半导体?
解:Ge 、Ga 、As 的半径分别为137、141和119 pm ,Ge 优先占据Ga 的位置;施主杂质,形成n 型半导体。
Se 、Ga 、As 的半径分别为117、141和119 pm ,Se 优先占据As 的位置;施主杂质,形成n 型半导体。
5 在下列晶体中主要存在何种缺陷?
(1) NaCl 中掺入MnCl 2; (2) ZrO 2中掺入Y 2O 3;
(3) CaF 2中掺入YF 3; (4) WO 3在还原气氛中加热。
解:(1) NaCl 中掺入MnCl 2,形成Mn 2+替代Na +杂质缺陷及Na +空位(Mn ·Na +V ’Na );
(2) ZrO 2中掺入Y 2O 3,形成Y 3+替代Zr 4+的杂质缺陷及O 2-空位(2Y ·Zr +V ‥O ); 物质 r +/pm r —/pm r +/r — 类型 结构 LiF 60 136 0.441 NaBr 95 195 0.487 KCl 133 181 0.735 MgO 65 140 0.464 NaCl 型负离子作面心立方密堆,正离子填充在负离子密堆结构的孔隙中
CsI 169 216 0.782 PbO 2 121 140 0.864 BaCl 2 135 181 0.746 CsCl 型负离子作简单立方堆积,正离子处于立方体体心位置 AlN 50 171 0.292 ZnS 型负离子呈六方密堆结构 SiO 2 Si 4+处于氧负离子的四面体空隙中,硅氧四面体共顶点连接
图2.4.1 三角形配位
(3) CaF2中掺入YF3,形成Y3+替代Ca2+的杂质缺陷及间隙F-离子缺陷(Y·Ca+F’i);
(4) WO3在还原气氛中加热,形成WⅥ还原价态及O2-空位缺陷(2W’W+V‥O)。
6 为什么过渡金属比非过渡金属的氧化物更易形成非整比化合物?
解:(1) 过渡金属半径大,空隙大;(2) 易变价。
7 写出下列体系的可能的化学式:
(1) MgCl2在KCl中的固溶体;(2) Y2O3在ZrO2中的固溶体;
(3) Li2S在TiS2中的固溶体;(4) Al2O3在MgAl2O4中的固溶体。
解:(1) MgCl2在KCl中的固溶体:Mg x K1-2x Cl;同时出现(V’K)x;
(2) Y2O3在ZrO2中的固溶体:Y4x/3Zr1-x O;同时出现(V‥O)x;
(3) Li2S在TiS2中的固溶体:Li2x Ti1-x S2-x;同时出现(V‥S)x;
(4) Al2O3在MgAl2O4中的固溶体:Mg1-3x Al2+2x O4;同时出现(V’ ’Mg)x。
8 请预料少量下列杂质对AgCl晶体的电导率将会有什么影响(如果有的话):
解:(1) AgBr-不变(2) ZnCl2-增大(3) Ag2O-增大(4) KCl-不变
(5) NaBr-不变(6) CaCl2-增大(7) AgCl-不变(8) Na2O-增大
9 简述下列概念:
受主缺陷施主缺陷色心热缺陷化学缺陷n―型半导体p―型半导体
答:受主缺陷:类似于金属能带中的空穴,以空穴作为载流子。
施主缺陷为:可以提供载流子起导电作用的缺陷。
色心:电子占据了本应由负离子占据的位置而得到的缺陷,这种缺陷在晶体吸光时起主导作用,故叫作色心,并常用德文名称的首写字母表示为F-心。
热缺陷:热缺陷分作Frenkel缺陷(“空位+间隙原子”成对出现)和Schottky缺陷(“空位”缺陷单独出现)两类。
化学缺陷:即化学杂质缺陷,是因晶体组成以外的原子(离子)进入到了晶体中,往往是由于化学制备过程而带来,故称作化学缺陷。
n―型半导体:施主半导体或n-型半导体。
如将As掺入Si的晶体,由于As具有五个电子,引起电子的过剩,As能给出电子,所以这种半导体就是n-型半导体。
p―型半导体:受主半导体或p-型半导体。
如将掺入Si的晶体,由于B能接受一个电子,所以这种体系叫受主半导体或叫p型半导体。
10 试设计一个对氟气敏感的含有快离子导体的装置,选择电极料、画出示意图、写出反应原理。
解:
F2(待测)/H+CaF2-YF3 H+/F2(参比)
利用原电池原理,采用快离子导体CaF2-YF3制成的化学传感器,将化学信息转化为电信号,然后再还原为化学信息,这样就可以测出氟气的分压。
待测氟气和参比氟气分压差和电池电压之间
关系为: E=(RT/2F)ln(p F
2”/p
F2
’)。
11 能用作激光源的固体一般需要满足哪些条件。
答:能用作激光源的固体一般需要满足以下条件:
(1) 良好的荧光和激光性能;
(2) 优良的光学均匀性;
(3) 良好的物理化学性能;
(4) 容易制得大尺寸,易于加工。
12 反斯托克发光体发射的波长较短于激发光的波长。
试说明为什么能量守恒并没有被违反。
答:从发光机理来看,激活过程采用了多级激活机制,激活剂逐个接受敏活剂提供的光子,激发到较高的能级;或者是采用合作激活机制,激活剂可以同时接受敏活剂提供的2个光子,激发到较高的能级。
因而能量守恒并没有违反。
13 为什么含有未成对电子壳层的原子组成的物质只有一部分具有铁磁性?
答:如果未成对电子平行地排成一列,材料就有净的磁矩,表现为铁磁性;相反,未成队电子反平行排列时,总磁矩为零,材料就呈现反铁磁性;如果自旋子虽是反平行排列,但两种取向的数量不同,会产生净的磁矩,材料就具有亚铁磁性。