顶扣包埋:单层细胞透射电镜制样
- 格式:docx
- 大小:492.84 KB
- 文档页数:4


透射电镜生物样品制作过程透射电镜生物样品制作过程大致经过取材、固定、脱水、浸透、包埋、切片及染色等步骤。
一. 取材取材时要注意的要点是:快、小、冷、净、准、避免机械损伤。
取材方法:将固定液滴在冰台上的卡片上,在麻醉后的动物身上快速用剪刀剪取一块组织,用预冷的过的缓冲液将剪下的组织洗净,迅速放到卡片上的固定液中,用刀片切去被镊子夹到和剪刀剪过的组织,后按实验的目的将组织切成0.5~1mm2的立方或横截面为1mm2的长方体。
用牙签将切好的组织块转移到装有固定液的小瓶中,贴好标签并置于4℃的冰箱中。
二.固定以下操作尽可能在4℃的环境下,使用的溶液也要保存在4℃的冰箱中。
1、戊二醛固定:用镊子轻轻的将组织块从固定液中取出,放在卡片上的固定液中,利用双面刀片把组织块切成小块状,放进盛有1~1.5ml的0.1%的戊二醛的固定液的细管中,将吸管放进真空箱中,将大气压抽到760托后取出,使组织块在戊二醛溶液中固定1小时。
2、漂洗:经戊二醛固定的组织块要用1~1.5ml的0.1%PBS缓冲溶液漂洗,漂洗的次数为5次,在漂洗到第四次时可以将组织留在PBS漂洗液中过夜,放入4℃的冰箱中。
第二天早晨再进行第五次漂洗。
3、四氧化锇固定:向漂洗过的组织中加入0.5ml的0.1%四氧化锇固定液,固定时间为2个小时。
由于四氧化锇具有毒性,因此操作在通风橱里进行。
4、漂洗四氧化锇:用0.1%PBS缓冲溶液漂洗剩余的四氧化锇,然后再漂洗两次,其时间间隔为10min。
三.脱水为了保证包埋介质完全渗入组织内部,必须事先将组织内的水分驱除干净,即用一种和水及包埋剂均能相混溶的液体来取代水,常用的脱水剂是乙醇和丙酮。
1、酒精脱水:用浓度梯度依次为30%、50%、70%、90%的酒精,依次浸泡组织,其浸泡的时间一般为10min。
当在70%梯度的酒精时,样品可以放置过夜。
2、丙酮脱水:用浓度梯度为90%、100%的丙酮浸泡组织,在纯丙酮中浸泡三次。

透射电镜制样步骤以及注意事项透射电子显微镜(Transmission Electron Microscope,简称TEM)是目前最常用的高分辨率电子显微镜,可以用于观察物质的微观结构。
制备TEM样品的过程非常重要,下面将详细介绍TEM制样的步骤以及需要注意的事项。
制备TEM样品的步骤一般包括样品的选择、固定与固化、切片、薄化、网格制备和贴膜等。
第一步是样品的选择,样品应具有研究价值且适合观察。
例如,生物样品可以是细胞、组织或器官的薄片,金属样品可以是扁平的块状、粉末或薄膜等。
第二步是固定与固化。
对于生物样品,常用的固定方法包括浸泡法、灌注法和切片冷冻法;对于无机样品,可以使用固定剂将样品固定在固定剂中。
第三步是切片。
将固定好的样品切割成薄片,一般要求薄片的厚度在100 nm以下,通常使用超薄切片机来进行切割。
第四步是薄化。
将切割好的样品进行薄化处理,使其达到TEM观察所需的薄度。
常见的薄化方法有机械薄化、电化学薄化和离子薄化等。
第五步是网格制备。
将薄化好的样品放置在铜网格上,网格的选取应该根据所研究样品的性质和需要进行选择。
最后一步是贴膜。
将组织切片或带有样品的网格进行贴膜,以保护样品并提高图像的对比度。
在以上步骤中,需要注意的事项有:1.样品在制备过程中要避免受到污染或氧化,尽量在纯净无尘的环境中进行操作。
2.固定剂的选择要合理,不同的样品可能需要使用不同的固定剂,应根据需要进行选择。
3.切片时要注意刀片的尖锐度和切割角度,以免对样品造成损伤或变形。
4.薄化过程中要控制好加工参数,以保证样品的均匀薄化。
5.制作网格时应选择合适的网格尺寸和类型,以适应观察需求。
6.贴膜时要使薄膜均匀平整,并避免出现气泡或杂质。
总之,TEM制样是一项复杂而关键的过程,要保证样品的质量和可观察性,需要仔细选择方法、控制操作参数、注意样品的保护与处理。
合理的样品制备能够获得高质量的TEM图像,并提供准确的实验数据和结论。

透射电镜生物样品制备方法我折腾了好久透射电镜生物样品制备方法,总算找到点门道。
一开始的时候,我真是瞎摸索,走了不少弯路。
就说取材这一步吧。
我最开始取材,根本就没有考虑到样本的新鲜度有多重要。
有一次我取了一块组织,因为中间耽搁了点时间,结果后面在电镜下看的时候,细胞结构那叫一个模糊,好多细节都没了。
我这才恍然大悟,取材就得要快,尽可能减少样本暴露在外界的时间。
好比咱摘个苹果,要是在手里捏半天再去观察它的表皮细胞,肯定和刚摘下来就看是不一样的。
而且取材的时候大小也要合适,不能太大,大了后续处理不容易,像大房子打扫起来总是比小房子费劲。
固定也特别关键。
我试过用戊二醛固定,这个浓度可得小心。
浓度高了呢,可能会对样品有损伤;浓度低了嘛,又固定不好。
我一开始没经验,浓度没调好,整个样品固定下来乌七八糟的。
后来我就严格按照标准来配比,慢慢就好了很多。
就像做菜放盐,咸了淡了都不行。
清洗这一步我也没少摔跤。
清洗不彻底的话,残留的固定液还在样本上,也会影响后面的成像。
我之前总是洗得马马虎虎的,直到得到很糟糕的结果后才知道要多用心。
这就好比洗衣服,得把洗涤剂都漂洗干净。
脱水这一环节是个精细活儿。
我打算用一系列不同浓度的乙醇来脱水。
乙醇浓度要逐渐升高,得一步一步来,不能跳着来。
我就试过急着快点完成这一步,跳了个浓度,结果样本皱巴巴的,在电镜下看完全不是正常的形态了。
这就像盖房子,基础没打好,上层肯定不稳。
包埋的时候也是,要选择合适的包埋剂。
我用过环氧树脂包埋,这个过程中要按照正确的比例混合包埋剂,就像调鸡尾酒,比例不对就调不出那个味道。
关于切片,我最大的教训就是切片的厚度。
切得太厚,图像叠影重重,看不清楚;切得太薄又容易弄碎。
这得靠多练习,掌握自己设备的脾气,就跟炒菜掌握火候似的,多试几次就有感觉了。
最后就是染色了,染色剂的选择和染色的时间都需要好好琢磨。
用错了染色剂或者染色时间不对,呈现出来的图像颜色就不对,对比度不行,很多结构就显示不出来。

透射电镜生物制样透射电镜(Transmission Electron Microscope, TEM)是一种强大的工具,用于研究和观察生物制样,特别是在纳米级别下的细胞和组织结构。
利用透射电镜,科学家可以深入研究生物体内部的微观结构和化学组成,为我们深化理解生命的基本单位提供了巨大帮助。
在生物制样的过程中,首先需要对样品进行固定,以保持其原始的形态和结构。
常用的固定剂包括冷冻与化学固定剂。
冷冻固定将样品迅速冷冻至极低温,以保留细胞的天然形态和水合状态。
化学固定则通过化学反应交联细胞中的分子结构,稳定样品并防止其后续的变化。
固定后,样品需要进行剖面制备。
通常采用超薄切片技术,将样品切割成约70至100纳米厚的薄片。
这一步骤需要高超净实验室环境和专业的技术操作,以确保样品的质量和薄片的均匀性。
之后,透射电镜的操作步骤就开始了。
样品薄片被放置在透明的铜网上,并通过仔细的步骤逐渐加膜、压制,最终制备成为透射电镜样品。
为了提高样品的对比度,在样品制备过程中,常常需要对其进行染色。
例如,使用重金属盐(如铇酸)对样品进行染色,使得不同细胞组分在电镜下有更明显的特征。
在样品制备完毕后,样品会被放置在透射电镜的样品室中。
电子束经过样品,透射到另一端的检测器上。
通过检测电子束的强度和散射情况,透射电镜可以产生高分辨率和详细的图像。
这些图像经过处理和分析,可以揭示出生物样品中微观结构的细节。
利用透射电镜生物制样,可以提供许多重要的信息。
例如,可以观察到细胞的亚细胞结构,如线粒体、内质网和高尔基体等细胞器的详细形态。
还可以研究细胞和组织中的超微结构、蛋白质聚集和聚体、核糖体和核纤维等。
透射电镜也能够帮助科学家研究细胞和组织中的病理变化和与疾病相关的结构异常。
例如,可以观察到病毒的形态和复制过程,深入了解病毒感染的机理。
同时,也可以通过透射电镜观察神经元的超微结构,帮助我们理解神经系统疾病的发病机制。
总之,透射电镜生物制样为生命科学领域提供了研究细胞和组织的有力工具。

透射电镜样品制备过程
组织取材(60s内),体积<1mm3,之后进行如下步骤
1)前固定:3%戊二醛2h或过夜。
2)漂洗:磷酸缓冲液,3次,10min/次。
3)后固定:1%锇酸固定液,2h。
4)漂洗:(同上)。
5)梯度脱水:50%丙酮,70%丙酮,80%丙酮,90%丙酮两次,各10min 。
100%丙酮两次,各15min。
6)渗透:丙酮/包埋剂(1:1,1:2),室温各1h。
丙酮/包埋剂1:3, 4度过夜。
纯包埋剂,4度过夜。
7)包埋:纯包埋剂(37度,45度,60度各24h)。
取出包埋块,进行超薄切片,片厚70nm。
分别采用醋酸双氧铀对切片进行染色30min,双蒸水漂洗3-5次,之后用柠檬酸铅
染色10min,双蒸水漂洗3-5次。
待切片干燥后,透射电镜观
察。
切片机型号:Leica UC7 超薄切片机,速度1mm/s.
透射电镜型号:日立高新HT7700,电压80kv 电流10μa.。

包埋块的制备(1)取材分别取在铅胁迫浓度为0μg/g、1 000μg/g时,接种AMF的玉米须根。
用镊子夹取玉米须根,并用蒸馏水冲洗干净后,用锋利的无油污双面刀片将其切成0.5 cm大小的根段。
(2)前固定将玉米根段放入装有3%戊二醛固定液的1 ml离心管中,并用真空泵抽去组织内部的气体,0-4℃下固定6 h或过夜。
(3)漂洗用0.1 ml/L PBS(pH7.2)漂洗4-6次,开始时间间隔较短,15~20 min换一次,最后1 h换1次。
(4)后固定1%锇酸4℃固定2 h。
(5)漂洗PBS缓冲液漂洗多次。
(6)丙酮脱水从低浓度脱水剂逐步过渡到高浓度脱水剂。
30%丙酮(20 min)→50%丙酮(30 min)→70%丙酮(30 min)→80%丙酮(30 min)→90%丙酮(30 min)→95%丙酮(30 min)→100%丙酮(30 min)→100%丙酮(30 min)→100%丙酮(30 min)。
(7)浸透浸透的目的是用包埋剂逐步取代植物组织中的脱水剂,使细胞内外空隙被包埋剂所填充。
按Epon812(9.5 ml)、DDSA(4.9 ml)、MNA(5.6 ml)、DMP-30(0.3ml)的比例配好包埋剂。
包埋剂:丙酮(1:3)浸透2~3 h→包埋剂:丙酮(1:1)浸透4~5 h→包埋剂:丙酮(3:1)浸透10~12 h→纯包埋剂浸透24 h→纯包埋剂浸透48 h。
(8)包埋先加一滴包埋剂在包埋板孔前端,再用牙签把组织块送入包埋板孔最前端的中部后,将写好的标签放在后端的中间,最后用纯包埋剂加满包埋孔,不能产生气泡。
(9)聚合将含有包埋好样品的包埋板放入烘箱内,30℃下放置48 h,60℃放置48 h。
组织块从烘箱中取出后,放在干燥器中保存。
3.2.8.2修整包埋块(1)用样品夹夹紧包埋块,放于双目显微镜下。
(2)先用单面刀片将包埋块修成金字塔形,顶面修成大约1 mm2的长方形或梯形。
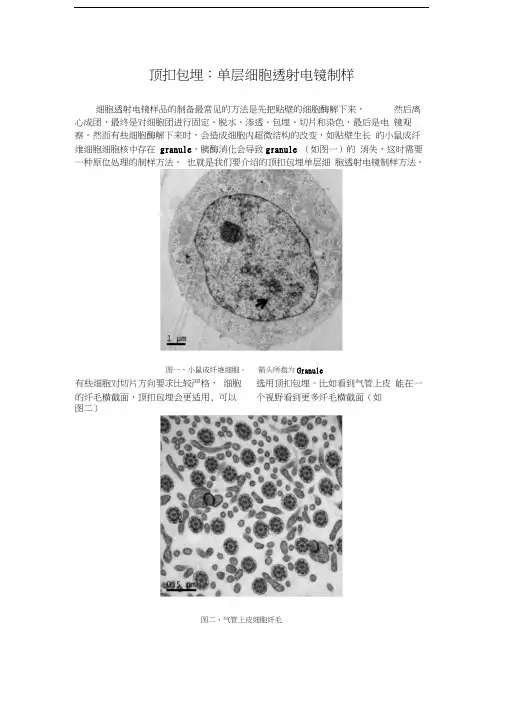
顶扣包埋:单层细胞透射电镜制样细胞透射电镜样品的制备最常见的方法是先把贴壁的细胞酶解下来,然后离心成团,最终是对细胞团进行固定、脱水、渗透、包埋、切片和染色,最后是电镜观察。
然而有些细胞酶解下来时,会造成细胞内超微结构的改变,如贴壁生长的小鼠成纤维细胞细胞核中存在granule,胰酶消化会导致granule (如图一)的消失,这时需要一种原位处理的制样方法,也就是我们要介绍的顶扣包埋单层细胞透射电镜制样方法。
有些细胞对切片方向要求比较严格,细胞的纤毛横截面,顶扣包埋会更适用, 可以选用顶扣包埋。
比如看到气管上皮能在一个视野看到更多纤毛横截面(如图二)图一、小鼠成纤维细胞。
箭头所指为Granule图二、气管上皮细胞纤毛以活体皿(玻璃底)培养细胞为例,介绍顶扣包埋的具体操作方法:1.PBS浸洗一次,10 min ;2. 2.5%戊二醛固定,30 min;3.PBS浸洗三次,每次10 min;4.1%锇酸固定30 min ;5.乙醇梯度脱水;6.树脂渗透,树脂7.聚合注意:以上操作都在活体皿里进行,尽可能再空气干燥时制样,并做好防潮措施。
图三、活体皿中处理细胞,封口膜防潮8.顶扣粘贴再聚合A带玻璃底的活体皿,已完成聚合;B 40%的氢氟酸溶解玻璃底15 min,水洗,烘干;图五、正在腐蚀活体皿的玻璃底C从活体皿中取下圆形树脂块,单层细胞在树脂块里;图六、圆形的树脂块D分割圆形树脂块成小块;图七、分割树脂块E用液体树脂粘贴分割的小树脂块到空包埋块上(有细胞一面超外侧),然后再次聚合;图八、粘贴树脂块F修块,为超薄切片做准备;图九、修块9.超薄切片、染色和透射电镜观察。
注意事项:1、脱水不要用丙酮。
活体皿边缘是塑料材质,易溶于丙酮,在脱水或渗透过程中要避免使用丙酮。
2、在活体皿里聚合,所加树脂要适量。
聚合所用树脂的量要适量,以刚刚覆盖玻璃底为标准,若太厚会导致分割困难,太薄粘贴时会出现打卷现象,不利于超切。

透射电镜观察特定原位培养细胞样品的制备杨 怡,张 飒,周 涛,张德添,张学敏(军事医学科学院国家生物医学分析中心,北京 100850)[收稿日期] 2002-12-09[作者简介] 杨 怡(1948-),女,上海市人,高级实验师。
通过透射电镜观察体外培养细胞,最早的方法是将细胞培养在载玻片上,按照顶扣法制备样品即可得到满意的结果[1]。
现在大部分体外培养的细胞生长在玻璃培养瓶中,需要用硅胶刮子将细胞刮下来然后离心,再按常规方法制作超薄切片才能在电镜下观察[2]。
有些细胞,如在塑料培养皿(直径35mm )中生长的神经细胞,如果要求观察该皿中某个特定神经元的超微结构,按上述方法制备样品是不能满足要求的。
为此,我们建立了塑料组织培养皿中特定细胞连续超薄切片的制备技术。
1 材料与方法1.1 样品制备送检组织培养皿(直径35mm )中的培养细胞,先用1/15mol /L PBS (p H 7.4)清洗3次;再用2.5%~3%戊二醛(1/15mol /L PBS ,pH7.4)4℃固定1h ;1%四氧化锇(0.24mol /L PBS ,pH 7.4)4℃后固定1h ;系列乙醇脱水及Epon 812树脂包埋;35℃、45℃各聚合12h ;60℃聚合24h 。
1.2 特定细胞的准确定位在相差显微镜下选好要在电镜下观察的特定细胞,用刀片或解剖针在包埋块的树脂面上画一个“井”字,特定细胞在“井”字的中央,“井”字中“口”的宽度为0.3~0.5mm 。
最好在“井”字的周围用标志笔再做一个记号,以便能肉眼核对细胞的位置。
剪去塑料培养皿取出包埋块,用刀片修去“井”字四周多余的树脂,制成特定细胞所在部位的包埋块(薄片)。
1.3 连续超薄切片术及电镜观察取一个旧样品块作为样品托,将样品托的凸出部分用锉刀锉成一个平面,再将Epon812树脂涂在该面上,将上述修好的包埋块粘到样品托上,放入60℃烤箱中聚合24h 。
用钻石刀在Reichet S 型超薄切片机上切连续超薄切片,每张切片厚度为75~80n m 。

透射电镜样品制备流程由于透射电镜能观察的样品必须很薄(60~70nm),所以透射电镜的样品准备要求很严格,方法也很单一,仅有一下两种方法:一.负染色技术负染色技术简单快速,可以显示生物大分子、细菌、分离的细胞器以及蛋白晶体等样品的形态、结构、大小以及表面结构的特征。
尤其在病毒学中,负染色技术有着广泛的应用。
样品要求:①样品悬液的纯度不要求很纯,但是如果杂质太多,如大量的细胞碎片,培养基残渣,糖类以及各种盐类结晶的存在都会干扰染色反应和电镜的观察。
尤其是不能有过多的糖类,因为在电子束的轰击下,糖类容易碳化而有碍观察,因此样品要适当提纯。
②样品悬液的浓度要适中,太稀在电镜下很难找到样品,太浓样品堆积影响观察。
操作流程:吸取样品悬液滴到有膜的铜网上,静置数分钟,然后用滤纸吸去多余的液体,滴上负染色液,染色1~2min后滤纸吸去负染色液,待干后用于电镜观察。
二、超薄切片技术超薄切片技术是为透射电镜观察提供薄样品的专门技术,是生物学中研究细胞超微结构最常用的技术。
广泛应用于生物体的各种细胞的超微结构观察。
一般厚度在10~100nm的切片称为超薄切片,制作这种切片的技术叫做超薄切片技术。
超薄切片制作的过程包括取材、固定、脱水、渗透、包埋、聚合、切片和染色等几个环节,和一般光学显微镜的石蜡切片过程相似。
但是,超薄切片切片过程更为细致与复杂,要求更严格,而且所用的试剂比较昂贵、配制复杂、强致癌。
具体操作步骤、注意事项如下:1.取材和前固定:快速的切取大小为0.5~1.0mm3的样品块,一分钟内把组织(样品)块浸入2.5%戊二醛(进口品质)溶液(取样前来平台领取),每个离心管内装20个以上的样品块,作为一个样送到平台。
要求:①取材前一定要和工作人员取得电话联系!②取材选择部位要准确可靠,确保每块材料都是要观察的部位。
③所有植物样品一定要抽真空,能够沉底的样品也抽真空15mins,不能沉底的样品一定要抽真空致沉底!④细菌、散在细胞等不能成块的样品,加戊二醛固定液,离心沉淀后送到平台,由平台工作人员处理。

透射电镜制样方法
透射电镜制样方法主要包括以下步骤:
1. 样品制备:首先需要选择合适的样品,并进行必要的前处理。
根据需要,可以使用传统的金相方法,如切片、打磨和腐蚀等来制备样品;也可以使用更先进的方法,如离子切片、聚焦离子束等来制备样品。
2. 高真空处理:将样品置于高真空环境下进行处理,以去除气体和水分的影响。
这可以通过在真空槽中加热样品、通入惰性气体等方法来实现。
3. 制备薄片:将制备好的样品制备成足够薄的薄片,通常厚度要求在几十纳米至几百纳米之间。
这可以通过使用超薄切片机或聚焦离子束来实现。
4. 电导涂层:为了提高样品的导电性,可以在样品表面涂上金薄层或碳薄层。
这可以通过蒸镀、溅射、离子镀等方法来实现。
5. 透射电镜成像:将制备好的样品放入透射电镜中,调整仪器参数,如加速电压、透镜聚焦等,进行成像。
可以使用像差校正技术、电子衍射等方法来提高成像质量。
需要注意的是,不同样品的制备方法会有一定差异,制备薄片时要注意避免样品的破裂和变形,电导涂层要均匀且致密,成像时要注意样品与探针的相对位置等
细节问题。
此外,透射电镜制样方法还包括一些先进的技术,如原位制备、低温制备、离子减薄等,可以根据需要选择适合的方法进行制备。
透射电镜制样方法
透射电镜制样是实验室中极为重要的一项技术操作,它将不同结构和尺寸的样品细粒度地进行分离,使之适应望远镜进行观察。
目前实验室高等学校科研都广泛运用透射电镜进行材料研究。
透射电镜制样大致可分为以下步骤:
1.准备样品:将细分的材料(如金属、碳、化学物质等)放在石英板上,以保证材料表面光滑。
2.制备标本:用刮子将样品按一定密度均匀地刮到石英板上制备出一个标本,再在标本表面进行抛光,使标本表面光滑,并保证其大小和厚度圆滑兼容。
3.金相分析:将抛光的标本放在金相检测仪上,通过金相范式素材库,自动检测标本的组成成分,较快准确得出有关分析结果。
4.涂覆镜片:将样品夹在两个玻璃挡板间,倒入特殊的样品涂覆液,将两片玻璃挡板缓慢压缩,使涂覆液平稳均匀地涂覆到样品表面,以形成镜片。
5.放入电镜:将涂覆后的样品放入透射电镜,并用调节电源选择对应的廓线调节器,即可通过连续的廓线选择实现不同的形状的样品的聚焦。
6.观察分析:在放大可视屏上观察样品,然后拍照或录制,以便进一步分析。
以上就是透射电镜制样的大致步骤,制备一个完美样品需要仔细操作,技术人员必须熟悉此项技术操作,并结合实际材料和实验步骤多次实践,以达到良好的实验效果。
透射电镜样品制备方法透射电镜的样品制备方法,需要经过取材、固定、脱水、渗透、包埋聚合、切片及染色等步骤。
一.取材的基本要求组织从生物活体取下后,如果不立即进行适当处理,会由于细胞内部的各种酶作用,出现细胞器自溶现象。
因此,为了细胞结构尽可能保持天然状态,必须做到快、小、准、冷。
(1)动作迅速,组织从活体取下后应在最短的时间内(1分钟内)投入2.5%戊二醛固定液。
(2)所取组织的体积要小,一般不超过1mm*1mm,取样形状为牙签状。
也可将组织修成1mm*1mm*2-5mm大小长条形。
因为固定剂的渗透能力较弱,组织块如果太大,块的内部将不能得到良好的固定。
(3)机械损伤要小,解剖器械应锋利,操作宜轻,避免牵拉、挫伤与挤压。
推荐使用手术刀或双面刀片。
(4)操作最好在低温(0℃—4℃)下进行,以降低酶的活性,防止细胞自溶。
(5)取材部位要准确。
切片窗小于1mm*1mm,如取样带有太多的多余组织,可能造成你需要的部分刚好被修掉。
二.取材方法(按照自己的样品类型检索)1.动物及人体组织的取材(在冰浴上进行)动物组织的取材,应麻醉(1%戊巴比铵5 ml/kg体重腹腔注射)或断头急性处死,解剖出所需器官。
用手术刀切割取一小块组织,放在干净的硬质板上(例如培养皿底部),滴一滴冷却的固定液。
用新的、无油污的锋利双面刀片将材料切成大约1 mm宽,3~5 mm长的小块并从中选出受损伤较小的小条(牵拉损伤将直接破坏组织,切取时刀片下压,不要来回拉锯),用牙签将这些小块逐一放入盛有预冷的、新鲜固定液的1.5 ml管内,放入冰箱冷藏室低温固定(0~4℃)4小时或以上。
*固定结束后,将固定液用磷酸盐缓冲液稀释三倍,样品于该溶液中在4℃冰箱保存。
送样前请用磷酸盐缓冲液于4度冰箱浸泡清洗15 min,共3次,做好标记送至电镜室。
送样请使用2 ml离心管,用记号笔在离心管管壁上写好编号,用透明胶带缠绕。
后续管子会接触丙酮和乙醇,一定要用透明胶带缠绕,以防记号被洗掉。
透射电镜送样须知1、观察对象和检测周期:(一)通过超薄切片方法观察细胞的细胞壁,细胞膜以及细胞器等细胞内部超微结构,分辨率1nm左右。
通常固定好的样品任选周四之前任意一个工作日的早上9点半开始制样,到下6点左右结束当天制样工作,我实验室技术人员负责后期的包埋、切片、染色的环节。
从样品制备到观察需要两周的时间。
(二)病毒、蛋白、细菌或者细胞器等亚细胞结构通过滴染到铜网上的方法直接进行观察,分辨率1nm左右。
通常情况送检当天取得观察结果。
2、送检样品状态:(一)切片类样品用化学固定这一常规方法制样时,初固定是保证样品结构最大程度接近初始状态的最关键的一步。
初固定液的组分:与细胞环境相适应的缓冲液以及醛类物质。
通常样品缓冲液为0.1M,PH=7.2~7.4的PB缓冲液(对缓冲液有特殊要求的生物样品请酌情调配,如高盐,嗜酸,嗜碱,胚胎等富水组织等)。
用此缓冲液将固定剂母液稀释到使用的浓度,其固定剂成分是终浓度为2.5%的戊二醛和2%的多聚甲醛的混合物。
1)微生物类单细胞样品的取样和固定A、细胞量:低速离心细胞沉淀约20微升(尚未固定的细胞尽可能低速离心)。
B、固定:加入1ml体积固定液,将沉淀吹吸混匀,室温固定(保证每个细胞均被第一时间充分固定)2小时后放置4℃冰箱保存;特殊需求可低温固定。
C、针对对条件变化敏感的样品如厌氧菌等,可先固定后离心收集。
2)植物类样品的取样和固定A、取材:先将含目标组织在内的大块组织粗略剪裁到固定液中,快速切割下1mm3或者1*1mm2大小的目标组织块(尽可能取靠近边缘位置最先被固定液固定的样品)放入1毫升的固定液中,对切片方向有要求的样品请在取材时通过切取组织块的一个小角或者取材时通过样品块的长宽不同来作以区分。
以一个火柴为例,我们切片的方向是从火柴头切向火柴杆。
B、叶片等含有气孔的组织需要真空抽气,让样品快速下沉,促进固定液的渗透。
取材后放置在室温固定2小时后4℃冰箱保存,特殊需求的样品可低温固定。
透射电镜的制样方法一、超薄切片法。
1.1 取材。
这可是制样的头一遭,就像盖房子打地基一样重要。
取材的时候得特别小心,要选取咱们感兴趣的部位。
这部位得有代表性啊,不能瞎取。
比如说研究细胞结构的,就得找到细胞长得好、特征明显的那块组织。
而且动作要快,就像抢红包似的,手慢无。
为啥呢?因为组织一旦离开生物体,就开始发生变化了。
1.2 固定。
固定这一步可不能含糊。
就像给组织“定个型”,让它保持生前的状态。
通常会用到化学固定剂,像戊二醛啥的。
把组织泡在里面,就像把东西放在保险柜里一样,稳稳当当的。
这一步要是没做好,后面的观察就全乱套了,那可就是“一着不慎,满盘皆输”。
1.3 脱水。
脱水就像给组织“脱衣服”,把水分一点一点去掉。
用的是一系列不同浓度的乙醇或者丙酮。
这个过程得循序渐进,不能操之过急,不然组织就会被破坏。
这就好比爬山,得一步一个脚印,急不得。
1.4 浸透与包埋。
浸透呢,就是让包埋剂慢慢渗到组织里。
包埋就像给组织做个“小房子”,把它保护起来。
常用的包埋剂有环氧树脂之类的。
这一步就像给宝贝裹上一层保护膜,得仔仔细细的。
1.5 超薄切片。
这可是个精细活,切片要薄得像蝉翼一样。
用超薄切片机来切,切的时候得全神贯注,稍有不慎就会前功尽弃。
切出来的片子就像一片片小雪花,又薄又脆弱。
二、负染法。
2.1 样品准备。
先把要观察的样品处理好,比如说提纯之类的。
这就像把菜洗干净,准备下锅一样。
得把杂质去掉,让咱们想看的东西“干干净净”地呈现出来。
2.2 负染。
用重金属盐溶液来进行负染。
这就像给样品穿上一件深色的“衣服”,让它在电镜下更明显。
染的时候要控制好量,多了少了都不行,就像炒菜放盐,得恰到好处。
三、冷冻制样法。
3.1 冷冻固定。
直接把样品快速冷冻,让它瞬间定格。
这就像给样品来了个“急冻魔法”。
这样能最大程度地保持样品的原始状态,避免化学固定带来的一些变化。
3.2 冷冻超薄切片。
在冷冻的状态下进行超薄切片。
这可不容易,就像在冰上雕刻一样,需要特殊的设备和技术。
细胞透射电镜制样流程嘿,朋友们!今天咱就来唠唠细胞透射电镜制样流程这个事儿。
你想想,细胞那么小,就像个小小的神秘世界,咱要想看清它里面到底啥样,就得用些特别的办法,就像咱要进一个神秘的小城堡,得找到正确的钥匙和路径一样。
先说说取材吧。
这可太关键啦!就好比你要挑一个最好最有代表性的果子,可不能随随便便就拿一个。
得快、准、稳,还得保证细胞别被损伤喽。
不然你后面再怎么努力,那也白搭呀!取完材,就得固定啦。
这就像是给细胞穿上一件坚固的铠甲,让它能保持住原本的模样,不变形、不损坏。
这一步要是没做好,那后面看到的可能就不是细胞本来的样子啦,那不就成了张冠李戴啦?接下来就是脱水啦。
哎呀呀,这就像把细胞身上多余的水分都给挤掉,让它变得干干爽爽的。
但可别太狠啦,把细胞给弄干瘪喽。
然后是浸透。
这就像是给细胞泡个特殊的澡,让它能好好地和后面要用到的材料融合在一起。
包埋呢,就像是给细胞做个小房子,把它安安稳稳地放进去。
可别小看这个小房子,要是没做好,后面可就麻烦啦。
切片啦!这可是个技术活,要切得薄薄的,像纸一样。
这可不容易呀,得小心翼翼的,就像在雕刻一件精美的艺术品。
最后就是染色啦。
给细胞染上颜色,让它能在电镜下更加清楚地显现出来。
这就像是给细胞化个妆,让它能更加漂亮地展现在我们眼前。
你说这一系列操作下来,是不是就像在完成一个伟大的工程呀?每一步都得认认真真、仔仔细细的。
要是有一步出了差错,那可能就前功尽弃啦!所以呀,做这个可得有耐心、有细心,还得有技术。
咱想想,通过这么多步骤,咱就能看到细胞里面那些奇妙的结构啦,那些小小的细胞器,就像一个个小机器在工作着。
这多有意思呀!这就是科学的魅力呀,能让我们看到平时看不到的世界。
总之呢,细胞透射电镜制样流程可不简单,但只要咱认真对待,肯定能揭开细胞那神秘的面纱,看到它最真实的模样。
加油吧,朋友们!让我们一起探索细胞的奥秘!。
顶扣包埋:单层细胞透射电镜制样细胞透射电镜样品的制备最常见的方法是先把贴壁的细胞酶解下来,然后离心成团,最终是对细胞团进行固定、脱水、渗透、包埋、切片和染色,最后是电镜观察。
然而有些细胞酶解下来时,会造成细胞内超微结构的改变,如贴壁生长的小鼠成纤维细胞细胞核中存在granule,胰酶消化会导致granule(如图一)的消失,这时需要一种原位处理的制样方法,也就是我们要介绍的顶扣包埋单层细胞透射电镜制样方法。
图一、小鼠成纤维细胞。
箭头所指为Granule有些细胞对切片方向要求比较严格,可以选用顶扣包埋。
比如看到气管上皮细胞的纤毛横截面,顶扣包埋会更适用,能在一个视野看到更多纤毛横截面(如图二)。
图二、气管上皮细胞纤毛以活体皿(玻璃底)培养细胞为例,介绍顶扣包埋的具体操作方法:1.PBS浸洗一次,10 min;2. 2.5%戊二醛固定,30 min;3.PBS浸洗三次,每次10 min;4.1%锇酸固定30 min;5.乙醇梯度脱水;6.树脂渗透,树脂7.聚合注意:以上操作都在活体皿里进行,尽可能再空气干燥时制样,并做好防潮措施。
8.顶扣粘贴再聚合A 带玻璃底的活体皿,已完成聚合;B 40%的氢氟酸溶解玻璃底15 min,水洗,烘干;图三、活体皿中处理细胞,封口膜防潮图四、已树脂聚合的活体皿图五、正在腐蚀活体皿的玻璃底C 从活体皿中取下圆形树脂块,单层细胞在树脂块里;D 分割圆形树脂块成小块;E 用液体树脂粘贴分割的小树脂块到空包埋块上(有细胞一面超外侧),然后再次聚合;F 修块,为超薄切片做准备;图六、圆形的树脂块图七、分割树脂块图八、粘贴树脂块图九、修块9.超薄切片、染色和透射电镜观察。
注意事项:1、脱水不要用丙酮。
活体皿边缘是塑料材质,易溶于丙酮,在脱水或渗透过程中要避免使用丙酮。
2、在活体皿里聚合,所加树脂要适量。
聚合所用树脂的量要适量,以刚刚覆盖玻璃底为标准,若太厚会导致分割困难,太薄粘贴时会出现打卷现象,不利于超切。
顶扣包埋:单层细胞透射电镜制样
细胞透射电镜样品的制备最常见的方法是先把贴壁的细胞酶解下来,然后离心成团,最终是对细胞团进行固定、脱水、渗透、包埋、切片和染色,最后是电镜观察。
然而有些细胞酶解下来时,会造成细胞内超微结构的改变,如贴壁生长的小鼠成纤维细胞细胞核中存在granule ,胰酶消化会导致granule (如图一)的消失,这时需要一种原位处理的制样方法,也就是我们要介绍的顶扣包埋单层细胞透射电镜制样方法。
有些细胞对切片方向要求比较严格,可以选用顶扣包埋。
比如看到气管上皮细胞的纤毛横截面,顶扣包埋会更适用,能在一个视野看到更多纤毛横截面(如图二)。
图一、小鼠成纤维细胞。
箭头所指为Granule
图二、气管上皮细胞纤毛
以活体皿(玻璃底)培养细胞为例,介绍顶扣包埋的具体操作方法: 1. PBS 浸洗一次,10 min ; 2. 2.5%戊二醛固定,30 min ; 3. PBS 浸洗三次,每次10 min ; 4. 1%锇酸固定30 min ; 5. 乙醇梯度脱水; 6. 树脂渗透,树脂 7.
聚合
注意:以上操作都在活体皿里进行,尽可能再空气干燥时制样,并做好防潮措施。
8. 顶扣粘贴再聚合
A 带玻璃底的活体皿,已完成聚合;
B 40%的氢氟酸溶解玻璃底15 min ,水洗,烘干;
图三、活体皿中处理细胞,封口膜防潮 图四、已树脂聚合的活体皿 图五、正在腐蚀活体皿的玻璃底
C 从活体皿中取下圆形树脂块,单层细胞在树脂块里;
图六、圆形的树脂块
D 分割圆形树脂块成小块;
图七、分割树脂块
E 用液体树脂粘贴分割的小树脂块到空包埋块上(有细胞一面超外侧),然后再次聚合;
图八、粘贴树脂块
F 修块,为超薄切片做准备;
图九、修块
9.超薄切片、染色和透射电镜观察。
注意事项:
1、脱水不要用丙酮。
活体皿边缘是塑料材质,易溶于丙酮,在脱水或渗透过程
中要避免使用丙酮。
2、在活体皿里聚合,所加树脂要适量。
聚合所用树脂的量要适量,以刚刚覆盖
玻璃底为标准,若太厚会导致分割困难,太薄粘贴时会出现打卷现象,不利于超切。
3、氢氟酸腐蚀玻璃的操作要在通风橱进行,并做好防护措施,避免皮肤直接接
触氢氟酸。
4、粘贴带细胞的小树脂块宜用液体树脂。
最好采用树脂再聚合的方式粘贴分割
出的小块,这样会需要更长的时间,但粘贴更牢固,这一点在超切中至关重要。
速粘胶502虽然粘贴快速,但不牢靠,不建议使用。
5、超切要更仔细。
由于单层细胞样品厚度只有20μm左右,所以超薄切片前要
调整各个方向的角度,尽可能减少样品损失。