病毒增殖概述浅谈
- 格式:doc
- 大小:58.50 KB
- 文档页数:7



病毒缺乏增殖所需要的酶系统,只能在活的宿主细胞内增殖(⾃我复制)。
绝⼤多数病毒复制过程可分为下列六步:吸附、侵⼊、脱壳、⽣物合成、组装和释放。
吸附 吸附是决定感染成功与否的关键环节。
病毒吸附于敏感细胞需要病毒表⾯特异性的吸附蛋⽩与细胞表⾯受体相互作⽤。
病毒吸附蛋⽩(virus attachment protein, VAP)⼀般由⾐壳蛋⽩或包膜上的糖蛋⽩突起充当。
细胞表⾯受体(也称为病毒受体,virus receptor)则为有效结合病毒粒⼦的细胞表⾯结构,⼤多数噬菌体的病毒受体为细菌细胞壁上的磷壁酸分⼦、脂多糖分⼦以及糖蛋⽩复合物,有的则位于菌⽑、鞭⽑或荚膜上。
⼤部分动物病毒的病毒受体为镶嵌在细胞膜脂质双分⼦层中的糖蛋⽩,也有的是糖脂或唾液酸寡糖苷。
植物病毒迄今尚未发现有特异性细胞受体,其进⼊植物细胞的机制是通过伤⼝或媒介传播。
病毒的细胞受体具有种系和组织特异性,决定了病毒的宿主谱。
不同种属的病毒其细胞受体不同,有的甚⾄同种不同型的病毒以及同型不同株的病毒受体也不相同;另⼀⽅⾯,有些不同种属的病毒却有相同的细胞受体,其吸附和感染可对其它病毒的感染产⽣⼲扰。
VAP与病毒受体的结合需要⼀定的温度条件,以促进与酶反应相类似的化学反应。
在0-37℃内温度越⾼病毒吸附效率也越⾼。
病毒吸附细胞的过程可在⼏分钟到⼏⼗分钟的时间内完成。
侵⼊ 病毒通过以下不同的⽅式进⼊宿主细胞:注射式侵⼊、细胞内吞、膜融合以及其它特殊的侵⼊⽅式。
注射式侵⼊是有尾噬菌体通常的侵⼊⽅式。
通过尾部收缩将⾐壳内的DNA基因组注⼊宿主细胞内。
细胞内吞是动物病毒的常见侵⼊⽅式。
经细胞膜内陷形成吞噬泡,使病毒粒⼦进⼊细胞质中。
膜融合是有包膜病毒侵⼊过程中,病毒包膜与细胞膜融合的⼀种侵⼊⽅式。
直接侵⼊⼤致可分为⼏种类型。
1)部分病毒粒⼦直接侵⼊宿主细胞,其机理不明;2)病毒与细胞膜表⾯受体结合后,由细胞表⾯的酶类帮助病毒粒体释放核酸进⼊细胞质中,病毒⾐壳仍然留在细胞膜外,将病毒侵⼊和脱壳融为⼀体。

名词解释病毒的增殖病毒的增殖,是指病毒在寄主细胞内繁殖和增加数量的过程。
病毒是一类非细胞生物,无法自主生长和繁殖,需要寄生在寄主细胞内完成其生命周期。
病毒的增殖过程是一个复杂而精密的机制,涉及到多个环节和调控因子。
病毒入侵寄主细胞后,首先要进入细胞内部。
病毒通常通过与细胞膜相互结合或利用细胞内的胞吞作用等方式进入细胞内。
一旦病毒成功进入细胞内,它会释放出自己的核酸(DNA或RNA)和一些必要的蛋白质,以便进行复制和转录。
这些病毒蛋白质和核酸将开始调控细胞内的机制,以促使自身的表达和复制。
在病毒增殖的过程中,病毒核酸的复制起着关键作用。
通过病毒自身编码的酶或利用细胞内的酶,病毒核酸得以实现复制。
病毒的DNA或RNA在细胞内得到复制后,将形成更多的病毒基因组,为进一步的繁殖提供基础。
随着病毒复制过程的进行,病毒基因组和蛋白质逐渐积累。
病毒蛋白质具有特定的功能,如帮助病毒组装、促进病毒颗粒的形成以及干扰宿主细胞的正常功能。
这些蛋白质在病毒增殖过程中扮演着重要的角色,它们能够与细胞内的分子相互作用,从而实现病毒的繁殖和扩散。
一旦病毒完成了其内部的复制、转录和翻译等过程,它将开始组装成完整的病毒颗粒。
这个过程涉及到病毒蛋白质的自组装以及与病毒基因组的结合。
细胞内的胞吞或胞吐过程可以帮助病毒颗粒离开寄主细胞,并以不同的方式传播到其他细胞或宿主体内。
病毒的增殖是一个快速而高度有序的过程,它必须严密地控制每个环节的时机和数量,以保证病毒能够高效地繁殖。
在病毒增殖过程中,许多调控机制参与其中,包括细胞因子、信号转导通路以及病毒自身编码的蛋白质等。
这些因子相互作用,形成一个复杂的网络,以保证病毒的复制和繁殖在适当的时间和条件下进行。
病毒增殖不仅对于病毒本身具有重要意义,也对宿主细胞和宿主体具有重要影响。
病毒增殖过程中,病毒会耗尽宿主细胞的资源,并破坏宿主细胞内部的正常机制。
一些病毒还能够抑制宿主的免疫系统,使得宿主更容易受到感染和疾病的侵袭。

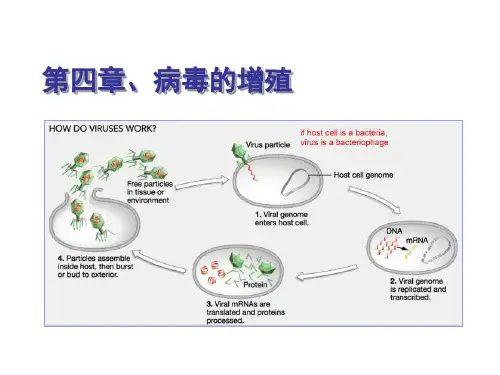
病毒的增殖病毒以复制方式进行增殖,从病毒进入细胞开始,经基因组复制到子代病毒释放的全过程,称为一个复制周期(replication cycle),包括吸附、穿入、脱壳、生物合成、组装、成熟和释放等连续的过程。
1.吸附 即病毒体与易感细胞的特异性结合,是病毒增殖的第一步。
吸附是特异的、不可逆的,这种特异性决定了病毒的嗜组织特征。
2.穿入 吸附在易感细胞的病毒穿过细胞膜进入细胞内的过程称为穿入。
穿入的方式有三种:①胞饮(pinoclytosis)或内吞(endocytosis):胞质膜内陷将病毒包裹其中,形成类似吞噬泡的结构使病毒进入胞质内,无包膜病毒一般以此方式穿入;②融合(fusion):有包膜的病毒依靠吸附部位的酶作用及包膜与细胞胞质膜的同源性等,发生病毒包膜与胞质膜的融台,使病毒核衣壳进入胞质内:③转位作用(transposition):少数无包膜病毒吸附于宿主细胞膜时,其衣壳蛋白的某些多肽成分发生改变,使病毒可直接穿过细胞膜,称为转位。
此外噬菌体吸附于宿主菌后,噬菌体尾部插入宿主菌细胞内,将其头部内的核酸通过尾髓直接注入宿主茵内,称为转染。
3.脱壳 穿入胞质中的核衣壳脱去蛋白质壳,使基因组核酸裸露的过程称为脱壳。
脱壳必须有酶的参与,多数病毒在穿入时已在细胞溶酶体酶作用下脱壳,有些病毒具有特异性水解病毒衣壳蛋白的酶称为脱壳酶。
4.生物合成 病毒体经脱壳后,病毒基因组释放进入细胞中,开始病毒的生物合成:包括基因组的复制(genome replication)和基因表达(gene expression)两部分。
DNA病毒的合成按遗传中心法则进行,即“DNA-RNA-protein”,除痘类病毒在胞质内复制以外,DNA病毒都是在细胞核内复制DNA,在胞质内合成蛋白质(+)ssRNA病毒按照“(+)ssRNA→protein”的方式进行合成,(-)ssRNA病毒的合成按照“(-)ssRNA→(+)ssRNA→protein”的方式进行;反转录病毒合成中先以病毒RNA为模板转录出互补DNA链,构成RNA:DNA杂交中间体,由病毒RNA酶H水解去除RNA链,使单链DNA进入细胞核内互补另一条DNA,形成双链DNA并以前病毒的形式整合于宿主细胞DNA中,当病毒复制时前病毒先从细胞DNA上脱离F来,在宿主细胞提供的依赖,DNA的RNA聚合酶作用下转录出病毒RNA,再按RNA病毒的方式进行复制。

病毒的增殖1.同学们大家好,欢迎来到微生物检验技术微课堂,本次课我们学习病毒的增殖。
2.病毒的增殖又称为病毒的复制,是指病毒在宿主细胞中繁殖的过程,由于病毒的结构非常简单,缺乏能够独立代谢的酶系统,所以它只能够借助宿主细胞的代谢系统来进行增殖。
那么病毒的增殖是在病毒的核酸进入宿主细胞后,生物活性才能够启动,病毒以自身的基因为模板,借助宿主的细胞器和酶系统,并由宿主细胞来提供原料、能量等等,然后再按照一定的程序复制出病毒的基因组,同时转录,翻译出相应的病毒蛋白,最终装配释放出子代病毒。
3.我们把这个过程可以人为的分为吸附,穿入、脱壳、生物合成和装配释放五个相互联系的阶段。
我们把这个过程称为复制周期。
4.接下来我们来详细了解病毒增殖的过程,病毒增殖的第一步是对易感细胞的吸附,病毒通过它表面结构当中的吸附蛋白与宿主易感细胞表面的特异性的受体进行结合,这种结合是不可逆的,但有高度的特异性,所以这种病毒和宿主细胞结合的特异性,就决定了病毒宿主的范围和组织的噬性,我们把它称之为病毒组织选择性。
比如说人类免疫缺陷病毒HIV它会通过包膜表面的刺突蛋白gp 120与受体的CD4分子进行一个特异性的结合,因此HIV它只会感染带有CD4分子的T细胞,我们知道CD4分子主要是表达在CD4T淋巴细胞表面,所以HIV它主要攻击的对象就是CD4阳性的T淋巴细胞,这时候病毒就完成了增殖的吸附过程。
5.病毒增殖的第二步就是穿入过程,病毒与细胞表面结合吸附于易感细胞后就开始了穿入过程,穿入的方式随着病毒种类的不同而会不同,一般来说无包膜的病毒通过细胞膜内陷以包饮的方式将衣壳吞入,而有包膜的病毒则通过包膜与宿主细胞膜融合以后再进入到细胞内,当然还有一些病毒可以直接穿透细胞膜而进入宿主细胞内。
6.病毒增值的第三步就是脱壳过程,病毒必须要在穿入细胞以后先脱去蛋白衣壳,再将核酸游离释放出来以后才能够发挥作用,脱壳的过程包括去除包膜、衣壳蛋白和基质蛋白,大多数的病毒在穿入的过程中,一边脱衣壳,一边释放病毒核酸,只有少数的病毒在进入宿主细胞以后再进行脱壳。

)
医学微生物学(Medical Microbiology
病毒的基本性状
Basic Characters of Viruses
补充学习和理解
第二节病毒的增殖
1. 病毒的异常增殖
●顿挫感染或流产感染(abortive infection):病毒进入非容
纳细胞,不能产生子代病毒体,称为顿挫感染。
●缺陷病毒:指病毒基因组不完整或某一基因位点突变,不能
进行正常增殖产生子代病毒体。
当与另外一种病毒共同感染细胞时,后者可提供前者所缺乏的物质而导致前者正常增殖,起这种辅助作用的病毒,称为辅助病毒。
2. 病毒的干扰现象
●定义: 两种病毒感染同一细胞时,可发生一种病毒抑制另一种病毒增殖的现象。
●常发生于:
异种病毒间
同种同型病毒间
缺陷病毒(缺陷干扰颗粒:发挥干扰作用的缺陷病毒)与野生型病毒之间
活病毒间
死病毒与活病毒间
●临床意义:阻止发病、终止感染
●可能机制: 诱导细胞产生干扰素、阻止病毒吸附和穿入、改变宿主细胞代谢。

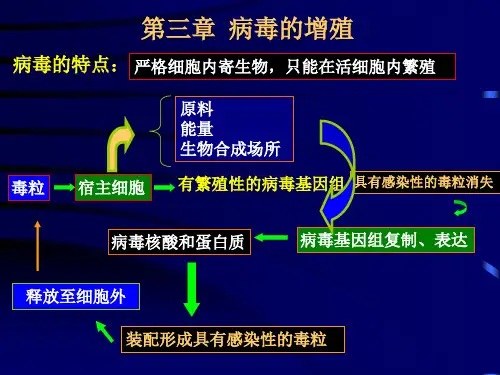
项目三病毒任务三病毒的增殖和培养一、病毒的增殖病毒的增殖是病毒基因组在宿主细胞内复制与表达的结果,它完全不同于其他微生物的繁殖方式,又称为病毒的复制。
病毒由于缺乏完整的酶系统,不能单独进行物质代谢,必须在易感的活细胞中寄生。
由宿主细胞提供病毒合成的原料、能量和场所。
(一)病毒增殖的一般过程病毒粒子进入细胞内增殖发育成熟的全过程,大体上分为吸附、侵入与脱壳、生物合成、装配、释放5个阶段。
不同病毒的增殖过程在细节上有所差异。
噬菌体的增殖方式见图2-8。
1、吸附吸附是指病毒以其表面的特殊结构与宿主细胞的病毒受体发生特异性结合的过程,这是发生感染的第一步。
病毒吸附蛋白(VAP)是病毒表面的结合蛋白,它能特异性识别宿主细胞上的病毒受体并与之结合。
如流感病毒包膜表面的血凝素,T偶数噬菌体的尾丝蛋白。
病毒受体是宿主细胞的表面成分,能够被病毒吸附蛋白特异性识别并与之结合,介导病毒侵入。
如狂犬病毒的受体是细胞表面的乙酰胆碱受体,单纯疱疹病毒的受体是硫酸乙酰肝素。
噬菌体以其尾丝尖端的蛋白质吸附于菌体细胞表面的特异性受体上。
如T3、T4和T7噬菌体吸附的特异性受体是脂多糖;T2和T5噬菌体的受体为脂蛋白;沙门氏菌的X噬菌体吸附在细菌的鞭毛上。
吸附作用受许多内外因素的影响,如细胞代谢抑制剂、酶类、脂溶剂、抗体,以及温度、pH值、离子浓度等。
2、侵入与脱壳侵入是指病毒或其一部分进入宿主细胞的过程。
侵入的方式因病毒或宿主细胞种类的不同而异。
有伸缩尾的T偶数噬菌体吸附于宿主细胞后,尾丝收缩使尾管触及细胞壁,尾管端携带的溶菌酶溶解局部细胞壁的肽聚糖。
接着通过尾鞘收缩将尾管推出并将头部核酸迅速注入到细胞内,其蛋白质衣壳留在菌体外。
动物病毒侵入宿主细胞有3种方式:①膜融合,病毒包膜与宿主细胞膜融合,将病毒的内部组分释放到细胞质中,如流感病毒;②利用细胞的胞吞作用,多数病毒按此方式侵入;③完整病毒穿过细胞膜的移位方式,如腺病毒。
植物病毒的侵入通常是由表面伤口或咬食的昆虫口器感染,并通过胞间连丝、导管和筛管在细胞间乃至整个植株中扩散。
病毒的增殖病毒的增殖一般包括吸附、侵入、生物合成、子代病毒的装配和释放这五个阶段。
但不同种类的病毒,在某一细节上会有所不同。
吸附它是指病毒以其特殊结构与宿主细胞表面的特异性受体发生特异性结合的过程。
如大肠杆菌T系列噬菌体靠尾丝尖端附着在大肠杆菌的细胞壁上(图5-3)。
一些有囊膜的动物病毒则靠刺突吸附在宿主细胞表面的特异性受体上。
侵入它是指病毒或病毒的一部分进入宿主细胞的过程。
不同种类的病毒,侵入方式有所不同。
如T4噬菌体先用溶菌酶在宿主细胞壁上“钻”出一个小孔,然后将核酸注入到细胞内部,蛋白质外壳则留在外面。
多数病毒通过类似胞饮或吞噬的方式,使整个病毒进入细胞内部。
植物病毒往往通过昆虫的口器或从植物体上的伤口进入植物体内。
连同衣壳或囊膜一起进入细胞内部的病毒,还要在水解酶等的作用下,脱去衣壳或囊膜。
生物合成病毒释放出核酸以后,原有的形态消失,称为隐蔽期。
在隐蔽期内,病毒在宿主细胞内活跃地进行生物合成,包括病毒核酸的复制和蛋白质的合成。
由于病毒所含的核酸类型不同,其生物合成的过程也不完全相同。
下面以含DNA的痘病毒为例说明。
痘病毒带有依赖DNA的RNA多聚酶。
当病毒进入隐蔽期后,在自身的RNA多聚酶的催化下,首先合成早期的mRNA,由它翻译成早期的蛋白质。
早期蛋白质主要是病毒复制所需要的酶以及抑制宿主细胞正常代谢的调节蛋白质。
在这些酶的催化下,以亲代DNA为模板,复制出子代病毒的DNA。
在DNA开始转录以后合成的mRNA,称晚期的mRNA,再由晚期的mRNA翻译成晚期的蛋白质。
晚期的蛋白质主要是构成病毒衣壳的结构蛋白质。
装配病毒核酸和蛋白质的生物合成是分别进行的,因而必须将它们装配在一起才能成为成熟的病毒。
结构简单的病毒,其各个组分是自发地装配在一起的。
结构复杂的病毒往往需要在非结构蛋白质的指导下进行装配。
释放无囊膜的病毒靠裂解宿主细胞的方式,一起释放出来。
有囊膜的病毒,以类似出芽的方式,逐个从宿主细胞中释放出来。
第三章病毒的增殖一、细胞——病毒的增殖场所二、病毒的增殖过程三、病毒的不全增殖和缺损病毒四、亚病毒五、病毒和病毒成分的细胞外增殖主要参考文献研究病毒的增殖过程和生物合成,不仅关系到病毒病的防治,而且对于揭示许多生命现象的本质乃至生命的起源等具有重要意义。
因为有关生命本质及其起源的研究,必须从非细胞形态的生命物质开始。
对病毒结构及其生物合成各环节的深入了解,是对病毒性疾病进行化学防治的基础。
切断病毒增殖周期的任何一个环节,均可阻碍病毒增殖而达到防治目的;另外,已发现的一些不见于正常细胞而为病毒增殖所必需的核酸合成酶和其他蛋白质,为病毒病的化学防治提供了可能性。
一、细胞—病毒的增殖场所病毒缺乏自身增殖所需的完整酶系统,增殖时必须依靠宿主细胞合成核酸和蛋白质,甚至直接利用宿主细胞的某些成分,这就决定了病毒在细胞内专性寄生的特性。
活细胞是病毒增殖的唯一场所,也是病毒生物合成所需的能量和材料的主要供应者。
因此,了解动物细胞的超微结构及其功能,特别是其中对病毒增殖具有重要意义的结构,是认识病毒增殖过程和规律的必要前提。
但有关细胞的超微结构及其功能,在细胞生物学书籍中有十分详细的介绍,这里不再赘述。
二、病毒的增殖过程动物病毒的增殖过程大致可以分为:吸附与侵入、脱壳、病毒成分的合成以及装配与释放等4个主要阶段。
1.吸附和侵入病毒吸附分两步进行,即可逆的非特异性吸附和不可逆的特异性吸附。
首先,非特异性吸附即病毒与细胞以静电引力相结合。
这种吸附可发生在细胞表面任何部位且易被冲洗、高浓度盐类和一定的pH环境所破坏,使病毒从吸附物上重新解脱出来。
随后是病毒的特异性吸附,即病毒蛋白(抗受体)与细胞膜上的受体特异性结合。
这种吸附是不可逆的。
细胞受体主要是胞膜上的糖蛋白。
据估计,一个宿主细胞上的特异性受体部位可达104~105个。
这里必须指出,不一定每个细胞表面都有特定病毒的特异受体。
细胞有无特定病毒的受体,直接影响是否对该病毒具有易感性。
病毒如何在宿主体内细胞增殖的?
病毒,是在地球上有别于细胞的另外一种生命形式。
在体积上,病毒比细胞还要小,只有10到100纳米之间。
由于病毒比细胞还要小,这就决定了病毒结构及其简单,其结构主要部分是:蛋白质外壳和遗传物质的核。
而病毒作为生命独特形式,最大特点是不能独立在自然环境生存,只能在宿主活的细胞中以增殖方式生存。
病毒在细胞内的增殖过程
一株病毒在宿主细胞内增殖的周期包括5个过程,分别是:吸附、侵入、复制、成熟和释放。
第一步:吸附-病毒对细胞的感染起始于病毒蛋白外壳同宿主细胞表面特殊受体结合,受体分子是宿主细胞膜或细胞壁的正常成分。
因此,这一特点决定了病毒不是什么细胞都能被感染,而是感染特异的细胞。
第二步:侵入-病毒成功吸附在宿主的表面后,病毒就将核酸注入到宿主的细胞内,开始对宿主遗传信息进行破坏。
第三步:复制-病毒核酸进入细胞后,核酸有两种去向:一种情况是,病毒的遗传物质整合到宿主的基因中;第二种情况病毒DNA或者病毒的RNA利用宿主的酶系进行复制和表达。
这样宿主的原有细胞生物功能就发生了改变,这一步病毒完成对宿主细胞内遗传信息的破坏。
第四步:成熟-病毒在宿主的细胞进行基因表达就可合成病毒装配所需的蛋白质外壳,并将病毒的遗传物质再次包裹起来,形成新的成熟的病毒颗粒。
第五步:释放-病毒在宿主细胞内成熟之后,就可从被感染的细胞中释放出来进入到细胞外,并继续寻找新的细胞,进行上述步骤的再次循环。
在释放过程中,有的病毒将被感染的细胞裂解,有些则是通过分泌的方式进入到细胞外。
闪堕市安歇阳光实验学校病毒的增殖类型及应用价值汝第一高级中学马念胜 471200一、增殖类型病毒体在细胞外是处于静止状态,基本上与无生命的物质相似,当病毒进入活细胞后便发挥其生物活性。
由于病毒缺少完整的酶系统,不具有合成自身成份的原料和能量,也没有核糖体,因此决定了它的专性寄生性,必须侵入易感的宿主细胞,依靠宿主细胞的酶系统、原料和能量复制病毒的核酸,借助宿主细胞的核糖体翻译病毒的蛋白质。
病毒这种增殖的方式叫做“复制”。
病毒复制的过程分为吸附、穿入、脱壳、生物合成及装配释放五个步骤,又称复制周期。
1.DNA复制型在DNA复制型的生物中,生物体的增殖包含3点:DNA的自我复制, DNA →DNA;DNA的转录和翻译,由DNA→RNA→蛋白质;最后合成的DNA和蛋白质组装到一块就形成了新的病毒。
这种类型的生物主要针对地球上绝大多数的动植物和噬菌体病毒等。
2.RNA复制型在RNA复制型的生物中,RNA是遗传信息的携带者,具有自我复制的能力,并同时作为mRNA,指导病毒蛋白质的生物合成。
增殖过程包含2点:RNA的自我复制, RNA→RNA;翻译,由RNA→蛋白质。
这种类型的生物主要针对植物病毒如烟草花叶病毒和动物病毒如脊髓灰质炎病毒等。
也有些病毒的RNA不能直接作为mRNA,指导病毒蛋白质的生物合成,遗传信息的流动只有1种:RNA的自我复制,遗传信息流动方向由RNA→RNA;这种类型的生物主要针对SARS病毒,流感病毒等。
3.RNA逆转录型在RNA逆转录型的生物中,增殖过程包含3点:RNA的逆转录,由RNA→DNA;转录,由DNA→RNA;,翻译,由RNA→蛋白质。
这种类型的生物主要针对致癌病毒和导致艾滋病的人体免疫缺陷病毒(HIV)。
4.蛋白质复制型在蛋白质复制类型的生物中,增殖过程只包含1点:蛋白质的复制,由蛋白质→蛋白质;这种类型的生物目前只发现一种即盛行欧美的疯牛病病毒(朊病毒)。
二、病毒的可利用价值病毒对动物、植物、微生物等的危害是众所周知的,然而病毒也有其利用价值。
简述病毒增殖的五个阶段
病毒是一种个体微小,结构简单,只含一种核酸,必须在活细胞内寄生并以复制方式增殖的非细胞型生物。
病毒增殖过程分为吸附、注入、复制、组装与释放道五个阶段。
病毒增值过程
吸附:病毒的蛋白复质外壳依靠尾部的小勾吸附在细菌等宿主制细胞的表面。
注入:病毒自己的遗传物质DNA或RNA注入到宿主细胞内。
复制:利用宿主细胞的物质和结构,在病毒百遗传物度质的指导下,合成病毒蛋白质,同时病毒的遗传物质进行复制。
组装:病毒复制的遗传物质和蛋白质外壳组装到一起,在宿主知细胞中形成许许多多的子病毒。
释放:宿主细胞的营养物质被子病毒利用,宿主细胞解体,子病毒被释放出来。
病毒增值
病毒必须在活细胞内寄生并以复制方式增殖,病毒进入宿主的活细胞后,借助于宿主细胞为其提供的原料、能量和酶等百必要条件,以自我复制的方式进行增殖,即以病毒基因组核酸为模板,在DNA或RNA多聚酶度及其他必要因素作用下合成子代病毒的核酸和蛋白质,装配成完整的病毒颗粒并释放到细胞外。
病毒增殖过程分为吸附、穿入、脱壳、生物合成、装配与释放道五个阶段,将这五个阶段称为病毒的增殖周期专或复制周期。
研究病毒的增殖过程和生物合成,不仅关系到病毒病的防治,而且涉及生命起源和肿瘤学等重大理论和实践课题。
有关生命本质及其起源的研究,必须从非细胞形态的生命物质开始。
在这方面,病毒是最理想的模型。
目前关于“人工制造生命”的研究,大多就是应用病毒或病毒成分进行的,而且已经取得了很大进展。
例如在有适当的前体和酶的存在条件下,提纯的病毒 RNA和DNA可在体外复制已成为普通的常识。
同样,病毒RNA可在体外于细菌核糖体上译制病毒蛋白;病毒核酸和病毒蛋白也可在体外装配成为完整的病毒粒子等等。
所有这些成就,均为生命本质的探索提供了途径和证据。
甚至有人认为,病毒可能以“附加基因”的方式,结合入细胞基因组内,成为生物进化的原因。
肿瘤,就其本质来讲,是细胞基因突变或某些基因异常表达的结果。
病毒至少是肿瘤病因中的一个重要因素。
目前发现的脊椎动物肿瘤病毒已经超过30种,而有致瘤特性的病毒约有150多种。
许多DNA病毒能在一定条件下引起动物肿瘤,RNA病毒中则只有反转录病毒具有致瘤作用。
这种RNA致瘤病毒可借反转录酶的作用(将在下述),在细胞内复制出含有病毒信息的DNA,也就是前病毒DNA中间体,整合入细胞DNA,改变细胞的遗传性,干扰细胞的正常生命活动而导致细胞恶性变。
病毒性疾病的化学预防和化学治疗,已被证明是可能的,实践中也已取得初步成果。
目前发现的一些不见于正常细胞而为病毒增殖所必需的核酸合成酶和其他蛋白质,为病毒病的化学防治提供了进一步的可能性。
而对病毒结构及其生物合成各环节的深入了解,则为选择适当药物,切断病毒增殖周期,阻碍病毒增殖而达到防治目的,建立现实的基础。
物病毒的增殖过程大致可以分为:吸附与侵入、脱壳、病毒成分的合成以及装配与释放等4个主要阶段。
1.吸附和侵入病毒吸附分两步进行。
首先,病毒与细胞以静电引力相结合。
这种吸附是非特异性的。
病毒可在细胞表面任何部位吸附,不具有任何选择性。
非细胞颗粒物质,甚至玻璃或金属器皿表面也都可吸附病毒。
这种吸附是可逆的,单纯的稀释或冲洗以及应用抗病毒血清或高浓度盐类和一定的pH环境,都可使病毒从吸附物上重新解脱出来。
病毒吸附的第二阶段,呈不可逆性结合。
此时,病毒蛋白(抗受体)与细胞膜表面特定蛋白(受体)特异性结合。
病毒粒子上与细胞受体结合的蛋白质,一般都是病毒表面蛋白,如流感病毒的血凝素。
不过,抗受体虽在病毒表面,但不一定参与病毒的高度抗原区,如脊髓灰质炎病毒的病毒蛋白1(VP1),其抗受体区域与高度变异的中和抗原区并不一致。
某些结构复杂的病毒,如痘病毒和疱疹病毒,具有多个抗受体蛋白分子,而每个抗受体蛋白分子又可有几个不同的区域,每个区域可与细胞表面不同的受体结合。
据估计,一个宿主细胞上的特异性受体部位可达10 4~105个。
这里必须指出,不一定每个细胞表面都有特定病毒的特异受体。
细胞有无特定病毒的受体,直接影响是否对该病毒具有易感性。
受体与抗受体的结合,需要具备一定的离子浓度,以减少静电干扰。
不过,这种特异性结合与温度及能量的关系不大。
必须指出,可逆与不可逆的两阶段吸附过程,可能并非所有病毒的共同规律,某些病毒一经吸附于敏感细胞,就再不能解脱,似乎没有可逆吸附阶段的存在。
而另一些病毒,例如正粘病毒及副粘病毒,即使进入了不可逆的结合阶段,病毒粒子仍可由细胞分离,并吸附另一细胞。
这是由于这些病毒具有神经胺酸酶,该酶可切断细胞受体多糖链上的神经胺酸。
应用抗细胞血清处理细胞,常可阻止细胞发生病毒感染,可能是这种抗体封阻了细胞表面的结合部位而使病毒不能吸附的缘故。
Much等(1973)应用抗HeLa细胞血清处理 HeLa细胞,得以阻止脊髓灰质炎病毒的吸附。
就某些病毒来说,病毒感染范围似乎决定于细胞表面有无相应的病毒受体。
抗病毒抗体也可阻抑病毒对细胞的特异性吸附。
脊髓灰质炎病毒能够在灵长类的肾培养细胞中增殖,但不能在啮齿类的肾培养细胞中增殖,就是因为前者具有而后者缺乏对脊髓灰质炎病毒的特异脂蛋白受体。
流感病毒的吸附,取决于敏感细胞表面特异糖蛋白受体的存在。
破坏这些受体,例如应用由霍乱弧菌抽提出来的神经胺酸酶处理细胞,即可使其不再吸附流感病毒,因而不发生感染。
为什么脊髓灰质炎病毒能在体外培养的猴肾细胞中增殖,但却不在活猴体内的肾细胞中增殖?相反,考克赛基病毒能够感染幼龄小鼠,但却不易在小鼠的各种组织培养细胞中增殖?有人认为这也是因为这些细胞在培养过程中获得或丧失了相应受体的缘故。
这种解释看来颇为牵强。
因为病毒的特异性吸附只是其在细胞中增殖的重要的第一步,而决不是其全部。
影响病毒增殖的因素很多,而病毒增殖本身又是一个极为复杂的过程。
应用一定的方法人为地将病毒或病毒核酸引入非敏感细胞内,也常不能引起病毒感染。
由于细胞膜制剂也能结合病毒,并有抑制其吸附于细胞表面的作用,说明细胞膜上确有病毒受体存在。
某些病毒对细胞上的特殊结构,例如微绒毛和致密网状结构具有亲和性,似乎病毒受体就存在于这些特殊结构上。
某些病毒似乎对淋巴细胞具有亲和性,例如麻疹病毒选择性地结合T淋巴细胞,而EB病毒(一种疱疹病毒)则结合于B淋巴细胞,不仅使其转化为淋巴母细胞,而且还是引起B淋巴细胞肿瘤(Burkitt淋巴瘤)的原因。
最近发现,对脊髓灰质炎病毒的人敏感株细胞和抵抗株细胞之间的一种恒定的特征是后者丧失了19号染色体。
因此有人推断19号染色体含有对于脊髓灰质炎病毒敏感性起决定性作用的基因,而这些基因可能就是细胞表面病毒受体的结构基因。
动物细胞上某些特异的病毒受体的存在,已被许多实验所反复证明。
但是这些受体是怎样形成的呢?从进化论的观点来看,我们应当看作是病毒长期适应于细胞内寄生的结果。
换句话说,“受体”原来是细胞的固有成分,是病毒在适应细胞内寄生时逐渐具备了对细胞膜上某些成分的相应结合机构。
这样,细胞的这些成分就成为了病毒吸附的对象——受体。
现已证明,乳酸脱氢酶病毒的受体是小鼠Ia抗原,狂犬病病毒可利用乙酰胆碱受体而进入细胞,痘苗病毒也能通过表皮生长因子受体侵入宿主细胞。
细胞的病毒受体可能还有促进病毒感染的其它作用,例如由猴肾细胞上将携带着脊髓灰质炎病毒受体的细胞膜部分分离出来,使其与脊髓灰质炎病毒在试管内于37℃感作,病毒即将发生不可逆性改变。
虽然在电子显微镜下并不能见到形态学变化,但由细胞膜上洗脱下来的这些病毒,却不再能吸附其他敏感细胞。
脊髓灰质炎病毒一般对胰酶有抵抗力,但是洗脱下来的这些病毒却可被胰酶消化而释出病毒核酸。
洗脱下来的病毒还丧失了其对特异性抗体的结合能力。
看来,病毒与细胞膜上的受体结合之后,病毒核衣壳的结构单位发生改变。
由于易受细胞蛋白酶的作用而可能有利于病毒的脱壳。
病毒吸附细胞的过程,可在几分钟到几十分钟的时间内完成。
西方型马脑炎病毒在鸡胚成纤维细胞上,30分钟内的吸附率达85%。
狂犬病病毒在BHK-21细胞上的吸附,也可在30分钟内完成。
病毒学实践中以病毒感染细胞时,通常亦只感作30~60分钟,即可达到感染目的。
但对某些病毒来说,似乎需要更长一些时间才能获得最大量的病毒吸附,例如口蹄疫病毒对悬浮培养的牛舌上皮的吸附需要15~30分钟,但其对牛肾或猪肾单层细胞的吸附,却需80~90分钟才能完成。
侵入与吸附是一个连续过程。
不过,侵入是一个依靠能量的过程。
目前发现病毒侵入细胞有3种方式:①病毒直接转入胞浆;②细胞吞饮病毒;③病毒囊膜同细胞膜融合。
无囊膜病毒以前二种方式侵入,囊膜病毒常以第三种方式进入。
小RNA病毒是以第一种方式侵入细胞的典型。
小RNA病毒以抗受体VP1同细胞受体吸附。
由于结合力的影响,病毒衣壳发生微细空间变化,失去VP4,形成“A”粒子。
肠道病毒及鼻病毒由于衣壳较致密,“A”粒子在进一步穿过胞膜时,失去VP2,形成“B” 粒子,并进入胞浆。
而心病毒和口蹄疫病毒由于衣壳相对疏松,“A”粒子在穿过胞膜时,被彻底裂解,结果以RNA及12~14S蛋白亚单位形式释入胞浆。
多瘤病毒进入胞浆是第二种侵入方式的例子。
电镜下可以见到胞浆中吞噬小泡内的病毒粒子。
这是细胞吞饮异物的方式。
囊膜病毒以第三种方式侵入细胞。
以流感病毒为例,病毒囊膜上血凝素(HA)蛋白在靠近胞膜受体时,HA 分子开始折叠,并同邻近2个HA分子共同形成三合体(trimer)。
三合体的HA分子在自然感染情况下(呼吸道或鸡胚),受宿主蛋白酶水解,成为HA1和HA2。
HA1具有抗受体的部位,可同细胞受体结合。
此时,HA2的氨基末端也向结合部位靠近, HA2氨基末端20个氨基酸呈疏水性,这个片段可进入胞膜磷脂层疏水区。
这种插入迅速导致囊膜与胞膜的融合,使核衣壳进入胞浆。
〖BT4〗2.脱壳病毒脱壳,包括脱囊膜和脱衣壳两个过程。
在囊膜病毒(除痘病毒外),脱囊膜的过程就是上述侵入的过程。
在没有囊膜的病毒,则只有脱衣壳的过程。
病毒核衣壳的进一步裂解,也就是衣壳的脱落和核酸的逸出,主要发生在细胞浆内。
吞饮泡和溶酶体可能起着将完整核衣壳送入这些部位的作用。
电子显微镜观察吞饮泡中的流感病毒,常可见其继续保持完整的核衣壳结构。
有人认为,核衣壳的裂解也就发生在吞饮泡中。
这种说法尚待进一步证实。
因在吞饮泡内存在着溶酶体分泌的高浓度的水解酶,包括核酸酶,病毒核酸在此种环境下可能迅速灭活。
某些病毒,例如呼肠孤病毒,并不发生完全的脱壳。
因在感染细胞的胞浆中从未发现过呼肠孤病毒的游离双链RNA。
呼肠孤病毒在脱掉外层衣壳以后,以整个核心进行核酸转录和复制过程。
某些在细胞核内增殖的DNA病毒,例如乳多空病毒、腺病毒和疱疹病毒,其核衣壳可能在未被完全脱壳的情况下就进入细胞核内。
口蹄疫病毒则可能就在细胞膜上脱掉衣壳,病毒核酸直接进入细胞内。
痘病毒的外层囊膜在胞膜或吞饮泡膜上被融合。
病毒核心被释入胞浆内。
核心借助自身衣壳上的依赖DNA的RNA聚合酶合成mRNA。
进一步译制出一些早期蛋白。
这些蛋白质中有脱壳酶,该酶反过来帮助病毒核心进一步脱壳。
〖BT4〗3.病毒成分的合成实验观察证明,吸附于细胞上的病毒通常迅速消失。
此时即使应用冻融或超声波裂解等方法,也不能或极少能够发现细胞内(上)的病毒粒子。
这一事实说明,吸附病毒很快侵入细胞,并且迅速裂解。
从种入的病毒粒子消失开始,到新的子代病毒粒子出现为止,这一段时间称为“隐蔽期”(晦暗期)。
隐蔽期的长短随病毒种类而不同。
痘苗病毒为 10小时,脊髓灰质炎病毒为2~4小时。
“隐蔽期”实际上是病毒增殖过程中最主要的阶段。
此时,病毒的遗传信息向细胞传达,细胞在病毒遗传信息的控制下合成病毒的各种组成成份及其所需的酶类,包括病毒核酸转录或复制时所需的聚合酶。
最后是由新合成的病毒成分装配成完整的病毒粒子。
关于病毒核酸自衣壳内脱出之后的直接命运,尚未彻底阐明。
已有证据,RNA病毒的RNA分子在由病毒粒子或核衣壳内释出后,迅速与细胞蛋白质结合而形成所谓的信息体(informosome),病毒RNA从而可以直接利用细胞器,并避免细胞内核酸酶的分解作用。