高三无机推断
- 格式:doc
- 大小:41.00 KB
- 文档页数:3

高三化学无机推断题知识点一、化学无机推断的概念和目的化学无机推断是指通过实验方法,根据各种反应现象和特征性质来确定未知物质的性质和组成。
它在化学分析中起着重要的作用,能够帮助我们准确地确认化合物的成份、结构和性质。
化学无机推断的目的主要有两个方面:一是通过实验结果推断出未知物质的性质,例如判断其是否为盐酸、硫酸等酸性物质;二是通过实验结果推断出未知物质的组成和结构,例如判断其是否为氯化钠、硫酸铜等化合物。
二、无机盐的推断方法1. 阳离子的推断方法(1)利用化学特性:根据阳离子的特性,如化学反应、颜色、气味等,来推断出未知物质中所含的阳离子。
例如,铁离子在NaOH溶液中生成红棕色沉淀,可以推断出未知物质中可能含有Fe3+离子。
(2)利用气体的生成:一些阳离子在特定条件下能够生成气体,通过气体的产生来判断阳离子的存在。
例如,硫酸钾溶液中存在铜离子时,加入氨水会产生蓝色沉淀,同时释放出氨气,可以推断出未知物质中可能含有铜离子。
2. 阴离子的推断方法(1)利用溶液的凝固特性:一些阴离子在特定条件下能够凝固成为固体沉淀,通过凝固的出现来判断阴离子的存在。
例如,硝酸银溶液中存在氯离子时,会产生白色沉淀,可以推断出未知物质中可能含有氯离子。
(2)利用特殊的化学反应:一些阴离子在特定条件下会发生特殊的化学反应,通过反应的出现来判断阴离子的存在。
例如,加入Barfoed试液后,出现红色沉淀,可以推断出未知物质中可能含有还原糖。
三、常见无机化合物的推断1. 硝酸盐的推断(1)加热产生棕色气体:利用加热产生棕色气体的特点,可以推断出未知物质中可能含有硝酸盐。
(2)与亚硝酸银反应:亚硝酸银溶液可以与硝酸盐反应生成红褐色沉淀,从而推断出未知物质中可能含有硝酸盐。
2. 硫酸盐的推断(1)与氯化钡反应:氯化钡溶液可以与硫酸盐反应生成白色沉淀,通过判断是否有白色沉淀的生成来推断出未知物质中可能含有硫酸盐。
(2)加入氯化钠酸化亚硫酸:硫酸盐加入氯化钠酸化亚硫酸后产生气体的反应,可以推断出未知物质中可能存在硫酸盐。

颜色现象篇:1.焰色反应:Na 、K2. FeS(黑色,s)↑Fe 3O 4(黑色,s)←Fe →Fe 2+(浅绿色)→Fe (OH )2(白色↓)→Fe (OH )3(红褐色↓)→Fe 2O 3(红棕色)↓Fe 3+(棕黄色)→Fe (SCN )3(血红色,aq )3.Cu (红色s )→Cu 2+(蓝色)→Cu (OH )2(蓝色↓)→Cu 2O(砖红色↓) ↓CuO(黑色,s)←Cu 2(OH)2CO 3(铜绿,s)CuSO 4(白色,s)→CuSO 4.5H 2O(蓝色晶体) 4.黄色:AgBr 、AgI 、Ag 3PO 4、S 、Na 2O 2、 白色:AgCl 、BaSO 4、CaCO 3、Fe (OH )2黑色:Ag 2O 、MnO 2、CuO 、C 、Ag 2S (其他硫化物)5.KMnO 4(紫黑色,s)、MnO 4—(紫红色)、Br 2、NO 2(红棕色↑)、Cl 2(黄绿色↑) 置换篇① 2F 2 + 2H 2O == 4HF + O 2 ②2H 2S + O 2(不足) 2S + 2H 2O③ SiO 2+ 2C Si + 2CO ↑④C + H 2O CO + H 2⑤SiCl 4 + 2H 2Si + 4HCl ⑥8Al + 3Fe 3O 44Al 2O 3 + 9Fe⑦2Al + 2NaOH + 2H 2O == 2NaAlO 2 + 3H 2↑ ⑧2Mg + CO 22MgO + C⑨2Na + 2H 2O == 2Na OH + H 2↑⑩3Fe + 4H 2OFe 3O 4 + 4H 2↑联想篇1. 2Na + 2H 2O == 2Na OH + H 2↑联想:?+ H 2O=?+↑例如:K 、F 2、、C 、Fe 、Na 2O 2、Mg 3N 2 、Al 2S 3、CaC 22. NaOH O Na O Na Na OH O O −−→−−→−−→−222222(固体) 联想:)(222酸或碱D C B A OH O O −−→−−→−−→−323222HNO NO NO NH O H O O −−→−−→−−→−(气体) 42322222SO H SO SO S S H OH O O −−→−−→−→−→−(气体) 322222CO H CO CO C O H O O −−→−−→−−→−(固体)3.联想:A 为弱酸的铵盐:(NH 4)2CO 3或NH 4HCO 3;(NH 4)2S 或NH 4HS ;(NH 4)2SO 3或NH 4HSO 3⎪⎩⎪⎨⎧−−→−−−→−偏铝盐铝盐NaOHHClAl 、Al 2O 3、Al(OH)3→ ⎪⎩⎪⎨⎧−−→−−−→−C B NaOH HClA →4.联想:A+B=↓+↑例如Fe 3+与HCO 3-或CO 32-、Ba(OH)2与(NH 4)2SO 4或(NH 4)2CO 3或(NH 4)2SO 3、Na 2S 2O 3与强酸5.Al 3+→Al(OH)3白色沉淀→NaAlO 2沉淀溶解 联想:A →↓→沉淀溶解例如CO 2与Ca(OH)2、氨水与AgNO 3、强酸与偏铝酸盐 6. Cl 2 + 2OH —== Cl O —+ Cl —+ H 2O 联想:单质+强碱:S 、Al 、Si 、F 27.品红联想:使品红褪色有:Cl 2、次氯酸盐、过氧化钠、过氧化氢、活性炭等工业生产篇1. 煅烧石灰石:CaCO 3CaO+CO 22. 硫酸工业:4FeS 2+11O 2 8SO 2+2 Fe 2O 3.2SO 2 + O 2 2SO 3 SO 3+H 2O H 2SO 43. 合成氨:3H 2 + N 2 2NH 34. 氨的催化氧化:4NH 3+5O 24NO+6H 2O5. 工业制盐酸:H 2 + Cl 2 == 2HCl (点燃燃烧)6. 高炉炼铁:Fe 2O 3+3CO 3CO 2+2Fe7. 工业制水煤气:C + H 2O CO + H28.硅的冶炼与提纯:SiO 2+ 2CSi + 2CO ↑ Si + 2Cl 2SiCl 4SiCl 4 + 2H 2Si + 4HCl9侯氏制碱:(1)NH 3+H 2O+CO 2=NH 4HCO 3(2)NH 4HCO 3+NaCl=NH 4Cl+NaHCO 3↓()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H OH O H 与加热SO2褪色复原 燃烧10.电解饱和食盐水:2NaCl + 2HO 2NaOH + Cl2↑+ H2↑反应条件篇1.催化剂、加热条件下的反应2.高温条件下的反应3.通电(电解)条件下的反应。

高考化学无机推断题解题技巧随着高考的临近,同学们也开始重视化学无机推断题这部分题型的复习。
化学无机推断题是高考化学中重要的知识点之一,同时也是难题之一。
本文将介绍化学无机推断题解题技巧,希望对同学们有所帮助。
一、常见的无机离子及其特性在进行化学无机推断题时,需要了解常见的无机离子以及它们的特性。
常见的无机离子包括阳离子和阴离子,分别是:阳离子:NH4+、K+、Na+、Ca2+、Mg2+、Cu2+、Fe2+、Fe3+、Pb2+、Zn2+等。
阴离子:OH-、CO32-、SO42-、NO3-、NO2-、Cl-、Br-、I-、S2-、PO43-等。
在化学无机推断题的解题过程中,还需掌握无机离子的特性,例如:1. NH4+:加入NaOH溶液(或Na2CO3溶液),产生氨气和蒸气,同时出现熏黑的滤纸。
2. CO32-:加入酸,产生气泡,pH值下降。
3. SO42-:与Ba2+作用,生成白色沉淀BaSO4。
4. NO3-、NO2-:加入FeSO4溶液,再滴加硫酸,出现红棕色环。
5. Cl-:与Ag+作用,生成白色沉淀AgCl。
6. Br-:与Ag+作用,生成淡黄色沉淀AgBr。
7. I-:与Ag+作用,生成黄色沉淀AgI。
8. S2-:加入酸,产生硫磺气味(SO2)。
9. PO43-:加入NH4MgPO4溶液,生成白色沉淀(NH4)2MgPO4。
掌握这些特性,可以在解题时根据实验现象推断出无机离子的种类。
二、化学无机推断题解题的思路在解题时,需要根据实验现象对新物质进行分类,分析各实验结果,再运用化学反应知识进行推断。
化学无机推断题解题的思路可以概括为以下步骤:1. 根据实验现象分类:将新物质按照实验结果进行分类归纳。
2. 分析实验结果:对各分类中的物质进行分析,得到它们的性质和可能的成分。
3. 确定可能的离子:根据物质性质,确定可能的阴、阳离子组合。
4. 运用化学反应知识进行推断:根据可能的离子组合,运用化学反应知识,除去不符合条件的离子,最终得到待测物的成分。

高三化学二轮专题复习——无机推断知识总结无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理f得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找岀有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的拿称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、Cl=、03苴他有色单质:Br:(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、 Cu (紫红色固体)、P(白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:%、0:、比有色气体化合物:N0:(红棕色)黄色固体:S、Na©、AgBr (浅黄)、Agl、AgaPOj (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、FeO (红棕色)、CucO (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜(胆矶或蓝矶)CuSO. ・5H:0、Cu(OH)s;绿色固体:七水合硫酸亚铁(绿矶〕FeSO.・7比0:紫黑色固体:KMnOi、碘单质。
有色离子(溶液):Cf (蓝色或绿色)、F』(浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SCN)54(血红色〕、(淀粉遇碘单质(IJ水溶液呈蓝色、 Fe"与苯酚呈紫色)不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag:SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:比、Cl=、0=氢化物:讯、H$、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、沁 C-Hi. HCHO如能使品红溶液褪色加热又复原红色的气体是S0=; CL能使品红溶液褪色加热不能复原红色:滴有石裁试液的C0:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的C0=(或SOJ溶液加热后红色变橙色或黄色等。
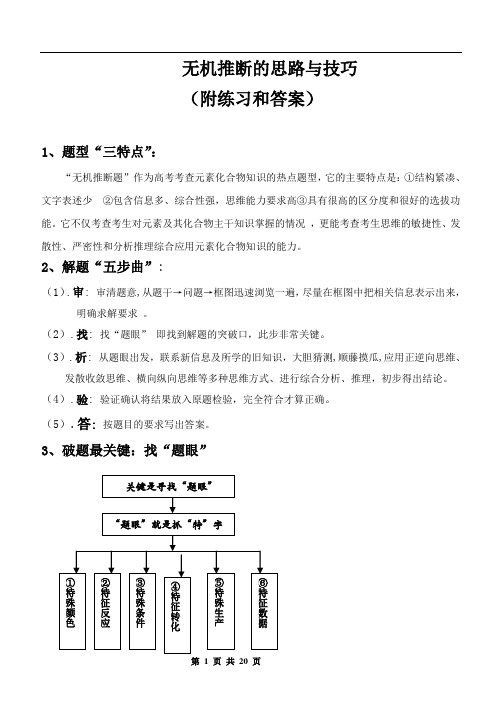
无机推断的思路与技巧(附练习和答案)1、题型“三特点”:“无机推断题”作为高考考查元素化合物知识的热点题型,它的主要特点是:①结构紧凑、文字表述少②包含信息多、综合性强,思维能力要求高③具有很高的区分度和很好的选拔功能。
它不仅考查考生对元素及其化合物主干知识掌握的情况,更能考查考生思维的敏捷性、发散性、严密性和分析推理综合应用元素化合物知识的能力。
2、解题“五步曲”:(1).审: 审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
(2).找: 找“题眼”即找到解题的突破口,此步非常关键。
(3).析: 从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论。
(4).验: 验证确认将结果放入原题检验,完全符合才算正确。
(5).答:按题目的要求写出答案。
3、破题最关键:找“题眼”4.常见“题眼”归类解析方法一:根据物质的特殊颜色推断知识准备:物质颜色(1)有色固体:红色:Cu 、Cu 2O 、Fe 2O 3; 褐色:Fe(OH)3; 黄色:AgI 、Ag 3PO 4;浅黄色:S 或Na 2O 2或AgBr ; 蓝色:Cu(OH)2; 紫黑色:KMnO 4 I 2 黑色:炭粉、CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS ; 白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3;(2) 有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO 4-(紫红色)、[]±y x SCN Fe )((x=1~6)(红色)(3).有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2、(红棕色)、I 2(紫色)O 3(淡蓝色)例1、下图表示各物质之间的转化关系。
已知:A 、D 、F 、H 均为单质,X 常温下为无色液体,B 为淡黄色固体,J 溶于酸得到黄色溶液。

高考化学无机推断知识点高考化学无机推断是高考化学考试中的一个重要内容,也是考生需要重点关注和掌握的知识点之一。
本文将通过介绍无机推断的基本概念、常见方法、应用和注意事项,来帮助考生全面了解并有效备考化学无机推断。
一、基本概念无机推断是通过一系列实验方法和化学反应,根据物质在反应过程中的特点,推断出物质的组成成分、性质或结构的一种方法。
它是根据指定化合物在特定条件下的物理和化学性质,通过与未知物质的反应,确定未知物质的成分和性质,从而推断出未知物质的特征。
二、常见方法1. 滴定法:滴定法是通过反应物容量的测定来推断未知物质的化学组成。
常见的滴定法包括酸碱滴定法、氧化还原滴定法和络合滴定法等。
2. 沉淀法:沉淀法是通过沉淀形成与溶液中某些离子形成不溶性沉淀物,来推断未知物质中的离子组成。
常见的沉淀法包括硫化沉淀法、氯化沉淀法和碳酸盐沉淀法等。
3. 反应法:反应法是通过观察未知物质与其他物质发生反应的结果,来推断出未知物质的性质和成分。
常见的反应法包括酸碱中和反应、氧化还原反应和络合反应等。
三、应用无机推断在实际应用中具有广泛的用途,主要体现在以下几个方面:1. 化学分析:无机推断可以应用于分析化学领域,通过对样品中各种离子的推断,来判断样品的组成和性质。
这对于环境监测、食品检测和医药分析等具有重要意义。
2. 金属材料检验:无机推断可以帮助检验人员快速准确地判断金属材料的成分和品质。
例如,通过检测金属材料中的杂质元素,可以评估其纯度和可用性。
3. 矿物鉴定:无机推断在地质学和矿物学中有着重要的应用,可以帮助研究人员确定矿物样品的成分和结构,从而进一步探索矿产资源和地质活动。
四、注意事项在进行无机推断的过程中,考生应注意以下几点:1. 实验操作的准确性:化学实验操作的准确性对于推断结果的准确性至关重要,因此考生需要熟练掌握实验操作技巧,并注意实验条件和反应时间等关键因素。
2. 化学反应的基本原理:在进行无机推断时,考生需要了解化学反应的基本原理,掌握不同反应类型的特点和规律,从而能够准确判断未知物质的性质和成分。
高三化学二轮复习之无机推断无机物推断是在化学学科的历次高考改革中始终保留的一种基本题型,因为它以无机物的结构、性质和转化为载体,能够突出考查学生的推理能力和分析综合能力,也能很好地与化学实验、计算、基本化学用语、化学基础理论进行学科内综合考查,对考生有很好的区分度,预计在今年中,它将依然是化学学科的一种重要题型。
无机物推断一般以II卷的综合题为主。
要很好地解答无机物推断题通常应注意以下几个方面:解题“五步曲”⑴审:审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求⑵找:找“题眼”即找到解题的突破口,此步非常关键⑶析:从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论⑷验:验证确认将结果放入原题检验,完全符合才算正确⑸答:按题目的要求写出答案常见“题眼”归类解析1.根据物质的特殊颜色推断物质颜色⑴有色固体:红色:Cu、Cu2O、Fe2O3红褐色:F e(O H)3黄色:AgI、Ag3PO4浅黄色:S或Na2O2或AgBr 蓝色:C u(O H)2紫黑色:KMnO4、I2黑色:炭粉、CuO、FeO、FeS、CuS、Ag2S、PbS;白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3;⑵有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4(紫红色)、Fe(SCN)3(血红色)关键是寻找“题眼”①特殊颜色②特征反应③特殊条件④特征转化⑤特殊生产“题眼”就是抓“特”字⑥特征数据水(溶剂) 苯(溶剂) CCl 4(溶剂) Br 2 黄→橙 黄→橙红 I 2深黄→褐淡紫→紫红紫→深紫说明:表格中的溶液基本随着溶液浓度的升高而接近单质本身的颜色 ⑶有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2(红棕色)、I 2蒸气(紫色)、O 3(淡蓝色) 2.根据特征反应现象推断 特征反应现象:⑴焰色反应:Na +(黄色)、K +(紫色)⑵使品红溶液褪色的气体:SO 2 (加热后又恢复红色)、Cl 2(加热后不恢复红色)⑶白色沉淀F e (O H )2置于空气中最终转变为红褐色[F e (O H )3](由白色→灰绿→红褐色) ⑷在空气中变为红棕色:NO⑸气体燃烧呈苍白色:H 2在Cl 2中燃烧;在空气中点燃呈蓝色:CO 、H 2、CH 4 ⑹使湿润的红色石蕊试纸变蓝:NH 3⑺使湿润的淀粉碘化钾试纸变蓝:Cl 2、Br 2、FeCl 3、碘水等(即只要有能力将I -氧化为I 2分子,不一定是碘分子) 3.根据特征转化关系推断⑴掌握一些特别的连续变化关系)(D C B A O H O O 222酸或碱−−→−−→−−→−①3OH 2OO 3HNO NO NO )(NH 222−−→−−→−−→−气体②42OH 3O 2O 2SO H SO SO )(S H 222−−→−−→−−→−气体 ③32OH 2O O CO H CO CO )(C 222−−→−−→−−→−固体④NaOH O Na O Na )(Na OH 22O2O222−−→−−→−−→−固体⑵注意几个典型转化关系三角转化:⑶与碱反应产生气体①⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-23222222OH H 2SiO Na O H NaOH 2Si H 3NaAlO 2O H 2NaOH 2Al 2H Si Al 、单质 ②铵盐:O H NH NH 234+↑−→−+碱③既能与酸反应又能与碱反应 单质:Al化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸 A — ⎪⎩⎪⎨⎧−−→−−−→−CB 气体强碱气体强酸A 为弱酸的铵盐如(NH 4)2CO 3或NH 4HCO 3;(NH 4)2S 或NH 4HS ;(NH 4)2SO 3、NH 4HSO 3④与酸反应产生气体⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−→−22HNO 2SO H 22HNO 22SO H 2HNO 2SO H 2HCl NO SO SO S CO NO CO SO C NO NO SO H 342342342、、、非金属、金属单质浓浓浓浓浓 ()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2H 3232H 22H 323SO HSO SO S H HS S CO HCO CO 化合物 ⑤Na 2S 2O 3与酸反应既产生沉淀又产生气体:S 2O -23+2H +=S↓+SO 2↑+H 2O⑥与水反应产生气体单质⎪⎩⎪⎨⎧↑+=+↑+=+22222O HF 4O H 2F 2H NaOH 2O H 2Na 2化合物()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+2222223232322232222H C OH Ca O H 2CaC S H 3OH Al 2O H 6S Al NH 2OH Mg 3O H 3N Mg O NaOH 4O H 2O Na 2⑦强烈双水解()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+3O H 232O H 232O H 3233OH Al AlO OH Al S H HS S OH Al CO HCO CO Al 222与⑧与Na 2O 2反应⎪⎩⎪⎨⎧+↑−−→−+↑−−→−NaOH O CO Na O 2O H 322CO 22⑨电解()⎪⎩⎪⎨⎧↑+↑+−−→−↑+−−→−↑+↑−−→−22232222H Cl NaOH NaCl O Al O Al O H O H 电解电解电解溶液熔融 其他反应铝热反应:Al+金属氧化物−−→−高温金属+Al 2O 3归中反应:2H 2S+SO 2=3S+2H 2O 4NH 3+6NO−−→−催化剂4N 2+6H 2O ClO -和ClO -3和Cl -在酸性条件下的归中反应置换反应: 金属→金属⎩⎨⎧+→+铝热反应盐金属盐金属.2.1金属→非金属⎪⎩⎪⎨⎧+−−→−+↑−−−→−+C MgO 2CO Mg 2H Fe Mg Na 22O H H 2点燃或)、、活泼金属(非金属→非金属⎪⎪⎩⎪⎪⎨⎧+=++−−→−++−−→−+↑+=+)、(、高温高温HI HBr HCl 2S S H )I Br (Cl H CO O H C CO 2Si SiO C 2O HF 4O H 2F 22222222222非金属→金属⎪⎩⎪⎨⎧+−−→−++−−→−+222CO C O H H 金属金属氧化物金属金属氧化物高温高温受热分解产生2种或3种气体的反应:铵盐⎪⎩⎪⎨⎧↑+↑−→−+↑+↑−→−+↑+↑−→−∆∆∆S H NH ]S )NH [(HS NH O H SO NH ]SO )NH [(HSO NH O H CO NH ]CO )NH [(HCO NH 232442233243422332434硝酸盐⎪⎩⎪⎨⎧↑+↑+−→−↑+↑+−→−∆∆2232223O NO 2Ag 2AgNO 2O NO 4CuO 2)NO (Cu 2 无机框图中常用到催化剂的反应:OH 6NO 4O 5NH 4SO 2O SO 2O O H 2O H 2O 3KCl 2KClO 222332222MnO 222MnO 322+−−−→−+−−−→−+↑+−−→−↑+−−−→−∆∆∆催化剂,催化剂,, N 2+3H 22NH 34.根据特殊工业生产推断重要工业生产反应(回忆重要的工业过程)⑴煅烧石灰石(工业上制取生石灰,副产物为CO 2) ⑵煅烧黄铁矿⑶二氧化硫的催化氧化(工业上制硫酸,请关注反应的热效应、反应设备、厂址的选择、三废的利用等问题、反应条件的选择) ⑷合成氨⑸氨的催化氧化(用于硝酸工业,知识个极为典型的连续反应工程应特别予以关注)⑹电解饱和食盐水⑺工业制盐酸⑻工业制取漂粉精⑼工业制水煤气⑽硅酸盐工业5.根据特征数据推断近两年计算型推断题成为高考热点之一①解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO 2,NO → NO 2,SO 2→SO 3转化时分子中都增加1个氧原子,相对分子质量变化均为16); ②放出气体的体积或生成沉淀的量; ③化合物中各元素的含量;④气体的相对密度、相对分子质量; ⑤离子化合物中离子个数比; ⑥反应物之间的物质的量比;⑦电子总数、质子总数等重要数据。
高三化学二轮专题复习——无机推断知识总结doc高中化学无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理一得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找出有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的名称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、C1:、03苴他有色单质:B“(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、Cu (紫红色固体)、P (白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:N:、0=、比有色气体化合物:NO:(红棕色)黄色固体:S^ Na:0:% AgBr (浅黄)、Agl、AgjPOi (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、Fe20,(红棕色)、Cu=0 (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜〔胆矶或蓝矶)CuSO, ・5H:0、C U(OH)3;绿色固体:七水合硫酸亚铁(绿矶〕FeSO. - 7H:0:紫黑色固体:KMnO。
、碘单质。
有色离子(溶液1 :Cf (蓝色或绿色)、Ff (浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SC『(血红色〕、〔淀粉遇碘单质(IJ水溶液呈蓝色、Fe”与苯酚呈紫色〕不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag=SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:H:、CL、0=氢化物:NH»、H:S、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、GHs、CH、HCHO如能使品红溶液褪色加热又复原红色的气体是so:; Cl:能使品红溶液褪色加热不能复原红色:滴有石裁试液的CO:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的co=(或SOJ溶液加热后红色变橙色或黄色等。
无机推断题解题策略本专题着重总结了“无机推断题考察内容”、“无机推断试题的失分原因”、“无机推断题的特点”“无机推断题的一般解题思路”、“无机推断题常见的突破口”、“典型例题分析”、“思维能力训练”七部分,希望以此提高同学们的无机推断题的解题水平。
一、无机推断考察内容物质推断题由于可全面考查无机化学知识的内在联系,及其分析问题的方法和解决问题的能力,而成为优秀的传统题型,主要分为限定范围推断(给出实验现象,或特定组合元素及必要数据)和不定范围推断(只给出物质类别或状态及转化框图)两大类。
无机推断题型不但综合性考查学生在中学阶段所学的元素及其化合物知识以及物质结构元素周期律、电解质溶液、化学平衡氧化还原反应、化学用语等知识,而且更重要的是它能突出考查学生的综合分析判断能力、逻辑推理能力。
无机推断题既能考查元素及其化合物知识的综合应用,又能对信息的加工处理、分析推理、判断等方面的能力加以考查,因此此类题型应是考查元素及其化合物知识的最佳题型之一。
二、无机推断试题的失分原因无机推断题考查知识面广,考题内容多为常见元素及其化合物知识,但与双基知识、有机、实验、计算均可联系,试题的容量比较大。
但推断的物质不会超出中学范围所学的元素及其化合物知识,要学生书写的内容也不过是常用的化学用语。
这类试题的失分原因有以下几点:一是学生对元素及其化合物的知识不够全面与熟悉;二是学生的分析判断能力与逻辑推理能力欠缺;三是学生的化学用语掌握不够;四是学生对这种试题练习不够,有一种恐惧心理;五是学生缺乏对这种题型的解题思路。
因此,要想帮助学生解好推断题,教师指导学生对这种试题做专题训练,在专题训练的时候,一要让学生了解无机推断题的特点与考查的知识点与能力要求;二要求学生自己整理或帮助学生整理归纳元素及其化合物知识以熟练掌握一些特征的性质与变化;三要通过示例分析总结出常见的解题思路与方法;四要让学生训练考查不同知识点与不同解题思路的的各种试题,让他们在训练中找感觉,同时要认真并及时纠正学生练习过程中出现的化学用语错误和疏漏的表达缺陷,以求达到解题科学化标准化。
一. 无机推断题的分析思路审题→挖掘、筛选信息→联系已学知识→寻找突破点→推理判断→得出结论→正向求证审题,就是阅读题目的过程。
先阅读全题形成一个整体印象,再仔细领会题意,反复推敲、认真辨析,注意题目所给的限制性语句,把条件找准、找全。
已知条件找出来以后,经过与大脑中储存的知识信息相比较,对信息、条件进行加工、筛选,目的是找出解决问题的突破点。
突破点可以是物质的特殊性质、反应所需的特殊条件、反应所产生的特殊现象等。
找到突破点后再联系已学过的知识,进行推断,推断时既可正向推断,又可逆向推断,通过筛选、论证,然后得出结论。
最后按正向顺序代入推断结果进行检验以确保答案的准确性。
二. 基本解题方法––––“突破点”法找准突破点是解无机推断题的关键,也是解无机推断题的基本方法。
根据“突破点”的类型不同,可分为以下几种:1. 以特殊现象为突破点例1. 下图每一方框中的字母代表一种反应物或生成物。
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。
试填写下列空白:(1)L的化学式为__________________(2)F的化学式为__________________(3)J受热分解反应的化学方程式为__________________(4)H和G之间反应的化学方程式为__________________解析:此题的突破点是:D是淡黄色固体单质,且能够在空气中燃烧,则D应是单质硫,G应是SO2,H应是H2S,L应是H2O。
又因为J是含A金属元素的白色沉淀,再结合I为NaCl,则F应为Na2S,E是AlCl3,二者与水混合发生双水解反应。
答案:(1)H2O;(2)Na2S;(3);(4)例2. 已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。
元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
绝杀秘诀---与元素周期律相关的几个重要结论
两种题型:一是元素推断题,先将元素推断出来之后,再进行相关元素及其化合物知识的考查;二是考查元素周期律,对元素性质的递变规律进行“是非性”的判断。
一、元素推断题的“突破口”
1、短周期元素原子结构的九大特征
(1)原子核中无中子的原子:1H
(2)原子最外层有1个电子的元素:H Li Na
(3)原子最外层有2个电子的元素:Be Mg He
(4)最外层电子数等于次外层电子数的元素:Be Ar
(5)最外层电子数是次外层电子数2倍的元素:C
(6)电子层数与最外层电子数相等的元素:H Be Al
(7)电子总数是最外层电子数2倍的元素:Be
(8)次外层电子数是最外层电子数2倍的元素:Li Si
(9)内层电子数是最外层电子数2倍的元素:Li P
2、含量与物理性质
(1)地壳中质量分数最大的元素是氧,其次是硅质量分数最大的金属元素是铝,其次铁。
(2)其单质是人工制得纯度最高的元素是硅;其单质为天然物质中硬度最大的元素是碳(3)其气态氢化物含氢量最高的元素是碳
(4)其单质是有色气体的元素有氟、氯
(5)所形成的化合物种类最多的元素是碳
3、化学性质与用途
(1)其单质与水反应最剧烈的非金属元素是氟
(2)其气态氢化物与其最高价氧化物对应的水化物能起反应的:NH3 +HNO3 = NH4NO3(3)其最高价氧化物对应水化物的酸性最强的元素是氯
(4)其气态氢化物水溶液呈碱性的元素是氮
(5)能导电的非金属单质有石墨和硅
(6)能与强碱溶液作用的单质有Al Cl2、S 、Si 3S +6 NaOH = 2Na2S + Na2SO3 + 3H2O (7)单质本身有毒,在一定条件下又可以杀菌消毒的是硫、氯气
二、辨析几个易错易混淆的结论
1、金属元素与非金属元素能形成共价化合物。
2、只有在原子中,质子数才与核外电子数相等。
(分子)
3、目前使用的元素周期表中,最长的周期含有36种元素。
(32)
4、非金属元素形成的共价化合物中,原子的最外层电子数只能2或8。
(2、8、10 ---PCl5)
5、主族元素原子最外层电子数等于元素的最高正化合价(F无正价,O一般不显正价)
6、多电子原子中,在离核较近的区域内运动的电子能量较高。
(较低)
7、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素。
(过渡元素从第3
列到12列,共10个纵行)
8、同一元素不可能既表现金属性,又表现非金属性。
(Al)
9、短周期元素形成离子后,最外层都达到8电子稳定结构。
(氢-2)
10、同一主族元素的原子,最外层电子数相同,化学性质完全相同。
11、形成离子键的阴阳离子间只存在静电吸引力。
(静电斥力)
12、第三周期非金属元素含氧酸的酸性从左到右依次增强。
(最高价)
13、元素周期律是元素原子核外电子排布周期性变化的结果。
14、HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱(稳定性,还原性)
无机推断练习
1、A、B、C、D、E、F为原子序数依次增大的短周期主族元素,其中A、B、F
在不同周期,且F为气体,E的最外层电子数为电子层数的2倍,B、E同主族,C的原子在短周期元素中原子半径最大,D的离子在同周期元素形成的简单离子中半径最小,回答下列问题:
(1)ABC三种元素形成的化合物M的电子式
练习电子式的写法—NaOH Na2O2HBr NH4Cl CO2Cl2
MgCl2H2O2 CH2=CH2 CH3Cl
(2)将过量EB2通入M溶液中,其溶液显酸性的原因是
该溶液离子浓度从大到小的顺序是
扩展:NaHCO3 NaHSO3 NaHSO4(溶液中)完成电离方程式
若向该溶液中通入F的单质,发生反应的离子方程式为
(3)将含D离子的溶液加入过量的M溶液中,发生反应的离子方程式为
(4)E最高价氧化物的水化物的化学式为N ,将1mol/L200mL的M溶液与
1.5mol/L100mL的N溶液混合,放出的热量为11.46kJ ,反应的热化学方程
式为
热化学方程式的书写注意:物质状态、系数与焓变的对应,焓变的单位与正负1、X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图,若Y原子的
最外层电子数是内层电子数的3倍,下列说法中不正确的是()
A、原子半径:W>Z>Y>X
B、气态氢化物的稳定性:Y>Z
C、最高价氧化物对应水化物的酸性:W>Z
D、四种元素的单质中,Z的熔沸点最高
2、某矿石由前20号元素中的四种组成,其化学式为WYZX。
X、Y、Z、W分布在三个周期,原子序数依次增大,Y、W为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同一周期,Z单质是一种良好的半导体,则下列判断正确的是()
A、Y、Z的氧化物都有两性
B、气态氢化物的稳定性:Z>X
C原子半径:W>Y>Z>X D、最高价氧化物对应水化物的碱性:Y>W
3、a、b、c、d、e、f为六种短周期元素,a、b、e、f位于同一周期,c、d也是同一周期,且d、e同一主族,原子半径d<e,a、b、c、d、f原子最外层电子数依次增多,则下列说法中正确的是()
A、e氢化物的沸点一定比d 的氢化物的沸点高
B、d元素可能是第一周期元素
C、六种元素中,a元素最高价氧化物对应水化物碱性最强
D、a、b、c、d 的原子序数逐渐增大
元素推断题型
类型一:利用元素的原子结构推断
类型二:利用元素周期表和周期律进行推断
六类常见考点:
1、四判断:判断位置;判断元素;判断性质;判断组成(分子式)
2、六比较:比较最高价氧化物对应水化物的酸碱性;比较气态氢化物的稳定性及水溶液
的酸碱性;比较金属性与非金属性;比较氧化性、还原性;比较微粒半径的大小;比较原子序数的大小。
3、用递变规律解释相关规律
4、依据原子结构特点进行推断
5、用元素位置、结构和性质之间的关系进行推断
6、考查离子键和共价键、离子化合物和共价化合物的判断。
【题型建模】
模型一、由主族元素在周期表中的位置及性质推断
1、明确元素周期表的结构
2、把握元素推断题的几个要点:熟记元素符号,直接导出;掌握几种关系,列式导出;
利用排布规律,逐层导出;弄清带电原因,分析导出;抓住元素特征,综合导出;根据量的关系,计算导出。
3、掌握常见元素及其化合物的特性
模型二:图示法元素推断题
1、题型特点:采用图形或图表对题目的条件、信息进行形象展示,直观地揭示题目条件
间的内在联系和变化规律。
2、解题关键:细心审题,准确理解图或表中的图形、文字或数字信息,找准解题突破口。
模型三、综合利用“位、构、性”的关系推断综合性强,难度大。
【题型建模】无机推断题的解题思路
解题思路:迅速浏览,整体扫描,产生印象,寻找突破口,注意联系,大胆假设,全面分析,验证确认。
思维方法:顺向思维---从已有条件一步步推出未知信息
逆向思维---从问题往条件上推,作假设
发散思维---从自己找到的突破口进行发散推导
解题流程:推断题---审题、深挖细找---明显条件、隐含条件----抓关键、分析突破----结构特征、反应特征、现象特征、操作特征----推断(顺推、逆推)-----结论---- 验证。