液相活度系数方程总结
- 格式:doc
- 大小:149.50 KB
- 文档页数:4


状态方程和活度系数模型1. 引言在化学领域,我们经常需要描述和预测化学反应的行为和性质。
为了达到这一目的,我们需要建立一些数学模型来描述不同物质在不同条件下的行为。
状态方程和活度系数模型是其中两个重要的模型,它们在研究溶液中的物质浓度和反应速率等方面发挥着重要的作用。
2. 状态方程状态方程是一种用数学语言描述物理和化学系统状态的模型。
在化学中,最常见的状态方程是气体状态方程,如理想气体状态方程和范德瓦尔斯状态方程。
理想气体状态方程可以表示为:[ PV = nRT ]其中,P表示气体的压力,V表示气体的体积,n表示气体的物质量,R表示气体常数,T表示气体的温度。
理想气体状态方程假设气体分子之间没有相互作用,体积可忽略不计。
但在一些情况下,气体分子之间会存在相互作用,此时可以使用范德瓦尔斯状态方程:[ (P + )(V - nb) = nRT ]其中,a和b为范德瓦尔斯常数,分别代表相互作用带来的修正。
范德瓦尔斯状态方程适用于高压和低温条件下的气体。
除了气体状态方程,还有液体和固体的状态方程,如液体的状态方程可以由万有气体状态方程经过适当的修正得到:[ P = P^* + ]其中,P^*为理想液体的气体状态方程。
同理,固体的状态方程也可以类似进行修正。
3. 活度系数模型在溶液中,溶质分子和溶剂分子之间会发生相互作用。
这些相互作用会导致溶质分子在溶液中的活动程度与其在纯溶剂中的活动程度不同。
为了描述溶液中物质的活性,引入了活度系数的概念。
活度系数(activity coefficient)描述了溶液中溶质活性和摩尔浓度之间的关系。
活度是指溶液中溶质的实际浓度和理想溶液中相同浓度之间的比值。
活度系数模型是一种用于计算活度系数的数学模型。
常用的活度系数模型有Debye-Huckel模型和Pitzer模型。
Debye-Huckel模型适用于稀溶液中的弱电解质。
该模型通过引入电离度和离子间相互作用来计算活度系数。


液相活度系数方程总结1、Wohl 模型Wohl 模型是一个普通模型,可以概括Margules 方程(1895年)、Van Laar 方程(1910年)以及Scatchard-Hamer 方程(1953年)。
Whol 在1946年提出将超额自由焓EG 表示为有效容积分率的函数,并展开成为Mc Laurin 级数:+++=∑∑∑∑∑∑∑∑∑∑ijklijkl l k j i ijkijk k j i ijij j i iii E a Z Z Z Z a Z Z Z a Z Z x q RT G(1-1)式中:i Z ——混合物中i 组分的有效容积分率:1=⇒=∑∑iiiii ii i Zx q x q Z ;i x ——i 组分的摩尔分数; i q ——i 组分的有效摩尔体积; ij a ——i-j 两组分之间的交互作用参数,称为二尾标交互作用参数; ijk a ——i-j-k 三组分之间的交互作用参数,称为三尾标交互作用参数; ijkl a ——i-j-k-l 四组分之间的交互作用参数,称为四尾标交互作用参数;略去四分子以上集团相互作用项,将式(1-1)用于二元系统时变为:()12222111222112212211332a Z Z a Z Z a Z Z x q x q RT G E ++=+ (1-2)令: ()12212132a a q A +=()11212232a a q B +=代入上式,根据()jn p T i E i n RT nG ,,ln ⎥⎦⎤⎢⎣⎡∂∂=γ将式(1-2)对i n 进行偏微分,经整理得: ⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+=A q q B Z A Z 2112212ln γ (1-3a ) ⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+=B q q A Z B Z 1222122ln γ (1-3b ) 式(1-3)中包括三个参数A 、B 与12q q ,其值必须用实验值来确定。

课题:溶液的热力学性质——活度及活度系数课程名称:钢铁冶金原理教材:黄希祜主编 .《钢铁冶金原理(第3版)》. 北京:冶金工业出版社,2004.01第一章 冶金热力学基础1.2 溶液的热力学性质——活度及活度系数 教学要求:1) 理解拉乌尔定律、亨利定律、理想溶液、稀溶液、亨利定律常数的含义;理解活度及活度系数的概念、。
2) 掌握不同浓度单位间的换算;确定(%))(*,,H x H B K K P 的方法及它们间转换。
3) 掌握活度及活度系数的计算方法;活度标准态的选择及其与活度的关系;不同活度标准态间的转换。
教学重点:1) 三种标准态的活度及活度系数的计算。
2) 三种活度标准态间的转换。
3) 亨利定律常数的确定。
教学难点:1) 计算活度的公式)(/标B B B p p a =中)(标s p 的确定。
2) 三种活度标准态间的转换系数0B γ的确定。
第一部分 复习上节课主要内容第二部分 新课引入:由于冶金反应中常遇到的钢液、熔渣等都是非理想溶液,这种溶液里的组分浓度并不适合理想溶液的热力学公式,必须用一系数对组分浓度进行修正,使其适用于常见物理化学定律。
被修正后的浓度称为活度。
所以有必要学习活度有关的知识。
第三部分 讲授新课1.2.1 溶液组分浓度的单位及其相互转换关系 一、常用溶液组分浓度单位 B w —质量百分浓度B n —组分B 的摩尔数 B x —组分B 的摩尔分数B c —体积摩尔浓度(3/m mol 溶液)B ϕ—标准总压数B p —组分B 的分压数注意:本课后面出现的B w 值及B ϕ值是百分号“%”前的数字。
二、浓度单位间的关系式1))1(1100BA B B A B M Mx M M w -+⋅=(二元系) (2-1)证明: BB A A BB B A B B n M n M n M m m m w +=+=100100 =)1(1100)(100BA B B A BA BA B A BA B BM Mx M M n n n M M M n n n M -+⋅=+-++证毕。
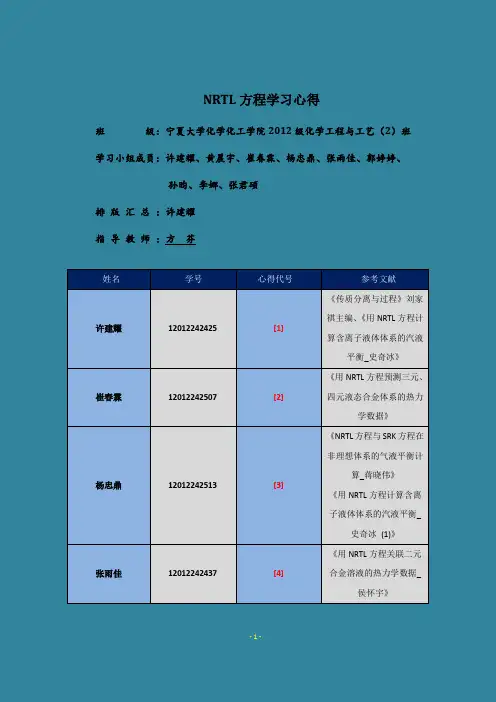
NRTL方程学习心得班级:宁夏大学化学化工学院2012级化学工程与工艺(2)班学习小组成员:许建耀、黄晨宇、崔春霖、杨忠鼎、张雨佳、郭婷婷、孙昀、李娜、张君硕排版汇总:许建耀指导教师:方芬姓名学号心得代号参考文献许建耀12012242425 [1] 《传质分离与过程》刘家祺主编、《用NRTL方程计算含离子液体体系的汽液平衡_史奇冰》崔春霖12012242507 [2] 《用NRTL方程预测三元、四元液态合金体系的热力学数据》杨忠鼎12012242513 [3] 《NRTL方程与SRK方程在非理想体系的气液平衡计算_蒋晓伟》《用NRTL方程计算含离子液体体系的汽液平衡_史奇冰(1)》张雨佳12012242437 [4] 《用NRTL方程关联二元合金溶液的热力学数据_侯怀宇》郭婷婷12012242438 [5] 《用NRTL方程关联和预测离子液体_醇_水体系的液液相平衡_焦真》黄晨宇12012242512 [6]《Use of the NRTL equation for simultaneous correlation of vapour liquid equilibria and excessenthalpy》李娜12012242444 [7] 《NRTL方程与SRK方程在非理想体系的气液平衡计算》孙昀12012242506 [8]《用NRTL方程计算含离子液体体系的汽液平衡》张君硕12012242514 [9] 《用NRTL方程预测部分互溶体系的汽液平衡_刘永新》NRTL(non-random two liquid)方程为溶液理论中非随机(局部)双液体模型方程,1968年由Renon和Prausnitz提出。
1982年,Chen将Pitzer-Debye-Huckel理论与局部模型中的NRTL方程相结合,提出电解质NRTL(electrolyte NRTL)方程应用于电解质溶液的计算,并取得了成功。

一、 实验目的1. 用气液色谱法测定苯和环己烷在邻苯二甲酸二壬酯中的无限稀释活度系数。
2. 通过实验掌握测定原理和操作方法。
熟悉流量、温度和压力等基本测量方法。
3. 了解气液色谱仪的基本构造及原理。
二、 实验原理采用气液色谱测定无限稀释溶液活度系数,样品用量少,测定速度快,仅将一般色谱仪稍加改装,即可使用。
目前,这一方法已从只能测定易挥发溶质在难挥发溶剂中的无限稀释度系数,扩展到可以测定在挥发性溶剂中的无限稀释活度系数。
因此,该法在溶液热力学性质研究、气液平衡数据的推算、萃取精馏溶剂评选和气体溶解度测定等方面的应用,日益显示其重要作用。
当气液色谱为线性分配等温线、气相为理想气体、载体对溶质的吸附作用可忽略等简化条件下,根据气体色谱分离原理和气液平衡关系,可推导出溶质 i 在固定液 j 上进行色谱分离时,溶质的校正保留体积与溶质在固定液中无限稀释活度系数之间的关系式。
根据溶质的保留时间和固定液的质量,计算出保留体积,就可得到溶质在固定液中的无限稀释活度系数。
实验所用的色谱柱固定液为邻苯二甲酸二壬酯。
样品苯和环己烷进样后汽化,并与载气H 2混合后成为气相。
当载气H 2将某一气体组分带过色谱柱时,由于气体组分与固定液的相互作用,经过一定时间而流出色谱柱。
通常进样浓度很小,在吸附等温线的线性范围内,流出曲线呈正态分布,如图2-1所示。
图2-1 色谱流出曲线图设样品的保留时间为t r (从进样到样品峰顶的时间),死时间为t d (从惰性气体空气进样到其峰顶的时间),则校正保留时间为:)(1t -t t d r 'r校正保留体积为:c r r 式中,c F ——校正到柱温、柱压下的载气平均流量,s /m 3校正保留体积与液相体积t V 关系为:)(3l 'r KV V而)(4c c g ili K 式中,l V ——液相体积,m 3;K ——分配系数;l i c ——样品在液相中的浓度,mol/m 3; g i c ——样品在气相中的浓度,mol/m 3;由式(3)、(4)可得:)(5c c i'i gi l i V V 因气体视为理想气体,则)(6c cig i RT P而当溶液为无限稀释时,则)(7x c lll l i M式中,R ——气体常数l ——纯液体的密度,kg/m 3; l M ——纯液体的分子量;l x ——样品i 的摩尔分率; i p ——样品的分压,Pa ; c T ——柱温,K 。




液相活度系数方程总结1、Wohl 模型Wohl 模型是一个普通模型,可以概括Margules 方程(1895年)、Van Laar 方程(1910年)以及Scatchard-Hamer 方程(1953年)。
Whol 在1946年提出将超额自由焓EG 表示为有效容积分率的函数,并展开成为Mc Laurin 级数:+++=∑∑∑∑∑∑∑∑∑∑ijklijkl l k j i ijkijk k j i ijij j i iii E a Z Z Z Z a Z Z Z a Z Z x q RT G(1-1)式中:i Z ——混合物中i 组分的有效容积分率:1=⇒=∑∑iiiii ii i Zx q x q Z ;i x ——i 组分的摩尔分数; i q ——i 组分的有效摩尔体积; ij a ——i-j 两组分之间的交互作用参数,称为二尾标交互作用参数; ijka ——i-j-k 三组分之间的交互作用参数,称为三尾标交互作用参数;ijkl a ——i-j-k-l 四组分之间的交互作用参数,称为四尾标交互作用参数;略去四分子以上集团相互作用项,将式(1-1)用于二元系统时变为:()12222111222112212211332a Z Z a Z Z a Z Z x q x q RT G E ++=+ (1-2)令: ()12212132a a q A +=()11212232a a q B +=代入上式,根据()jn p T i E i n RT nG ,,ln ⎥⎦⎤⎢⎣⎡∂∂=γ将式(1-2)对i n 进行偏微分,经整理得: ⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+=A q q B Z A Z 2112212ln γ (1-3a ) ⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+=B q q A Z B Z 1222122ln γ (1-3b ) 式(1-3)中包括三个参数A 、B 与12q q ,其值必须用实验值来确定。
2、Scatchard-Hamer eq .用纯组分的摩尔体积lV 1及lV 2代替有效摩尔体积1q 及2q ,则式(1-3a )和式(1-3b )就变为:⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+=A V V B Z A Z l l 2112212ln γ (2-1a )⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+=B V V A Z B Z l l 1222122ln γ (2-1b )式中: l l V V x x x Z 122111+= llll V V x x V V x Z 12211222+= 由于lV 1、lV 2为已知,所以式(2-1a )和式(2-1b )为二参数方程,关联方便。
液相活度系数方程总结
1、Wohl 模型
Wohl 模型是一个普通模型,可以概括Margules 方程(1895年)、Van Laar 方程(1910年)以及Scatchard-Hamer 方程(1953年)。
Whol 在1946年提出将超额自由焓E
G 表示为有效容积分率的函数,并展开成为Mc Laurin 级数:
+++=∑∑∑∑∑∑∑∑∑∑i
j
k
l
ijkl l k j i i
j
k
ijk k j i i
j
ij j i i
i
i E a Z Z Z Z a Z Z Z a Z Z x q RT G
(1-1)
式中:i Z ——混合物中i 组分的有效容积分率:1=⇒
=
∑∑i
i
i
i
i i
i i Z
x q x q Z ;
i x ——i 组分的摩尔分数; i q ——i 组分的有效摩尔体积; ij a ——i-j 两组分之间的交互作用参数,称为二尾标交互作用参数; ijk a ——i-j-k 三组分之间的交互作用参数,称为三尾标交互作用参数; ijkl a ——i-j-k-l 四组分之间的交互作用参数,称为四尾标交互作用参数;
略去四分子以上集团相互作用项,将式(1-1)用于二元系统时变为:
()
1222
2111222112212211332a Z Z a Z Z a Z Z x q x q RT G E ++=+ (1-2)
令: ()12212132a a q A +=
()11212232a a q B +=
代入上式,根据()
j
n p T i E i n RT nG ,,ln ⎥
⎦⎤
⎢⎣⎡∂∂=γ将式(1-2)对i n 进行偏微分,经整理得: ⎥⎦⎤
⎢⎣
⎡⎪⎪⎭⎫ ⎝⎛-+=A q q B Z A Z 2112
2
12ln γ (1-3a ) ⎥⎦⎤
⎢⎣
⎡⎪⎪⎭⎫ ⎝⎛-+=B q q A Z B Z 1222122ln γ (1-3b ) 式(1-3)中包括三个参数A 、B 与12q q ,其值必须用实验值来确定。
2、Scatchard-Hamer eq .
用纯组分的摩尔体积l
V 1及l
V 2代替有效摩尔体积1q 及2q ,则式(1-3a )和式(1-3b )就变为:
⎥⎦⎤
⎢⎣
⎡⎪⎪⎭⎫ ⎝⎛-+=A V V B Z A Z l l 2112
2
12ln γ (2-1a ) ⎥⎦⎤
⎢⎣
⎡⎪⎪⎭⎫ ⎝⎛-+=B V V A Z B Z l l 1222
1
22ln γ (2-1b )
式中: l V V x x x Z 122111+= l
l
l
l V V x x V V x Z 1
2211
222+= 由于l V 1、l V 2为已知,所以式(2-1a )和式(2-1b )为二参数方程,关联方便。
3、Margules eq .
当21q q =时,则i i x Z =,式(1-3a )和式(1-3b )就变为:
()[]A B x A x -+=12
2
12ln γ (3-1a ) ()[]B A x B x -+=22122ln γ (3-1b )
式(3-1a )和式(3-1b )为三阶Margules 方程,即为常用的Margules 方程。
参数A 、B
需由实验值确定,当01=x 时,A =∞1ln γ;当02=x 时,B =∞2ln γ。
此处∞1γ和∞
2
γ表示无限稀释时的活度系数。
4、Van Laar eq .
当A B q q =12时,则式(1-3a )和式(1-3b )就变为:
2
2111ln ⎪
⎪⎭⎫
⎝⎛+=
Bx Ax A γ (4-1a )
2
1221ln ⎪
⎪⎭⎫ ⎝
⎛+=
Ax Bx B γ (4-1b )
式(4-1a )和式(4-1b )为V an Laar 方程。
当01=x 时,A =∞1ln γ;当02=x 时,B =∞
2ln γ。
参数A 、B 需由实验值确定,通常可以从汽液平衡实验数据求得:
2
11221ln ln 1ln ⎪⎪⎭⎫
⎝⎛+=γγγx x A (4-2a )
2
22112ln ln 1ln ⎪⎪⎭⎫
⎝
⎛+=γγγx x B (4-2b )
5、Wilson eq .
Wilson 于1964年提出将局部组成概念和Flory-Huggin 模型结合,得出E
G 模型为:
∑∑==⎪⎪⎭
⎫ ⎝⎛Λ-=N i N j j ij i E
x x RT G 11ln (5-1) 其中: ()[]
RT g g V V ii ij l
i
l j ij --=
Λexp (5-2)
ij Λ称为Wilson 参数,由式(5-2)可知ij Λ通常不等于ji Λ,1=Λ=Λjj ii ,0>Λij ;
()ii ij
g g
-为二元交互作用能量参数,可为正值或负值。
将式(5-1)对i x 微分可导出Wilson 计算活度系数i γ的通式:
∑∑∑===ΛΛ-⎪⎪⎭⎫ ⎝⎛Λ-=N k N
j j
kj k
ki N j j ij i x x x 11
1ln 1ln γ (5-3) 式中 每个加和号表示包括所有的组分。
对二元溶液,上式简化为:
()⎥⎦⎤
⎢⎣⎡Λ+Λ-Λ+Λ+Λ+-=121221************ln ln x x x x x x x γ (5-4a )
()⎥⎦⎤
⎢⎣⎡Λ+Λ-Λ+Λ-Λ+-=1212212121
12112122ln ln x x x x x x x γ (5-4b )
式中 Wilson 参数12Λ和21Λ按式(5-2)可分别表示为:
()[]RT g g V V l l
11121212exp --=Λ (5-5a )
()[]RT g g V V l l
22212
121exp --=Λ (5-5b )
式中二元交互作用能量参数()1112g g -和()2221g g -需由二元汽液平衡的实验数据确定。
通常采用多点组成下的实验数据,用非线性最小二乘法回归求取参数最佳值。
6、NRTL eq .
① 二元系统
NRTL 模型对二元体系的E
G 表达式为:
⎥⎦
⎤⎢⎣⎡+++=121212122121212121G x x G G x x G x x RT G E ττ
7、Margules- Van Laar eq.
8、UNIQUAC eq.
9、Scatchard- Hildebrand eq.。