化学平衡练习题
- 格式:doc
- 大小:150.50 KB
- 文档页数:11
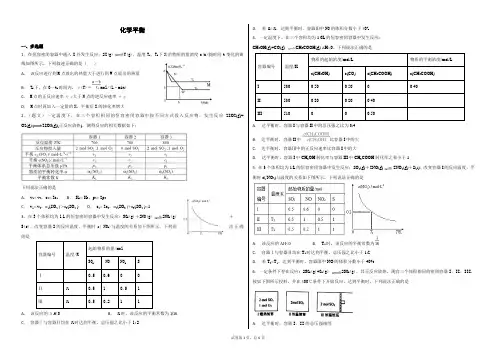
化学平衡一、多选题1.在恒容密闭容器中通入X 并发生反应:2X(g)Y(g),温度T 1、T 2下X 的物质的量浓度c(x)随时间t 变化的曲线如图所示,下列叙述正确的是( )A . 该反应进行到M 点放出的热量大于进行到W 点放出的热量B . T 2下,在0~t 1时间内,υ(Y)=mol/(L·min)C . M 点的正反应速率υ正大于N 点的逆反应速率υ逆D . M 点时再加入一定量的X ,平衡后X 的转化率增大2.(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下:下列说法正确的是A . v 1< v 2,c 2< 2c 1B . K 1> K 3,p 2> 2p 3C . v 1< v 3,α1(SO 2 ) >α3(SO 2 )D . c 2> 2c 3,α2(SO 3 )+α3(SO 2 )<1 3.在3个体积均为1 L 的恒容密闭容器中发生反应:SO 2(g)+2NO(g)2NO 2(g)+S(s)。
改变容器I 的反应温度,平衡时c ( NO 2)与温度的关系如下图所示。
下列说法正确的是A . 该反应的ΔH <0B . T 1时,该反应的平衡常数为1/16 1D . 若T 2<T 1,达到平衡时,容器Ⅲ中NO 的体积分数小于40% 4.一定温度下,在三个容积均为1.0L 的恒容密闭容器中发生反应: CH 3OH(g)+CO(g)CH 3COOH(g) △H<0。
下列说法正确的是A . 达平衡时,容器I 与容器II 中的总压强之比为3:4B . 达平衡时,容器II 中比容器I 中的大C . 达平衡时,容器Ⅲ中的正反应速率比容器I 中的大D . 达平衡时,容器I 中CH 3OH 转化率与容器III 中CH 3COOH 转化率之和小于1 5.在3个体积均为1 L 的恒容密闭容器中发生反应:SO 2(g)+2NO(g)2NO 2(g)+S(s)。

高中化学《化学平衡》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.煤气化的主要反应为:C(s)+H 2O(g)高温 CO(g)+H 2(g)下列有关叙述错误的是( ) A .升高温度 反应速率加快B .将块状固体粉碎 反应速率加快C .平衡时 CO 的浓度不再变化D .平衡时 反应就停止了2.工业生产氨气的适宜条件中不包括( )A .用浓硫酸吸收产物B .用铁触煤作催化剂C .温度500℃左右D .压强为20~50MPa3.在绝热的某刚性容器中置入1molF 2和3molClF 3 发生反应:F 2(g)+ClF(g)ClF 3(g)。
下列说法中能够判断该反应一定处于平衡状态的有( )A .F 2(g)与ClF(g)体积之比恒定不变B .F 2(g)与ClF 3(g)速率之比恒定不变C .混合物中Cl 元素质量分数恒定不变D .断裂1molF —F 键 同时生成3molF —Cl 键4.下列化工生产中未使用催化剂的是( )A .合成氨B .制纯碱C .乙烯水化D .SO 2转化为SO 35.下列过程中 需要增大化学反应速率的是( )A .钢铁腐蚀B .食物腐败C .塑料老化D .工业合成氮6.通过缩小反应容器体积而增大压强对下列反应的速率无影响的是( )A .CO 2(g)+Ca(OH)2===CaCO 3↓+H 2OB .H 2(g)+I 2(g)2HI(g)C .NaCl +AgNO 3===AgCl ↓+NaNO 3D .N 2(g)+3H 2(g)2NH 3(g)7.下列叙述正确的是( )A .升高温度 可降低活化能B .反应2SiO (s)2C(s)Si(s)2CO(g)+=+必须在高温下才能自发进行 则有H 0∆>C .合成氨生产中将NH 3液化分离 可加快正反应速率D .任何可逆反应 其平衡常数变大 反应物的转化率变小8.对于反应: (g)+ I 2(g) (g)+2HI(g) △H>0.达到平衡后 欲增加环戊烯的平衡转化率 可采取的措施有( )A .恒压条件下通入惰性气体B .降低温度C .增大环戊烯浓度D .将容器体积减小到原来的一半9.当其他条件不变时 下列说法正确的是( )A .增加反应物的质量 一定能加快反应速率B .用粉状锌代替块状锌与稀硫酸反应一定会加快反应速率C .当反应物与生成物浓度相等时 可逆反应一定已达到化学平衡状态D .在合成氨反应中 增大N 2浓度一定可以使H 2的转化率达到100%10.乙烯气相直接水合反应制备乙醇:24225C H (g)H O(g)C H OH(g)+。
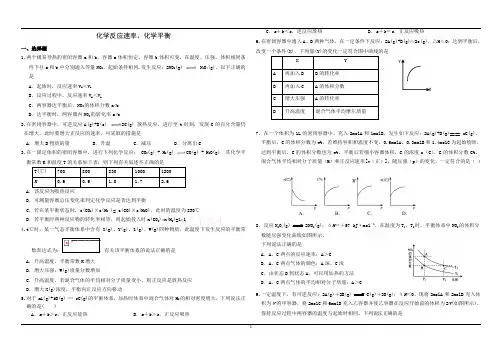
化学反应速率、化学平衡一、选择题1.两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在温度、压强、体积相同条件下往a和b中分别通入等量NO2,起始条件相同.发生反应:2NO2(g) N2O4(g),以下正确的是A.起始时,反应速率V a<V bB.反应过程中,反应速率V a<V bC.两容器达平衡后,NO2的体积分数a<bD.达平衡时,两容器内NO2的转化率a>b2.在密闭容器中,可逆反应A(g)+B(s) 2C(g) 放热反应,进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是A.增大B物质的量 B.升温 C.减压 D.分离出C3.在一固定体积的密闭容器中,进行下列化学反应: CO2(g) + H2(g) CO(g) + H2O(g) 其化学平衡常数K和温度T的关系如下表:则下列有关叙述不正确的是T(℃) 700 800 830 1000 1200K0.6 0.9 1.0 1.7 2.6A.该反应为吸热反应B.可测量容器总压变化来判定化学反应是否达到平衡C.若在某平衡状态时,c(CO2)×c(H2 )= c(CO)×c(H2O),此时的温度为830℃D.若平衡时两种反应物的转化率相等,则起始投入时n(CO2):n(H2)=1:14.t℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:,有关该平衡体系的说法正确的是A.升高温度,平衡常数K增大B.增大压强,W(g)质量分数增加C.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应D.增大X(g)浓度,平衡向正反应方向移动5.对于a A(g)+b B(g) c C(g)的平衡体系,加热时体系中混合气体对H2的相对密度增大,下列说法正确的是( )A.a+b>c,正反应放热B.a+b>c,正反应吸热C.a+b<c,逆反应放热D.a+b=c,正反应吸热6.在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)2c(g),△H<0;达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是X YA 再加入B B的转化率B 再加入C A的体积分数C 增大压强A的转化率D 升高温度混合气体平均摩尔质量7.在一个体积为1L的密闭容器中,充入2molA和1molB,发生如下反应:2A(g)+B(g)==x C(g),平衡后,C的体积分数为w%,若维持容积和温度不变,0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数也为w%。

化学平衡状态练习题化学平衡是指在化学反应中,反应物转化为产物的速率与产物转化为反应物的速率相等的状态。
在平衡状态下,反应物和产物的浓度保持稳定,且反应物与产物之间的速率不再发生改变。
为了帮助理解化学平衡的概念和计算平衡常数,以下是一些化学平衡状态的练习题。
练习题1:考虑以下反应:2A + B ⇌ C + 3Da) 在给定的条件下,如果初始时反应物A的浓度为0.5 mol/L,反应物B的浓度为0.8 mol/L,产物C的浓度为0.4 mol/L,产物D 的浓度为0.2 mol/L,请计算平衡常数Kc。
解答:根据平衡常数的定义,Kc可以通过以下公式计算:Kc = [C]^c[D]^d / [A]^a[B]^b在这个反应中,反应物A的系数为2,反应物B的系数为1,产物C的系数为1,产物D的系数为3。
代入给定的浓度值,计算Kc值:Kc = (0.4)(0.2)^3 / (0.5)^2(0.8) = 0.032 mol/L因此,平衡常数Kc为0.032 mol/L。
练习题2:考虑以下反应:N2(g) + 3H2(g) ⇌ 2NH3(g)b) 给定以下反应物和产物的浓度:[N2]=0.1 mol/L,[H2]=0.3 mol/L,[NH3]=0.2 mol/L。
请计算平衡常数Kc。
解答:根据平衡常数的定义,Kc可以通过以下公式计算:Kc = [NH3]^2 / [N2][H2]^3代入给定的浓度值,计算Kc值:Kc = (0.2)^2 / (0.1)(0.3)^3 = 2.96 mol/L因此,平衡常数Kc为2.96 mol/L。
练习题3:考虑以下反应:2SO2(g) + O2(g) ⇌ 2SO3(g)c) 如果给定反应物和产物的浓度:[SO2]=0.2 mol/L,[O2]=0.1 mol/L,[SO3]=0.3 mol/L,请判断该反应处于偏向反应物还是偏向产物的方向,并解释原因。
解答:为了判断反应处于偏向反应物还是偏向产物的方向,我们可以比较给定浓度与准平衡浓度的比值。

化学平衡综合练习【例题精选】例1、某温度下,反应:N2O4(气)2NO2(气) -Q在密闭容器中达到平衡,下列说法中,不正确的是A.加压时(体积变小),将使正反应速率增大B.保持体积不变,加入少许NO2,将使正反应速率减小C.保持体积不变,加入少许N2O4,再达到平衡,颜色变深D.保持体积不变,升高温度,再达到平衡时,颜色变深解析:增大压强使密闭容器体积变小,(N2O4)增大,随之增大。
A正确。
若保持体积不变,加入NO2,则(NO2)增大,随之增大。
由于增大,使(N2O4)也增大,因此增大,B不正确。
已知N2O4为无色气体,NO2为棕红色气体。
由这两种气体组成的混合气体,其颜色的深浅,视两种气体的含量多少而定。
若保持体积不变,加入少许N2O4,由于(N2O4)增大,化学平衡向正反方向移动,(而四氧化二氮减小),因此再达到平衡时,混合气体颜色加深;升高温度,平衡向吸热(正)反应方向移动,使(NO2)增大,故颜色变深。
C和D都正确。
答案:B例2、将固体NH4I置于密闭容器中,在某温度下发生下列反应:①HN4I(固)NH3(气)+HI(气);②2HI(气)H2(气)+I2(气)。
当反应达到平衡时,(H2)=0.5 mol·L-1,(HI)= 4 mol·L-1,则NH3的浓度为A.3.5 mol·L-1B.4 mol·L-1C.4.5 mol·L-1 D.5 mol·L-1解析:固体NH4I在密闭容器中的反应存在两个相关联的化学平衡①和②。
①中(NH3)平应与(HI)平相等。
因为HI要发生②的反应,所以①中(HI)平应与②中(HI)始相等,并设为A。
2H H2 + I2(a)(H2)变== (H2)始+(H2)平= 0+0.5= 0.5 mol·L-1(b)(HI)变= 2(H2)变= 2×0.5= 1 mol·L -1(c)A=(HI)始= (HI)变+(HI)平= 1 + 4 =5 mol·L-1。

化学平衡练习题化学平衡是化学反应原理中的重要概念,为了帮助大家更好地理解和掌握这一知识点,下面为大家准备了一系列化学平衡的练习题。
一、选择题1、对于可逆反应:2SO₂+ O₂⇌ 2SO₃,在恒温恒容条件下,下列能说明反应已达到平衡状态的是()A 单位时间内生成 2n mol SO₃的同时消耗 n mol O₂B 容器内压强不再变化C 容器内气体的密度不再变化D SO₂、O₂、SO₃的分子数之比为 2∶1∶2答案:B解析:A 选项中,生成 2n mol SO₃的同时消耗 n mol O₂,都表示的是正反应速率,不能说明达到平衡状态;B 选项,该反应是气体分子数发生变化的反应,在恒温恒容条件下,压强不再变化,说明气体的物质的量不再变化,反应达到平衡状态;C 选项,容器体积不变,气体质量不变,密度始终不变,不能作为平衡的判断依据;D 选项,SO₂、O₂、SO₃的分子数之比为 2∶1∶2 ,不一定是平衡状态,浓度不再改变才是平衡状态的标志。
2、在一定温度下,可逆反应 A(g) + 3B(g) ⇌ 2C(g) 达到平衡的标志是()A C 生成的速率与 C 分解的速率相等B 单位时间内生成 n mol A,同时生成 3n mol BC A、B、C 的浓度不再变化D A、B、C 的分子数之比为 1∶3∶2答案:AC解析:A 选项,C 生成的速率与 C 分解的速率相等,说明正逆反应速率相等,达到平衡状态;B 选项,生成 n mol A 和生成 3n mol B 都表示的是逆反应速率,不能说明达到平衡;C 选项,各物质浓度不再变化,说明反应达到平衡;D 选项,分子数之比不能作为平衡的判断依据。
3、下列说法可以证明反应 N₂+ 3H₂⇌ 2NH₃已达到平衡状态的是()A 1 个N≡N 键断裂的同时,有 3 个 H—H 键形成B 1 个N≡N 键断裂的同时,有 3 个 H—H 键断裂C N₂、H₂、NH₃的分子数之比为 1∶3∶2D 容器内压强保持不变答案:AD解析:A 选项,1 个N≡N 键断裂表示正反应,3 个 H—H 键形成表示逆反应,且速率之比等于化学计量数之比,说明达到平衡;B 选项,1 个N≡N 键断裂和 3 个 H—H 键断裂都表示正反应,不能说明达到平衡;C 选项,分子数之比不能作为平衡的判断依据;D 选项,该反应是气体分子数发生变化的反应,压强不变说明反应达到平衡。

化学平衡练习题(一)一、关于达到平衡状态的标志:()1、在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是A、C生成的速度与C分解的速度相等B、单位时间生成n摩尔A,同时生成3n摩尔BC、A、B、C的浓度不再变化D、A、B、C的分子数比为1:3:2()2、在容器中充入SO2和只有18O原子组成的氧气(18O2),在一定条件下达到平衡时,18O存在于A、只存在于O2中B、只存在于O2和SO3中C、只存在于SO2和SO3中D、SO2、SO3和O2中都有可能存在()3、对于可逆反应M + N Q达到平衡时,下列说法正确的是()A、M、N、Q三种物质的浓度一定相等B、M、N全部变成了QC、反应混合物各成分的百分组成不再变化D、反应已经停止()4、在一定条件下,某容器中充入N2和H2合成NH3,以下叙述中错误的是()A、开始反应时,正反应速率最大,逆反应速率为零B、随着反应的进行,正反应速率逐渐减小,最后正反应速率减小为零C、随着反应的进行,逆反应速率逐渐增大,最后保持恒定D、随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定()5、对一定条件下,在密闭容器中已达到平衡状态的可逆反应:NO2 + CO NO + CO2,下列说法中不正确的是()A、从开始反应至达到平衡状态,容器内压强始终保持不变B、达到平衡时,NO2、CO2、NO、CO的物质的量均相等C、平衡体系中气体总的物质的量等于开始反应时体系中气体总的物质的量D、达到平衡时,NO和CO2的物质的量之和等于NO2和CO的物质的量之和二、关于影响化学平衡的条件:()1、对于任何一个平衡体系,采取以下措施一定会引起平衡移动的是A、加入一种反应物B、增加体系的压强C、升高温度D、使用催化剂()2、在高温下反应:2HBr(g) H2(g) + Br2(g)(正反应为吸热反应)达到平衡时,要使混合气体颜色加深,可采取的方法是A、减小压强B、缩小体积C、升高温度D、增大H2浓度()3、在某温度下反应:ClF(g) + F2(g) ClF3(g)(正反应为放热反应)在密闭容器中达到平衡,下列说法正确的是A、温度不变,缩小体积,ClF的转化率增大;B、温度不变,增大体积,ClF3的产率提高;C、升高温度,增大体积,有利于平衡向正反应方向移动;D、降低温度,体积不变,F2的转化率降低()4、某温度下反应N2O4(g)2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是①加压时(体积变小),将使正反应速率增大②保持体积不变,加入少许NO2,将使正反应减小;③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;④保持体积不变,升高温度,再达平衡时颜色变深⑤升高温度,正反应速率减小,平衡逆向移动A、①④⑤B、③④⑤C、①③④D、①②③④⑤()5、一定温度下,在带活塞的密闭容器中,反应H2(g) + I2(g) 2HI(g)(正反应为放热反应),达到平衡后,下列说法中不正确的是A、恒压时,通入HI气体,刚开始时正反应速率会减小B、恒温时,减小容积平衡不移动,但气体颜色加深C、恒容时,通入H2,I2的质量分数减小D、恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小()6、反应2A(g) 2B(g) + E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且A的浓度减小,应采取的措施是A、加压B、减压C、减小E的浓度D、降温()7、(全国)在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B 的浓度是原来的60%,则A、平衡向正反应方向移动了B、物质A的转化率减少了C、物质B的质量分数增加了D、a>b()8、(全国)在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g) + 5Q(g)4X(g) + nY(g) ,完全反应后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n的值是A、2 B、3 C、4 D、5()9、下列事实能用勒夏特列原理解释的是A、由H2、I2、HI组成的平衡体系加压后颜色变深B、黄绿色的氯水光照后颜色变浅C、使用催化剂可加快SO2转化为SO3的速率D、将木炭粉碎后与O2反应,速率更快()10、反应:NH4HS(s )NH3(g) + H2S(g),在某温度下达到平衡,下列情况下,不能发生平衡移动的是A、其他条件不变时通入SO2B、移走部分NH4HS固体C、容器体积不变时充入N2D、压强不变时充入N2()11、对于可逆反应:aA(g) + bB(g) cC(g) + dD(g) + Q,下列说法正确的是A、浓度改变平衡必移动B、增大压强平衡必移动C、升高温度平衡必移动D、导入氩气平衡可能移动也可能不移动()12、对于mA(g) + nB(g) pC(g) + qD(g)的平衡体系中,当温度升高时,体系的平均式量由38变为34,则下列判断正确的是A、m+n>p+q,正反应为放热反应B、m+n>p+q,正反应为吸热反应C、m+n<p+q,正反应为放热反应D、m+n<p+q,正反应为吸热反应()13、(上海)对于反应2SO2(g)+O2(g)==2SO3(g),下列判断正确的是A、2体积SO2和足量O2反应,必定生成2体积SO3B、其他条件不变,增大压强,平衡必定向右移动C、平衡时,SO2消耗速率必定等于O2生成速率的两倍D、平衡时,SO2浓度必定等于O2浓度的两倍()14、(上海)可逆反应:3A(气)==3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是A、B和C可能都是固体B、B和C一定都是气体C、若C为固体,则B一定是气体D、B和C可能都是气体( )15.下列事实不能用勒夏特列原理解释的是 A.用排饱和食盐水法收集Cl 2 B . 温度控制在500℃有利于合成氨反应 C .加入催化剂有利于氨的合成 D.工业制取金属钾Na(l)+ KCl(l) NaCl(l)+ K(g)选取适宜的温度,使K 成蒸气从反应混合物中分离出来 16、在一定条件下,xA + yB zC 的可逆反应达到平衡。

化学平衡练习题一、就是非题,下列各题得叙述就是否正确,对得画√错得画×1、对于理想气体反应,等温等容下添加惰性组分时平衡不移动。
( )2、指定状态下得∆r G或就就是定温定压下G~ξ曲线上某一点切线得斜率。
( )3、化学反应达到平衡时,反应得摩尔吉布斯函数∆r G m=0。
( )4、恒T、p、Wˊ=0下,化学反应得平衡条件为: 。
( )5、某一反应在等温等压且无非体积功得条件下> 0 ,则该反应不能正向进行。
( )6、理想气体化学反应,在恒温下增大总压时,反应物转化率将增大。
( )7、对理想气体反应:0 = ∑νB B,在定温定压下当∑νB>0时,随着惰性气体得加入而平衡向右移动。
( )8、由∆r G=-RT ln K,因为K就是平衡常数,所以∆r G就是化学反应达到平衡时得摩尔吉布斯函数变化值。
( )9、等温等压且不涉及非体积功条件下,一切吸热且熵减小得反应,均不能自动发生。
( )10、对于得理想气体反应,等温等压下添加惰性组分时平衡不移动。
( )11、标准平衡常数变了,平衡一定会移动。
反之,平衡移动了,标准平衡常数一定会改变。
( )12、对理想液态混合物中得反应,标准平衡常数K(T)≈K x。
( )13、任何一个化学反应都可以用标准摩尔吉布斯函数来判断反应得方向。
( )14、某反应得平衡常数就是一个不变得常数。
( )15、在一定温度与压力下,某反应得∆r G> 0,所以要选用合适得催化剂,使反应得以进行。
( )二、选择题1、温度升高时,固体氧化物得分解压力(分解反应就是吸热反应):( )。
(1)降低;(2)增大;(3)恒定;(4)无法确定。
2、HgO(s)得标准摩尔生成吉布斯函数∆f G为- 58、52 kJ·mol-1,其分解反应为:2HgO(s) == 2Hg(l) + O2(g), HgO(s)在298K得分解压力就是:( )。
(1)5、499×10-9 kPa; (2)3、0×10-21 kPa;(3)5、5×10-11 kPa; (4)3、024×10-19 kPa。

化学平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、 对于理想气体反应,等温等容下添加惰性组分时平衡不移动。
( )2、指定状态下的 ∆r G 或∑μνB OB B 就是定温定压下G ~ξ 曲线上某一点切线的斜率。
( ) 3、化学反应达到平衡时,反应的摩尔吉布斯函数∆r G m =0。
( )4、恒T 、p 、W ˊ=0下,化学反应的平衡条件为:0r m B B G νμ∆=∑= 。
( )5、某一反应在等温等压且无非体积功的条件下∆r m G > 0 ,则该反应不能正向进行。
( )6、理想气体化学反应()()()A g B g C g →+,在恒温下增大总压时,反应物转化率将增大。
( )7、对理想气体反应:0 = ∑νB B ,在定温定压下当∑νB >0时,随着惰性气体的加入而平衡向右移动。
( )8、由∆r G =-RT ln K ,因为K 是平衡常数,所以∆r G 是化学反应达到平衡时的摩尔吉布斯函数变化值。
( )9、等温等压且不涉及非体积功条件下,一切吸热且熵减小的反应,均不能自动发生。
( )10、 对于B B 0ν≠∑的理想气体反应,等温等压下添加惰性组分时平衡不移动。
( )11、标准平衡常数变了,平衡一定会移动。
反之,平衡移动了,标准平衡常数一定会改变。
( )12、对理想液态混合物中的反应,标准平衡常数K (T )≈B eq B B )χ(ν∏K x 。
( )13、任何一个化学反应都可以用标准摩尔吉布斯函数来判断反应的方向。
( )14、某反应的平衡常数是一个不变的常数。
( )15、在一定温度和压力下,某反应的∆r G > 0,所以要选用合适的催化剂,使反应得以进行。
( )二、选择题1、温度升高时,固体氧化物的分解压力(分解反应是吸热反应):( )。
(1)降低;(2)增大;(3)恒定;(4)无法确定。
2、 HgO(s)的标准摩尔生成吉布斯函数 ∆f G 为- 58.52 kJ ·mol -1,其分解反应为:2HgO(s) == 2Hg(l) + O 2(g), HgO(s)在298K 的分解压力是:( )。

化学平衡练习一、选择题(每小题有1.~.2.个.选项符合题意)1.反应 2A(g) + B(g )2C(g);△H > 0 。
下列反应有利于生成C的是:A. 低温、低压B. 低温、高压C. 高温、高压D. 高温、低压2.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s);ΔH>0下列叙述正确的是A.加入少量W,逆反应速率增大B.当容器中气体压强不变时,反应达到平衡C.升高温度,平衡逆向移动D.平衡后加入X,上述反应的ΔH增大3 右图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采用的措施是A 加入催化剂B 增大Y的浓度C 降低温度D 增大体系压强4 对可逆反应A(g)+B(g)===C(g)(正反应为吸热反应),下列图像正确的是( D )5.已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是A.通入稀有气体使压强增大,平衡将正向移动的正反应速率是Y的逆反应速率的m/n倍C.降低温度,混合气体的平均相对分子质量变小D.增加X的物质的量,Y的转化率降低6、在密闭容器中发生如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的倍。
下列说法中正确的是( )A、m+n>pB、平衡向逆反应方向移动C、A的转化率降低D、C的体积分数增加7、右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是A、升高温度,同时加压。
B、降低温度,同时减压C、增大反应物浓度,同时使用催化剂;D、增大反应物浓度,同时减小生成物浓度8、反应NH4HS(s) NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是 ( )A.移走一部分NH4HS 固体 B、其他条件不变时,通SO2气体C.容器体积不变时,充入氦气 D.保持压强不变时,充入氦气9.某温度下,反应2A(g) B(g);△H<0,在密闭容器中达到平衡,此时c(A)/c(B)=a,若改变某一条件,反应再次平衡,此时c(A)/c(B)=b,下列叙述正确的是 ( ) A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a>bB.保持温度、压强不变,充人惰性气体,则有a=bC.若其他条件不变,升高温度,则有a>bD.若a=b,容器中一定使用了催化剂10、有一化学平衡mA(g)+nB(g)===PC(g)+qD(g),右图表示的转化率与压强、温度的关系。

化学平衡专项练习题1. 气态反应中的平衡常数(a)选择下列反应中的平衡常数的正确单位:i. 2NO(g) + O2(g) ⇌ 2NO2(g)ii. CO(g) + H2O(g) ⇌ CO2(g) + H2(g)(b)给出以下反应的平衡常数表达式:i. 2H2(g) + O2(g) ⇌ 2H2O(g)ii. N2(g) + 3H2(g) ⇌ 2NH3(g)2. 溶液中的平衡常数(a)给出以下酸碱反应的离子方程式:i. HCl(aq) + NaOH(aq) ⇌ NaCl(aq) + H2O(l)ii. H2SO4(aq) + 2NaOH(aq) ⇌ Na2SO4(aq) + 2H2O(l) (b)写出以下反应的平衡常数表达式:i. HCl(aq) + H2O(l) ⇌ H3O+(aq) + Cl-(aq)ii. H2SO4(aq) + H2O(l) ⇌ H3O+(aq) + HSO4-(aq)3. 应用平衡常数计算浓度和压力(a)根据以下反应的平衡常数,计算以下浓度:i. 2SO2(g) + O2(g) ⇌ 2SO3(g)ii. N2(g) + 3H2(g) ⇌ 2NH3(g)(b)根据以下反应的平衡常数,计算以下分压:i. PCl3(g) + Cl2(g) ⇌ PCl5(g)ii. H2(g) + Br2(g) ⇌ 2HBr(g)4. 平衡常数与反应方向(a)根据以下反应的平衡常数,判断反应的方向:i. 2CO(g) + O2(g) ⇌ 2CO2(g) (∆H=−563 kJ)ii. 2H2O(l) ⇌ 2H2(g) + O2(g) (∆H=+483 kJ)(b)根据以下反应的平衡常数和温度变化,判断反应的方向:i. 2SO3(g) ⇌ 2SO2(g) + O2(g) (ΔH<0,ΔS>0)ii. 3FeO(s) + CO(g) ⇌ 2Fe3O4(s) + CO2(g) (ΔH>0,ΔS>0)5. 影响平衡常数的因素(a)说明以下因素如何影响平衡常数:i. 温度变化ii. 压力变化(对气态反应)(b)举例说明温度和压力变化对平衡常数的影响。
化学平衡练习题一、选择题(每小题只有一个正确答案)1.现有反应4NH 3+5O 2==4NO+6H 2O ,反应速率分别用v(NH 3)、v(O 2)、v(NO)、v(H 2O)、表示,其关系正确的是( )A.4v(NH 3)=5(O 2)B.4 v(NH 3)=5 v(H 2O)C.4(O 2)=5 v(NO)D.4 v(NH 3)=5 v(NO) 2.下列事实不能用勒夏特列原理解释的是 ( ) A.用排饱和食盐水法收集Cl 2B. 温度控制在500℃有利于合成氨反应C.打开碳酸饮料会有大量气泡冒出D.工业制取金属钾 Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K 成蒸气从反应混合物中分离出来3.右图曲线a 表示放热反应 X(g)+Y(g) Z(g)+M(g)+N(s) 进行过程中X 的转化率随时间变化的关系。
若要改变起始条件,使反应过程按b 曲线进行,可采取的措施是 ( )A .升高温度B .加大X 的投入量C .缩小容器的容积D .增大容器的体积4.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g)+Q ,达到平衡后测得A 气体的浓度为0.5mol ·L -1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A 的浓度为0.3mol ·L -1。
则下列叙述正确的是 ( )A .平衡向右移动B .x+y>zC .B 的转化率提高D .C 的体积分数增加5.往一体积不变的密闭容器中充入H 2和I 2,发生反应H 2(g)+I 2(g)===2HI(g)+Q ,当达到平衡后,t 0时改变反应的某一条件(混合气体总物质的量不变...........),且造成容器内压强增大,下列说法正确的是 ( )A .容器内气体颜色变深,平均相对分子质量变小B .平衡不移动,混合气体密度增大C .改变条件前后,速度图象为(如右图)D .H 2转化率增大,HI 平衡浓度变小 6.对于可逆反应,A 2(g)+3B 2(g) 2AB 3(g )(正反应放热),下列图像不正确的是 ( )7.某体积可变的密闭容器,盛有适量的A 和B 的混合气体,在一定条件下发生反应:A+3B 2C 若维持温度和压强不变,当达到平衡时,容器的体积为V 升,其中C 气体的体积占10%,下列推断正确的是( )①原混和气体的体积为1.2V 升 ②原混和气体的体积为1.1V 升; ③反应达平衡时气体A 消耗掉0.05V 升; ④反应达平衡时气体B 消耗掉0.05V 升;A .②③B .②④C .①③D .①④ 8.在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是 ( )(1)C 的生成速率与C 的分解速率相等;(2)单位时间内amol A 生成,同时生成3amol B ;(3)A 、B 、C 的浓度不再变化;(4)混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amol A ,同时生成3amol B ;(7)A 、B 、C 的分子数目比为1:3:2。
化学平衡练习题【例1】将3 mol A与1 mol B混合于一体积可变得密闭容器P中,以此时得温度、压强与体积作为起始条件,发生了如下反应: 3A(g)+B(g) 2 C(g)+D(g)达到平衡时C得浓度为w mol·L-1。
回答⑴~⑸小题:(1)保持温度与压强不变,按下列四种配比充入容器P中,平衡后C得浓度仍为w mol·L-1得就是( )(A)6 mol A+2 mol B(B)3 mol A+1 mol B十2 mol C,(C)2 mol C+1 mol B+1 mol D(D)1 mol C+2mol D(2)保持原起始温度与体积不变,要使平衡后C得浓度仍为w mol·L-1,应按下列哪种配比向容器Q中充入有关物质( )(A)3 mol A+1 mol B(B)4 mol C十2 mol D(C)1、5 mol A+0、5mol B+1 mol C +0、5 mol D(D)以上均不能满足条件,(3)保持原起始温度与体积不变,若仍按3 mol A与1 mol B配比在容器Q中发生反应,则平衡时C得浓度与w rml·L-1得关系就是( )(A)>w(B)<w(C)= w(D)不能确定(4)将2 mol C与2 mol D按起始温度与压强充入容器Q中,保持温度与体积不变,平衡时C得浓度为V mol·L-1,V与w与叫得关系就是( )(A) V>w(B) V<w(C) V=w(D)无法比较(5)维持原起始温度与体积不变,按下列哪种配比充入容器Q可使平衡时C得浓度为V mol·L-1 ( )(A)1 mol C+0、5 m01 D .(B)3 mol A+2 mol B(C)3 mol A+1 mol B+1 mol D(D)以上均不能满足条件解析⑴略:答案为(A)⑵因容器P得体积可变,且正反应就是体积缩小得反应,故相当于加压.而现在容器Q体积不变,条件不同了,不属等效平衡,无法判断.答案为(D).⑶本题所述条件相当于减压,平衡向逆反应方向移动,C得浓度降低.答案为(B).⑷温度、体积不变时2mol C与1 mol D反应与3 mol A与1 mol B相当,属等效平衡.再加1 mol D时平衡将向左移动,V<w。
化学平衡练习题一、选择题1. 在一个密闭容器中进行如下反应:A(g) + 2B(g) ⇌ 3C(g),若A 的浓度增加,平衡将如何移动?A. 向左移动B. 向右移动C. 不移动D. 无法确定2. 反应N2(g) + 3H2(g) ⇌ 2NH3(g)的平衡常数Kp与温度T的关系是什么?A. 温度升高,Kp增大B. 温度升高,Kp减小C. 温度降低,Kp增大D. 温度降低,Kp减小3. 某化学反应的正反应是放热反应,当温度升高时,下列哪个说法是正确的?A. 正反应速率增加B. 正反应速率减小C. 逆反应速率增加D. 正反应速率和逆反应速率都减小4. 对于一个可逆反应,如果增加反应物的浓度,平衡将如何移动?A. 向左移动B. 向右移动C. 不移动D. 无法确定5. 根据勒夏特列原理,当一个处于平衡状态的系统受到外部条件的改变时,系统将如何调整以减少这种改变的影响?A. 向吸热方向移动B. 向放热方向移动C. 向生成物方向移动D. 向反应物方向移动二、填空题6. 化学平衡状态是指反应物和生成物的浓度保持_________的状态。
7. 一个化学反应的平衡常数Kc表示在平衡状态下,生成物浓度的_________与反应物浓度的_________之比。
8. 如果一个反应的平衡常数Kc很大,这意味着_________。
9. 一个反应的平衡常数Kp与Kc之间的关系是Kp=Kc(RT)^_________,其中R是_________常数,T是温度。
10. 勒夏特列原理指出,当一个处于平衡状态的系统受到外部条件的改变时,系统将_________以减少这种改变的影响。
三、简答题11. 解释为什么在某些情况下,增加反应物的浓度可以增加生成物的产量,但在其他情况下则不能。
12. 描述如何通过改变温度来影响一个放热反应的化学平衡,并解释其原因。
13. 说明为什么在化学反应中,平衡常数是一个重要的参数,它如何帮助我们理解反应的自发性。
化学平衡习题及答案【篇一:第五章__化学平衡习题和答案】xt>1. 对于化学平衡, 以下说法中不正确的是(a) 化学平衡态就是化学反应的限度 (b) 化学平衡时系统的热力学性质不随时间变化 (c) 化学平衡时各物质的化学势相等 (d) 任何化学反应都有化学平衡态答案:c。
正确的说法应为??bb?b?02. 下面的叙述中违背平衡移动原理的是3.要使一个化学反应系统在发生反应后焓值不变, 必须满足的条件是 (a) 温度和内能都不变 (b) 内能和体积都不变5.已知反应 2nh3 = n2 + 3h2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 n2 + 3/2 h2 = nh3 的标准平衡常数为:(a) 4 (b) 0.5 (c) 2 (d) 1 答案:c。
(a) rgm? 变负,反应更完全 (b) kp? 变大,反应更完全 (c) kp? 变小,反应更不完全(d)无法判断答案:c7.对于气相反应,当体系总压力p变化时(a) 必须低于409.3℃(b) 必须高于409.3k (c) 必须低于409.3k (d) 必须等于409.3k 答案:c9.某化学反应在298k时的标准吉布斯自由能变化为负值,则该温度时反应的kp?将是:?(a)kp?= 0(b) kp? 0(c) kp 1(d) 0 kp? 1 答案:c。
根据?rgm??rtlnkp。
?$$布斯自由能为:-1---1003.168?,再加上液态水的标准生成吉布斯自由能?fgm即可。
11.在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是:?(a) ?rgm(b)kp(c) ?rgm(d) ?rhm 答案:c。
12.某温度时,nh4cl(s)分解压力是p? ,则分解反应的平衡常数 kp? 为: (a) 1(b) 1/2(c) 1/4(d) 1/8答案:c。
某温度不,固体分解为气体产物的平衡总压称为该固体的分解压力。
第二章 化学平衡练习题(含解析)一、选择题1.在一个密闭容器中进行反应:2SO 2(g)+O 2(g) 2SO 3(g)已知反应过程中某一时刻,SO 2、O 2、SO 3分别是0.2mol/L 、0.1mol/L 、0.2mol/L ,当反应达到平衡时,可能存在的数据是( )A .SO 2为0.4mol/L ,O 2为0.2mol/LB .SO 2为0.25mol/LC .SO 2、SO 3(g)均为0.15mol/LD .SO 3(g)为0.4mol/L2.I 2在KI 溶液中存在下列平衡:I 2(aq)+I -(aq)I 3-(aq) 某I 2、、KI 混合溶液中,I 3-的物质的量浓度c(I 3-)与温度T 的关系如图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是A . 反应 I 2(aq)+I -(aq)I 3-(aq)的△H>0 B .若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2C .若反应进行到状态D 时,一定有v 正>v 逆D .状态A 与状态B 相比,状态A 的c(I 2)大3.可逆反应H 2(g)+I 2(g) 2HI(g)达到平衡时的标志是( )A. 混合气体密度恒定不变B. 混合气体的颜色不再改变C. H 2、I 2、HI 的浓度相等D. I 2在混合气体中体积分数不变4.在一定温度下的定容密闭容器中,取一定量的A 、B 于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是( )A .混合气体的压强B .混合气体的密度C .C 、D 的物质的量的比值 D .气体的总物质的量5.在一真空密闭容器中,通入一定量气体A .在一定条件下,发生如下反应:2A(g) B(g) + x C(g),反应达平衡时,测得容器内压强增大为P %,若此时A 的转化率为a %,下列关系正确的是( )A .若x=1,则P >aB .若x=2,则P <aC .若x=3,则P=aD .若x=4,则P≥a6.在一定体积的密闭容器中放入3L 气体R 和5L 气体Q ,在一定条件下发生反应:2R (g )+ 5Q (g ) 4X (g ) + nY (g )反应完全后,容器温度不变,混合气体的压强是原来87.5%,则化学方程式中的n 值是( )A 、2B 、3C 、4D 、57.在1L 的密闭容器中通入2molNH 3,在一定温度下发生下列反应:2NH 3N 2+3H 2,达到平衡时,容器内N 2的百分含量为a%。
化学平衡练习题【例1】将3 mol A和1 mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生了如下反应:3A(g)+B(g) 达到平衡时C的浓度为w mol·L-1。
回答⑴~⑸小题:(1)保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为w mol·L-1的是( )(A)6 mol A+2 mol B(B)3 mol A+1 mol B十2 mol C,(C)2 mol C+1 mol B+1 mol D(D)1 mol C+2mol D(2)保持原起始温度和体积不变,要使平衡后C的浓度仍为w mol·L-1,应按下列哪种配比向容器Q中充入有关物质( )(A)3 mol A+1 mol B(B)4 mol C十2 mol D(C)1.5 mol A+0.5mol B+1 mol C +0.5 mol D(D)以上均不能满足条件,(3)保持原起始温度和体积不变,若仍按3 mol A和1 mol B配比在容器Q中发生反应,则平衡时C的浓度和w rml·L-1的关系是( )(A)>w(B)<w(C)= w(D)不能确定(4)将2 mol C和2 mol D按起始温度和压强充入容器Q中,保持温度和体积不变,平衡时C的浓度为V mol·L-1,V与w和叫的关系是( )(A) V>w(B) V<w(C) V=w(D)无法比较(5)维持原起始温度和体积不变,按下列哪种配比充入容器Q可使平衡时C的浓度为V mol·L-1 ( )(A)1 mol C+0.5 m01 D .(B)3 mol A+2 mol B(C)3 mol A+1 mol B+1 mol D(D)以上均不能满足条件解析⑴略:答案为(A)⑵ 因容器P 的体积可变,且正反应是体积缩小的反应,故相当于加压.而现在容器 Q 体积不变,条件不同了,不属等效平衡,无法判断.答案为(D).⑶本题所述条件相当于减压,平衡向逆反应方向移动,C 的浓度降低.答案为(B). ⑷温度、体积不变时2mol C 和1 mol D 反应与3 mol A 和1 mol B 相当,属等效平 衡.再加1 mol D 时平衡将向左移动,V<w 。
1、在200 o C下的体积为V的容器中,下列吸热反应达到平衡态,通过以下各种措施,反应NH4HS(s)=NH3(g)+H2S(g)再达到平衡态时,NH3的分压跟原来相比,有何变化?A、增加氨气;B、增加硫化氢气体;C、增加固体NH4HS;D、增加温度;E、加入氩气以增加总压;F、把反应容器的体积增加到2 V。
2、PCl5的分解作用为:PCl5(g) ===PCl3(g) +Cl2(g),在523.2 K、101325 Pa下反应到达平衡后,测得平衡混合物的密度为2.695 kg·m–3,试计算该反应在523.2 K下的标准平衡常数。
M(PCl5)=208.23、在1000 K时,理想气体反应CO(g)+H2O(g)===CO2 (g) + H2(g)的KΦ=1.43。
设有一反应系统,各物质的分压分别为p(CO)=0.500 MPa,p(H2O)=0.200 MPa,p(CO2)=0.300 MPa,p(H2)=0.300 MPa。
试计算:(1)此反应条件下的Δr G m,并说明反应的方向。
(2)已知在1200 K时KΦ=0.73,试判断反应的方向。
(3)求该反应在1000~1200 K范围内的Δr H mΦ和Δr S mΦ。
4、在机械制造业中,为了消除金属制品中的残余应力和调整其内部组织,常采用有针对性的热处理工艺,以使制品机械性能达到设计要求。
CO和CO2的混合气氛用于热处理时,调节CO/CO2既可成为氧化性气氛(脱除钢制品中的过量碳),也可成为还原性气氛(保护制品在处理过程中不被氧化或还原制品表面的氧化膜)。
反应式为Fe(s)+CO2(g)=FeO (S)+CO(g)。
已知在1673 K,2CO(g)+O2(g)=2CO2(g),△r G mΦ=–278.4 kJ·mol-1;2Fe(s)+O2(g)=2FeO(s),△r G mΦ=–311.4 kJ·mol-1 混合气氛中含有CO、CO2及N2(N2占1.00%,不参与反应)(1)CO/CO2比值为多大时,混合气氛恰好可以防止铁的氧化?(2)此混合气氛中CO和CO2各占多少百分比?(3)混合气氛中CO和CO2的分压比、体积比、物质的量比及质量比是否相同?若相同,写出依据,若不同,请说明相互换算关系。
(4)若往由上述气氛保护下的热处理炉中投入一定的石灰石碎片,如气氛的总压不变(设为101.3 kPa),石灰石加入对气氛的氧化还原性有何影响?已知298.15 K时碳酸钙分解反应的Δr H mΦ=179.2 kJ·mol-1;Δr S mΦ=160.2 J·K-1·mol-1。
5、若用298 K液态水与氧作用不能形成H2O2,但湿的锌片与氧作用却能产生H2O2(耦合反应)。
(1)分析反应H2O(l)+1/2 O2(g)==H2O2(l)不能自发进行的原因;(2)通过计算说明上述反应能不能通过改变温度而实现。
(3)加入锌就能使该过程实现,写出总反应的化学反应方程式。
(4)分析为什么加入锌就能使该过程实现。
6、碘钨灯因在灯内发生下列反应:W(s)+I2(g)=WI2(g),碘蒸气与扩散到内壁的钨会反应生成碘化钨气体,后者扩散到钨丝附近会因钨丝的高温而分解出钨重新沉积到钨丝上,从而可延长灯丝的寿命。
已知在298 K时:W(s) I2(g) WI2(g)Δf G mθ/kJ∙mol-10 19.327 -8.37S mθ/J∙mol-133.5 260.69 251(1)设玻璃外壁的温度为623 K,计算上述反应的Δr G mθ(623 K)。
(2)估算WI2(g)在钨丝上分解的最低温度。
7、560℃时,在恒容闭容器中发生如下反应:C(s)+H2O(g)=CO(g)+H2(g)(正反应吸热)(1)请写出上述反应的平衡常数表达式,若温度升高,则平衡常数_____(填―变大‖、―变小‖或―不变‖)。
(2)若560℃时,在恒容密闭容器中,若起始浓度[H2O]=0.03 mol/L,当5秒钟时,测得[H2O]=0.01 mol/L,则前5秒钟H2的平均反应速率V(H2)=________________。
(3)能判断该反应是否达到化学平衡状态的依据是_____________。
A 容器中压强不变,B 混合气体中密度不变,C V正(H2)=V正(H2O)D c (CO)=c (H2)(4)达到平衡后且恒容情况下,往容器中充入适量的H2S气体,重新达到平衡时,H2O的反应速率将______(填―增大‖、―减小‖或―不变‖),理由是。
8、在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g)=2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。
若相同条件下,达到平衡时混合物中各组分的百分含量不变。
回答下列问题:(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数KΦ值越大,表明建立平衡时___________(填序号)A N2的转化率越高B NH3的产量越大C 正反应进行得越彻底D 化学反应速度越快(3)a与b的关系是:a b(填>、<、=)9、2007年第6题:在给定的实验条件下,一元弱酸HA在苯(B)和水(W)中的分配系数K D=[HA]B/[HA]w=1.00。
已知水相和苯相中HA的分析浓度分别为3.05⨯10–3和3.96⨯10–3 mol/L。
在水中,HA发生离解,K a=1.00⨯10–4;在苯中发生二聚生成(HA)2。
1、计算水相中各物种的浓度及pH值。
2、计算HA的苯相中的二聚平衡常数。
3、已知HA中有苯环,1.00 g HA含有3.85⨯1021个分子,给出HA的化学名称。
4、解释HA在苯中发生二聚的原因,画出二聚体的结构。
10、06年第五题:配置KI(0.100 mol/L)-I 2的水溶液,用0.100 mol/L Na 2S 2O 3标准溶液测得c(I 2)=4.85⨯10–3 mol/L 。
量取50.0 mL KI-I 2溶液和50.0 mL CCl 4溶液振荡达到平衡,分液后测得CCl 4相中c(I 2)=2.60⨯10–3 mol/L 。
已知实验条件下CCl 4溶液从水溶液中萃取I 2的分配比为85:1。
求水溶液中I 2+I –=I 3–的平衡常数。
11、05年第1题:1、已知室温下用CCl 4萃取I 2的分配系数为c I 2(CCl 4)/c I 2(H 2O)=84,预计用CCl 4萃取AtI 的分配系数c AtI(CCl 4)/c AtI(H 2O) 84(填 >, < 或 =);理由是 。
2、已知I 2 + I - ⇌ I 3- 的平衡常数K = 800,可推断AtI + I - ⇌ AtI 2-的平衡常数K 800(填 >, < 或 =); 依据是: 。
12、03年第10题:美国Monsando 公司生产了一种除草剂,结构如下图,酸式电离常数如下: p K a1 0.8, p K a2 2.3 , p K a3 6.0 , p K a4 11.0。
与它配套出售的是转基因作物(大豆、棉花、玉米、油菜籽)的种子,转入了抗御该除草剂的基因,喷洒该除草剂后其他植物全部死光,唯独这些作物茁壮成长,由此该除草剂得名Roundup ,可意译为―一扫光‖。
这四种转基因作物已在美国大量种植,并已向我国和巴西等国大量出口,但欧洲至今禁止进口。
1、Roundup 为无色晶体,熔点高达200 o C ,根据如上结构式进行的分子间作用力(包括氢键)的计算,不能解释其高熔点。
试问:Roundup 在晶体中以什么型式存在?写出它的结构式。
2、写出其1、2、3级电离方程式。
13、下列四种物质:(A)CH 3COOH (B)CH 2NH 2COOH (C)CH 2(OH)COOH (D)CH 2ClCOOH 1、它们的熔点高低顺序是 > > > , 简述其理由 。
2、其pk a 值由大到小的顺序为 > > > , 简述理由 。
14、乙酸的分子量为60。
乙酸熔点之所以比较高是因为容易形成二聚物的缘故。
这一反应可以表示为2HAc=(HAc)2在0℃,乙酸的密度为1.05 g/ml ,上述反应的平衡常数K=15.8。
(1)画出乙酸二聚物的结构 。
(2)计算在0 ℃,100%乙酸中单分子状态所占的百分数。
15、室温下,MgF 2在水中的溶解度为1.29×10–3 mol.L –1,试计算溶液中F –、Mg 2+及MgF +的浓度,并计算MgF 2的溶度积。
已知Mg 2++F —==MgF +的平衡常数为63.0,计算时不需考OH C OC NC POH OOHH 2H 2H虑HF的生成。
16、稀有气体氙Xe和氟F2反应可生成XeF2、XeF4和XeF6。
在523 K和673 K反应的平衡常数K如下:①Xe(g)+F2(g)=XeF2(g) K p(523 K)=8.80×104K p(673 K)=3.60×102②Xe(g)+2F2(g)=XeF4(g) K p(523 K)=1.07×108K p(673 K)=1.98×103③Xe(g)+3F2(g)=XeF6(g) K p(523 K)=1.01×108K p(673 K)=36.0(1)指出在所给温度下,最有利的和最不利的反应。
(2)按①式制备XeF2,产物中必有XeF4。
为了减少XeF2中XeF4的含量应采取什么措施?(3)今拟制取分压为1 atm(1.013×105 Pa)的XeF2,其中XeF4的含量须低于1%。
试计算起始的Xe︰F2分压比值至少为多少?(提示:可利用Xe(g)+XeF4(g)=2XeF2(g)减少XeF4的生成)17、已知240 K时液氨的自电离常数及相应的平衡常数:NH3+NH3=NH4++NH2-K1=1.0×10-33又知氨水的电离及电离常数为:NH3+H2O=NH4++OH-K2=1.8×10-5(1)试计算NH2-+H2O=NH3+OH-的平衡常数。
(2)仔细想来,以上计算是错误的,请指出错在何处。
18、密闭钢制容器中,NH4I固体在一定条件下首先发生分解反应并达平衡:①NH4I(s)=NH3(g)+HI(g),然后缓慢进行反应②2HI(g)=H2(g)+I2(g),亦达平衡。
它们的平衡常数K(K只随温度的变化而变化)分别为K1与K2,式中p指平衡时气体的分压。