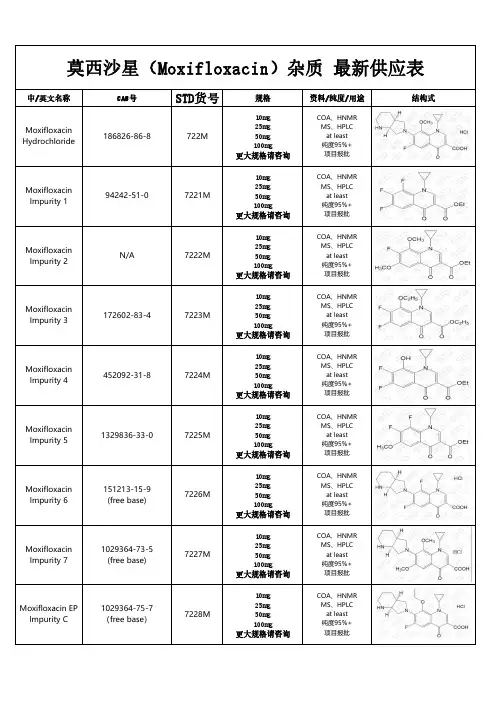
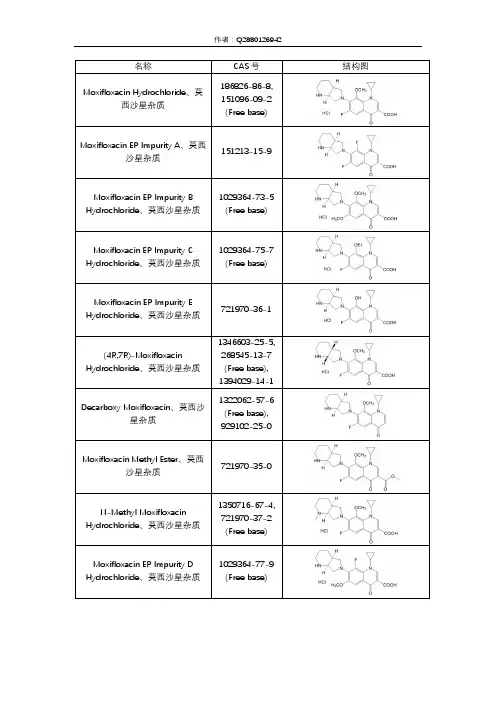
莫西沙星杂质汇总
- 格式:pdf
- 大小:145.12 KB
- 文档页数:1

. 225 .文章编号:1001-8689(2021)03-0225-07收稿日期:2020-12-03基金项目:国家科技重大专项-重大新药创制“药物一致性评价关键技术与标准研究”课题(No. 2017ZX09101001)作者简介:周小华,女,生于1982年,硕士,副主任药师,研究方向:计算药物分析,E-mail:*************** #并列第一作者:陈瑶,男,生于1995年,在读硕士研究生,研究方向:药物分析,E-mail:*****************通讯作者,袁耀佐,E-mail:**********************;柳文媛,E-mail:**********************第一作者:周小华,女,2008年毕业于中国药科大学计算药物分析专业,现就职于江苏省食品药品监督检验研究院化学二室,副主任药师。
主要从事抗生素药品检验、质量标准起草和复核工作以及药品的快速检验研究工作。
通讯作者:袁耀佐,男,博士,主任药师。
江苏省食品药品监督检验研究院检院化学二室主任。
中国药科大学、南京中医药大学和南京师范大学硕导,江苏省产业教授,USP(BIO4)委员,中国药学会药分及抗生素专业委员会委员等。
共同第一作者:陈瑶,男,在读硕士研究生,就读于中国药科大学药学院药学专业。
参与2019年国家药品评价性抽验工作。
通讯作者:柳文媛,女,博士,教授,博士生导师。
从事药物仪器分析研究。
主持国家自然科学基金项目两项,入选江苏省六大人才高峰计划。
近年来以通讯作者在Analytical Chemical , Journal of Chromatography A , Biomaterials 等发表SCI 论文60余篇。
盐酸莫西沙星注射液的质量分析周小华1,2 陈瑶1,4 ,# 赵恂1,2 庞庆林1,2 张玫1,2 胡昌勤3 袁耀佐1,2,* 柳文媛4,*(1 江苏省食品药品监督检验研究院,南京 210019;2 国家药品监督管理局化学药物杂质谱研究重点实验室,南京 210019;3 中国食品药品检定研究院,北京 102629;4 中国药科大学药物分析系,南京 210009)摘要:目的 评价盐酸莫西沙星注射液的质量现状。

盐酸莫西沙星(Ph Eur monograph 2254) NHH F2CO HNH HCl ·N O O 3CHC 21H 25ClFN 3O 4(C 21H 24FN 3O 4·HCl) 分子量:437.9 [名称]1-环丙基-6-氟-8-甲氧基-7-[(4a S ,7a S )-八氢-6H -吡咯并[3,4-b ]吡啶-6-基]-4-氧代-1,4-二氢-3-喹啉羧酸盐酸盐[含量] 98%~102%(按无水物计)。
[产品] 生产方法由最终产品的对映体纯度来验证证明。
[性质] 外观 浅黄色或黄色粉末或固体,会略微吸潮。
溶解度 略溶于水,微溶于乙醇(96%),几乎不溶于丙酮。
[鉴别]A. 比旋光度(见测试)。
B .红外吸收分光光度法(2.2.24)与莫西沙星盐酸盐对照品的红外谱图比较。
C .将50 mg 样品溶于5 ml 水中,加入1 ml 的稀硝酸,混合,静置5分钟后过滤,滤液显示氯化物反应(2.3.1)。
[检查]溶液外观检查 测试溶液不得比参考悬浮液Ⅱ(2.2.1)更白,并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
如果要生产羟嗪剂型,溶液须澄清并且不得比参考液GY 2(2.2.2 ,方法Ⅱ)的颜色更深。
PH 值测试溶液: 将1.0 g 样品溶于20 ml 稀氢氧化钠溶液中。
PH (2.2.3) 3.9~4.6。
将0.10 g 样品溶于50 ml 不含二氧化碳的水中。
比旋光度(2.2.7)-125 ~ -138 (按无水物质计)。
将0.200 g样品溶于20.0 ml 乙腈与水的混合溶液(体积相等)中。
有关物质液相色谱法(2.2.29),避光测试。
溶液A:将0.50 g四丁基硫酸氢铵和1.0 g、磷酸氢二钾溶于500ml水中,再加2ml磷酸和0.050g无水亚硫酸钠,然后用水稀释至1000ml。
供试溶液(a):精确称取50.0mg样品溶于溶液A中,并用溶液A稀释至50ml。

莫西沙星母核:1-环丙基-6,7-二氟-1,4-二氢-8-甲氧基-4-氧代-3-喹啉羧酸(乙酯)
分子式: C16H15F2NO4
外观淡色至白色粉末
红外鉴定与标准IR图谱一致
含量≥99.0%(HPLC)
单个杂质≤1.0%
熔点 182~186℃中国药典2005年版二部附录Ⅵ C
燃烧残渣≤0.2%中国药典2005年版二部附录Ⅷ N
干燥失重≤0.5%中国药典2005年版二部附录Ⅷ L
保质期:36 月
莫西沙星侧键::(S,S)-2,8-二氮杂双环[4,3,0]壬烷
分子式C7H14N2
分子量:126.16
含量:99.5%以上。
包装规格:5公斤铝听。
性状:无色至浅棕色液体
用途:莫西沙星中间体
莫西沙星:1-环丙基-7-(S,S-2,8-二氮杂双环[4.3.0]壬烷-8-基)-6-氟-8-甲氧-4-氧代-1,4-二氢-3-喹啉羧酸
盐酸莫西沙星:1-环丙基-7-(S,S-2,8-重氮-二环[4.3.0] non-8-yl)-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物。
分子式:C21H24FN3O4·HCI,分子量:437.9。

HPLC法测定盐酸莫西沙星含量及其有关物质马好斌【摘要】通过HPLC法检测盐酸莫西沙星的含量与和它有关的物质,色谱柱是Sepax BR-C18 (250 mm × 4.6 mm,5 μm),流动相是甲醇-四丁基硫酸氢铵磷酸缓冲液(28:72),检测流速是1.3 ml/min,波长是293 nm,柱温是45℃.在已建立的色谱状况中,盐酸莫西沙星能很好的和各杂质分离开来,当盐酸莫西沙星的浓度处在38.55~57.82μg/ml的范围里时,其和峰面积可以保持一个良好的线性关系(r=0.9998),检测的最低限是0.006 25μg/ml,定量限是0.025 μg/ml.经研究发现,建立起的方法有较好的专属性,极易操作,能够在测定盐酸莫西沙星的含量和相关物质含量时使用.【期刊名称】《中国现代药物应用》【年(卷),期】2012(006)023【总页数】2页(P119-120)【关键词】HPLC法测定;盐酸莫西沙星;物质【作者】马好斌【作者单位】454000,焦作煤业(集团)有限责任公司中央医院【正文语种】中文莫西沙星(moxifloxacin)是德国的拜耳公司研发出来的第四代的氟喹诺酮类超广谱抗生素,第三代的抗革兰阴性菌的活性被它保留了下来,它的8-甲氧基部分使抗革兰阳性菌的活性得到了显著提高,尤其是使对厌氧菌的抗菌活性得到了改善[1]。
在1999年的时候德国首次上市,在2002年的时候在我国得以上市,拜复乐是其商品名[2]。
因为其能快速吸收,且在体内的分布非常的广,较之于β-内酰胺类抗生素,在临床上治疗相当一部分的致病菌时莫西沙星的的疗效要更好一些[3]。
2009年被英国药典收载的关于莫西沙星的质量标准里需要逐一的控制多个相关物质,结构图详见下图1,一般使用的是HPLC的分析方法,然而根据其标准借助于苯基硅烷键合硅胶柱来测定,在对峰定位对照品里的五个杂质进行分离时,分离度并不理想,所以笔者构建了通过常用的十八烷基硅烷键合硅胶作填充剂的HPLC的分析方法,该方法有较好的专属性,极易操作,能够在测定盐酸莫西沙星的含量和相关物质含量时使用[4]。

盐酸莫西沙星理化性质与质量指标1.1 盐酸莫西沙星的概况盐酸莫西沙星通用名:盐酸莫西沙星片;商品名:拜复乐(Avelox);其他名:Bay-12-8039、Avelox®、Avalox®、Actira®、Octegra®、Proflox;英文名:Moxifloxacin Hydrochloride Tablets;Moxifloxacin Hydrochloride;(1'S,6'S )-1-Cyclopropyl-7-(2,8-diazabicyclo[4.3.0]non-8-y1)-6-fluoro-8-methoxy-4-oxo-1,4 -dihydroquinoline-3-carboxylic acid hydrochloride;化学名:1-环丙基-7-{S,S-2,8-重氮-二环[4.3.0] non-8-yl}-6-氟-8-甲氧-1,4-二氢-4-氧-3-喹啉羧酸氢氯化物;(1'S,6'S)-1-环丙基-7-(2,8-二氮杂双环[4.3.0]壬烷-8基)-6-氟-8-甲氧基-4-氧代-二氢喹啉-3-羧酸盐酸盐;分子式:C21H24FN3O4·HCl;分子量:437.9;CAS:186826-86-8;图1.1 盐酸莫西沙星结构式盐酸莫西沙星是广谱和具有抗菌活性的8-甲氧基氟喹诺酮类抗菌药。
用于治疗社区获得性肺炎、慢性支气管炎急性发作、泌尿生殖系感染、急性鼻窦炎。
疗效显着,不良反应小。
适应症为治疗患有上呼吸道和下呼吸道感染的成人。
盐酸莫西沙星是德国拜耳公司研制的超广谱喹诺酮类药物,商品名为“拜复乐”,1999年9月在德国上市,同年12月在美国获 FDA批准上市。
2002年销售额达到3.33亿美元,进入了2002年世界十大畅销抗生素药物,列第8位。
德国拜耳公司和美国先灵葆雅公司的产品在2006年的世界市场销售额高达8.22 亿美元,在全球畅销处方药排名第129位;2007年世界市场销售额高达 10.34亿美元,比上年增长 25.8%;2008年上半年为5.75亿美元。

HPLC法测定盐酸莫西沙星葡萄糖注射液中有关物质的含量莫西沙星作为超广谱氟喹诺酮类抗菌药物,作用于细菌的两个靶位即拓扑异构化酶Ⅱ和Ⅳ,所以本品不仅对敏感的细菌有效,而且对耐药菌株也有高度活性。
临床上对多种感染显示优良的治疗效果[1]。
近几年,由于空气污染等多种原因,我国呼吸系统感染发病率直线上升,本品在此领域内有显著优势,需求量稳步攀升。
本品已逐渐成为治疗呼吸道感染的重要药物。
盐酸莫西沙星的进口产品为拜复乐注射液,中文名称为“盐酸莫西沙星氯化钠注射液”[2]由于德国拜耳的专利限制,目前国内尚无原料药及制剂生产,国内上市品种为拜耳医药的盐酸莫西沙星片及盐酸莫西沙星氯化钠注射液[3-4],尚无盐酸莫西沙星葡萄糖注射液生产,更无关于其有关物质的测定的文献报道。
本文采用公司研制的盐酸莫西沙星葡萄糖注射液,用反相高效液相色谱法测定盐酸莫西沙星的有关物质,结果证明该法专属性强,重现性好,为制剂的质量控制提供了方法学依据。
1 仪器与试药1.1 仪器戴安U3000高效液相色谱仪,检测器:VWD检测器,工作站:变色龙软件;LC-10AT 电子天平。
1.2 试药溶剂:0.50g四丁基硫酸氢铵和1.0g磷酸二氢钾溶于500mL水,加2mL磷酸和0.050g无水亚硫酸钠,加水稀释至1000mL。
杂质对照品:已知杂质A,B,C,D,E样品:自制的盐酸莫西沙星葡萄糖溶液。
2 方法与结果2.1 色谱条件色谱柱:BDS HYPERSIL 4.6mm×250mm,5μm;流动相:甲醇(0.50g/L 四丁基硫酸氢铵,1.0g/L磷酸二氢钾和3.4g/L磷酸混合溶液;28∶72)。
检测波长:293nm;柱温:40℃;流速:1.5mL/min;进样量:20μL;理论板数不低于3500。
2.2 供试品溶液和对照溶液的制备称取供试品3mL,置于10mL棕色容量瓶中,加溶剂稀释至刻度,摇匀,作为供试品溶液;精密量取1mL,置于10mL棕色容量瓶中,加溶剂稀释至刻度,摇匀,精密量取1mL,置于100mL棕色容量瓶中,加溶剂稀释至刻度,摇匀,作为对照溶液。
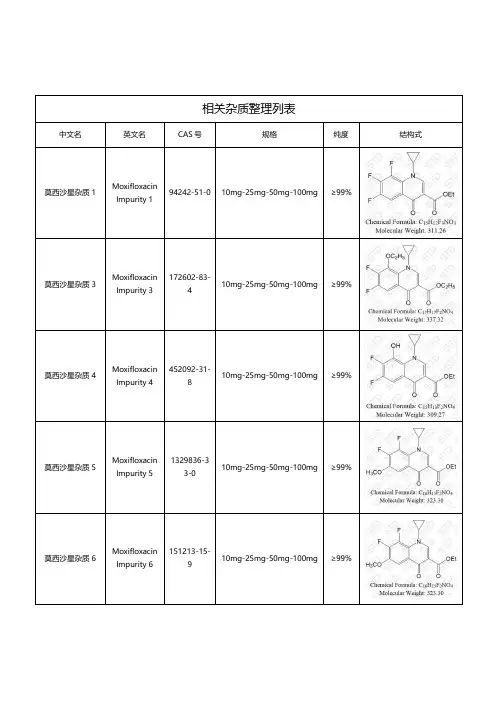
相关杂质整理列表中文名英文名CAS 号规格纯度结构式莫西沙星杂质1MoxifloxacinImpurity 194242-51-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质3MoxifloxacinImpurity 3172602-83-410mg-25mg-50mg-100mg ≥99%莫西沙星杂质4MoxifloxacinImpurity 4452092-31-810mg-25mg-50mg-100mg ≥99%莫西沙星杂质5MoxifloxacinImpurity 51329836-33-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质6MoxifloxacinImpurity 6151213-15-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质7MoxifloxacinImpurity 71029364-73-510mg-25mg-50mg-100mg ≥99%莫西沙星杂质8(莫西沙星EP 杂质C)Moxifloxacin Impurity 8(MoxifloxacinEP Impurity C)1029364-75-710mg-25mg-50mg-100mg ≥99%莫西沙星杂质9MoxifloxacinImpurity 91029364-77-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质10MoxifloxacinImpurity 101292904-74-510mg-25mg-50mg-100mg ≥99%莫西沙星杂质11MoxifloxacinImpurity 11268545-13-710mg-25mg-50mg-100mg ≥99%莫西沙星杂质12MoxifloxacinImpurity 12139693-52-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质13MoxifloxacinImpurity 13112811-71-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质15MoxifloxacinImpurity 15147459-51-6&151213-42-210mg-25mg-50mg-100mg ≥99%莫西沙星杂质16MoxifloxacinImpurity 16154093-72-810mg-25mg-50mg-100mg ≥99%莫西沙星杂质17(莫西沙星USPRC F)Moxifloxacin Impurity 17(Moxifloxacin USP RC F )1350716-67-410mg-25mg-50mg-100mg ≥99%莫西沙星杂质18MoxifloxacinImpurity 18112811-72-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质19MoxifloxacinImpurity 19112811-70-810mg-25mg-50mg-100mg ≥99%莫西沙星杂质20MoxifloxacinImpurity 2029124-57-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质21MoxifloxacinImpurity 21128740-13-610mg-25mg-50mg-100mg ≥99%莫西沙星杂质22MoxifloxacinImpurity 22128740-14-710mg-25mg-50mg-100mg ≥99%莫西沙星杂质23MoxifloxacinImpurity 2318184-75-310mg-25mg-50mg-100mg ≥99%莫西沙星杂质26MoxifloxacinImpurity 261322062-57-610mg-25mg-50mg-100mg ≥99%莫西沙星杂质27MoxifloxacinImpurity 27172426-88-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质29MoxifloxacinImpurity 29169533-55-510mg-25mg-50mg-100mg ≥99%莫西沙星杂质30MoxifloxacinImpurity 30169533-56-6&158060-81-210mg-25mg-50mg-100mg ≥99%莫西沙星杂质31MoxifloxacinImpurity 31112811-66-210mg-25mg-50mg-100mg ≥99%莫西沙星杂质32MoxifloxacinImpurity 321117-37-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质34MoxifloxacinImpurity 34721970-35-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质35MoxifloxacinImpurity 351403836-23-610mg-25mg-50mg-100mg ≥99%莫西沙星杂质36MoxifloxacinImpurity 361797982-51-410mg-25mg-50mg-100mg ≥99%莫西沙星杂质39MoxifloxacinImpurity 39151213-45-510mg-25mg-50mg-100mg ≥99%莫西沙星杂质40MoxifloxacinImpurity 40151213-40-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质41MoxifloxacinImpurity 41161594-54-310mg-25mg-50mg-100mg ≥99%莫西沙星杂质42MoxifloxacinImpurity 42112811-65-110mg-25mg-50mg-100mg ≥99%莫西沙星杂质43MoxifloxacinImpurity 43765-30-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质46MoxifloxacinImpurity 461932499-97-210mg-25mg-50mg-100mg ≥99%莫西沙星杂质51MoxifloxacinImpurity 511395056-41-310mg-25mg-50mg-100mg ≥99%莫西沙星杂质57MoxifloxacinImpurity 57151213-39-710mg-25mg-50mg-100mg ≥99%莫西沙星杂质62MoxifloxacinImpurity 62855661-74-410mg-25mg-50mg-100mg ≥99%莫西沙星杂质67MoxifloxacinImpurity 671430075-14-110mg-25mg-50mg-100mg ≥99%莫西沙星杂质68MoxifloxacinImpurity 682085709-73-310mg-25mg-50mg-100mg ≥99%莫西沙星杂质69MoxifloxacinImpurity 691430075-08-310mg-25mg-50mg-100mg ≥99%莫西沙星杂质71MoxifloxacinImpurity 711467586-86-210mg-25mg-50mg-100mg ≥99%莫西沙星杂质75MoxifloxacinImpurity 75141290-02-010mg-25mg-50mg-100mg ≥99%莫西沙星杂质78MoxifloxacinImpurity 781571-13-710mg-25mg-50mg-100mg ≥99%莫西沙星杂质79MoxifloxacinImpurity 79652-11-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质80MoxifloxacinImpurity 80133492-64-510mg-25mg-50mg-100mg ≥99%莫西沙星杂质81MoxifloxacinImpurity 8156113-42-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质82MoxifloxacinImpurity 82652-03-910mg-25mg-50mg-100mg ≥99%莫西沙星杂质83MoxifloxacinImpurity 831201-31-610mg-25mg-50mg-100mg ≥99%莫西沙星杂质84MoxifloxacinImpurity 84551-62-210mg-25mg-50mg-100mg ≥99%莫西沙星杂质85MoxifloxacinImpurity 85116751-24-710mg-25mg-50mg-100mg ≥99%莫西沙星杂质86MoxifloxacinImpurity 8694695-48-410mg-25mg-50mg-100mg ≥99%莫西沙星杂质92MoxifloxacinImpurity 92557-66-410mg-25mg-50mg-100mg ≥99%莫西沙星杂质93MoxifloxacinImpurity 93109966-30-510mg-25mg-50mg-100mg ≥99%莫西沙星杂质96MoxifloxacinImpurity96112811-68-410mg-25mg-50mg-100mg≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD、LGC、TLC、EP、USP、TRC等多个品牌产品,提供上万种标准品对照品,真诚为您服务。

莫西沙星杂质C的合成工艺研究陈善龙;谭娟【摘要】目的合成莫西沙星杂质C,并对合成工艺进行优化.方法以1-环丙基-6,7-二氟-8-甲氧基-4-氧代-1,4-二氢-3-喹啉羧酸为原料依次经历醚键的断裂、螯合与(S,S)-2,8-二氮杂双环[4.3.0]壬烷缩合、最后脱去叔丁氧羰基保护基得到莫西沙星杂质C;对脱甲基试剂、反应温度、缚酸剂、螯合物与底物的投料比和反应时间等条件进行优化,考察了莫西沙星杂质C的总收率及产品质量.结果工艺优化后莫西沙星杂质C总收率为76.3%,并通过核磁共振氢谱和质谱对其结构进行了确证;HPLC 检测产品的纯度大于99%.结论首次报道了莫西沙星杂质C的合成工艺路线,其工艺反应条件温和,操作易行、收率高.本研究为开发莫西沙星杂质C提供了信息和依据.【期刊名称】《中国抗生素杂志》【年(卷),期】2016(041)002【总页数】5页(P117-121)【关键词】莫西沙星杂质C;合成;喹诺酮【作者】陈善龙;谭娟【作者单位】海南省人民医院药学部,海口570311;武汉市第三医院药学部,武汉430060【正文语种】中文【中图分类】R978.1莫西沙星(moxifloxacin,图1),商品名为“拜复乐”,化学名:1-环丙基-6-氟-1,4-二氢-8-甲氧基-7-[(4aS,7aS-八氢-6-H-吡咯并[3,4-b]吡啶-6-基]-4-氧代-3-喹啉羧酸盐酸盐,是1999年德国Bayer公司开发上市的第四代氟代喹诺酮类抗菌药物。
在喹诺酮抗菌药物中,第四代氟代喹诺酮(尤其莫西沙星)无论是在抗菌活性、安全性,还是在抗菌谱和临床应用方面均是最好的[1]。
莫西沙星在治疗上呼吸道和下呼吸道感染等方面有着较好的疗效。
除了保持第三代喹诺酮抗菌活性强、抗菌谱广等优点外,莫西沙星抗菌谱还进一步扩大到支原体、厌氧菌等非典型的病原体,且对革兰阳性菌和肺炎链球菌的活性作用显著强于第三代的环丙沙星。
众多的优点使莫西沙星在临床上正逐渐的代替了第三代喹诺酮类药物环丙沙星,其疗效也越来越被肯定[2-3]。

我们对莫西沙星的四大认识误区
莫西沙星是我们生活中比较常见的一种抗菌药物,与左氧氟沙星同属于氟喹诺酮类。
因其在肺部具有较高的浓度分布,且能广谱覆盖肺部常见的病原菌。
因此,其与左氧氟沙星、吉米沙星等成为“呼吸喹诺酮类”抗菌药物。
然而,即使是日常生活中比较常见的药物,我们对它也并非完全了解。
今天咱们就来盘点我们对莫西沙星的四大认识误区。
误区一、用于尿路感染
与左氧氟沙星药代动力学不同的是,莫西沙星仅有20%经由尿液排泄,而左氧氟沙星高达80%。
因此,临床应用时,不推荐莫西沙星用于尿路感染。
误区二、用于铜绿假单胞菌所致的感染
铜绿假单胞菌是社区获得性肺炎和医院获得性肺炎最常见的革兰阴性菌,但需要留意的是,莫西沙星本身对铜绿假单胞菌并无抗菌活性,不推荐用于铜绿假单胞菌所致的感染。
不得不使用时,可选用同类药物中的左氧氟沙星或者环丙沙星。
误区三、滴注时间过短
莫西沙星滴注时间应当≥90min,如果滴注时间过短,滴速过快时,会出现心律失常,表现为心悸、心动过速等。
误区四、用于未成年人
这主要是由于未成年人软骨尚未发育成熟,而莫西沙星对未成年人的骨骼发育有明显的影响,容易造成骨骼和软骨代谢障碍,尤其是膝关节、髋关节等。
因此,在有可替代药物的情况下,莫西沙星不用于18岁以下的未成年人。