【VIP专享】第7章 合金的相结构与结晶
- 格式:ppt
- 大小:4.12 MB
- 文档页数:6




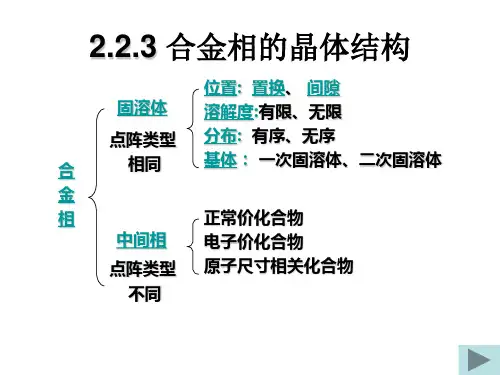
教学课题合金的相结构教学课时 2教学目的让学生了解合金相的概念掌握合金相的分类教学难点合金相的分类教学重点合金相的分类教学方法讲解法教具准备教材教学过程§2.1 固溶体固溶体:以合金某一组元为溶剂,在其晶格中溶入其他组元原子(溶质)后所形成的一种合金相,其特征是仍保持溶剂晶格类型,结点上或间隙中含有其他组元原子。
主要讨论溶剂为纯金属的固溶体。
一、固溶体的分类根据溶质原子在溶剂晶格中所占据的位置:置换固溶体和间隙固溶体;根据溶质原子在溶剂中的固溶能力:有限固溶体和无限固溶体。
固溶度(溶解度):在一定温度和压力下,溶质在固溶体中的浓度有一定限度,该浓度极限称为固溶度。
根据溶质原子在固溶体中的分布是否有规律:无序固溶体和有序固溶体。
二、置换固溶体影响置换固溶体固溶度的主要因素1.晶体结构因素晶体结构相同是组元间形成无限固溶体的必要条件。
2.原子尺寸因素指溶剂、溶质原子半径之差与溶剂原子半径之比,即△r = ∣r A-r B∣/ r A , A-溶剂,B-溶质,△r越小,即组元间原子半径越接近,固溶度越大。
△r<0.14-0.15时,固溶度较大,或形成无限固溶体。
3.电负性因素电负性:原子接受电子形成负离子的能力,即元素得失电子的能力。
易得电子,电负性大。
在周期表中,同一周期元素的电负性从左到右递增;同一族元素的电负性从下到上递增。
两元素电负性越相近,固溶度越大。
两元素电负性相差大,化学亲和力越强,易形成化合物。
4.电子浓度因素电子浓度:各组元价电子总数e与原子总数a之比,即C电子= e/a=[V A(100-X)+V B X]/100V A-溶剂原子价; 100-X-溶剂原子百分数;V A(100-X)-溶剂价电子数;V B-溶质原子价; X-溶质原子百分数; V B X-溶质价电子数.电子浓度对固溶度的影响: 溶剂为一价FCC金属,不同溶质元素的最大固溶度所对应的极限电子浓度均为1.36左右; 溶剂为一价BCC金属,其极限电子浓度约为1.48. 所以,溶质的原子价越高,其固溶度越低. 举例总之,组元元素的晶格类型相同,原子半径相差不大,在周期表中的位置邻近时,固溶度较大,甚至形成无限固溶体。