第一章反应机理09
- 格式:ppt
- 大小:6.38 MB
- 文档页数:1

第一章:物质结构与元素周期律本章以物质结构和元素周期律为主要内容和线索,将原子结构、碱金属与卤素的性质、电子层排布、化学键、元素周期表和周期律紧密结合。
本章内容划分为三节。
第一节为元素周期表:它主要介绍了元素周期表的结构,并且通过碱金属和卤素两个典型的族,引入同一族的元素的性质递变,最后基本了解元素、核素、同位素等几个基本概念;第二节是元素周期律:本节通过核外电子排布的学习,用第三周期为例,通过典型金属和典型非金属的性质递变,引入元素周期律;第三节是化学键:介绍了离子键和共价键,极性键和非极性键,电子式和结构式,本节主要是为了选修内容和化学专业的同学打基础。
全章内容的设计,通过实验和同学们比较熟悉的元素化合物,利用探究模式,体现了由感性认识上升到理性认识的科学认知规律。
1第二章:化学键和晶体结构1、理解离子键、共价键的含义。
理解极性键和非极性键。
了解极性分子和非极性分子。
了解分子间作用力,初步了解氢键。
2、了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
会判断晶体类型,会比较晶体熔沸点高低和硬度大小。
3、化学键与物质类别关系规律4、共价键的极性与分子极性关系规律5、物质熔沸点高低比较规律2第三章:化学中的平衡化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。
从历年高考经典聚焦也不难看出,这是每年高考都要涉及的内容。
从高考试题看,考查的知识点主要是:①有关反应速率的计算和比较;②条件对反应速率影响的判断;③确定某种情况是否是化学平衡状态的特征;④平衡移动原理的应用;⑤转化率的计算或比较;⑥速率、转化率、平衡移动等多种图象的分析。
要特别注意本单元知识与图象结合的试题比较多。
从题型看主要是选择题和填空题,其主要形式有:⑴根据化学方程式确定各物质的反应速率;⑵根据给定条件,确定反应中各物质的平均速率;⑶理解化学平衡特征的含义,确定某种情况下化学反应是否达到平衡状态;⑷应用等效平衡的方法分析问题;3⑸应用有关原理解决模拟的实际生产问题;⑹平衡移动原理在各类平衡中的应用;⑺用图象表示外界条件对化学平衡的影响或者根据图象推测外界条件的变化;⑻根据条件确定可逆反应中某一物质的转化率、消耗量、气体体积、平均式量的变化等。


化学反应的反应机理化学反应是指发生在化学物质之间的物质变化过程。
在化学反应中,反应物进入反应体系后,通过一定的反应机理进行转化,产生新的化学物质,同时原有的化学键被断裂或形成新的化学键。
了解化学反应的反应机理对于深入理解化学反应的过程和研究新的反应方法具有重要意义。
化学反应的反应机理主要包括两个方面,即反应的分子层面机理和宏观层面的反应速率。
下面将详细介绍这两个方面的内容。
一、反应的分子层面机理反应的分子层面机理是指反应的微观过程,包括反应物的相互作用、化学键的断裂和形成以及反应中间体的生成等。
在化学反应中,反应物初级步骤是吸附和活化过程。
当反应物接触到反应体系中的固体催化剂或在溶液中被溶剂分子包围时,其分子会与催化剂或溶剂分子发生吸附作用,从而形成吸附复合物。
吸附使得反应物分子距离更近,相互作用增强,有利于进一步发生化学反应。
在吸附的基础上,反应物进一步发生活化过程,化学键的断裂和形成是活化过程的关键步骤。
当反应物分子吸附在催化剂表面时,活化能得到降低,反应物分子的化学键容易断裂,从而使得反应更容易发生。
断裂的化学键形成由反应物分子解离生成自由基、离子或是中性分子。
在这个过程中,生成的自由基、离子或中性分子通过与其他反应物分子相互作用,形成新的化学键,从而完成化学反应。
反应的分子层面机理还包括反应中间体的生成。
在一些复杂的反应中,反应物分子可能经历多个步骤的转化,在不同的步骤中会生成一些中间体。
中间体是反应过程中的稳定物种,可以参与其他的反应步骤,并最终转化为最终产物。
中间体的生成往往是通过一系列的反应步骤实现的,不同的反应步骤之间可能形成不同类型的化学键。
二、宏观层面的反应速率宏观层面的反应速率描述的是反应物物质的转化速率。
在化学反应中,反应速率是指单位时间内反应物消失或产物增加的量。
反应速率受到多种因素的影响,如反应物浓度、温度、催化剂和表面积等。
反应物浓度增加可以提高反应速率,因为反应物浓度的增加会提高反应物之间的碰撞频率,从而增加化学反应的机会。

一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
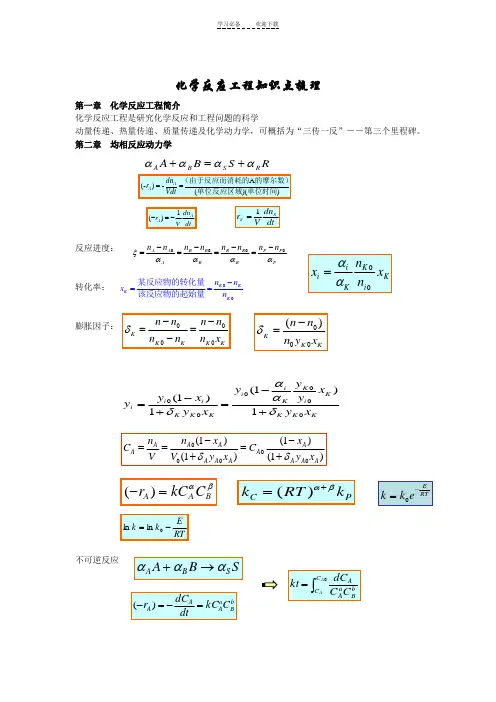
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。

第一章产品及原料概述一原料氯气1、分子式:Cl22、分子量:35.53、物理性质:氯气在常温、常压下为黄绿色气体,具有强烈的刺激性气味,对肺和呼吸道粘膜有损害作用。
略重于空气,微溶于水,氯气的水溶液叫氯水,氯水具有氧化性,氯气与水在低于9.6℃时形成黄色水合物(Cl·8H2O)。
4、化学性质:氯气化学性质活泼,具有较强的氧化性,能与许多单质及化合物起反应,因此,具有强烈的腐蚀性。
二、原料氢气1、分子式:H22、分子量:23、性质:氢气是一种无色、无味、易燃的气体,具有还原性,在水中及其它溶液中溶解度极小。
液态氢具有超导性质。
氢是最轻的物质,在空气中体积含量为4—74%时,即形成爆炸性混合气体。
三、产品氯化氢:1、分子式:HCl2、分子量:36.463、物理性质:密度:气态氯化氢在标准状况下的密度为1.63Kg/m3,相对密度(与空气密度之比)为1.2679。
溶解度:气态氯化氢极易溶解于水,在20℃,101.325Kpa下,1体积水能溶解442体积的氯化氢气体,但氯化氢在水中的溶解度随温度的升高而逐渐下降。
表1—1 在不同的温度和压力下(101.325KP)下氯化氢在水中的溶解度4、化学性质:(1)、氯化氢为共价极性分子,化学性质活泼,具有强烈的腐蚀性,但在较高温度特别是在最高露点108.65℃以上时,几乎对碳钢无显著腐蚀作用,若温度保持在108.65—250℃之间,氯化氢对碳钢的腐蚀速度可保持在适度的范围之内。
另外,石英、石棉、酚醛树脂、耐酸陶瓷、耐酸人造树脂、塑料以及一些金属合金比较耐氯化氢气体的腐蚀。
(2)、加聚反应氯化氢气体再有机合成中的一类主要反应为加成反应═CHCL→ CH—CHCL nCH≡CH+HCL→nCH2此反应为工业制PVC的基本反应,氯化氢工段合成氯化氢的目的也在于此。
四、产品盐酸氯化氢的水溶液,即盐酸,是一种重要的工业原料和化学试剂,用于制造各种氯化物,常用的浓盐酸的质量百分数为37% ,密度1.1g.cm-1,浓度12mol.l-1.工业上生产的盐酸质量浓度为31% ,可广泛用于冶金工业中金属清洗,电力工业中锅炉除垢。


物理化学傅献彩第六版物理化学傅献彩第六版为学习者提供了一种全新的、全面的物理化学学习资源。
这套书引进了各种最新的理论模型和实验技术,内容涵盖了近代物理化学的诸多方面,适用于本科、研究生、以及大学教师的学习。
全书共有12章:第一章主要介绍物理化学的基本原理,其中包括玻尔定律、联系键和分子间作用等知识;第二章着重论述分子结构与性质之间的联系,其中涉及到范德华力、液态流体、凝固物以及多孔介质等内容;第三章主要讲解通过表面积和化学活化能描述的反应机理;第四章重点介绍各种溶解的定义、特性以及它们的溶解度曲线特征;第五章探讨不同环境条件下反应的速率以及各种反应条件的变化所带来的影响;第六章涉及到化学平衡的定义以及平衡常数的实验求取;第七章讲授了振动分子模型、化学势能以及热力学基础知识;第八章介绍了赝势与极变理论;第九章阐述了量子力学中重要的概念;第十章讲授了各种分子磁属性和配位化学;第十一章介绍了自由能曲线和化学反应的分析;第十二章是物理化学的一些基本原理的概述,包括基础物理知识、库仑力和分子吸引力等内容。
此外,物理化学傅献彩第六版还设计了丰富的教学实验,以帮助学习者更好的理解书中的知识。
可以使用的仪器例如旋光仪、比色计、FTIR、微流控芯片等,可以检测离子浓度、pH值、温度、溶气压等参数。
此外,这套书还提供了一套额外的实验反应处理工具,可以帮助学习者管理各种反应变量,更好地理解实验性质。
总的来说,物理化学傅献彩第六版可以说是一本完整的物理化学教材,它以最新的理论模型和实验技术为基础,可以满足学习者不同层次的需求,是本科、研究生和教师学习物理化学的首选,必将对物理化学的学习及课堂授课产生积极的影响。

九年级科学第一章知识归纳一、概念:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子(NH4+)+酸根离子4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
中和反应的本质:7、置换反应——一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应,叫置换反应。
A+BC=B+AC 或A+BC= C+BA二、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;负二价:氧和硫。
(可变正价):一二铜汞,二三铁,二四碳,四六硫。
(原子团的化合价:负一价:氢氧根(OH-),硝酸根(NO3-),氯酸根(ClO3-),高锰酸根(MnO4-);负二价:硫酸根(SO42-),碳酸根(CO32-),亚硫酸根(SO32-),锰酸根(MnO42-);负三价:磷酸根(PO43-);正一价:铵根(NH4+)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+活泼金属=盐+氢气。
(3)酸+某些金属氧化物=盐+水。
(4)酸+碱=盐+水。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn + 2HCl = ZnCl2 + H2 ↑有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2↑3、铁跟稀盐酸反应:Fe + 2HCl = FeCl2 + H2 ↑有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应:Fe + H2SO4 =FeSO4 + H2↑溶液变成浅绿色。
5、铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:CuO +H2SO4 = CuSO4 + H2O 溶液变成蓝色。

化学反应原理选修4
化学反应原理是化学学科的重要内容,它研究化学变化的基本规律和机理。
通过观察和分析化学反应过程中的现象和性质变化,可以推断反应物的结构和性质,探索反应途径和反应速率的规律,揭示反应过程中的能量变化以及物质转化过程中的电荷转移与电子重排等基本原理。
在化学反应中,反应物经历物质的转化和能量的转化。
物质的转化是指反应物的原子间键的断裂和形成,进而生成新的化学物质。
这种转化可以是单一的,也可以是多种反应物之间的复杂转化。
能量的转化是指化学反应过程中能量的吸收和释放。
反应物中的化学键断裂需要吸收能量,而新的化学键形成则释放能量。
这种能量变化影响着化学反应的热效应和速率。
化学反应的速率是描述反应进行快慢的参数,它反映了反应物从初始状态到最终状态的转化速度。
反应速率受到多种因素的影响,如反应物浓度、温度、压力、催化剂等。
通过改变这些因素,可以调控反应速率达到所需的目的。
同时,通过反应速率的研究可以推断出反应途径和机理。
化学反应的机理是指反应的详细步骤和中间产物的形成和消失过程。
它通过实验数据和理论模型的分析,揭示了反应物转化的详细过程。
在探索化学反应机理的过程中,常常涉及到配位化学、光化学、电化学等多个分支学科的知识。
化学反应原理的研究不仅有助于理解物质的转化过程和能量的转化规律,还对于工业生产和环境保护等方面具有重要意义。
通过理论研究和实验验证,可以进行合成新化合物、改进反应工艺、提高反应效率等。
同时,了解反应原理也有助于节约资源、减少废弃物排放、控制环境污染等方面的应用。

化工原理王志魁第五版答案
《化工原理》王志魁第五版习题答案列表如下:
一、第一章
1.1 什么是化学工程
化学工程是一门研究化学过程及其工艺的学科,主要涉及化学反应、
传热、传质、流动等方面。
1.2 化学反应基础
化学反应是化学工程中最重要的环节之一,包括化学平衡、反应速率、反应热等方面。
1.3 能量和能量平衡
能量是化学工程中最基本的物理量之一,能量平衡是化学工程设计和
运行的基础。
二、第二章
2.1 流体静力学基础
流体静力学是研究静止流体力学性质和流体中的压力分布的学科。
2.2 流体动力学基础
流体动力学是研究流体在运动中的力学性质、运动规律及其应用的学科。
2.3 流体动力学基本方程
流体动力学的基本方程包括质量守恒方程、动量守恒方程和能量守恒方程。
三、第三章
3.1 质量传递基础
质量传递是化工过程中必不可少的环节之一,包括传递过程和传递速率等方面。
3.2 质量传递基本方程
质量传递的基本方程包括扩散方程、对流方程和总质量守恒方程。
3.3 物料平衡
物料平衡是化工过程中必不可少的环节之一,包括原料的进出量、反
应产物的生成量和回收量等方面。
四、第四章
4.1 常见的化工反应
常见的化工反应包括酸碱中和、氧化还原、脱水、加氢等方面。
4.2 燃烧反应
燃烧反应是一种氧化还原反应,是化工过程中常发生的一种反应类型。
4.3 催化剂的应用
催化剂在化学工程中的应用广泛,能够提高反应速率和选择性,降低
反应温度和压力等。
以上是《化工原理》王志魁第五版习题答案列表。
化学反应机理
1 化学反应机理
化学反应机理是描述化学反应过程中反应物和产物之间变化的过程。
它非常重要,因为可以用来找到以下重要特征:
- 如何辨认反应物和产物
- 是否有活性位点
- 足够能量来激活反应物
- 它可以用来帮助确定反应在不同情况下的速率
- 等等
为了正确描述一个化学反应的机理,首先应该知道经历的每一步是如何发生的,以及发生的每一步之间有什么样的关系。
每一步以及反应物和产物之间的关系都用化学方程式和表格简洁的表达出来,因此,分子的相互作用可以用分子动力学的模型表示,大部分基本的反应机理都可以用相同的方程式进行表达。
此外,可以使用算法和统计模型来处理反应机理。
反应机理有多种表示形式,例如矢量图,体系,动力学路径和焓差图等,可以根据情况用不同的表示法。
此外,还可以采用分子的重力,相变能量环境,热导率,反应进程能量,反应定义等来把反应机理分析的更加精细。
这些信息能够用来评估每种反应机理的可行性和实际应用价值。
总之,化学反应机理是一个协调系统,它关联了反应进程中反应物和产物之间的关系,提供有关反应过程和反应物之间关系的重要见解。
对它的研究可以帮助我们更好的理解化学反应,并且可以用来探讨如何更好的利用它来开发新的反应,改善现有的反应,和优化反应的生产环境。
化工原理各章节知识点总结化工原理是化学工程专业的基础课程,主要介绍了化学工程的基本概念、理论和技术。
下面是各章节的知识点总结:第一章:化工原理的基本概念和性质1.化工原理的定义和基本任务2.化工原理的基本性质和特点3.化工原理的基本方法和技术第二章:化学平衡和能量平衡1.化学反应平衡的条件和表达式2.平衡常数和平衡常数表达式3.能量平衡的基本原理和方法4.热力学和热力学函数5.熵和化学势的概念和计算第三章:物相平衡1.物质在不同相之间存在的平衡条件2.相平衡的相图和相平衡计算3.蒸馏和萃取等物相平衡的应用第四章:质量平衡和物质迁移1.质量平衡的基本原理和方程2.质量平衡的应用:反应工艺和物料平衡3.物质迁移的基本理论和计算方法第五章:流体力学1.流体的基本概念和性质2.流体的连续性方程和动量方程3.流体的能量方程和压力损失4.流体的流动和阻力的计算第六章:传递现象1.传递现象的基本概念和分类2.传递现象的数学模型和方程3.质量传递、热量传递和动量传递的计算第七章:反应工程基础1.化学反应的速率和速率方程2.反应速率的测定和表达3.反应工程的热力学和动力学分析4.反应器的分析和设计第八章:传热和传质1.传热的基本机制和传热方式2.导热和对流传热的计算3.汽液传质和固液传质的计算第九章:流体传动和流动分布1.流体传动的基本方式和流动性质2.流体传动的计算和分析3.流动分布的原理和应用第十章:分离工程基础1.分离过程的基本概念和分类2.平衡分离的基本理论和计算3.萃取、吸附和蒸馏等分离工艺的应用第十一章:生化反应工程基础1.生物反应器的基本概念和种类2.酶反应和微生物反应的基本原理3.生化反应器的分析和设计以上是化工原理各章节的知识点总结,涵盖了化工原理的核心内容。