羧酸衍生物的化学性质
- 格式:doc
- 大小:2.63 MB
- 文档页数:8

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。




羧酸及其衍生物羧酸及其衍生物Ⅰ 目的要求羧酸是含有羧基(―COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ 学习提要(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相β α同。
γCH3-CH-CH2-COOH2 14 3 OH 芳香酸命名是把芳环视作取代基。
76羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质亲核取代O 还原R-C-C-O-H α-H反应H 脱羧酸性1、酸性?E O O O +?R-C H + R-C R-C E EO-H O OO O NaOH/Na2CO3/ NaHCO3H2O + R-C E R-C EH+ O-Na O-H应用:①鉴别:与酚不同,与非酸性物质不同。


第六章羧酸及羧酸衍生物得性质及重要反应机理一、羧酸得化学性质1、酸性羧酸具有酸性,诱导、共轭、场效应等对酸性强弱有影响。
利用羧酸得酸性可以制备羧酸酯与羧酸盐。
2、亲核取代反应这就是羧酸在一定条件下转变成羧酸生物得反应。
大多数亲核取代反应就是通过加成-消除历程完成得。
3、还原反应羧酸能被LiAlH4与B2H6还原成相应得伯醇。
4、α-H得卤化(Hell-Volhard-Zelinsky反应)通过控制卤素得用量可以制备一元或多元得卤代羧酸,并进一步制备羟基酸与氨基酸。
5、脱羧反应羧酸在适当得条件下,一般都能发生脱羧反应,这就是缩短碳链得反应。
通常得脱羧反应表示如下:A为-COOH、-CN、-(C=O)R、-NO2、-CX3、-C=O、C6H5-等吸电子基团时,脱羧反应相当容易进行。
此外还有一些特殊得脱羧方法。
二元羧酸得脱羧规律就是:乙二酸、丙二酸、加热失羧,丁二酸、戊二酸加热就是水生成分子内酸酐,己二酸、庚二酸加热就是水、失羧生成环酮。
根据以上反应可以得出一个结论,在有机反应中有成环可能时,一般易形成五元环或六元环。
这称为布朗克(Blanc)规则。
二、羧酸衍生物得化学性质1、亲核取代反应这就是羧酸衍生物得转换反应。
转换得活性顺序为:RCOX>CRCOOOCR>RCOOR′>RCONR2酸与碱都能催化反应。
2、与有机金属化合物得反应选用空阻大得酰卤,反应能控制在酮得阶段。
选用甲酸酯,可以制备对称二级醇。
选用碳酸酯,可制备三个烃基相同得三级醇。
二元酸得环状酸酐可用来制备酮酸。
酰胺氮上有活泼氢,一般不宜使用。
3、还原反应反应物还原剂NaBH4LiAlH4催化氢化B2H6RCOCl Rosenmund法RCHO+ + RCH2OH RCOOOCR + + + + 2RCH2OHRCOOR′+ +特殊催化剂+ RCH2OHR′OHRCONH2+ +特殊催化剂+ RCH2NH2RCN + + RCH2NH2反应、Bouveault-Blanc反应、酮醇反应、酯得热裂等见重要反应机理。


羧酸及其衍生物学习指南羧酸是分子中含有羧基的有机化合物。
羧基是由羰基和羟基组成的官能团,羧酸的化学反应主要发生在羧基及受羰基影响的—氢原子上。
羧酸分子中的羟基被其他原子或基团取代后生成羧酸衍生物。
它们都是含有酰基的化合物,由于结构相似,所以具有许多相似的化学性质。
本章重点介绍羧酸及其衍生物的特征反应、官能团间的相互转化规律及其在实际中的应用。
学习本章内容应在了解羧酸及其衍生物结构特点的基础上做到: 1.了解羧酸的分类,掌握羧酸及其衍生物的命名方法;2.了解羧酸及其衍生物的物理性质和变化规律,熟悉重要羧酸及其衍生物的化学反应及应用;3.掌握羧酸及其衍生物官能团的特征反应及鉴别方法.掌握羧酸及其衍生物间的相互转化关系;4.熟悉重要羧酸及其衍生物的工业制法以及在生产、生活中的实际应用。
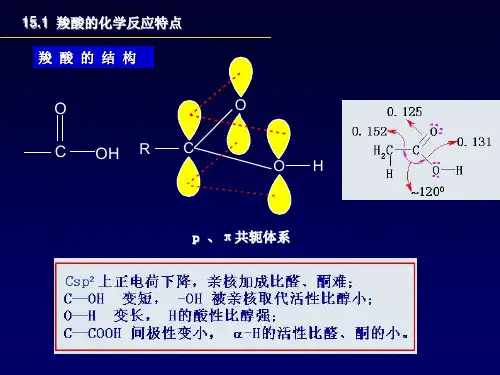
任务1 羧酸一、羧酸的结构、分类和命名1. 羧酸的结构由羰基和羟基组成的基团叫做羧基。
羧基的构造式为(),(也可简写为)羧酸就是分子中含有羧基的一类有机化合物,常用通式()来表示。
在羧基中,由于羰基和羟基互相影响,使它们不同于醛酮分子中的羰和醇分子中的羟基,而表现出一些特殊的性质。
2.羧酸的分类根据分子中烃基的结构不同可将羧酸分为脂肪族羧酸、脂环族羧酸和芳香族羧酸;根据烃基是否饱和,又可分为饱和羧酸和不饱和羧酸;还可以根据分子中所含羧基数目分为一元羧酸、二元羧酸和三元羧酸等,二元及二元以上的羧酸统称为多元羧酸。
例如:异丁酸丙烯酸丙二酸(脂肪族饱和一元羧酸) (脂肪族不饱和一元羧酸) (脂肪族饱和二元羧酸)环己基甲酸 苯甲酸 对苯二甲酸 (脂环族一元羧酸) (芳香族一元羧酸) (芳香族二元羧酸) 3.羧酸的命名 (1)俗名羧酸广泛存在于自然界中,而且早已被人们所认识,因此,许多羧酸有俗名,这些俗名一般是α C OH OCOOH RCOOH CH 3HOOCCH 2COOHCH 3 CH COOHCH 2 CH COOH COOH COOHCOOHHOOC根据他们最初来源命名的。
大学化学实验-(取代)羧酸及其衍生物、胺的性质大学化学实验-(取代)羧酸及其衍生物、胺的性质实验二十五(取代)羧酸及其衍生物、胺的性质【实验目的】1. 熟悉羧酸、羧酸衍生物和取代羧酸的化学性质;2. 掌握胺类化合物的性质及其鉴别方法;3. 了解酰化反应和缩二脲反应的应用。
【实验原理】羧酸一般为弱酸性(但酸性比碳酸强)。
羧酸能发生脱羧反应,而且不同各种羧酸的脱羧的条件各有不同,如草酸、丙二酸经加热即易脱羧,放出CO2;羧酸与醇在酸的催化下,加热可以发生酯化反应。
甲酸含有醛基,故能还原托伦试剂。
羧酸除能生成酯外,也能生成酰卤、酸酐和酰胺(四者统称为羧酸衍生物)。
它们的化学性质相似,能发生水解机、醇解和氨解。
活泼顺序为:酰卤酸酐酯酰胺。
取代羧酸中重要的有羟基酸和酮酸。
羟基酸中的羟基比醇分子中的羟基易被氧化,如乳酸能被托伦试剂氧化成丙酮酸;,在碱性高锰酸钾溶液中,则因高锰酸钾被乳酸还原而使紫色褪去。
乙酰乙酸乙酯是酮型和烯醇型两种互变异构体的平衡混合物,这两种异构体借分子中氢原子的移位而互变转换,所以它既具有酮的性质(如与2,4-二硝基苯肼反应生成2,4-二硝基苯腙),又具有烯醇的性质(如能使溴水褪色并能与FeCl3溶液作用呈现紫色)。
胺可以看做是氨分子中的氢原子被羟基取代的衍生物。
胺类化合物有碱性,能与酸反应生成盐。
芳香胺由于氨基的存在使苯环活化,易发生取代反应。
在酰化反应中,伯胺和仲胺由于氮上有氢原子可被酰基取代,生成相应的酰胺类化合物,叔氨氮上无氢原子则无此反应。
大多数酰胺为结晶固体,故可利用酰化反应鉴别胺类化合物。
胺类容易被氧化,氧化产物往往很复杂。
将尿素缓慢加热至熔点以上,则二分子尿素可脱去一分子氨生成缩二脲。
缩二脲在碱性溶液中与稀的硫酸铜溶液反应能产生紫红色,这种反应叫做缩二脲反应。
【仪器材料】小试管10支,烧杯(100 mL)2个,玻璃棒1根,小橡皮塞1个,酒精灯1个,温度计1个,石棉网1个,铁架台1个,铁圈1个,铁夹1个,大试管1个,带孔橡皮塞1个,导管1个,药匙1个。
羧酸衍生物有机化学性质
羧酸衍生物是指由羧酸及其衍生物与其他化合物组成的有机化合物。
羧酸衍生物具有以下有机化学性质:
1.水溶性:大部分羧酸衍生物都能与水发生反应,形成羧
酸和羧酸盐。
2.碱性:羧酸衍生物是碱性物质,它们能与酸性物质发生
反应。
3.热稳定性:羧酸衍生物在加热时易分解,特别是在高温
下,它们的稳定性较差。
4.可溶于有机溶剂:羧酸衍生物能与许多有机溶剂混溶,
如醇、醚、醛、酮等。
5.化学性质多样性:羧酸衍生物的化学性质因其结构不同
而有所差异。
羧酸衍生物的化学性质一、羧酸衍生物的共性反应 (一)“亲核取代”反应 1、“亲核取代”反应概述体系中的亲核试剂进攻正电性的酰基碳,发生亲核加成反应形成四面体负离子,接着发生消去反应,其结果是亲核试剂取代了L 基团:R C L O δ+δ-:Nu-亲核加成R C LO NuR C Nu O 结果:亲核取代2、“亲核取代”反应历程(1)碱催化(提高试剂的亲核能力或有效浓度)RRRCCC OO O : B: L BLB+-:L -(2)酸催化(酰基质子化增加酰基碳的电正性)L-R R COH O OH BL+++BH:L OH +H+C O R CL:BC3、“亲核取代”反应活性比较亲核取代=亲核加成+消除 因此,反应活性与下列因素有关:(1)酰基C δ+↑、C 周围空间位阻↓,则亲核加成活性↑; (2)离去基团稳定性↑,离去能力↑(越易离去),则消除活性↑,亲核性越强(即稳定性越小)越不易离去,而亲核性与其碱性强弱一致,可由其共轭酸的酸性来比较得出:酸性:HX > RCOOH > ROH>NH 3碱性:NH 2->RO ->RCOO ->X -,则离去能力为:NH 2-﹤RO -﹤RCOO -﹤X -;羧酸衍生物亲核取代活性分析如下:①酰卤:R C X O卤原子具有-I>+C 的电子效应,使C δ+↑↑,亲核活性↑↑;且X -最易离去,消除活性↑↑。
②酰胺:R C NH 2O氨基(或者是取代氨基)具有+C>-I 的电子效应(相对于氧原子,氮还有+I 效应),使C δ+↓↓,亲核活性↓↓;且NH 2-最难离去,消除活性↓↓。
③酯:ORCOR(R')烃氧基具有+C>-I 的电子效应,使C δ+↓,亲核活性↓(给电子能力较氨基弱,因此酯中C δ+比酰胺↑);且RO -比NH 2-易离去,消除活性较酰胺↑。
④酸酐:O RCOCR(R')O氧原子同时向两边的酰基给电子(+C >-I ),因此给电子能力比酯弱,使C δ+较酯↑,亲核活性较酯↑;且RCOO -较RO -易离去,消除活性较酯↑。
综上所述,羧酸衍生物的亲核取代活性:酰卤﹥酸酐﹥酯﹥酰胺 常见的亲核试剂有:水、醇、氨(胺)。
反应分别称为水解、醇解、氨(胺)解。
4、羧酸衍生物的亲核取代反应 (1)水解+ HOHRCOOH +RCOOCOR'R'COOHRCOOH RCOCl + HOH+ HCl RCOOR' + H 2+-RCONH 2 + H 2O 回流RCOOH + NH 4+RCONH 2 + H2O回流RCOO - + NH 3注:①酰氯反应剧烈,故酰氯遇湿气冒白烟,可作为判断存在酰氯基团的依据;②由反应条件的变化可以看出反应活性是酰卤﹥酸酐﹥酯﹥酰胺; ③水解产物均为酸;④酰胺如果连有大体积烃基,则反应难进行,可用下述反应得到酸(参见酰胺与亚硝酸的反应):NH 2O + HNO 2H 2SO 4oOH O(2)醇解①酰氯活性大,反应容易进行,常用于制备酯:COCl + HOC(CH 3)3COOC(CH 3)3②开链酸酐醇解可得到酯和酸;环酐醇解可得开链的酯酸(醇过量可再酯化得到二酯);不对称环酐,RO -进攻活性大的酰基碳,得到开链酯酸(醇过量可再酯化得到二酯):RCOOR' + RCOOH R'OHRCO O COROCH 2COOCH 3CH 2COOHCH 3OHCH 2COOCH 3OO3CH 2COOCH 3H3H 3COCCH 2CHCOOHO CH 3CH 3OHH 3COCCH 2CHCOOCH3O CH 3③酯的醇解得到新的酯和新的醇,故又称酯交换反应:RC OR'O+ R''OHRC OR''O+ R'OH +-酯交换反应的应用:(i )药效弱的酯 药效强的酯NH 2COOEtHOCH 2CH 2NEt 2NH 2COOCH 2CH 2NEt 2+ EtOH对氨基苯甲酸乙酯普鲁卡因(局麻剂)(ii )二酯化合物的选择性水解例:OCCH 3H 3COC O O OHH 3COC O解:33OCCH 3H 3COCO O OH H 3COCO + CH 3COOCH 3分析:要去掉乙酰基而保留甲酯基,考虑选用甲醇进行醇解;酯交换中甲酯仍得甲酯(a途径),酰基可被交换下来(b 途径);选用大量甲醇可使反应近于完全:3H 33OCCHH 3COCO O+ CH OHOH H 3COC O + CH 3COOCH 3(iii )生命体内亦有酯交换反应 CH 3C OS CoA 乙酰辅酶A + HOCH 2CH 2N +(CH 3)3OH -胆碱CH 3C OOCH 2CH 2N +(CH 3)3OH -乙酰胆碱+ HS CoA辅酶A④酰胺反应活性差,需酸催化、高温高压,产物为酯和氨(胺):RCONH 2CH CH OH +RCOOCH 2CH 3 + NHNH 4+(3)氨(胺)解氨(胺)的亲核性强,故氨(胺)解较水解、醇解容易,叔胺不能氨解;产物为酰胺:RCOCl + NH R'2RCONR'2 + HCl(RCO)2O + NH R'2RCONR'2 + RCOOHO OO CONHRCOOHN-R + RNH 2OORC OR'O+ NH R''2RC NR''2O+ R'OH RCONH 2 + CH 3NH 2 HClRCONHCH 3 + NH 4Cl5、羧酸衍生物“亲核取代”反应小结RCO LH 2OR'OH HNR'2R C O OH R C O OR'RCO NR'2L 基团被OH 取代,或H 2O 中的H 被RCO-取代L 基团被OR'取代,或R'OH 中的H 被RCO-取代L 基团被NR 2'取代,或HNR 2'中的H 被RCO-取代(1)从羧酸衍生物的变化看,是L 被各类亲核基团取代,谓之发生了水解、醇解和氨解; (2)从亲核试剂的变化来看,是活性H 被羧酸衍生物中的酰基取代,故羧酸衍生物起到了提供酰基的作用,因此,羧酸衍生物也称为“酰化剂”,上述水解、醇解、氨解反应又称为“酰化反应”,即“羧酸衍生物的‘亲核取代’反应”又称“酰化反应”; (3) 羧酸衍生物“亲核取代”反应活性为“酰卤>酸酐>酯>酰胺”,亦即酰化反应活性同样为“酰卤>酸酐>酯>酰胺”,酰化常用酰卤和酸酐,因其反应活性高。
6、其他亲核试剂与羧酸衍生物的亲核取代反应其他许多的亲核试剂都可与羧酸衍生物发生上述亲核取代反应,如格式试剂与酯的反应,首先“亲核取代”生成酮,酮继续与过量格氏试剂反应最终生成叔醇(当底物和试剂的烃基体积都较大时,可停留在酮阶段):RCOEtOR'MgBrRCR'O R'MgBr RCR'OH R'无水乙醚无水乙醚H 3O +(二)羧酸衍生物的还原羧酸衍生物较羧酸容易还原,可根据产物要求选择不同的还原体系。
1、催化加氢还原法(1)催化条件要求高,酰卤、酸酐、酯→醇;酰胺→胺(较难); (2)工业上应用最好的催化剂是铜铬氧化物;(3)喹啉-硫催化体系可以减活,使酰卤还原为醛——罗森孟还原法。
RCH 2OH + R'OH4200~300 C.RCOOR' + H 2o10~30MPaCuCr 2O氧化物30MPa,250 CoNH 2RCOCl + H 2Pd-BaSO 4喹啉-硫RCHO + HCl2、金属氢化物还原法(LiAlH 4)(1)酰卤、酸酐、酯→ 醇;酰胺→ 胺(双键保留);(2)NaBH 4能还原醛酮,不能还原酸和酯(B 2H 6可还原羧酸/双键,不能还原酯)。
例如:Et 2OLiAlH 4H 2ORCH 2OH + R'OH CON(CH 3)2LiAlH 4H 2OCH 2N(CH 3)23、金属钠还原酯——鲍维特~勃朗克反应酯Na, EtOH醇(双键保留)二、羧酸衍生物的特性反应(一)酸酐的重要反应——Perkin 反应(了解)脂肪酸酐+ 芳醛 α,β-不饱和酸碱酸酐的α-H 被碱夺去形成C -,然后进攻芳醛基,形成羟酐,再经脱水和酸酐水解, 最终生成α,β-不饱和酸。
例如:2COOCOCH 3C HOHCH 2COOCOCH 3C HCHCOOCOCH 3C HCHCOOH + CH 3COOH-H 2OH 2O(二)酯的重要反应(掌握)1、酯缩合反应(克莱森酯缩合)→β- 羰基酯RCH 2COOC 2H 5 + H CHCOOC 2H 5RRCH 2COCHCOOC 2H 5REtONa酯的α-H 被碱夺去形成C -,与另一分子酯发生“亲核取代”反应,形成β- 羰基酯;β- 羰基酯水解得到β-羰基酸,再经酮式或酸式分解,可得到酮或酸。
2、克莱森酯缩合的应用——合成开链或环状β-羰基酯、1,3-二羰化物 (1)交叉酯缩合→β- 羰基酯底物选用一个含α-H 的酯,一个不含α-H ,则产物单一:+CH 2COOEtCH 2COOEt HCOOEtNaOEt OHC CHCOOEtCH 2COOEt + HOEt(2)酮酯缩合→1,3-二酮酮的α-H 较酯活泼,更易被碱夺取,因此酮形成C -,再与酯发生“亲核取代”,生成1,3-二酮化合物。
CCH 3OO+CH 3+ EtOHCCH 2CCH 3O(3)分子内酯缩合生成环酮酯(迪克曼反应)①二酯分子中的一个α-H 被碱夺取形成C -,进攻另一端的酯基,发生分子内酯缩合反应,生成环状的β–酮酯(主要合成五、六、七元环); ②环β–酮酯再经水解(成β-酮酸)、脱羧(酮式分解),生成少1个C 的环酮;③存在多个α-H ,则酸性强的α-H 先被碱夺走形成C -。
例如:CH 2CH 2CH 2COOEt CH2CHCOOEtCH 3:BCH 2CHCOOEt CH 2CH 3O COOEt CH 3+O CH 33、共轭加成——迈克尔反应(了解)(1)活泼亚甲基物与α,β-不饱和醛酮腈等在碱中1,4-加成,可合成1,5-二羰基化物;(2)活泼亚甲基物提供C -,主要有:O OO O EtOO O例如:OO+EtO -OCOOEtCOOEt+EtOHO OONPhCHCH 2CPh OCH(COOC 2H 5)2 CH 2(COOC 2H 5)2 +(三)酰胺的重要反应(掌握) 1、酸碱性氮的孤对电子与酰基共轭,使碱性减弱,酰胺是近乎中性的物质;酰亚胺与两个酰基共轭,因此反而具有弱酸性,可与强碱成盐。