物化复习计算题目
- 格式:doc
- 大小:166.00 KB
- 文档页数:4

物理化学复习题一、判断题1、一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
×2、根据道尔顿分压定律,P=∑PB,可见压力具有加和性,应属于广度性质。
×3、因Qp =△H, Qv=△U,所以Qp与Qv都是状态函数。
×4、自发过程一定是不可逆过程。
√5、熵增加的过程一定是自发过程。
×6、物质B在两相之间进行宏观转移的方向总是从浓度高的相迁至浓度低的相。
×7、吉布斯函数减小的过程一定是自发过程。
×8、在等温、等压不作非体积功的条件下,反应的△rGm<0时,若值越小,自发进行反映的趋势也越强,反应进行得越快。
×9、三组分系统最多同时存在5相。
√10、单组分系统的相图中两相平衡线都可以用克拉佩龙方程定量描述。
√⑴电解质溶液中各离子迁移数之和为1。
√11、无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
×12、电解质的无限稀摩尔电导率Λm ∞可以由Λm对√c作图外推至√c =0得到。
×13、恒温、恒压下ΔG>0的反应不能自发进行。
×14、只有在比表面很大时才能明显地看到表面现象,所以系统表面增大是表面张力产生的原因。
×15、单分子层吸附只能是化学吸附,多分子层吸附只能是物理吸附。
×16、由于溶质在溶液的表面产生吸附,所以溶质在溶液表面的浓度大于它在溶液内部的浓度。
×17、在同一反应中各物质的变化速率相同。
×18、零级反应的反应速率不随反应物质的浓度变化而变化。
√19、一个化学反应进行是级数越大,其反应速率也越大。
×二、填空题1、理想气体分子的最基本的特征是和,当温度越,压力越时,一切实际气体的行为就越接近理想气体。
2、1mol理想气体从300k,200Kpa绝热向真空膨胀至100Kpa,则此过程的△U 0,△H0,△T 0,△V 0.3、实际气体经节流膨胀,Q 0,△H 0,△P 0.4、在绝对零度时纯物质完美晶体的熵值= 。

物理化学复习题及答案一、选择题1. 以下哪个选项是热力学第一定律的数学表达式?A. ∆U = Q + WB. ∆H = Q + WC. ∆S = Q/TD. ∆G = Q - W答案:A2. 理想气体状态方程为:A. PV = nRTB. PV = nRT + aC. PV = nRT - aD. PV = nRT^2答案:A3. 以下哪个选项是化学平衡常数的定义?A. K = [反应物]/[生成物]B. K = [生成物]/[反应物]C. K = [生成物]^系数/[反应物]^系数D. K = [反应物]^系数/[生成物]^系数答案:C二、填空题1. 绝对零度是______开尔文。
答案:02. 摩尔气体常数R的数值是______焦耳/(摩尔·开尔文)。
答案:8.3143. 阿伏伽德罗常数的近似值是______。
答案:6.022×10^23 mol^-1三、简答题1. 描述熵的概念及其物理意义。
答案:熵是热力学中描述系统无序程度的物理量,它代表了系统微观状态的多样性。
在物理意义上,熵的增加表示系统的无序程度增加,即系统趋向于更加混乱的状态。
2. 什么是理想溶液?理想溶液的热力学性质有哪些特点?答案:理想溶液是指溶液中各组分的分子间作用力与同种分子间的作用力相同,且溶液的体积和熵变符合理想行为的溶液。
理想溶液的热力学性质特点包括:混合过程不伴随体积变化,即体积可加性;混合过程不伴随熵变,即熵可加性;混合过程中不伴随热效应,即无热效应。
四、计算题1. 已知理想气体在等压条件下,从状态1(P1, V1, T1)变化到状态2(P2, V2, T2),求该过程中气体所做的功。
答案:W = P1 * (V2 - V1)2. 某化学反应在298K时的标准吉布斯自由能变化为-50kJ/mol,求该反应在该温度下的标准平衡常数K。
答案:K = exp(-ΔG°/RT) = exp(50,000 J/mol / (8.314J/(mol·K) * 298 K)) ≈ 1.7×10^6以上为物理化学复习题及答案的排版格式,供参考。
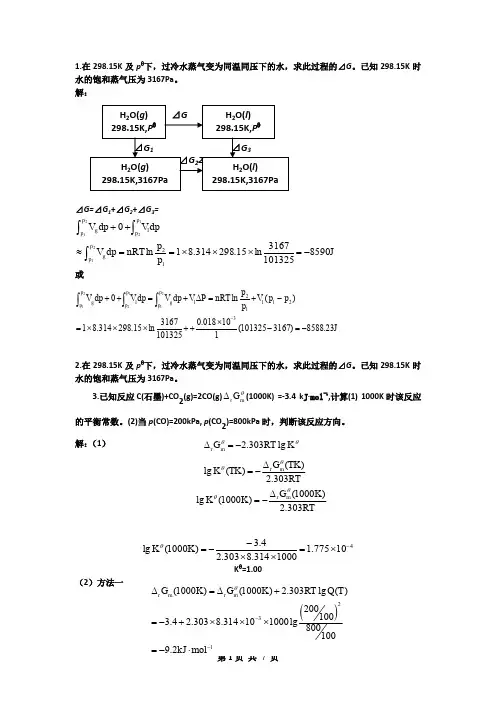
1.在298.15K 及p θ下,过冷水蒸气变为同温同压下的水,求此过程的⊿G 。
已知298.15K 时水的饱和蒸气压为3167Pa 。
解:⊿G=⊿G 1+⊿G 2+⊿G 3=J85901013253167ln 15.298314.81ln 021122112-=⨯⨯⨯==≈++⎰⎰⎰p p g p p l p p g p p nRT dp V dpV dp V或J 23.8588)3167101325(110018.010********ln15.298314.81)(ln032112211221-=-⨯++⨯⨯⨯=-+=∆+=++-⎰⎰⎰p p l l g p p l p p g p p V p p nRT P V dp V dp V dp V2.在298.15K 及p θ下,过冷水蒸气变为同温同压下的水,求此过程的⊿G 。
已知298.15K 时水的饱和蒸气压为3167Pa 。
3.已知反应C(石墨)+CO 2(g)=2CO(g)r m G θ∆(1000K)=-3.4 k J ·mol -1,计算(1) 1000K 时该反应的平衡常数。
(2)当p (CO)=200kPa, p (CO 2)=800kPa 时,判断该反应方向。
解:(1)410775.11000314.8303.24.3)1000(lg -⨯=⨯⨯--=K K θK θ=1.00(2)方法一2.303lg r m G RT K θθ∆=-∵⊿r G m(1000K)<0,∴反应正向自发进行方法二Q=(200/100)2/(800/100)=4/8=0.5Kθ=1.00∵Q<Kθ∴反应正向自发进行4.某抗菌素在人体内的代谢反应为一级反应,若服药后每24小时药物代谢一半,而药物代谢20%则必须补充该药,问第二次服药时间?解:t1/2=0.693/kk=0.693/24=0.028875(小时)-1ln(C0/C A)=ktt=7.73(小时)5.Zn-Hg(含Zn10%)∣ZnSO4·7H2O(s)饱和溶液‖Hg2SO4(s)(饱和溶液)∣Hg(l)。

1.1mol 理想气体从298.15K,2P0经下列两条途径到达压力为1 P0的终态:(1)等温可逆膨胀;(2)自由膨胀,试求这两过程的ΔU 、ΔH 、Q 、W 、ΔS 、ΔG 和ΔA.2.试求1mol 理想气体从1000kPa,300K 等温可逆膨胀至100kPa 过程中的ΔU 、ΔH 、ΔS 、Q 、W 、ΔG 和ΔA 。
解:理想气体等温变化,因此:ΔU = ΔH =0; 设计同样始终状态的可逆过程,则:12114.191001000ln 314.81ln -⋅=⨯⨯===∆K J p p nR T Q S R kJ nRT p p nRT Vdp G 743.51000100ln 300314.811000100ln ln121001000-=⨯⨯⨯====∆⎰kJ p p nRT V V nRT pdV A 743.51000100ln 300314.81ln ln12121001000-=⨯⨯⨯==-=-=∆⎰或:()kJG nRT G pV G A 743.5)(-=∆=∆-∆=∆-∆=∆3.计算说明:-10℃、θp 下的过冷C6H6(l)变成定温定压的C6H6(s),该过程是否为自发过程。
已知1mol 过冷C6H6(l)的蒸汽压为2632Pa ,C6H6(s)的蒸汽压为2280Pa ,Cp,m(l)=127J·mol-1·K-1, Cp,m(s)=123J·mol-1·K-1,凝固热为9940J·mol-1。
解:该过程为不可逆相变,需将其设计为可逆过程,p 1为液态C 6H 6的蒸汽压,p 2为固态C 6H 6的蒸汽压。
),(66θp l H C ),(66θp s H C),(166p l H C ),(266p s H C),(166p g H C ),(266p g H C54321G G G G G G ∆+∆+∆+∆+∆=∆其中,042=∆=∆G G 为两个可逆相变过程。

1、298K,101.3kPa下,Zn和CuSO4溶液的置换反应在可逆电池中进行,做电功200kJ,放热6kJ,求反应的△rU、△rH、△rA、△rS、△rG。
解、1、298K,101.3kPa下,Zn和CuSO4溶液的置换反应在可逆电池中进行,做电功200kJ,放热6kJ,求反应的△r U、△r H、△r A、△r S、△r G。
解:系统对环境做功为负,根据题意可知非体积功W′及体积功W V分别为W′=-200kJ,W V=0则总功为W= W′+ W V=-200kJ故△r U=Q+W=(-6-200)kJ=-206kJ△r H=△r U+△(pV)= △r U+p△V=△r U=-206kJ△r S=Q/T=(-6000/298) J·K-1=-20.1 J·K-1△r A=△r U-T△r S=△r U-Q= W′=-200kJ△r G= W′=-200kJ2、20℃,101.3Kpa下,空气中氮在水中溶解的体积。
(换算成标准态)解、空气中含氮气78%,因此P N2=79Kpa;20℃时R=8.4*106KpaP N2=K*X N2则X N2=9.4*10-6n N2=5.2*10-4V N2=11.7ml1、炼钢过程中用铝脱氧的反应为:2[Al]+3[O]=Al2O3(S)2Al(l)+3/2O2=Al2O3△G1=-43095-32.26T2Al(l)=[Al] △G2=-43095-32.26T1/2O2=[0] △G3=-117150-2.89T1)求此反应在1600℃时的平衡常数是多少?解:2[Al]+3[O]=Al2O3(S)△Gm=△G1-2△G2-3△G3=-1243110+394.5T△G M=504210JMOL-1K=1.15*10142)如果脱氧过程中在1600℃时进行,近似计算钢中残留吕量为0.01%时,钢中氧含量是多少?由题意知[AL]和[O]都是以1%为标准态的,近似计算时,氧和铝的活度系数都为1则以k=1.15[%Al]=0.01%代入则[%0]=0.000443、1600℃摩尔质量为60和56的两种物质形成A-B二元溶液。

物理化学题库及详解答案物理化学是一门结合物理学和化学的学科,它通过物理原理来解释化学现象,是化学领域中一个重要的分支。
以下是一些物理化学的题目以及相应的详解答案。
题目一:理想气体状态方程的应用题目内容:某理想气体在标准状态下的体积为22.4L,压力为1atm,求该气体在3atm压力下,体积变为多少?详解答案:根据理想气体状态方程 PV = nRT,其中P是压力,V是体积,n是摩尔数,R是理想气体常数,T是温度。
在标准状态下,P1 = 1atm,V1 = 22.4L,T1 = 273.15K。
假设气体摩尔数n和温度T不变,仅压力变化到P2 = 3atm。
将已知条件代入理想气体状态方程,得到:\[ P1V1 = nRT1 \]\[ P2V2 = nRT2 \]由于n和R是常数,且T1 = T2(温度不变),我们可以简化方程为:\[ \frac{P1}{P2} = \frac{V2}{V1} \]代入已知数值:\[ \frac{1}{3} = \frac{V2}{22.4} \]\[ V2 = \frac{1}{3} \times 22.4 = 7.46667L \]所以,在3atm的压力下,该气体的体积约为7.47L。
题目二:热力学第一定律的应用题目内容:1摩尔的单原子理想气体在等压过程中吸收了100J的热量,如果该过程的效率为40%,求该过程中气体对外做的功。
详解答案:热力学第一定律表明能量守恒,即ΔU = Q - W,其中ΔU是内能的变化,Q是吸收的热量,W是对外做的功。
对于单原子理想气体,内能仅与温度有关,且ΔU = nCvΔT,其中Cv 是摩尔定容热容,对于单原子理想气体,Cv = 3R/2(R是理想气体常数)。
由于效率η = W/Q,我们有:\[ W = ηQ \]\[ W = 0.4 \times 100J = 40J \]现在我们需要找到内能的变化。
由于过程是等压的,我们可以利用盖-吕萨克定律(Gay-Lussac's law)PV = nRT,由于n和R是常数,我们可以简化为PΔV = ΔT。


物理化学考研复习题一、选择题1. 在理想气体状态方程PV=nRT中,下列哪个量是温度的函数?A. 压力PB. 体积VC. 物质的量nD. 气体常数R2. 根据热力学第一定律,系统吸收的热量Q与系统对外做的功W之间的关系是什么?A. Q = W + ΔUB. Q = W - ΔUC. Q = ΔU + WD. Q = ΔU - W3. 以下哪个选项描述的是熵的概念?A. 系统的能量B. 系统的混乱度C. 系统的质量D. 系统的体积4. 根据吉布斯自由能的表达式G = H - TS,下列哪个条件会导致吉布斯自由能降低?A. 温度升高B. 熵增加C. 焓增加D. 熵减少5. 电化学中,原电池的正极发生的反应类型是?A. 氧化反应B. 还原反应C. 电离反应D. 酸碱中和反应二、填空题6. 理想气体定律的数学表达式为______,其中P代表压力,V代表体积,n代表物质的量,R代表气体常数,T代表温度。
7. 根据热力学第二定律,不可能将热从低温物体传到高温物体而不引起其他变化,这被称为______。
8. 一个化学反应在恒定压力下进行,如果反应是放热的,那么该反应的焓变ΔH______0(填入“>”、“<”或“=”)。
9. 在电化学中,当电池的电动势大于零时,该电池是______电池(填入“原”或“电解”)。
10. 根据范特霍夫方程,当温度升高时,平衡常数K会______(填入“增加”或“减少”)。
三、简答题11. 简述热力学第二定律的开尔文表述和克劳修斯表述。
12. 解释什么是化学势,并说明它在化学反应平衡中的作用。
13. 描述电化学中的法拉第定律,并解释其在电镀过程中的应用。
四、计算题14. 假设一个理想气体在等压过程中从状态A(P=100kPa,V=2m³)变化到状态B(P=100kPa,V=4m³),计算过程中气体所做的功。
15. 一个化学反应在298K和1atm条件下的平衡常数K=10,如果温度升高到308K,假设反应的焓变ΔH=-50kJ/mol,计算新的温度下的平衡常数K'。

仅供参考,请勿外传计算题参考答案1.1mol 单原子理想气体的始态为300K ,500kPa 。
(1)在等温条件下向真空膨胀至100kPa ,求此过程的Q 、W 、U ∆、H ∆、S ∆、A ∆、G ∆。
(2)在恒压条件下,体积增至原来的两倍(V 2=2V 1), 求此过程的Q 、W 、U ∆、H ∆、S ∆。
解:(1) 因为向真空膨胀,等温过程,故:01=Q ,01=W ,01=∆U ,01=∆H J 4014kPa500kPa100ln K 300K mol J 8.314mol 1ln111211-=⨯⨯⋅⋅⨯==∆=∆--p p nRT G A 111211K J 38.13kPa100kPa 500ln K mol J 8.314mol 1ln---⋅=⨯⋅⋅⨯==∆p p nR S (2) 因为12212,V V p p ==,所以,由111222T Vp T V p =,得K 600212==T T J 6236K 300)(600K mol J 8.31425mol 1)(1112m ,22=-⨯⋅⋅⨯⨯=-==∆--T T nC Q H p J 3741K 300)(600K mol J 8.31423mol 1)(1112m ,2=-⨯⋅⋅⨯⨯=-=∆--T T nC U V J 2495J 6236J 3741222-=-=-∆=Q U W 1K600K300m,m ,2K J 4.14K300K600ln 8.314251d 1d 21-⋅=⨯⨯=⨯==∆⎰⎰T TC T TnC S p T T p2.1mol 理想气体,始态压力202650Pa ,体积为22.4dm 3,连续经历下列三个过程达到终态。
(1) 从始态可逆膨胀至B ,其压力为101325Pa ;(2)从B 再等容加热至C ,其温度为1091.9K ; (3)从C 再在等压条件下冷却至终态D ,其温度为545.9K 。

1.1mol 理想气体从298.15K,2P0经下列两条途径到达压力为1 P0的终态:(1)等温可逆膨胀;(2)自由膨胀,试求这两过程的ΔU 、ΔH 、Q 、W 、ΔS 、ΔG 和ΔA.2.试求1mol 理想气体从1000kPa,300K 等温可逆膨胀至100kPa 过程中的ΔU 、ΔH 、ΔS 、Q 、W 、ΔG 和ΔA 。
解:理想气体等温变化,因此:ΔU = ΔH =0; 设计同样始终状态的可逆过程,则:12114.191001000ln 314.81ln -⋅=⨯⨯===∆K J p p nR T Q S R kJ nRT p p nRT Vdp G 743.51000100ln 300314.811000100ln ln121001000-=⨯⨯⨯====∆⎰kJ p p nRT V V nRT pdV A 743.51000100ln 300314.81ln ln12121001000-=⨯⨯⨯==-=-=∆⎰或:()kJG nRT G pV G A 743.5)(-=∆=∆-∆=∆-∆=∆3.计算说明:-10℃、θp 下的过冷C6H6(l)变成定温定压的C6H6(s),该过程是否为自发过程。
已知1mol 过冷C6H6(l)的蒸汽压为2632Pa ,C6H6(s)的蒸汽压为2280Pa ,Cp,m(l)=127J·mol-1·K-1, Cp,m(s)=123J·mol-1·K-1,凝固热为9940J·mol-1。
解:该过程为不可逆相变,需将其设计为可逆过程,p 1为液态C 6H 6的蒸汽压,p 2为固态C 6H 6的蒸汽压。
),(66θp l H C ),(66θp s H C),(166p l H C ),(266p s H C),(166p g H C ),(266p g H C54321G G G G G G ∆+∆+∆+∆+∆=∆其中,042=∆=∆G G 为两个可逆相变过程。

物理化学考试题及答案一、选择题(每题2分,共20分)1. 以下哪个是物理化学中的基本概念?A. 质量B. 能量C. 熵D. 速度答案:C2. 根据热力学第一定律,能量守恒的数学表达式是:A. ΔU = Q - WB. ΔU = Q + WC. ΔH = Q - WD. ΔH = Q + W答案:B3. 理想气体状态方程是:A. PV = nRTB. PV = mRT/MC. P = nRT/VD. P = mRT/V答案:A4. 阿伏伽德罗常数的数值是:A. 6.02 × 10^23 mol^-1B. 6.02 × 10^26 mol^-1C. 6.02 × 10^32 mol^-1D. 6.02 × 10^-23 mol^-1答案:A5. 以下哪个不是热力学过程?A. 等温过程B. 等压过程C. 等熵过程D. 等速过程答案:D二、填空题(每空2分,共20分)6. 热力学第二定律表明,不可能从单一热源______而不产生其他影响。
答案:吸热使之完全转化为功7. 反应的吉布斯自由能变化(ΔG)是判断反应______的重要标准。
答案:自发性8. 化学平衡常数K与温度T的关系可以通过______方程来描述。
答案:范特霍夫9. 表面张力是液体表面分子之间相互吸引的力,它使得液体表面具有______。
答案:收缩趋势10. 根据分子运动论,气体分子的平均速率与温度成正比,其表达式为______。
答案:\( \sqrt{\frac{8kT}{\pi m}} \)(k为玻尔兹曼常数,m为分子质量)三、简答题(每题10分,共30分)11. 简述热力学系统与环境之间的能量交换方式。
答案:热力学系统与环境之间的能量交换主要有两种方式:做功和热传递。
做功是指系统与环境之间通过边界的位移变化来交换能量;热传递是指系统与环境之间由于温度差而发生的内能转移。
12. 描述熵的概念及其在热力学中的重要性。
1、在一定温度下,向某固定容积的密闭容器中加入1mol N₂和3mol H₂,发生如下反应:N₂(g) + 3H₂(g) ⇌ 2NH₃(g)。
当反应达到平衡时,测得N₂的转化率为60%,则此时容器中NH₃的体积分数为?A. 20%B. 40%C. 60%D. 80%(答案:B)2、某温度下,反应2A(s) + B(g) = 2C(g)的平衡常数为K,则在该温度下,反应C(g) = A(s) +0.5B(g)的平衡常数为?A. KB. 1/KC. √KD. 1/√K(答案:D)3、将0.1mol/L的醋酸溶液加水稀释,下列说法正确的是?A. 溶液中c(H⁺)和c(CH₃COO⁻)都增大B. 溶液中c(H⁺)增大,c(CH₃COO⁻)减小C. 醋酸的电离程度增大,c(H⁺)增大D. 醋酸的电离程度增大,但c(H⁺)减小(答案:D)4、对于反应A + B →C + D,如果A和B的初始浓度分别为0.1mol/L和0.2mol/L,反应进行到一半时,A的浓度为0.05mol/L,那么此时B的浓度为?A. 0.1mol/LB. 0.15mol/LC. 0.2mol/LD. 无法确定(答案:D)5、在一定条件下,某可逆反应的平衡常数为K,如果保持温度不变,增大反应物的浓度,则平衡常数K将?A. 增大B. 减小C. 不变D. 无法确定(答案:C)6、对于反应2SO₂ + O₂⇌ 2SO₃,在平衡状态下,如果增大O₂的浓度,平衡将如何移动?A. 向左移动B. 向右移动C. 不移动D. 无法确定(答案:B)7、在25℃时,某弱酸的电离平衡常数为Ka,则该酸的共轭碱的电离平衡常数为?A. KaB. 1/KaC. 水的离子积常数Kw/KaD. 无法确定(答案:C)8、对于反应A + B → C,如果反应物和生成物的初始浓度分别为[A]₀、[B]₀和[C]₀,且反应进行到某一时刻时,各物质的浓度分别为[A]、[B]和[C],则反应的转化率α(A)为?A. ([A]₀ - [A])/[A]B. ([A] - [A]₀)/[A]₀C. ([A]₀ - [A])/[A]₀D. ([A] - [A]₀)/[A](答案:C)9、在一定温度下,某溶液的pH值为5,则该溶液中氢离子浓度为?A. 10⁻⁵ mol/LB. 10⁻⁹ mol/LC. 10⁻¹⁴ mol/LD. 10⁻¹⁰ mol/L(答案:A)10、对于反应A + 2B →3C,如果A的初始浓度为0.2mol/L,B的初始浓度为0.4mol/L,反应进行到某一时刻时,A的浓度减少了0.1mol/L,则此时B的浓度为?A. 0.3mol/LB. 0.2mol/LC. 0.1mol/LD. 无法确定(答案:A)。
1.1mol 理想气体从298.15K,2P0经下列两条途径到达压力为1 P0的终态:(1)等温可逆膨胀;(2)自由膨胀,试求这两过程的ΔU 、ΔH 、Q 、W 、ΔS 、ΔG 和ΔA.2.试求1mol 理想气体从1000kPa,300K 等温可逆膨胀至100kPa 过程中的ΔU 、ΔH 、ΔS 、Q 、W 、ΔG 和ΔA 。
解:理想气体等温变化,因此:ΔU = ΔH =0; 设计同样始终状态的可逆过程,则:12114.191001000ln 314.81ln -⋅=⨯⨯===∆K J p p nR T Q S R kJ nRT p p nRT Vdp G 743.51000100ln 300314.811000100ln ln121001000-=⨯⨯⨯====∆⎰kJ p p nRT V V nRT pdV A 743.51000100ln 300314.81ln ln12121001000-=⨯⨯⨯==-=-=∆⎰或:()kJG nRT G pV G A 743.5)(-=∆=∆-∆=∆-∆=∆3.计算说明:-10℃、θp 下的过冷C6H6(l)变成定温定压的C6H6(s),该过程是否为自发过程。
已知1mol 过冷C6H6(l)的蒸汽压为2632Pa ,C6H6(s)的蒸汽压为2280Pa ,Cp,m(l)=127J·mol-1·K-1, Cp,m(s)=123J·mol-1·K-1,凝固热为9940J·mol-1。
解:该过程为不可逆相变,需将其设计为可逆过程,p 1为液态C 6H 6的蒸汽压,p 2为固态C 6H 6的蒸汽压。
),(66θp l H C ),(66θp s H C),(166p l H C ),(266p s H C),(166p g H C ),(266p g H C54321G G G G G G ∆+∆+∆+∆+∆=∆其中,042=∆=∆G G 为两个可逆相变过程。
物化期末复习5238某反应的化学计量方程式为12A+B=D+12S,其速率方程为:-d[B]/d t=2k[A]1/2[B],假如化学计量式写成A+2B=2D+S,问这反应的速率方程为。
533025℃时,乙酸乙酯与NaOH的皂化作用,反应的速率常数为6.36dm3·mol-1·min-1,若起始时酯和碱的浓度均为0.02mol·dm-3,试求10min后酯的水解百分数。
5439异烯丙基-烯丙基醚(A)在气态可异构化为烯丙基丙酮(B)。
即CH2=C(CH3)-O-CH2CH=CH2──→CH3CH2-CO-CH2CH=CH2实验测得k/s-1=5.4×1011exp(-12300J·mol-1/RT)(1)该反应的活化能为多少?(2)在T=423K时,当p A,0=1.000p∃,求p B=0.395p∃所需的时间?5619反应A+2B─→P的可能历程如下:A+B─→II+B2k⎯⎯→P其中I为不稳定的中间产物。
若以产物P的生成速率表示反应速率,试问:(1)什么条件下,总反应表现为二级反应(2)什么条件下,总反应表现为三级反应。
4111铅蓄电池工作时发生的电池反应为:()(A)Pb(s)+SO42-→PbSO4(s)+2e-(B)2PbSO4(s)+2H2O(l)→Pb(s)+PbO2(s)+2H2SO4(aq)(C)Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)(D)PbO2(s)+SO42-(aq)+4H++2e-→PbSO4(s)+2H2O(l)4468计算下述电池于298K时的电动势并判断电池的反应方向,Cu│Cu(OH)2(s)│OH-(0.1mol·kg-1)‖Cu2+(0.1mol·kg-1)│Cu已知φ∃(Cu2+/Cu)=0.337V,φ∃[Cu(OH)2(s)/Cu]=-0.224V40090.001mol·kg-1KCl与0.001mol·kg-1K4Fe(CN)6混合水溶液的离子强度I=。
物化下册复习题及答案一、选择题1. 以下哪种物质的摩尔质量与摩尔体积的比值等于密度?A. 气体B. 液体B. 固体D. 所有物质答案:B2. 在理想气体状态方程 PV = nRT 中,下列哪个变量是温度的函数?A. P(压强)B. V(体积)C. n(摩尔数)D. R(气体常数)答案:A3. 根据热力学第一定律,下列哪个选项正确描述了能量守恒?A. ΔU = Q + WB. ΔU = Q - WC. ΔU = W - QD. ΔU = Q / W答案:B4. 根据热力学第二定律,以下哪个说法是错误的?A. 热能自发地从高温物体传向低温物体。
B. 热机的效率不可能达到100%。
C. 熵总是增加的。
D. 可以制造一个完全无摩擦的机器。
答案:D5. 根据热力学第三定律,下列哪个说法是正确的?A. 绝对零度是不可能达到的。
B. 绝对零度下,所有物质的熵都是零。
C. 绝对零度下,物质的熵为负。
D. 绝对零度下,物质的熵是常数。
答案:A二、填空题6. 理想气体的内能只与________有关。
答案:温度7. 热力学温度与摄氏温度的关系是 T = t + ________。
答案:273.158. 一个系统与外界交换热量,但没有做功,此时系统的熵________。
答案:增加9. 根据热力学第二定律,不可能从单一热源吸热使之完全转化为功而不引起其他变化。
这是________定律的表述。
答案:开尔文-普朗克10. 绝对零度下,物质的熵达到________。
答案:最小值三、简答题11. 什么是热力学第一定律?请简述其物理意义。
答案:热力学第一定律是能量守恒定律在热力学过程中的体现,它表明在一个封闭系统中,能量既不能被创造也不能被消灭,只能从一种形式转化为另一种形式,或者从一个系统转移到另一个系统。
其数学表达式为ΔU = Q + W,其中ΔU 是系统内能的变化,Q 是系统吸收的热量,W 是系统对外做的功。
12. 解释什么是熵,并简述熵增加原理。
第1章 热力学基本原理(热力学第一定律)1、 300K 将1molZn Q p ,恒容反应热效应为Q v ,则Q p -Q v =( )J 。
无法判定2A. 必定改变B. 必定不变状态与内能无关3、1mol ,373K ,p o 下的水经下列两个不同过程达到(1 )A. W 1>W 2 Q 1>Q 2 W 1=W 2 Q 1=Q 2 D. W 1>W 2 Q 1<Q 2ΔHp = Qp ,所以:A.恒压过程中,焓不再是状态函数B.恒压过程中,体系与环境无功的交换D.恒压过程中, ΔU 不一定为零5、在非等压过程中加热某体系,使其温度从T 1升至T 2, 吸热Q, 则此过程的焓ΔH 为:A.ΔH=QB. ΔΔH 等于别的值6、若要通过节流膨胀达到制冷的目的,则节流操作应控制的条件是( ):A.0<⎪⎪⎭⎫ ⎝⎛∂∂-H T J p T μ0=⎪⎪⎭⎫ ⎝⎛∂∂-H T J p T μ D.不考虑μJ-T 的值7、下述哪一种说法正确?-汤姆孙系数μ一定不为零8、1mol 单原子理想气体从 298K ,202.65kPa 经历 ① 等温; ② 绝热; ③ 等压; 三条途径可逆膨胀使体积增加到原来的2倍,所作的功分别为W 1, W 2, W 3,三者的关系是:A. W 1> W 2> W 3W 3> W 2> W 1 D. W 3> W 1> W 29、下列说法中哪一个正确?水蒸气的生成热即是氢气的燃烧热C. 水的生成热即是氧气的燃烧热D. 水蒸气的生成热即是氧气的燃烧热10、 在298K 及101.325KPa 下的1.00dm 3 2.00 dm 3,所做功的绝对值为( )A 、0.418 JB 、0.0418 J 、7.11J11(Q+W)的变化是:; C. (Q+W)<0; D.不能确定12、同一温度下,同一气体的摩尔定压热容C p ,m 与摩尔定容热容C V ,m 之间的关系为:A 、 C p ,m < C V ,m ; B. C p ,m > C V ,m ; C. C p ,m = C V ,m ;13、 对于孤立体系的实际过程,下列关系式不正确的是( )A 、W=0B 、Q=0C 、△U=0 14、在P Ø下,C (石墨)+O 2(g )——>CO 2(g )的反应热为Δr H θm ,对于下列几种说法,哪种不正确?A. Δr H θm 是CO 2的标准生成热,B. Δr H θm 是石墨的燃烧热, C. Δr H θm =Δr U m ,15、焓是系统的状态函数,H=U+PV ,若系统发生状态变化时,ΔH=ΔU+Δ(PV),式中Δ(PV)的意思是:A 、P ΔV ; C 、 P ΔV- V ΔP ; D 、没有确定计算式16、 以下叙述中不正确的是( )A 体系的同一状态具有相同的体积B 体系的不同状态可具有相同的体积体系的某一状态函数改变,其状态一定改变17、经过一个循环过程,下面各个量的变化值不一定为零的是()。
一、判断题(正确打“√”,错误打“×”)1、处于临界状态的物质气液不分,这时Vm(g)=Vm(l)。
对2、在正常沸点时,液相苯和气相苯的化学势相等。
对3、绝热过程都是等熵过程。
错4、等温等压下的聚合反应若能自发进行,则一定是放热反应。
对5、气体的标准态是在标准压力下具有理想气体性质的纯气体。
对6、液体水在等温等压下可逆变为水蒸气,因温度不变,所以U也不变。
错7、当△H=Qp时,Qp就是状态函数。
错8、P1V1r =P2V2r只适用于理想气体可逆过程。
错9、绝热恒容过程,系统的△H=0。
错10、拉乌尔定律对理想液态混合物中任一组分都适用。
对11、理想气体分子之间无相互作用力,分子本身不占有体积。
对12、在正常沸点时,液相苯和气相苯的摩尔自由能相等。
对13、绝热过程是等温过程。
错19、功可全部转化为热,但热不能全部转化功。
错22、凡自发过程都要对外做功。
错24、理想液态混合物中各组分的分子间相互作用力完全相等。
对28、体系温度越高,其热能越大。
错29、1mol液态水在等温等压下可逆变为冰,过程的△G为零。
对30、绝热过程是等温过程。
错35、体系某状态函数变化决不会影响其它状态函数。
错37、恒温恒压下化学反应的熵变T GH S∆-∆=∆。
错52、纯组分的偏摩尔量等于其摩尔量。
对53、纯物质的化学势即为其摩尔吉布斯函数。
对54、物质总是从其化学势高的相向化学势低的相迁移,这一过程将持续至物质迁移达平衡时为止,此时系统中每个组分在其所处的相中的化学势相等。
对55、在高、低温热源间工作的所有可逆热机,其热机效率必然相等,与工作物质及其变化的类型无关。
对56、任意可逆循环的热温商之和为零。
对57、同分异构体,对称性越高,熵值越小。
对58、在恒温、恒容的条件下,增加反应物的量,无论是单独增加一种还是同时增加两种,都是会使平衡向右移动,对产物的生成有利。
对59、在恒温、恒压条件下,加入反应物却不一定总使平衡向右移动,反应物A与B的起始摩尔配比会对平衡移动产生影响。
10级储运复习计算题目
1、已知293K 时某电池标准电池电动势为1.0186V , ()P E T
∂∂= − 3.2×10 -3 V / K ,计算298K 时电池反应的Δr G m 、Δr H m 、Δr S m ,Q r 。
1解: Δr G m = −181.15kJ · mol Δr S m = − 617.6J / K· mol
Δr H m = −365.2 kJ · mol Q R = = − 184.0 kJ · mol
2、 25℃时,在同一电导池中,先装入c 为0.02mol/ dm3 的KCl 水溶液,测得其电阻为82.4Ω 。
将电阻池洗净,干燥后在装入c 为0.0025mol/ dm3 的K2 SO4水溶液,测得其电阻为326.0Ω。
已知25℃时0.02 mol/dm3 KCl 溶液的电导率为0.2768S/m 。
试求25℃时的:
(a )电导池的电池常数Kcell ;
(b )0.0025mol/dm3的K2 SO4溶液的电导率和摩尔电导率。
2(1) -1cell K =22.81m 124(K SO )0.06997S m κ-=⋅
21m 24(K SO )0.02799S m mol Λ-=⋅⋅
3、反应SO 2Cl 2SO 2 + Cl 2是一级的气相反应。
在320℃时,k =2.2×10-5 s -1。
问反应经过90 min 后SO 2Cl 2的分解百分数是多少?
3、解 x =0.112=11.2%
4、已知25℃时C(石墨),H 2(g),C 2H 6(g)的S 分别为5.69 J·K -1·mol -1,130.59 J·K -1·mol -1,229.49 J·K - 1·mol -1,C 2H 6(g)的∆f H =-84.68 kJ ·mol -1,试计算反应2 C(石墨) + 3 H 2(g) → C 2H 6(g)在25℃的标准平衡常数。
4、解: K =5.8×105
5、已知反应CCl 3COOH→CO 2+CHCl 3 在90℃时速率常数为 3.11×10-4s -1,70℃时为
1.71×10-5s -1,求该反应的活化能及50℃时的速率常数。
5、解: 该反应的活化能为E=1.50×105J·mol -1 k(50℃)=6.58×10-7s -1。
6、2mol 液体水在100℃和标准压力下蒸发,试计算此过程的△H,△S △G 和W 。
已知水在100℃和标准压力下蒸发为水蒸气的摩尔蒸发焓为40.67KJ.mol -1假设水的体积比之蒸气的体积可略去不计,蒸气作为理想气体.
6、解:
kJ ∆ H=81.34 1218.1J K ∆ S=-⋅ G 0∆= W 6.20kJ =-
7、在27 ℃时, 1mol 理想气体由106Pa 定温膨胀至105Pa,试计算此过程的△U 、 △H 、 △S
和 △G 。
7、解:∆U = 0,∆H = 0, -∆=1S 19.14J K · ∆=∆=-A G 5742J
8、已知NH 3(g),NO(g),及H 2O(g)25 ℃的标准摩尔生成热分别为
-46.191 kJ·mol -1;90.374 kJ·mol -1;-241.835 kJ·mol -1。
求25 ℃时2 mol NH 3(g)氧化成NO(g)及H 2O(g)反应的标准反应热∆r H ,∆r U 。
8, 2NH 3(g) + 5/2O 2(g) = 2NO(g) + 3H 2O(g)
∆r H =-452.38 kJ ∆r U =-453.62 kJ
9. 在40℃时,纯液体A 的饱和蒸气压是纯液体B 的饱和蒸气压的21倍,组分A 和B 形成理想液态混合物,当气液两相平衡时,若气相中A 和B 摩尔分数相等,试问液相中组分A 和B 的摩尔分数应为多少?
9 x B =0.95 x A =0.05
10.在136.7℃时,纯氯苯(A)的饱和蒸气压为115.7 kPa ,纯溴苯(B)为60.80 kPa 。
求101 325 kPa 下,能在上述温度沸腾的液态混合物的组成和蒸气组成。
设氯苯(A)和溴苯(B)组成理想液态混合物。
10 y A ==0.843 y B =0.157
11、已知在-33.6℃时,CO(g)在活性炭上的吸附符合朗缪尔直线方程。
经测定知,该(p /V )~p 直线的斜率为23.78 kg·m -3,截距为131 kPa·kg·m -3,试求朗缪尔方程中的常数V m 及b 。
11、解:斜率 m = 23.78 kg·m -3 = 1/V m
所以 V m = 1/m =0.0420 m 3 (STP)·kg -1
截距q = 131 kPa·kg·m -3 = 1/(V m ·b )
所以 b = 1/(V m ·q )
= 1/(0.0420 m 3·kg -1×131 kPa·kg·m -3)
= 1.82×10-4 Pa -1
12、200 ℃时测定O 2 在某催化剂上的吸附作用,当平衡压力为 0.1 MPa 及1 MPa 时,1 g 催化剂吸附O 2的量分别为2.5 cm 3及 4.2 cm 3 (STP) 设吸附作用服从朗缪尔公式,计算当O 2 的吸附量为饱和吸附量的一半时,平衡压力为多少。
12、解:bp
bp ΓΓ+=∞1 12212111bp bp p p ΓΓ++⋅= 即 ()()
Pa 101.01Pa 101111.02.45.266⨯+⨯+⋅=b b 所以 b = 12.2 ×10 -6 Pa -1
bp bp ΓΓ+=∞1 2
1=∞ΓΓ 即 211=+bp bp 所以 k P a 82Pa 1082Pa 102.1211
316=⨯=⨯==--b p
13、 已知A, B 两种液体完全互溶,且p *B >p*A ,在常压下具有最低恒沸混合物组成为D 。
13、解:(1)如图
试画出该系统T -x 图,p -x 图的草图;
14 、填作图题。
A-B 系统的固-液平衡相图如下:
(1)列表指出各区的相态及成分;
(2)画出aa’,bb’,cc’ 的冷却曲线的示意图;
(3)欲从a 系统中得最大量的纯结晶A ,应该采取什么操作条件?
14、填作图题。
解:(1)
(2) 步冷曲线如图。
(B )欲从a 系统中得到最大量纯结晶A ,应
该使温度降低至接近三相线MED 。
15、已知反应 (CH 3)2CHOH(g) == (CH 3)2CO(g) + H 2(g) 的C p ,m = 16.72 11mol K J -⋅-⋅⋅,在 457.4 K 时的K =0.36,在298.2 K 时
的∆r H = 61.5 kJ ·mol -1,求500 K 时反应的标准平衡常数
15、 K ( 500 K) = 1.53
16、反应2O 2(g) + S 2(g) == 2SO 2(g) 在298 K 至2 000 K 之间的K 与T 的关系为 : ()
37852lg 7.57/K K T θ=- 。
求 (1)反应在298 ~2 000K 之间的平均反应的标准摩尔焓;
(2) 1 000 K 时的K 。
16、解:(1)∆r H = -724.8 kJ ·mol -1
(2) K (1 000 K) = 301.910⨯。