SiO2+2NaOH=Na2SiO3+H2O
b. Na2SiO3+2CO2+2H2O=H2SiO3 ↓ +2NaHCO3
灼烧
c. H2SiO3==SiO2+H2O d. Al(OH)3能与酸.碱反应
2Al(OH)3+3H2SO4==Al2(SO4)3+6H2O Al(OH) +NaOH==NaAlO +2H O
巩固练习
3.铝在人体中积累可使人慢性中毒,1989年世 界卫生组织正式将铝确定为食品污染源之一而 加以控制。铝及其化合物在下列场合的使用须 加以控制的是 ( C) ①制铝锭 ②制易拉罐 ③制电线、电缆 ④制 包糖果用的铝箔 ⑤用明矾净水⑥制炊具 ⑦用 明矾和苏打作食物膨化剂 ⑧用氢氧化铝制胃 药 ⑨制防锈油漆 A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧ C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
返回
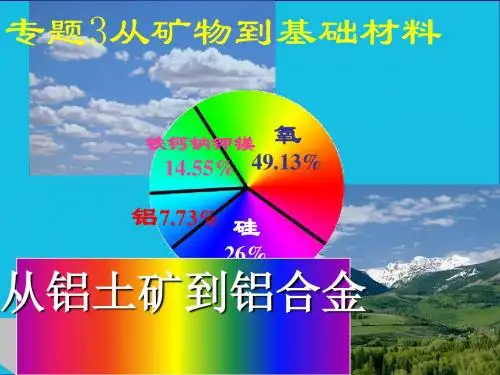
1.请同学们阅读62页,图3-2从铝土
问题讨论
2.铝土矿中的氧化铝与氢氧化钠溶液反应, 生成偏铝酸钠和水。向偏铝酸钠溶液中通 入二氧化碳,生成氢氧化铝沉淀和碳酸氢 钠,灼烧氢氧化铝得到氧化铝。请结合工 艺流程,写出从铝土矿制备氧化铝过程中 发生的化学反应方程式。 Al2O3+2NaOH=2NaAlO2+H2O
观察 与 思考
铝土矿
四、铝的冶炼 从铝土பைடு நூலகம்中提取铝
从铝土矿制备铝的工艺流程
二氧化碳 铝
溶解
过滤
酸化
过滤
灼烧
电解
NaOH溶液
残渣
滤液
H2O
问题讨论
矿制备的工艺流程,交流讨论,思考该 工艺分几步进行,每步的操作的作用 是什么? 1.溶解:用NaOH溶解Al2O3 2.过滤:除去杂质 3.酸化:从溶液中提取Al(OH)3 4.过滤:将Al(OH)3与溶液分离 5.灼烧:得到Al2O3 6.电解:制备Al