高一化学试题电解质及其电离练习题
- 格式:doc
- 大小:335.00 KB
- 文档页数:7

1.2.1 电解质的电离(精练)1.下列物质属于电解质的是( )A .氯化氢B .氨气C .石墨D .氯水【答案】A【解析】A .氯化氢的水溶液能够导电,属于酸,故属于电解质,A 符合题意;B .氨气的水溶液虽然能够导电,但由于不是其本身电离产生自由移动的离子,而是其与水反应的产物NH 3·H 2O 发生电离后才能导电,则NH 3属于非电解质,B 不合题意;C .石墨是单质,既不是电解质也不是非电解质,C 不合题意;D .氯水是混合物,既不是电解质也不是非电解质,D 不合题意;故答案为:A 。
2.下列物质能导电,但不属于电解质的是( )A .浓硝酸B .熔融的NaClC .3KNO 晶体D .液氨【答案】A【解析】A .浓硝酸是硝酸的水溶液,能导电,浓硝酸是混合物,既不是电解质又不是非电解质,故选A ;B .熔融的NaCl 中离子能自由移动,能导电,NaCl 是电解质,故不选B ;C .3KNO 晶体中离子不能自由移动,不能导电,3KNO 晶体属于电解质,故不选C ;D .液氨自身不能电离,不导电,液氨是非电解质,故不选D ; 故答案为:A 。
3.下列物质属于非电解质的是A .CuB .NaClC .NaOHD .32CH CH OH【答案】D【解析】A .Cu 为单质,既不是电解质,也不是非电解质,A 错误; B .氯化钠在水溶液和熔融状态下均能导电,为电解质,B 错误; C .氢氧化钠在水溶液和熔融状态下均能导电,为电解质,C 错误; D .乙醇在水溶液和熔融状态下均不能导电,为非电解质,D 正确; 故选D 。
4.(2022·北京怀柔·高一期末)下列物质中,属于电解质的是题组一 电解质与非电解质A.H2B.NaCl溶液C.Cu D.H2SO4【答案】D【解析】电解质是在水溶液或者熔融状态能导电的化合物,只有H2SO4是化合物、属于酸、属于电解质;H2、Cu都是单质,既不属于电解质又不属于非电解质;NaCl溶液是混合物,既不属于电解质又不属于非电解质;故答案为D。

第1课时电解质的电离夯实基础·轻松达标1.下列物质中能导电,但既不是电解质也不是非电解质的纯净物是( )A.熔融的NaClB.石墨晶体C.液氯D.盐酸项中熔融的NaCl能导电,它是电解质;B项中石墨晶体是单质,虽然能导电,但却既不是电解质也不是非电解质;C项中液氯是单质,不能导电;D项中盐酸是混合物。
2.下列叙述正确的是( )A.金属Na在熔融状态和溶于水时均能导电,所以Na是电解质B.SO3溶于水形成的溶液能导电,所以SO3是电解质C.通常情况下水不导电,所以水不是电解质D.氯化氢在液态时虽不导电,但溶于水后能导电,所以氯化氢是电解质是单质,既不是电解质,也不是非电解质,A项错误;SO3溶于水形成的溶液能导电,是由于SO3与水反应生成的硫酸发生电离而导电,所以SO3是非电解质,B项错误;水能发生微弱的电离,属于电解质,C项错误。
3.下列电离方程式书写错误的是( )A.BaCl2Ba2++Cl-B.Na2CO32Na++C O32-C.MgCl2Mg2++2Cl-D.Ba(OH)2Ba2++2OH-解析A项中的电离方程式没有配平,应写为BaCl2Ba2++2Cl-。
4.下列说法正确的是( )A.水的导电性很差,所以水是非电解质B.电解质与非电解质的本质区别是在一定条件下自身能否电离C.酸、碱和盐类都属于电解质,其他化合物一定都是非电解质D.NaCl和HCl都是电解质,所以它们在熔融状态下都能导电,A错;Na2O等活泼金属氧化物是电解质,C错;NaCl和HCl是电解质,但HCl在无水液体状态时不导电,D错。
5.下列关于酸、碱、盐的说法中,正确的是( )A.化合物电离时,生成的阳离子有氢离子的是酸B.化合物电离时,生成的阴离子有氢氧根离子的是碱C.能与碱发生反应生成水的化合物是酸D.NH4Cl的电离方程式是NH4Cl N H4++Cl-,所以NH4Cl是盐H+的化合物是酸,电离时生成的阳离子有H+的不一定是酸,如NaHSO4属于盐,A错;电离时生成的阴离子全部为OH-的化合物是碱,能电离出OH-的化合物不一定是碱,如Cu2(OH)2CO3属于盐,B错;能与碱反应生成水的化合物不一定是酸,如NaHSO4是盐,C错;NH4Cl属于盐,D正确。

电解质的电离练习题[合格基础练]1.下列物质容易导电的是( )①碳棒②铜丝③食盐固体④熔融NaCl ⑤乙醇⑥KNO3溶液A.全部 B.①②④⑥ C.②③⑤⑥ D.①②③④2.NaCl在熔融状态下能导电,其本质原因是( )A.是电解质 B.存在自由移动的电子 C.存在电子 D.存在自由移动的离子3.下列叙述正确的是( )A.固体氯化钠不导电,所以氯化钠不是电解质B.铜丝能导电,所以铜是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.CO2溶于水能导电,所以CO2是电解质4.下列电离方程式不正确的是( )A.H2SO4===2H++SO2-4 B.NH4NO3===NH+4+NO-3C.Na2CO3===Na+2+CO2-3 D.Ba(OH)2===Ba2++2OH-5.下列说法中正确的是( )A.稀硫酸是强电解质B.NaOH溶液能导电是因为溶液中有自由移动的Na+和OH-C.H2SO4在电流作用下,在水中电离出H+和SO2-4D.向盐酸中加入少量氢氧化钠固体,溶液的导电能力明显降低6.下列说法不正确的是( )A.酸都能在水溶液中电离出H+B.非金属元素不可能形成盐C.盐中不一定含有金属元素 D.盐中不一定含有氧元素7.下列物质中,导电性能最差的是( )A.石墨棒 B.盐酸 C.熔融氢氧化钠 D.固体氯化钾8.下列说法中正确的是( )A.氯化钠水溶液在电流的作用下电离出Na+和Cl-B.硫酸钡难溶于水,但硫酸钡属于强电解质C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质D.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2-9.今有10种物质:①铜;②稀硫酸;③氯化氢;④氨气;⑤空气;⑥二氧化碳;⑦金属汞;⑧氯化钠;⑨碳酸钙;⑩氯气。
将上述物质按要求填入下表。
(2) 电解质,但熔融状态下并不导电(3) 电解质,但难溶于水(4) 不是电解质,但本身能导电10.下图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线。


第二节离子反应第1课时电解质的电离(分层练习)1.下列物质能导电,但不属于电解质的是A.浓硝酸B.熔融的NaCl C.KNO3晶体D.液氨2.下列物质属于电解质且能导电的是A.金属铜B.碳酸钠晶体C.硝酸钠溶液D.熔融氯化钠3.下列说法正确的是A.酸、碱、盐都是电解质B.电解质都是易溶于水的物质C.氧化物都是电解质D.氢化物都不是电解质4.下列关于物质的分类中,均正确的是A.Cu丝——电解质;氢氧化钾——电解质B.二氧化硫——电解质;氧化钙——电解质C.NaCl溶液——非电解质;酒精——非电解质D.氧气——不属于电解质或非电解质;熔融的MgCl2——电解质5.根据电解质在溶液中的电离情况,我们划分出了酸、碱、盐,通过学习我们知道酸和碱都有通性,而盐是没有通性的,其本质原因是A.盐不能电离出阳离子B.盐不能电离出阴离子C.盐不能电离出H+或OH-D.盐不能电离出共同的离子6.仅能在水溶液中导电的电解质是A.NH3B.C2H5OH C.NaHCO3D.NaOH7.下列叙述中,正确的是A.干燥木棍不导电,但潮湿木棍导电,说明水的导电能力非常强B.熔融的KNO3能导电,所以KNO3是电解质C.铜丝、石墨均能导电,所以它们都是电解质D.NaOH溶于水,在通电条件下才能发生电离8.下列物质溶于水后,仅以分子形式存在的是A.乙醇B.醋酸C.醋酸钠D.硫酸钠9.下列电离方程式书写正确的是-A.把H2SO4放入水中:H2SO4=H2++SO24B.把KOH放入水中:KOH=K2++OH2--C.把NaHSO4放入水中:NaHSO4=Na++H++SO24-D.把BaCl2放入水中:BaCl2=Ba2++Cl210.下列电离方程式正确的是A.NaOH 电离方程式:NaOH=Na++H++O2-B.硫酸铝的电离方程式:Al2(SO4)3=Al23++(SO4)32-C.NaCl 的电离方程式:NaCl Na++Cl-D.硫酸电离方程式:H2SO4=2H++SO42-11.下列电离方程式正确的是A.硫酸氢钠的电离方程式:NaHSO4=Na++HSO4-B.MgCl2的电离方程式:MgCl2=Mg2++Cl22-C.氯酸钾的电离方程式:KClO3=K++Cl-+O2-D.碳酸钠的电离方程式:Na2CO3=2Na+ +CO32-12.下列物质在水溶液中的电离方程式书写错误的是A.CaCl2=Ca2++2Cl-B.NaHSO4=Na++H++SO42-C.HNO3=H++NO3-D.KClO3=K++Cl++3O2-13.下列物质在水中发生电离的电离方程式书写正确的是A.HNO3= H-+ NO3+B.Ba(OH)2 =Ba2++ OH2-C.NH4NO3 =NH4++NO3-D.CaO= Ca2+ + O2-14.下列电离方程式错误的是A.Al2(SO4)3=2Al3++ 3SO42-B.NaHCO3=Na++ HCO3-C.Ba(OH)2= Ba2+ + 2 OH-D.H2SO4=H2++SO42-15.下列说法中不正确的是①将硫酸钡放入水中不能导电,硫酸钡是非电解质;②氨溶于水得到氨水溶液能导电,氨水是电解质;③固态氯化氢不导电,液态氯化氢可以导电;④硫酸氢钠电离出的阳离子有氢离子,硫酸氢钠是酸;⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
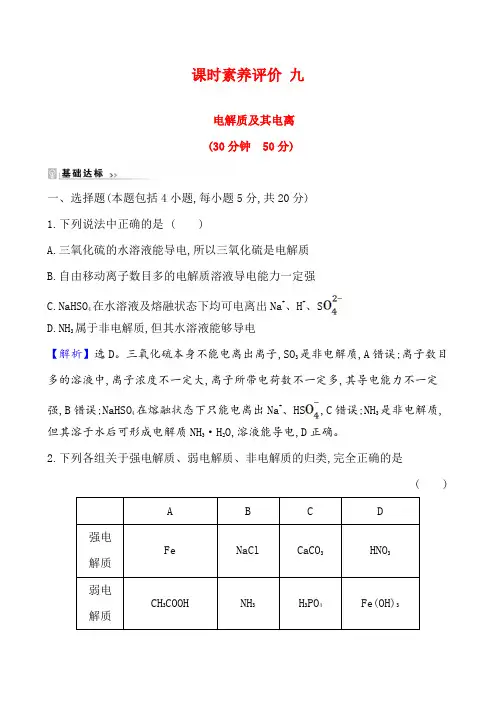
课时素养评价九电解质及其电离(30分钟50分)一、选择题(本题包括4小题,每小题5分,共20分)1.下列说法中正确的是 ( )A.三氧化硫的水溶液能导电,所以三氧化硫是电解质B.自由移动离子数目多的电解质溶液导电能力一定强C.NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、SD.NH3属于非电解质,但其水溶液能够导电【解析】选D。
三氧化硫本身不能电离出离子,SO3是非电解质,A错误;离子数目多的溶液中,离子浓度不一定大,离子所带电荷数不一定多,其导电能力不一定强,B错误;NaHSO4在熔融状态下只能电离出Na+、HS,C错误;NH3是非电解质,但其溶于水后可形成电解质NH3·H2O,溶液能导电,D正确。
2.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )A B C D强电Fe NaCl CaCO3HNO3解质弱电CH3COOH NH3H3PO4Fe(OH)3解质非电解质C12H22O11(蔗糖)BaSO4C2H 5OH(酒精)H2O【解析】选C。
铁既不是电解质,也不是非电解质,A项错误;NH3是非电解质,B项错误;碳酸钙是盐,为强电解质;磷酸是中强酸,是弱电解质;乙醇是非电解质,C 项正确;H2O是弱电解质,D项错误。
【易错提醒】判断电解质与非电解质应注意的问题(1)电解质和非电解质都是指化合物,单质、混合物既不是电解质,也不是非电解质。
(2)一种化合物不论是在水溶液里还是在熔融状态下能导电,就属于电解质;而非电解质必须是在这两种情况下均不导电的化合物。
(3)电解质是化合物,自身在水溶液中电离出离子而使得溶液导电,像SO2、NH3,两者的水溶液虽能够导电,但不能说SO2、NH3是电解质,因为导电的离子不是它们电离出来的,而是由它们与水作用分别生成H2SO3、NH3·H2O两种电解质所致。
所以只能说H2SO3、NH3·H2O是电解质,而SO2、NH3却不能称为电解质,类似的还有SO3、CO2、P2O5等。

高中化学《电解质的电离》练习题(附答案解析)学校:___________姓名: ___________班级: _____________一、单选题1. 下列物质属于电解质的是()A. 铜B. 葡萄糖C. 碳酸氢钠D. 食盐水2.下列电离方程式, 书写正确的是()A. Al2(SO4)3 = 2Al+3 + 3SOB. Mg(NO3)2 = Mg2++2NOC. KClO3= K+ +Cl5+ +3O2-D. FeCl3 = Fe2++Cl3. 下列有关物质的分类错误的是()A. 和蔗糖均属于非电解质B.将Na、分别投入饱和NaOH溶液中, 恢复原温度, 溶液浓度不变C. 和的水溶液均显酸性D. 苛性钠、纯碱分别属于碱和盐4.面对突如其来的新型冠状病毒, 越来越多人意识到口罩、医用酒精和双氧水的重要作用, 医用口罩由三层无纺布制成, 无纺布的主要原料是聚丙烯树脂。
下列说法正确的是()A. 医用酒精和双氧水都是非电解质B. 聚丙烯树脂属于纯净物C. 双氧水用于家庭消毒利用双氧水的氧化性D. 抗病毒疫苗冷藏存放的目的是避免蛋白质被氧化5. 判断下列物质中属于电解质的是()A. 氯化钠B. 蔗糖C. 金属铜D. 食盐水6. 下列物质属于电解质且能导电的是()A. 石墨B. 熔融NaClC. 液态HClD. 葡萄糖7.下列物质中, 属于电解质的是()A. CuB. H2SO4C. MgCl2溶液D. NH38.下列物质中, 属于酸的是()A. Na2OB. NaOHC. MgCl2D. H2SO49. 下列叙述中错误的是()A. 氯化钠固体不导电的原因是氯化钠固体中不含阴、阳离子B. 熔融态下能导电的物质不一定是电解质C. 硫酸不能导电而其水溶液能导电的原因是硫酸溶于水后在水分子的作用下产生自由移动的氢离子和硫酸根离子D.硫酸钡水溶液几乎不导电, 但硫酸钡是电解质10. 下列物质在水溶液中的电离方程式正确的是()A. B.C. D. (葡萄糖)11.将已污染的空气通入某溶液, 测其导电性的变化, 能获得某种污染气体的含量。

高一化学必修一电解质及其电离练习题及答案集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)高一化学必修一电解质及其电离练习题及答案1.下列物质中,属于电解质的是( )A.CO2 B.盐酸C.BaSO4 D.C2H5OH解析:判断某物质是否是电解质的要点有:是否是化合物,是否在水溶液或熔化状态下能电离出自由移动的离子。
CO2和C2H5OH是非电解质,盐酸是电解质溶液。
答案:C[来源:学*科*网]2.下列物质中有自由移动的氯离子的是( )A.氯化钠晶体B.熔化的氯化钾C.氯酸钾溶液D.液态氯化氢解析:氯化氢只有在水中溶解时才能产生自由移动的离子,故液态氯化氢不能电离。
氯酸钾溶于水虽能电离,但不产生自由移动的氯离子,产生的是氯酸根离子(ClO-3)。
氯化钠晶体中存在离子但不能自由移动。
当加热氯化钾时,热能破坏了阴、阳离子的相互作用,使离子自由移动,即发生电离。
综上所述:除氯化氢不存在离子,氯化钠、氯化钾、氯酸钾本身都存在离子,但NaCl中离子不能自由移动、KClO3虽能电离出自由移动的离子,但不是Cl-。
只有熔化的氯化钾能发生电离产生自由移动的氯离子。
答案:B3.关于酸、碱、盐的下列各种说法中,正确的是(双选)( )A.化合物电离时,生成的阳离子有氢离子的是酸B.化合物电离时,生成的阴离子有氢氧根离子的是碱C.化合物电离时,生成金属阳离子和酸根离子的是盐D.NH4Cl的电离方程式是:NH4Cl===NH+4+Cl-,所以NH4Cl是盐E.NaHSO4可以电离出H+,因此NaHSO4属于酸F.非金属元素不可能形成盐解析:A、B说法与定义不符,E中NaHSO4电离的阳离子除H+外还有Na+,因此不属于酸,NaHSO4应属于酸式盐。
非金属元素也能形成盐,例如铵盐。
故正确答案为CD。
答案:CD4.下列电离方程式错误的是( )A.NaHCO3===Na++H++CO2-3B.NaHSO4===Na++H++SO2-4C.CH3COOH CH3COO-+H+D.Na2SO4===2Na++SO2-4解析:A项HCO-3不能拆开写;B项正确,NaHSO4是强酸酸式盐,可完全电离;C项CH3COOH是弱酸,部分电离,用可逆号,正确;D项是强酸强碱盐,溶于水完全电离,正确。

高一化学(必修一)《第一章 电解质的电离》练习题及答案班级:___________姓名:___________考号:___________一、单选题1.下列说法中正确的是A .液态HCl 、固态NaCl 均不导电,所以HCl 、NaCl 均不是电解质B .蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质C .铜、石墨均导电,所以它们是电解质D .NH 3、CO 2的水溶液均导电,所以NH 3、CO 2均是电解质 2.下列说法正确的是A .水导电性很差,所以水是非电解质B .电解质与非电解质的本质区别,是在一定条件下能否电离C .酸、碱和盐都属于电解质,其他化合物都是非电解质D .NaCl 和HCl 都是电解质,所以它们在熔融状态下都能导电 3.下列电离方程式中,正确的是A .NaHCO 3=Na ++3HCO -B .KClO 3=K ++Cl -+3O 2-C .Ca(NO 3)2=Ca 2++2(NO)23-D .熔融状态下,NaHSO 4=Na ++H ++SO 24-4.下列说法正确的是A .氨水能导电,所以氨气是电解质B .盐酸是强电解质,所以导电能力比醋酸溶液强C .氯化银难溶于水,所以氯化银是非电解质D .蔗糖溶液和熔融的蔗糖都不能导电,所以蔗糖是非电解质5.下列物质中,①碘化氢 ②KF ③液氨 ④KClO ⑤液氯 ⑥浓H 2SO 4 ⑦干冰 ⑧NH 4NO 3 ⑨澄清石灰水 ⑩CaCO 3 ⑪酒精。
是强电解质的一组物质是 A .②④⑥⑧⑩B .①②④⑧⑩C .①②④⑥⑧D .①④⑥⑧⑩6.在水溶液中,下列电离方程式不正确的是( )A .2244H SO 2H SO +-+═B .44NaHSO Na HSO +-+═C .2233Na CO 2Na CO +-+═D .()22Ba OH Ba 2OH +-+═7.下表中物质的分类组合完全正确的是( )A .AB .BC .CD .D8.下列说法正确的是A .石墨有较好的导电性,所以石墨属于电解质B .实验可知NH 3的水溶液具有一定的导电性,所以NH 3是电解质C .液态HCl 、固态NaCl 均不能导电,所以HCl 、NaCl 均不是电解质D .蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖不是电解质 9.下列物质中含有自由移动的Cl -的是 A .KClO 3溶液B .MgCl 2溶液C .液态HClD .固态NaCl10.在以下各种情形下,下列电离方程式书写正确的是A .熔融状态下NaHSO 4的电离:NaHSO 4=Na ++H ++SO 24-B .水溶液中Ba(OH)2的电离:Ba(OH)2=Ba 2++OH -C .水溶液中NaHCO 3的电离:NaHCO 3=Na ++HCO 3-D .水溶液中Al 2(SO 4)3的电离: Al 2(SO 4)3=3Al 3++3SO 24-11.下列叙述正确的是( )A .NaCl 、MgCl 2等物质熔融状态时都导电,因此它们都是电解质B .HCl 、H 2SO 4液态时都不导电,因此它们都是非电解质C .易溶于水的化合物都是电解质D .浓溶液的导电能力一定强12.下列物质中既能导电,又属于强电解质的一组物质是( )A.石墨、醋酸溶液、食盐晶体B.熔融状态的KOH、熔融状态的NaClC.稀H2SO4、NaOH溶液、纯HNO3D.液氨、石灰水、水银13.某学生利用如图所示装置对电解质溶液导电性进行实验探究。

高一化学试题电解质及其电离练习题work Information Technology Company.2020YEAR(本栏目内容,在学生用书中以活页形式分册装订!)A组——知能训练1.下列物质中,属于电解质的是()A.CO2B.盐酸C.BaSO4D.C2H5OH解析:判断某物质是否是电解质的要点有:是否是化合物,是否在水溶液或熔化状态下能电离出自由移动的离子。
CO2和C2H5OH是非电解质,盐酸是电解质溶液。
答案:C2.下列物质中有自由移动的氯离子的是()A.氯化钠晶体B.熔化的氯化钾C.氯酸钾溶液D.液态氯化氢解析:氯化氢只有在水中溶解时才能产生自由移动的离子,故液态氯化氢不能电离。
氯酸钾溶于水虽能电离,但不产生自由移动的氯离子,产生的是氯酸根离子(ClO-3)。
氯化钠晶体中存在离子但不能自由移动。
当加热氯化钾时,热能破坏了阴、阳离子的相互作用,使离子自由移动,即发生电离。
综上所述:除氯化氢不存在离子,氯化钠、氯化钾、氯酸钾本身都存在离子,但NaCl中离子不能自由移动、KClO3虽能电离出自由移动的离子,但不是Cl-。
只有熔化的氯化钾能发生电离产生自由移动的氯离子。
答案: B3.关于酸、碱、盐的下列各种说法中,正确的是(双选)()A.化合物电离时,生成的阳离子有氢离子的是酸B.化合物电离时,生成的阴离子有氢氧根离子的是碱C.化合物电离时,生成金属阳离子和酸根离子的是盐D.NH4Cl的电离方程式是:NH4Cl===NH+4+Cl-,所以NH4Cl是盐E.NaHSO4可以电离出H+,因此NaHSO4属于酸F.非金属元素不可能形成盐解析:A、B说法与定义不符,E中NaHSO4电离的阳离子除H+外还有Na+,因此不属于酸,NaHSO4应属于酸式盐。
非金属元素也能形成盐,例如铵盐。
故正确答案为CD。
答案:CD4.下列电离方程式错误的是()A.NaHCO3===Na++H++CO2-3B.NaHSO4===Na++H++SO2-4C.CH3COOH CH3COO-+H+D.Na2SO4===2Na++SO2-4解析:A项HCO-3不能拆开写;B项正确,NaHSO4是强酸酸式盐,可完全电离;C项CH3COOH是弱酸,部分电离,用可逆号,正确;D项是强酸强碱盐,溶于水完全电离,正确。

电解质及其电离1.将NaCl固体溶解在水中,下列相关描述不正确的是( )A.NaCl===Na++Cl-B.NaCl溶液中存在自由移动的水合钠离子、水合氯离子C.该过程中,水分子的作用是氯化钠溶液能够导电的重要原因D.氯化钠固体中不存在钠离子、氯离子,所以氯化钠固体不导电解析:氯化钠固体中只存在Na+和Cl-,但这些离子均不能自由移动,故NaCl固体不导电。
答案:D2.下列关于纯净物、混合物、电解质和非电解质的正确组合是( )选项纯净物混合物电解质非电解质A 浓盐酸天然气硫酸干冰B 氢氧化钡蔗糖溶液硫酸钡三氧化硫C 胆矾石灰水苛性钾碳酸钙D 硫酸铝合金氯化钠氢气D项,氢气既不是电解质也不是非电解质。
答案:B3.下列电离方程式书写正确的是( )A.NaHCO3===Na++H++CO2-3B.NH4NO3===NH+4+NO-3C.H2SO4===2H++S2-+4O2-D.Ba(OH)2===Ba2++OH2-2解析:A项中HCO-3不能拆开。
C项中不能把硫酸根离子拆开,应该为H2SO4===2H++SO2-4。
D项中氢氧根离子书写错误,应该为Ba(OH)2===Ba2++2OH-。
答案:B4.下列物质中,导电性能最差的是( )A.石墨棒B.盐酸C.熔融氢氧化钠D.固体氯化钾解析:物质导电性能的优劣除与物质的本性有关外,还与物质的状态及外部条件有关。
石墨及金属单质都是电的良导体。
电解质溶液导电能力的大小取决于自由移动离子浓度的大小,盐酸中有自由移动的H+、Cl-,能导电。
熔融NaOH中,因NaOH===Na++OH-也存在自由移动的阴阳离子,故也能导电。
固体KCl虽为电解质,但因缺乏电离的条件,即在固体KCl中虽存在K+、Cl-,但因不能自由移动,故固体KCl不导电。
答案:D5.(1)下列物质的电离方程式如下:HClO4===H++ClO-4;Ba(OH)2===Ba2++2OH-;Al2(SO4)3===2Al3++3SO2-4;KHSO4===K++H++SO2-4。
高一化学必修一电解质及其电离练习[学业水平层次(A)]1.(2015·莆田二中高一检测)适度饮水有益于健康,但过量饮水使体内电解质浓度过低,导致生理紊乱而引起“水中毒”,下列属于人体内常见电解质的是() A.CO2B.NaClC.BaSO4D.葡萄糖【解析】NaCl、BaSO4属于电解质,CO2、葡萄糖属于非电解质;人体体液中离不开NaCl。
【答案】 B2.下列物质的水溶液能导电,但不属于电解质的化合物是()A.SO3B.Cl2C.NH4NO3D.HNO3【解析】SO3溶于水形成酸,能导电,但SO3不是电解质。
【答案】 A3.对下列物质进行的分类正确的是()A.纯碱、烧碱均属于碱B.CuSO4·5H2O属于电解质C.凡能电离出H+的化合物均属于酸D.盐类物质一定含有金属阳离子【解析】A项,纯碱是Na2CO3,属于盐;C项,NaHSO4、NaHCO3均能电离出H+,但它们均属于盐;D项,NH4Cl、NH4NO3等铵盐中不含金属阳离子;B项,CuSO4·5H2O是化合物,溶于水自身电离而使溶液导电,属于电解质。
【答案】 B4.下列关于电解质溶液的叙述正确的是()A.阳离子和阴离子总数一定相等B.阳离子带的正电荷总数一定和阴离子带的负电荷总数相等C.除阴、阳离子外,溶液中不再含有其他粒子D.NaCl溶液的导电性一定与KCl溶液的导电性相同【解析】依据溶液呈电中性,可知电解质溶液中阳离子带的正电荷总数与阴离子带的负电荷总数相等,B项正确、A项错误;电解质溶液中,一定含有H2O分子,有的还含有电解质分子,C不正确;不清楚NaCl和KCl两溶液中离子浓度大小关系,故无法比较其导电性强弱,D不正确。
【答案】 B5.下列说法正确的是()A.酸、碱、盐都是电解质B.难溶的物质一定不是电解质C.氧化物都是电解质D.氢化物都不是电解质【解析】电解质与非电解质是根据化合物能否在水溶液里或熔融状态下导电划分的,不是根据化合物的水溶性划分的,如CaCO3等物质难溶于水,但属于电解质,B项错;氧化物有的是电解质,如Na2O等离子化合物,有的不是电解质,如CO2等共价化合物,C项错;氢化物有的是电解质,如HCl等,有的不是电解质,如CH4等,D项错。
高一化学弱电解质的电离试题答案及解析1.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )A.相同浓度的两溶液中c(H+)相同B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PHD.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小【答案】BC【解析】A.盐酸是强酸,完全电离,醋酸是弱酸,只有部分发生电离。
当两种酸的浓度相等时电离产生的氢离子的浓度盐酸的大于醋酸的。
错误。
B.盐酸和醋酸都是一元酸,当二者的物质的量相等时中和碱的能力相等,即消耗的碱物质的量相等。
正确。
C.pH=3的两溶液都稀释10倍,盐酸的pH等于4.醋酸由于是弱酸,存在电离平衡,未电离的电解质分子会继续电离产生氢离子。
使的氢离子的浓度比盐酸大。
所以醋酸的PH 要比盐酸的小。
正确。
D.两溶液中分别加人少量对应的钠盐,c(H+)盐酸的不变,醋酸的电离平衡受到抑制,所以c(H+)明显减小。
错误。
【考点】考查影响强酸与弱酸溶液的酸性、稀释剂离子的浓度大小的关系的知识。
2.一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:(1)“O”点为什么不导电________.(2)a,b,c三点的pH由小到大的顺序是____________.(3) a、b、c三点中电离程度最大的是电离平衡常数Ka、Kb、Kc的大小关系为________.(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的 ________(填序号).A加热;B加很稀的NaOH溶液;C加NaOH固体;D加水;E加固体CH3COONa;F加入锌粒【答案】(1)纯净的醋酸不电离,不存在自由离子(2) b<a<c (3)c Ka=Kb=Kc (4) ACEF【解析】(1)冰醋酸是纯净的醋酸,只有电解质分子,没有发生电离。
没有自由移动的离子所以不能导电。
(2)自由移动的离子浓度越大,溶液的导电性就越强。
促敦市安顿阳光实验学校课时1 电解质及其电离考点1 电解质与非电解质1.(选考)下列属于电解质的是( )。
A.镁B.酒精C.硫酸铜D.食盐水答案:C解析:镁为单质,酒精为非电解质,食盐水为混合物。
2.(会考)电解质是一类在水溶液里或熔融状态下能够导电的化合物。
下列物质属于电解质的是( )。
A.铜B.蔗糖C.硝酸钾D.稀硫酸答案:C解析:铜为单质,蔗糖为非电解质,稀硫酸为混合物。
3.下列关于电解质、非电解质的叙述错误的是( )。
A.在水溶液熔融状态下均不导电的化合物叫非电解质B.电解质、非电解质都是针对化合物而言,单质不属于此范畴C.电解质在水溶液中一能导电,在水溶液中导电的化合物一是电解质D.纯水的导电性很差,但水也是电解质答案:C解析:A项叙述符合非电解质的概念,正确;B项,单质既不是电解质,也不是非电解质,正确;C项,CO2溶于水与水反生成的H2CO3能电离出离子而导电,但不是CO2自身的电离,CO2属于非电解质,错误;D项,水能电离出H+、OH-,属于电解质,正确。
4.下列关于电解质电离的叙述中正确的是( )。
A.CaCO3在水中溶解度很小,其导电能力很弱,所以CaCO3是弱电解质B.AgCl在水中溶解度很小,但溶解的AgCl电离,所以AgCl是强电解质C.氯气(Cl2)和氨气(NH3)的水溶液导电性都很好,所以它们都是电解质D.水难电离,纯水几乎不导电,水是非电解质答案:B解析:CaCO3和AgCl是强电解质,因为其在水中溶解的电离,A项错误,B项正确;Cl2是单质,既不属于电解质,又不属于非电解质,NH3在水溶液中自身不能电离出离子,不是电解质,氨气的水溶液之所以能够导电是因为NH3与水反生成了弱电解质NH3·H2O,C项错误;水是弱电解质,D项错误。
5.(2019·一中期末考试)下列说法正确的是( )。
①难溶于水的盐(CaCO3、BaSO4)都是非电解质②不是电解质的物质一是非电解质③强酸溶液中氢离子浓度一大于弱酸溶液中氢离子浓度④电解质溶液导电的原因是溶液中有自由移动的阴离子和阳离子⑤熔融的电解质都能导电A.①③⑤⑥B.②④⑤C.④D.⑤答案:C解析:CaCO3、BaSO4虽难溶于水,但它们是电解质,故①错误;单质既不是电解质,也不是非电解质,故②错误;极稀的强酸溶液中氢离子浓度比极浓的弱酸溶液中氢离子浓度小,故③错误;熔融的H2SO4不能导电,故⑤错误。
电解质的电离[基础达标]1.(2021·山东泰安检测)下列物质中,能够导电的电解质是()A.Cu B.熔融MgCl2C.酒精D.蔗糖B[Cu能导电,但Cu是单质,既不是电解质也不是非电解质,故A错误;熔融MgCl2中含有能自由移动的Mg2+和Cl-,能导电,所以熔融MgCl2是能够导电的电解质,故B正确;酒精、蔗糖中均没有能自由移动的阴、阳离子,不能导电,都是非电解质,故C、D错误。
]2.下列物质溶于水时,不能电离出酸根离子的是()A.NaNO3B.Ba(OH)2C.KMnO4D.KClB[氢氧化钡是碱,电离出的是氢氧根离子,其他三种物质均能电离出酸根离子。
] 3.(2021·福清市华侨中学期中)下列物质在水溶液中的电离方程式错误的是()A.CaCl2===Ca2++2Cl-B.NaHSO4===Na++H++SO2-4C.HNO3===H++NO-3D.KClO3===K++Cl++3O2-D[氯酸钾是强电解质,电离方程式为KClO3===K++ClO-3,D错误。
]4.下列各组均为两种互不反应化合物溶于水时电离出的离子,其中由酸电离的是() A.Na+、OH-、SO2-4B.H+、Cl-、SO2-4C.Na+、K+、OH-D.Na+、K+、NO-3B[依据酸的概念——电离产生的阳离子全部是H+的化合物,B符合题意。
]5.下列都是中学化学常见的物质:①Cu②NaCl③NaHSO4④SO2⑤H2SO4⑥C2H5OH(酒精)⑦CaCO3⑧BaSO4⑨Cu(OH)2⑩NaOH请按下列分类标准回答:(1)属于电解质的是________________(填序号,下同)。
(2)溶于水能电离出H+的是________,属于酸的是________。
(3)属于难溶性碱的是________,属于难溶性盐的是________。
答案:(1)②③⑤⑦⑧⑨⑩(2)③⑤⑤(3)⑨⑦⑧[能力提升]6.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。
1.2.1 电解质的电离(同步练习)一、选择题1.适度饮水有益于健康,但过量饮水使体内电解质浓度过低,导致生理紊乱而引起“水中毒”。
下列属于人体内常见电解质的是()A.二氧化碳B.氯化钠C.硫酸钡D.葡萄糖2.下列物质中,含有自由移动的Cl-的是()A.KClO3溶液B.CaCl2溶液C.KCl晶体D.液态氯化氢3.下列说法中正确的是()A.酸、碱、盐都是电解质B.电解质都是易溶于水的物质C.氧化物都是电解质D.氢化物都不是电解质4.电解质是指在水溶液中或熔融状态下能够导电的化合物。
几名同学对此定义中关键词发表了以下理解或看法,你认为不正确的是()A.“或”字意味着水溶液中、熔融状态下这两个条件只需具备其中之一就行了B.“能够导电”是指该物质本身能够导电,而不是它发生反应后的生成物能导电C.“化合物”指明了该物质不能是单质,更不能是混合物D.像硫酸钡、碳酸钙这样难溶于水的化合物就不可能是电解质了5.下列说法正确的是()A.石墨有较好的导电性,所以石墨属于电解质B.实验可知NH3的水溶液具有一定的导电性,所以NH3是电解质C.液态HCl、固态NaCl均不能导电,所以HCl、NaCl均不是电解质D.蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖不是电解质6.下列电离方程式中正确的是A.Ca(OH)2══Ca2++2(OH-)B.FeCl3══Fe2++3Cl-C.H2SO4══H++SO2-4D.Al2(SO4)3══2Al3++3SO2-47.下列物质属于非电解质的是()A.盐酸B.葡萄糖C.Na2SO4D.石墨8.下列有关物质分类的说法错误的是()A.SiO2、P2O5均为非电解质B.碘酒、氢氧化钠溶液均为混合物C.乙醇为电解质D.NaCl晶体、HCl气体均为电解质9.下列说法中正确的是()A.AgCl不溶于水,所以它不是电解质B.SO3溶于水得到的水溶液可以导电,所以SO3是电解质C.NaOH溶液能导电,所以NaOH溶液是电解质D.固体CuSO4不能导电,但CuSO4是电解质10.下列电离方程式中错误的是()。
现吨市安达阳光实验学校电解质的电离1.下列说法正确的是( )。
A.凡是能导电的物质都是电解质B.电解质溶液能导电的原因是溶液中有自由移动的离子C.盐酸能导电的原因是溶液在电流作用下电离生成了自由移动的离子D.凡是能电离的物质一能导电【答案】B【解析】金属单质能导电,但不是化合物,故排除A项;电解质电离是水分子作用的结果,而非电流作用的结果,故排除C项;电解质能导电需具备两个条件:即有离子并且离子能自由移动,两个条件同时具备才能导电。
例如NaCl 晶体在水溶液里或熔化状态下能导电,但固态的NaCl晶体中Na+、Cl-不能自由移动,故NaCl晶体能电离但不能导电,所以选B。
2.下列各组中的物质都是电解质的是( )。
A.H2O、NH3·H2O、HNO3、CH3CH2OHB.HCl、NaBr、SO3、Na3PO4C.CuSO4、NaOH、BaSO4、CH3COOHD.NH3、Na2CO3、BaSO4、NaI【答案】C【解析】CH3CH2OH 、SO3、NH3不是电解质。
3.根据电解质在溶液中的电离情况,从电解质中划分出了酸、碱、盐,酸和碱都有通性,而盐没有通性,其本质原因是( )。
A.盐不能电离出阳离子 B.盐不能电离出阴离子C.盐不能电离出H+或OH- D.盐不能电离出共同的离子【答案】D【解析】不同的盐电离出不同的阳离子或阴离子,不同的盐不能电离出共同的离子,而酸能电离出共同的阳离子H+,碱能电离出共同的阴离子OH-。
4.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。
则下列溶液的沸点最高的是( )。
A.0.01 mol/L的蔗糖溶液 B.0.01 mol/L的CaCl2溶液C.0.02 mol/L的NaCl溶液 D.0.02 mol/L的CH3OOH溶液【答案】C【解析】选项C中Na+和Cl-总浓度=0.02 mol·L-1+0.02 mol·L-1=0.04 mol·L-1,离子数最多。
(本栏目内容,在学生用书中以活页形式分册装订!)A组——知能训练1.下列物质中,属于电解质的是()A.CO2B.盐酸C.BaSO4D.C2H5OH解析:判断某物质是否是电解质的要点有:是否是化合物,是否在水溶液或熔化状态下能电离出自由移动的离子。
CO2和C2H5OH是非电解质,盐酸是电解质溶液。
答案:C2.下列物质中有自由移动的氯离子的是()A.氯化钠晶体B.熔化的氯化钾C.氯酸钾溶液D.液态氯化氢解析:氯化氢只有在水中溶解时才能产生自由移动的离子,故液态氯化氢不能电离。
氯酸钾溶于水虽能电离,但不产生自由移动的氯离子,产生的是氯酸根离子(ClO-3)。
氯化钠晶体中存在离子但不能自由移动。
当加热氯化钾时,热能破坏了阴、阳离子的相互作用,使离子自由移动,即发生电离。
综上所述:除氯化氢不存在离子,氯化钠、氯化钾、氯酸钾本身都存在离子,但NaCl中离子不能自由移动、KClO3虽能电离出自由移动的离子,但不是Cl-。
只有熔化的氯化钾能发生电离产生自由移动的氯离子。
答案:B3.关于酸、碱、盐的下列各种说法中,正确的是(双选)()A.化合物电离时,生成的阳离子有氢离子的是酸B.化合物电离时,生成的阴离子有氢氧根离子的是碱C.化合物电离时,生成金属阳离子和酸根离子的是盐D.NH4Cl的电离方程式是:NH4Cl===NH+4+Cl-,所以NH4Cl是盐E.NaHSO4可以电离出H+,因此NaHSO4属于酸F.非金属元素不可能形成盐解析:A、B说法与定义不符,E中NaHSO4电离的阳离子除H+外还有Na+,因此不属于酸,NaHSO4应属于酸式盐。
非金属元素也能形成盐,例如铵盐。
故正确答案为CD。
答案:CD4.下列电离方程式错误的是()A.NaHCO3===Na++H++CO2-3B.NaHSO4===Na++H++SO2-4C.CH3COOH CH3COO-+H+D.Na2SO4===2Na++SO2-4解析:A项HCO-3不能拆开写;B项正确,NaHSO4是强酸酸式盐,可完全电离;C项CH3COOH是弱酸,部分电离,用可逆号,正确;D项是强酸强碱盐,溶于水完全电离,正确。
答案:A5.下列化合物中,只有在溶于水之后才能导电的电解质是(双选)()A.NaCl B.CH3CH2OH(酒精)C.H2SO4D.NH4HCO3解析:酒精属于非电解质,B项不符合题意;NaCl、H2SO4、NH4HCO3均为电解质,NaCl溶于水或熔融状态下均能导电,NH4HCO3、H2SO4溶于水均导电,但H2SO4在液态时难导电,NH4HCO3受热易分解,无熔融状态,故C、D符合题意。
答案:CD6.已知溶液中存在下列离子,试判断该溶液的溶质并写出其电离方程式:(1)H+、Cl-________________________________________________________________________。
(2)Fe3+、SO2-4________________________________________________________________________。
(3)Na+、HCO-3________________________________________________________________________。
(4)NH+4、NO-3________________________________________________________________________。
答案:(1)溶质是HCl,电离方程式为:HCl===H++Cl-(2)溶质是硫酸铁,电离方程式为:Fe2(SO4)3===2Fe3++3SO2-4(3)溶质是碳酸氢钠,电离方程式为:NaHCO3===Na++HCO-3(4)溶质是硝酸铵,电离方程式为:NH4NO3===NH+4+NO-37.回答下列问题:(1)金属导电是因为存在________________________________________________________________________;(2)电解质溶液导电,是因为存在________________________________________________________________________;(3)液态氯化氢不导电,是因为________________________________________________________________________;(4)氯化氢水溶液能导电,是因为________________________________________________________________________;(5)氯化钠晶体不导电,是因为________________________________________________________________________;(6)熔融的氯化钠能导电是因为_______________________________________________________________________。
答案:(1)自由移动的电子(2)自由移动的离子(3)只有氯化氢分子,无离子存在(4)氯化氢在水分子作用下发生电离,产生了自由移动的H+、Cl-(5)氯化钠晶体中的Na+、Cl-不能自由移动(6)熔化状态下由于热能作用,氯化钠发生电离,产生了自由移动的Na+、Cl-B组——拔高训练8.下列叙述正确的是()A.NaCl溶液在电流作用下电离成Na+与Cl-B.溶于水后能电离出H+的化合物都是酸C.氯化氢溶于水能导电,但液态氯化氢不能导电D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多解析:电解质电离的条件是溶于水或受热熔化,不是通电。
电解质要导电的前提是电解质在水溶液中或熔融状态下电离出自由移动的离子,故A项错误;酸的定义中强调电离出的阳离子全部为H+,如NaHSO4也能电离出H+,但NaHSO4属于盐类,故B项错误;HCl溶于水能电离出自由移动的H+和Cl-,所以能导电,但液态HCl是由分子组成的,无离子,不能导电,故C项正确;溶液的导电性主要由溶液中自由移动离子的浓度决定,即由单位体积中自由移动离子的数目决定,故D项错误。
答案:C9.硫酸氢钠(NaHSO4)通常为晶体,易溶于水。
硫酸氢钠溶于水电离出三种不同的离子,溶液显酸性;硫酸氢钠受热熔化后只能电离出两种不同的离子。
(1)硫酸氢钠在水中电离的方程式是________________________________________________________________________。
(2)硫酸氢钠在熔融状态下电离的方程式是________________________________________________________________________。
(3)下列说法中,正确的是(多选)()A.硫酸氢钠属于酸B.硫酸氢钠属于盐C.硫酸氢钠属于电解质D.硫酸氢钠溶液跟锌单质反应生成氢气解析:硫酸氢钠的化学式为NaHSO4,它溶于水电离出三种不同的离子,且溶液显酸性,则硫酸氢钠在水中电离出的离子是Na+、H+和SO2-4。
硫酸氢钠受热熔化后只能电离出两种不同的离子,这两种离子是Na+和HSO-4。
由硫酸氢钠在水中的电离结果可知,硫酸氢钠既属于盐又属于电解质,不属于酸;硫酸氢钠溶液中存在大量H+,能跟锌单质反应生成氢气。
答案:(1)NaHSO4===Na++H++SO2-4(2)NaHSO4===Na++HSO-4(3)BCDA组——知能训练1.(2010·11泰安高一检测)下列叙述中正确的是()A .凡是强电解质在离子方程式中都要以离子的形式来表示B .离子反应一定使溶液中所有离子的浓度都发生变化C .复分解反应必须具备离子反应的某个条件D .酸碱中和反应都能用离子方程式:H ++OH -===H 2O 表示解析: 不溶性的盐大多数为强电解质,在离子方程式中应以化学式的形式表示,A 错;不参加反应的离子其浓度不变,B 项错;弱酸或弱碱参与的中和反应不能用H ++OH -===H 2O 表示,D 错。
答案: C 2.(2010·10福州一中质检)下列离子方程式中正确的是( ) A .碳酸钠溶液与石灰乳的反应:CO 2-3+Ca 2+===CaCO 3↓B .硝酸银溶液与食盐水的反应:Ag ++Cl -===AgCl↓ C .锌与盐酸的反应:Zn +2H ++2Cl -===Zn 2++2Cl -+H 2↑D .向沸水中滴加FeCl 3溶液制备Fe(OH)3胶体:Fe 3++3H 2O=====△Fe(OH)3↓+3H +解析: A 项应为CO 2-3+Ca(OH)2===CaCO 3+2OH -;C 项应为Zn +2H +===Zn 2++H 2↑;D 项应为Fe 3++3H 2O=====△Fe(OH)3(胶体)+3H +。
答案: B3.下列各组离子在水溶液中能够大量共存的是( )A .Ba 2+、Cl -、NO -3、Ca 2+B .H +、Na +、SO 2-4、CO 2-3C .Cu 2+、K +、Cl -、OH -D .Ca 2+、Na +、CO 2-3、Cl - 解析: 离子在水溶液中能够大量共存,就是相互间不发生化学反应,即不能反应生成沉淀、气体、弱电解质。
B 项中H +与CO 2-3反应;C 项中Cu 2+与OH -反应;D 项中Ca 2+与CO 2-3反应。
答案: A4.在强酸性无色透明溶液中,下列各组离子能大量共存的是( )A .Cu 2+、K +、Cl -、NO -3B .Ag +、Na +、NO -3、SO 2-4C .Na +、Al 3+、SO 2-4、Cl -D .Ba 2+、NH +4、Cl -、CH 3COO -解析: A 项:四种离子可以大量共存,但Cu 2+在溶液中是有色的,不符合题意;B 项:Ag +与SO 2-4反应生成Ag 2SO 4沉淀,不能大量共存;C 项:四种离子可大量共存,符合题设条件;D 项:四种离子可以大量共存,但CH 3COO -会与题干中隐含的条件“强酸性”暗示的H +反应,不符合题意。
答案: C5.某溶液中可能含有较大量的Cl -、CO 2-3、OH -等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是:①滴加Mg(NO 3)2溶液;②过滤;③滴加AgNO 3溶液;④滴加Ba(NO 3)2溶液( )A .①②④②③B .④②①②③C .①②③②④D .④②③②①解析: 首先滴加足量Ba(NO 3)2溶液,如果出现白色沉淀,证明有CO 2-3,同时除去CO 2-3;过滤后,在滤液中加入足量Mg(NO 3)2溶液,如果出现白色沉淀,证明有OH -,同时除去OH -;过滤后,滴加AgNO 3溶液,如果出现白色沉淀,证明有Cl -。