第一阶段 专题二 第1讲 物质结构和元素周期律
- 格式:ppt
- 大小:1.86 MB
- 文档页数:53

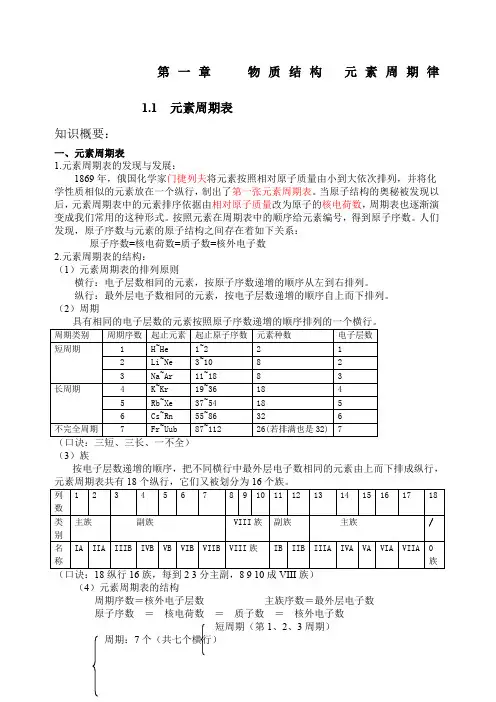
第一章物质结构元素周期律1.1 元素周期表知识概要:一、元素周期表1.元素周期表的发现与发展:1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表。
当原子结构的奥秘被发现以后,元素周期表中的元素排序依据由相对原子质量改为原子的核电荷数,周期表也逐渐演变成我们常用的这种形式。
按照元素在周期表中的顺序给元素编号,得到原子序数。
人们发现,原子序数与元素的原子结构之间存在着如下关系:原子序数=核电荷数=质子数=核外电子数2.元素周期表的结构:(1)元素周期表的排列原则横行:电子层数相同的元素,按原子序数递增的顺序从左到右排列。
纵行:最外层电子数相同的元素,按电子层数递增的顺序自上而下排列。
(2)周期(3)族按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,(4)元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数短周期(第1、2、3周期)周期:7个(共七个横行)周期表长周期(第4、5、6、7周期)主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素(5)认识周期表中元素相关信息随堂检测(一)1.已知某主族元素的原子结构示意图如下,判断其位于第几周期?第几族?2.主族元素在周期表中的位置取决于该元素的()A.相对原子质量和核外电子数B.电子层数和最外层电子数C.相对原子质量和最外层电子数D.电子层数和次外层电子数3.下列各表为周期表的一部分(表中为原子序数),其中正确的是()A.B.C.D.4.,同一周期ⅡA、ⅢA的两种元素的原子序数差可能为几?5.已知元素的原子序数,可以推断元素原子的()①质子数②核电荷数③核外电子数④离子所带电荷数A.①③B.②③C.①②③D.②③④6.由长周期元素和短周期元素共同构成的族是()①0族②主族③副族④第Ⅷ族A.①②B.①③C.②③D.③④7.下列说法中正确的是()A.现行元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的B.最外层电子数相同的元素一定属于同一族C.非金属元素的最外层电子数都≥4D.同周期元素的电子层数相同二、元素的性质与原子结构1.碱金属元素:从原子结构上看:相同点:最外层都只有一个电子。

第一章 物质结构 元素周期律第一节 元素周期表一、原子结构....1. 原子核得构成原子 A Z X核电荷数(Z) = 核内质子数 = 核外电子数 = 原子序数2、质量数将原子核内所有得质子与中子得相对质量取近似整数值加起来,所得得数值,叫质量数。
XA Z ——元素符号质量数——核电荷数——(核内质子数)表示原子组成的一种方法a ——代表质量数;b ——代表质子数既核电荷数;c ——代表离子的所带电荷数;d ——代表化合价e ——代表原子个数请看下列表示a b+dXc+e质量数(A)= 质子数(Z)+ 中子数(N)阳离子 a W m+ :核电荷数=质子数>核外电子数,核外电子数=a -m阴离子 b Y n -:核电荷数=质子数<核外电子数,核外电子数=b +n补充:1、原子就是化学变化中得最小粒子;2、分子就是保持物质得化学性质中得最小粒子;3、元素就是具有相同核电荷数即核内质子数得一类原子得总称二、核素、同位素......1、定义:核素:人们把具有一定数目质子与一定数目中子得一种原子称为核素。
同位素:质子数相同而中子数不同得同一元素得不同核素(原子)互为同位素。
2、同位素得特点 ①化学性质几乎完全相同原子核核外电子 Z 个中子 (A -Z)个质子 Z 个②天然存在得某种元素,不论就是游离态还就是化合态,其各种同位素所占得原子个数百分比(即丰度)一般就是不变得。
练习:1、法国里昂得科学家最近发现一种只由四个中子构成得粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。
下列有关“四中子”粒子得说法不正确得就是( )A.该粒子不显电性B.该粒子质量数为4C.与氢元素得质子数相同D.该粒子质量比氢原子大2、已知A2-、B-、C+、D2+、E3+五种简单离子得核外电子数相等,与它们对应得原子得核电荷数由大到小得顺序就是___________ 。
3、现有b X n-与aY m+两种离子,它们得电子数相同,则 a 与下列式子有相等关系得就是( )(A)b-m-n (B) b+m+n(C)b-m+n (D) b+m-n4、某元素得阳离子R n+,核外共用x个电子,原子得质量数为A,则该元素原子里得中子数为( )(A)A-x-n (B)A-x+n (C)A+x-n (D)A+x+n三、元素周期表得结构........1、编排原则:①按原子序数递增得顺序从左到右排列②将电子层数相同......得各元素从左到右排成一横行..。
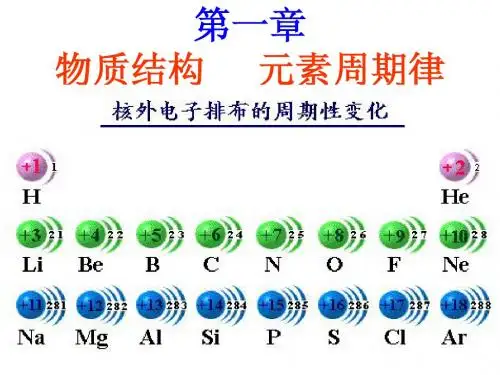


第四章元素周期律第1节原子结构与元素周期表“元素周期表”是必修一模块第四章。
新课程标准对本节内容要求是:认识原子结构、元素性质与元素在元素周期表中位置的关系。
知道元素和核素的含义,了解原子核外电子的排布。
结合有关数据和实验事实认识原子结构、元素性质呈现周期性变化的规律,构建元素周期律。
知道元素周期表的结构,以第三周期的钠、镁、铝、硅、硫、氯,以及碱金属和卤族元素为例,了解同周期和主族元素性质的递变规律。
给出的活动与探究建议是:查阅元素周期律的发现史料,讨论元素周期律的发现对化学科学发展的重要意义。
元素周期律这部分内容始终是高中化学概念理论部分的重点内容之一。
在新课程中,更加关注概念理论知识的建构过程和各部分知识间的联系。
课程标准规定或建议的核心教学活动凸现了概念理论的建构过程,更注重科学学习方法的教育。
【宏观辨识与微观探析】1、知道核外电子能量高低与分层排布的关系。
2、能够根据核外电子排布规律写出常见简单原子的原子结构示意图。
3、能说出元素周期表的编排原则及其结构。
4、能根据原子序数确定元素在周期表中的位置。
5、知道元素、核素的含义。
【科学态度与社会责任】1、了解原子结构模型演变。
2、了解元素周期表的发展历史。
1、核外电子排布规律写出常见简单原子的原子结构示意图。
2、能说出元素周期表的编排原则及其结构。
3、知道元素、核素、同位素的含义。
投影、电脑视频【引入】丰富多彩的物质世界是由一百多种元素组成。
那么这些元素之间有什么内在联系吗?它们是如何相互结合形成多种多样的物质呢?原子结构与元素周期表之间有什么样的关系呢?【科学史话】原子结构模型的演变【提问】原子由什么构成?什么叫质量数?质量数=质子数+中子数【板书】……【讲解】一、原子结构1.电子层(1)概念:在多电子原子里,把电子运动的的区域简化为的壳层,称作电子层。
(2)不同电子层的表示及能量关系a、在多电子原子里,电子的能量不同。
b、在离核近的区域运动的电子的能量较低,在离核远的区域运动的电子的能量较高。

第一讲物质结构和元素周期律一年模拟题1. (2012.杭州.第一次质检)下列说法正确的是()A.用火焰上灼烧后闻气味和焰色反应等方法都可鉴别纤维素和蛋白质B.1828年德国化学家武勒通过蒸发氰酸铵水溶液得到尿素,其意义在于找到了合成尿素的一种实用途径C.道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立作出了卓越的贡献D.测定出土文物标本中14C在碳元素中原子数含量的减少程度,可推算文物的大致年代【答案】D【解析】鉴别纤维素和蛋白质只需灼烧闻气味即可,不需要用焰色反应,A项错误;人工合成尿素的意义在于否定了有机物不可以通过无机物合成的说法,B项错误;C项中的门捷列夫没有给出过原子结构模型;D项是对14C性质的应用,说法正确。
2. (2012.郑州.第一次质量预测)依据元素周期律及元素周期表知识,下列推断正确的是A.酸性:H2SiO3>H2CO3B.热稳定性:H2Se>H2S>H20C.碱性:CsOH〉Ca(OH)2D.若离子半径:R2—>M+,则原子序数:R〉M【答案】C【解析】碳、硅同主族,碳的非金属性比硅强,故酸性H2CO3>H2SiO3,A项错误;非金属性O>S>Se,故氢化物的稳定性H20>H2S>H2Se,B项错误;若离子半径:R2—>M+,则原子序数: M>R,D项错误。
3. (2012.福州.期末)下列有关物质的性质或结构的说法正确的是A.第二周期元素最高价与其原子最外层电子数相等B.Na的原子半径比Cl的大,但Na+的半径比Cl一的小C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱D.Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4【答案】B【解析】A项,第二周期元素中主族元素的最高价与其原子最外层电子数相等,零族元素不符合此规律,A错误;B项,钠离子有两个电子层而氯离子有三个电子层,所以钠离子的半径小于氯离子的半径,B正确;C项,碱金属元素单质的还原性随原子序数的增大而增大,C错误;D项,高氯酸的酸性强于高碘酸,D错误。


专题检测卷(四)专题二基本理论第1讲物质结构和元素周期律(45分钟100分)一、选择题(本题包括7小题,每小题6分,共42分)1.(2013·海南高考)重水(D2O)是重要的核工业原料,下列说法错误的是()A.氘(D)原子核外有1个电子B.1H与D互称同位素C.H2O与D2O互称同素异形体D.1O与O的相对分子质量相同2.下列对非金属元素(除稀有气体元素外)的相关判断正确的是()①非金属元素都是主族元素②单质在反应中都只能作氧化剂③氢化物常温下都是气态,所以都叫气态氢化物④氧化物常温下都可以与水反应生成酸⑤非金属元素R所形成的含氧酸盐(M a RO b)中的R元素必定呈现正价A.②⑤B.①③⑤C.②③④D.①⑤3.(2012·大纲版全国卷)元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。
X元素为()A.AlB.PC.ArD.K4.(2013·南平质检)如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是()A.离子半径:N>ZB.氢化物的稳定性:M<NC.失电子能力:Y>ZD.单质的氧化性:N<X5.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲与丙同主族,丁元素原子最外层电子数是其电子层数的2倍。
下列说法正确的是()A.简单离子半径:甲<乙<丙<丁B.单质的还原性:乙<甲<丙<丁C.乙、丙、丁的最高价氧化物对应的水化物能两两相互反应D.甲、乙、丙、丁的单质一定条件下都能和氧气直接化合6.(2013·龙岩质检)下列关于原子结构、元素周期表和元素周期律的说法正确的是()A.核外电子排布相同的简单离子一定是同周期元素B.位于金属与非金属的交界处的铝、硅元素,属于过渡元素C.由水溶液的酸性:H2SO3>H2CO3,可推断出元素的非金属性:S>CD.Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)27.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。


1.(2011年高考山东卷)元素的原子结构决定其性质和周期表中的位置。
下列说法正确的是()A.元素原子的最外层电子数等于元素的最高化合价B.多电子原子中,在离核较近的区域内运动的电子能量较高C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素解析:选C。
有些元素的最高价不等于最外层电子数,如O、F等元素,故A错;根据核外电子排布规律,能量低的电子在离核较近的区域内运动,能量高的电子在离核较远的区域内运动,故B错;元素的得电子能力越强,其最高价氧化物对应的水化物的酸性越强,故C正确;周期表中位于金属和非金属分界线附近的元素通常既显一定的金属性,又显一定的非金属性,而过渡元素是指副族和第Ⅷ族元素。
故D错。
2.(2010年高考海南卷)短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。
下列化合物中同时存在极性和非极性共价键的是()A.Z2Y B.X2Y2C.Z2Y2D.ZYX解析:选B。
短周期元素X、Y、Z所在的周期数依次增大,故X、Y、Z所在的周期分别是第一周期、第二周期和第三周期,又因为Y2-与Z+核外电子层的结构相同,所以Y是氧元素,Z为钠元素,根据它们的原子序数之和为20,可知X的原子序数为20-8-11=1,3.(2011年高考天津卷)以下有关原子结构及元素周期律的叙述正确的是()A.第ⅠA族元素铯的s两种同位素137Cs比133Cs多4个质子B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强D.同主族元素从上到下,单质的熔点逐渐降低解析:选B。
A项,137Cs比133Cs多4个中子,两者质子数相等。
C项,氢化物的稳定性随元素非金属性的增强而增强。
D项,同主族元素从上到下,碱金属单质的熔点逐渐降低,第ⅦA族单质的熔点逐渐升高,而第ⅤA族单质的熔点先升高后降低,故D项错误。
一、单项选择题1.德国重离子研究中心于2010年2月19日宣布,经国际纯粹与应用化学联合会确认,由该中心合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”,。
有报道称该元素原子含有165个中子。
下列有关112号元素的相关说法正确的是()A.该原子可表示为165112CnB.该元素的相对原子质量为277C.该原子的核外电子数为112D.该原子能够稳定存在解析:选C。
该原子的质量数为:112+165=277,A项不正确;元素的相对原子质量是各种同位素相对原子质量的平均值,B项不正确;元素周期表中84号元素以后的元素均为放射性元素,不能稳定存在,故D项不正确;元素的原子序数=质子数=核外电子数,C 项正确。
2.(2011年高考安徽卷)中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是()A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO解析:选D。
Mg的第一电离能大于Al,A错误;卤素中的氟无正价,B错误;未标明温度,故pH=6.8的溶液不一定显酸性,C错误;CO2通入NaClO溶液中能生成HClO是根据较强酸可以制取较弱酸的规律,D正确。
3.下列叙述中,错误的是()A.原子半径:Na>Mg>OB.13C和14C属于化学性质不同的同位素C.ⅦA族元素是同周期中非金属性最强的元素D.N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强解析:选B。
根据同周期元素原子半径从左到右依次减小,同主族元素从上到下原子半径依次增大可知A项正确;互为同位素的原子,其化学性质几乎完全相同,B项错误;根据同周期元素非金属性从左到右依次增强可知C项正确;根据同主族元素从上到下非金属性依次减弱,其最高价氧化物对应水化物酸性依次减弱,D项正确。
高考化学一轮复习目录第一章化学计量在实验中的应用第1 讲物质的量、气体摩尔体积第2 讲物质的量浓度第二章化学物质及其变化第1 讲物质的组成、性质及分类第2 讲离子反响离子方程式第3 讲氧化复原反响的根本概念第4 讲氧化复原反响的规律和应用第三章金属及其化合物第1 讲碱金属元素——钠第2 讲铁及其化合物第3 讲镁及其化合物第4 讲铝及其化合物第四章常见的非金属及其化合物第1 讲无机非金属材料的主角——硅第2 讲富集在海水中的元素——氯第3 讲硫及其化合物第4 讲氮的氧化物和硝酸第5 讲氨和铵盐第五章物质结构与元素周期律第1 讲元素周期表第2 讲元素周期律第3 讲化学键第六章化学反响中的能量变化电化学第1 讲化学反响中的能量变化实验探究:中和热的测定第2 讲原电池化学电源第3 讲电解池金属的电化学腐蚀与防护第七章化学反响速率和化学平衡第1 讲化学反响速率第2 讲化学反响的方向和限度第3 讲化学平衡移动第八章水溶液中的离子平衡第1 讲弱电解质的电离平衡第2 讲水的电离和溶液的酸碱性第3 讲盐类的水解第4 讲难溶电解质的溶解平衡第九章认识有机化合物第1 讲有机物的结构特点和分类第2 讲研究有机化合物的方法第十章烃第1 讲脂肪烃第2 讲芳香烃第十一章烃的衍生物第1 讲卤代烃第2 讲醇酚第3 讲醛羧酸酯第十二章根本营养物质、高分子化合物第1 讲根本营养物质第2 讲进入合成有机高分子化合物的时代第十三章化学实验根底第1 讲化学实验根底知识实验探究:“仪器改造〞与“一器多用〞第2 讲物质的检验、别离和提纯第3 讲实验方案的设计与评价第4 讲探究性化学实验。
第一章物质结构元素周期律知识点总结1、元素周期表:H 元素周期表HeLi Be B C N O F Ne Na Mg24.Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br KrRb Sr Y Zr Nb Mo95.Tc[98]Ru101.Rh102.Pd106.Ag107.Cd112.In114.Sn118.Sb121.Te127.I126.Xe131.Cs 132.Ba137.La-LuHf178.Ta180.W183.Re186.Os190.Ir192.Pt195.Au197.Hg200.Tl204.Pb207.Bi209.Po[210]At[210]Rn[222]Fr [223 ]Ra[226]Ac-La2、元素周期表的结构分解:周期名称周期别名元素总数规律具有相同的电子层数而又按原子序数递增的顺序排列的一个横行叫周期。
7个横行7个周期第1周期短周期2电子层数 == 周期数(第7周期排满是第118号元素)第2周期8第3周期8第4周期长周期18第5周期18第6周期32第7周期不完全周期26(目前)族名类名核外最外层电子数规律周期表中有18个纵行,第8、9、10三个纵行为第Ⅷ族外,其余15个纵行,每个纵行标为一族。
7个主族7个副族0族第Ⅷ族主族第ⅠA族H和碱金属1主族数 == 最外层电子数第ⅡA族碱土金属2第ⅢA族3第ⅣA族碳族元素4第ⅤA族氮族元素5第ⅥA族氧族元素6第ⅦA族卤族元素70族稀有气体2或8副族第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族一、碱金属元素:1、锂钠钾铷铯钫(Li、Na、K、Rb、Cs、Fr)2、递变规律:同主族的元素随着原子序数的递增,最外层电子数相同,电子层数增多,原子半径在增大。
3、物理特性:①颜色逐渐加深;②密度不断增大(Na>K);③熔沸点逐渐降低;④均是热和电的良导体。