氧气的性质和用途
- 格式:ppt
- 大小:606.50 KB
- 文档页数:25

氧气的物理性质和用途
氧气的性质分为物理性质和化学性质。
氧气的物理性质是无色无味气体,熔点-218.8℃,沸点-183.1℃,相对密度1.14。
化学性质是氧气的化学性质比较活泼。
除了稀有气体、活性小的金属元素如金、铂、银之外,大部分的元素都能与氧气反应,这些反应称为氧化反应,而经过反应产生的化合物称为氧化物。
氧气的用途是冶炼工艺、化学工业、国防工业、医疗保健等。
冶炼工艺:在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。
高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。
在有色金属冶炼中,采用富氧也可以缩短冶炼时间提高产量。
化学工业:在生产合成氨时,氧气主要用于原料气的氧化,以强化工艺过程,提高化肥产量。
再例如,重油的高温裂化,以及煤粉的气化等。
国防工业:液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧炸药。
医疗保健:供给呼吸:用于缺氧、低氧或无氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
以下是氧气的储运方法的相关介绍:
大气层氧气的出现源于两种作用,一个是非生物参与的水的光解,一个是生物参与的光合作用。
生物的光合作用对大气层的影响巨大。
它造成了大气层由还原氛围向氧化氛围的转变。
使得水光解产生的氢气能重新被氧化为水回到地球而不至于扩散到外层空间去,从而防止了地球上的水的流失。
同时光合作用也加速了大气层氧气的积累,深刻地改变了地球上物种的代谢方式和体型。


氧气的性质和用途主要内容氧气是地球大气中的重要成分之一,也是生物体必需的重要气体之一、其性质及用途具体如下。
性质:1.物理性质:氧气是无色、无味、无臭的气体,它比空气略重,密度为1.43kg/m³。
它是一种较差的热导体,在常温下不易溶于水,但溶于液态氮、液氩和液氢之中,同时也能溶于一些有机液体。
2.化学性质:与其它元素发生广泛的反应。
氧气与大多数物质发生燃烧反应,它是维持生物氧化代谢过程的必需因子。
氧气还能与金属反应生成金属氧化物,与非金属元素反应生成非金属氧化物。
用途:1.呼吸用途:人体对氧气的需求量很大,绝大部分用于供给人类和动物的呼吸作用。
氧气的呼吸用途广泛,包括医学用气、急救、潜水、高原缺氧症的治疗等。
2.燃烧用途:由于氧气具有支持燃烧的性质,广泛应用于燃烧反应。
例如,氧气与燃料混合使用,可以提高燃料的燃烧速度和燃烧效果,被广泛用于工业生产及实验室中的火焰试验。
3.氧割用途:氧气有很强的氧化剂性质,可用于金属材料的切割、焊接和钎焊等工作。
在氧割过程中,将氧气与燃烧燃料(如乙炔)混合,使金属材料迅速氧化和燃烧,实现金属材料的切割。
4.氧化反应用途:氧气参与的氧化反应广泛应用于工业领域,如金属氧化反应用于制造金属氧化物,制造化工原料等。
5.卫生用途:氧气在医学上被广泛应用于调节人体有关生理功能失调的情况,如缺氧、窒息等。
同时氧气也可用于保持无菌状态,杀灭微生物等。
6.水处理用途:氧气可用于水的处理。
氧气在水中的溶解度较高,可通过充氧的方式供给水体中的溶解氧,提高水质。
7.工业用途:氧气在工业上有很多用途,如铁矿石的炼铁、炼钢等冶金工序中需要氧气作为氧化剂,合成氨、乙烯、乙醇等化学工艺中氧气也是必需物质。
需要注意的是,氧气作为一种强氧化剂具有一定的危险性,对于一般人群来说,要避免无故接触高纯度的氧气,以免引发意外事故。
此外,正常的大气中的氧气浓度为21%,过高或过低的氧气浓度对人体都可能造成危害,因此在使用氧气时应注意安全性。


初中化学教案:氧气的性质和用途一、基本概念氧气,化学符号为O2,是一种具有高度活性的非金属元素。
在空气中,氧气的含量约为21%左右,绝大部分生物都必须依靠它呼吸才能生存。
二、氧气的性质1. 氧气的物理性质•外观:氧气是一种无色、无臭、无味的气体。
•密度:氧气的密度比空气略大,为1.429 g/L。
•熔点和沸点:氧气的熔点为-218.4℃,沸点为-182.96℃。
•溶解度:氧气很难溶解在水中,但可溶于乙醇等有机溶剂。
2. 氧气的化学性质•氧气是一种高度活性的气体,它与大多数非金属元素(如碳、硫、氮等)能够直接反应,生成相应的氧化物。
•氧气还能与金属元素反应,产生相应的金属氧化物。
例如,钠与氧气反应生成氧化钠:2Na + O2 → 2Na2O。
三、氧气的用途1. 氧气在生命活动中的应用•呼吸:氧气是呼吸作用必需的气体之一,生物通过吸入空气中的氧气来进行细胞呼吸,产生能量。
•医疗:氧气的医疗用途十分广泛,可用于缓解呼吸困难、治疗各种呼吸系统疾病等。
•潜水:潜水员需要进行呼吸氧气的训练,以便在深海中进行作业。
2. 氧气在工业生产中的应用•燃烧:氧气是燃烧所必需的氧化剂,可用于氧气炉、氧气切割等。
•化学合成:许多化学反应需要氧气的参与才能进行,如焙烧白垩土等。
•氧气在生产中还可用于氧化碱金属、干燥烟丝、制造火箭燃料等。
四、教学提醒•学生在学习氧气的性质和用途时,可结合实验进行学习,通过实践感受氧气的特性。
•在掌握氧气的基本概念和性质的基础上,可以引导学生了解和探究氧化反应的相关知识。
•对于学生的安全教育十分重要,需注意学生在实验过程中的安全防护。


氧气的性质和用途初中化学知识点总结
1、氧气的物理性质:不易溶于水,密度比空气的略大。
液氧、固态氧淡蓝色。
2、氧气的用途:气焊、航天、潜水、登山、医疗、液氧炸药、炼铁、炼钢
3、氧气的化学性质:支持燃烧,有助燃性。
可供呼吸用,是常用的氧化剂。
⑴木炭在氧气中燃烧(O2可使带火星的木条的木条复燃)C+O2点燃CO2
现象:发出白光,放出热量,生成使石灰水变浑浊的气体
⑵硫在空气中燃烧,硫在氧气中燃烧S + O2 点燃SO2
硫在空气里燃烧发出微弱的淡蓝色火焰,产生有刺激性气味的气体,放出热量;
在氧气里燃烧发出蓝紫色火焰,产生有刺激性气味的气体;放出热量
⑶磷在空气中燃烧4P + 5O2点燃2P2 O5
现象:发出白光,产生大量的白烟,放出热量
白磷着火点低,易自燃,要放在水中密封保存,可隔绝空气,防止它自燃。
氧气的性质
1.物理性质
学习氧气的物理性质时,不要死记硬背,应结合具体的氧气,采用比较的方法,抓住重点,如氧气的熔沸点较低、密度比空气略大、不易溶于水等。
2.化学性质
(1)氧气的助燃性
带有火星的木条在氧气中能够复燃,说明氧气能支持燃烧。
常用这种方法检验氧气。
(2)与硫反应
硫跟氧气发生化学反应,生成有刺激性气味的二氧化硫,并放出热量。
其反应可以表示如下:
硫+氧气点燃生成二氧化硫
(3)与铁反应
细铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁黑色固体。
这个反应可以表示如下:
铁+氧气点燃生成四氧化三铁。

氧气的性质和用途氧气是一种无色、无味、无毒、可燃的气体,是地球大气中最常见的元素之一,占地球大气中的约21%,化学符号为O。
氧气具有以下几个主要的性质和用途:1.性质:(1)氧气是一种氧化剂,能够与很多物质进行氧化反应,促进其燃烧。
例如,燃烧过程就是指物质与氧气反应生成二氧化碳、水等物质释放出大量的热能;(2)氧气具有杀菌消毒的作用,可以抑制微生物的生长和繁殖,被广泛用于医疗保健、制药行业;(3)氧气是一种重要的气象制造原料,用于气象仪器的推进气体;(4)氧气可被液化为液氧,液氧常用于火箭推进剂、航天器的气源,提供足够的氧气供应以满足太空环境中的氧气需求。
2.用途:(1)医疗用途:氧气在医疗行业中是一种重要的气体,常用于供应氧气治疗各类呼吸系统疾病,如哮喘、肺炎等。
此外,氧气还可用于手术室、产房、急救车等场合的氧气供应。
(2)工业用途:氧气在工业生产中广泛应用。
因为氧气能促进燃烧,故广泛用于钢铁、有色金属、石油等工业的冶炼和熔炼过程。
(3)化工用途:氧气常被用作氧化剂,参与各种化学反应。
如氧气可以与氢气反应生成水,以氧气作为氧化剂,例如氧化锌、硫酸等。
(4)环保用途:氧气在环保方面也有重要的应用。
例如,废气处理器中使用氧气来氧化或还原有害物质,使其变为无害物质,起到净化空气的效果。
(5)航空航天用途:氧气在航空航天领域起着重要作用。
例如,航空器、火箭等的动力系统需要氧气作为氧化剂进行燃烧,提供推力和能量,从而实现飞行和太空探索。
(6)潜水用途:氧气在潜水时被广泛使用。
潜水员需呼吸氧气以维持生命,并提供给潜水员所需的气体,以便在水下更长时间地从事工作或进行探索。
总而言之,氧气是一种十分重要的气体,具有广泛的应用领域。
从人们的生活、医疗到工业、航空航天等多个领域中,氧气都起到了至关重要的作用。

氧气的性质和用途一、氧气的物理性质:1、通常氧气是无色无味的气体;2、氧气的密度比空气大,标况下密度是1.429g/L ;3、氧气不易溶于水;4、氧气能发生三态变化。
液氧、固态氧呈淡蓝色——储存在蓝色钢瓶二、氧气的检验:1、检验氧气的实验实验步骤:把带火星木条伸到盛有氧气的集气瓶中,观察现象。
实验现象:带火星木条复燃实验结论:氧气能支持燃烧。
氧气具有助燃性。
补充:(1)在空气中,带火星木条不复燃,并逐渐熄灭;在氧气中,带火星木条复燃,并剧烈燃烧。
(2)带火星木条不复燃有两种可能:一是不含氧气,二是氧气含量太低;(3)鉴别两种气体(其中一种是氧气)时,可使用带火星木条;(4)鉴别三种或三种以上的气体(其中一种为氧气)时,可使用燃着木条。
2、氧气的检验 把带火星木条伸入集气瓶中,若木条复燃,则证明该集气瓶中所装气体是氧气。
三、氧气的化学性质:1、几种可燃物燃烧实验【实验1】硫的燃烧实验步骤:……燃烧匙……集气瓶…… 实验现象:硫在空气中燃烧的现象硫在氧气中燃烧的现象 硫在空气中燃烧产生微弱的淡蓝色火焰,生成刺激性气味气体,同时放出大量热。
硫在氧气中燃烧产生明亮的蓝紫色火焰, 生成刺激性气味气体, 同时放出大量热。
实验结论:硫在空气和氧气中都能燃烧,在氧气中燃烧更旺。
文字表达式:硫+氧气——→二氧化硫点燃 注:硫粉点燃后燃烧匙需要由上至下缓慢地插入集气瓶中,目的是______________________。
【实验2】铁丝的燃烧实验步骤:……螺旋状……火柴……快燃尽时……集气瓶……实验现象:铁丝在氧气中剧烈燃烧,火星四射,放出大量热,生成黑色固体。
实验结论:铁丝能在氧气中燃烧,生成四氧化三铁。
文字表达式:铁+氧气——→四氧化三铁点燃 注:(1)先用砂纸打磨铁丝成表面光亮银白色,目的是___________________;(2)把铁丝绕成螺旋状,目的是_______________________;(3)把铁丝绕在火柴上,目的是_______________________;(4)待火柴快要燃尽时,才缓慢插入盛有氧气的集气瓶中,目的是__________________;(5)由上到下缓慢插入盛有氧气的集气瓶里,目的是___________________;(6)集气瓶里预先装入少量水或铺一层细沙,目的是___________________,【实验3】木炭的燃烧实验步骤:……燃烧匙……加热发红……集气瓶……澄清石灰水……实验现象:木炭在氧气中燃烧发出白光,放出大量热,生成气体使澄清石灰水变浑浊。

氧气的性质和用途氧气,化学符号为O2,是地球大气中最常见的元素之一。
它具有很多独特的性质和广泛的应用,对人类生活和工业领域都有着重要的影响。
一、氧气的性质1. 物理性质氧气是无色、无味、无臭的气体,常温下为双原子分子。
它的密度较大,略高于空气,能够溶解于水中。
此外,氧气还具有高熔点和高沸点,分别为-218.79°C和-182.96°C。
2. 化学性质氧气是一种高度活泼的气体,在许多化学反应中起着重要的作用。
它能与其他元素和化合物发生氧化反应,释放出大量的能量。
氧气的存在常常促进燃烧过程,并加速物质的氧化反应。
3. 生物性质氧气对生物体的生存至关重要。
它参与了呼吸作用,为动植物提供了必要的能量。
在人类身体中,氧气通过肺部进入血液,然后被输送到身体各个器官,维持正常的生理功能。
二、氧气的用途1. 医疗应用氧气在医疗领域中是一种重要的资源。
它被用于氧气吸入治疗,可帮助呼吸系统疾病患者吸入纯净的氧气,提高血氧含量,缓解呼吸困难。
此外,氧气还用于氧疗、急救和麻醉等过程中。
2. 工业利用在工业生产上,氧气也有着广泛的用途。
它常被用作氧化剂,促进各种反应的进行。
例如,在钢铁和铜的冶炼过程中,氧气能够与杂质发生反应,将其氧化,提高金属的纯度。
此外,氧气还可用于焊接、切割和化学合成等工艺中。
3. 液氧应用液态氧又称为LOX,是氧气在低温下的液体形式。
液氧具有较高的氧含量和较低的体积,因此在航天、火箭和导弹等领域中得到广泛应用。
液氧的高氧含量能够提供足够的氧气供应,使发动机能够在低压力环境下正常燃烧。
4. 氧气裂解氧气还被用于裂解过程,将其分解为单质氧。
这种单质氧可用于研究和实验室中,也可用于制造一些特殊化学品。
氧气的裂解还可产生高能氧,用于推动喷气式发动机、导弹和火箭等。
结语氧气是一种具有独特性质和广泛应用的重要气体。
它在医疗、工业、航天等领域发挥着至关重要的作用。
通过了解氧气的性质和用途,我们可以更好地利用它的优势,并推动科技和社会的持续发展。
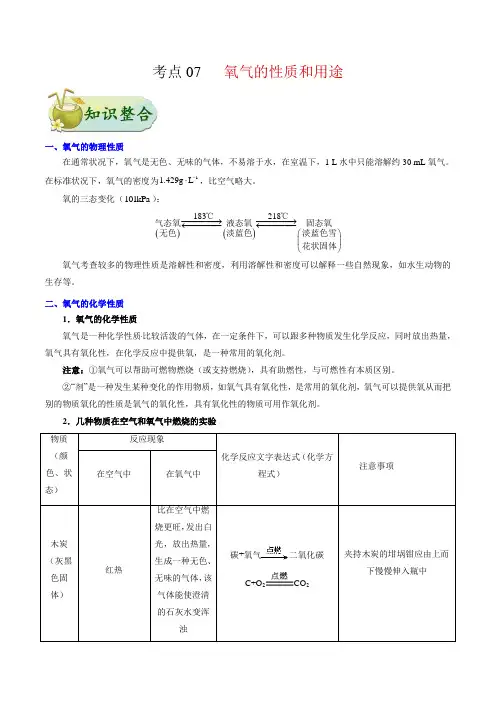
初中化学·同步辅导·学生版 明 道 私 塾编者:吕忠皓 好成绩来自持续的努力……103.1 氧气的性质和用途一、氧气的物理性质1、氧气是无色无味的气体,密度为1.429g/L ,略大于空气,难容于水。
2、氧气的物态变化:)固态(淡蓝色,雪花状液态(淡蓝色)气态(无色)−−→←−−→←--C218C183二、氧气的化学性质1、氧气是一种化学性质比较活泼的气体,支持燃烧和呼吸。
2、几种物质在氧气中燃烧和在空气中燃烧的比较。
物质名称 空气中燃烧现象 氧气中燃烧现象 文字与符号表达式备注木炭持续红热,无烟、无火焰。
在氧气里剧烈燃烧,发出白光,生成无色、无气味能使澄清石灰水变浑浊的气体。
二氧化碳氧气碳点燃−−→−+22CO O C −−→−+点燃不能说生成的物质的名称,只能说现象。
铁丝不燃烧剧烈燃烧,火星四射,放出热量,生成黑色固体。
四氧化三铁氧气铁点燃−−→−+432O Fe O Fe −−→−+点燃集气瓶底要加少量水或细沙,防止集气瓶爆裂。
蜡烛黄白色光亮火焰,火焰分层,放出热量,稍有黑烟 火焰十分明亮,分层,放出热量,瓶壁有雾珠,生成无色、无气味能使澄清石灰水变浑浊的气体。
二氧化碳水氧气石蜡点燃+−−→−+可以干冷的玻璃片在瓶口上方检验水 红磷黄白色火焰,伴随放热,冒出大量白烟。
发出耀眼的白光,放出热量,生成大量白烟。
五氧化二磷氧气磷点燃−−→−+52点燃2O P O P −−→−+镁条剧烈燃烧,发出耀眼白光,放出大量的热,生成白色粉末状物质。
剧烈燃烧,发出耀眼白光,生成白色粉末状物质。
氧化镁氧气镁点燃−−→−+ MgO O Mg 2−−→−+点燃照明弹的原理。
硫有淡蓝色火焰,放出热量,生成一种无色有刺激性气味的气体。
发出明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体。
二氧化硫氧气硫点燃−−→−+ 22S O O S −−→−+点燃 二氧化硫是空气污染物之一 铜 不燃烧,加热时由紫红色变成黑色。
【知识要点】一. 氧气的性质和用途1. 氧气的物理性质颜色状态气味密度水溶性无色气体无味大于空气密度不易溶于水液氧、固态氧都是蓝色的2. 氧气的化学性质氧气的化学性质比较活泼,在一定条件下能与许多物质发生氧化反应,例如与碳、硫、磷、镁、铁、石蜡等都能反应。
在氧化反应中提供氧,具有氧化性,是一种常见的重要的氧化剂。
另外氧气能助燃,但不可燃。
一些物质在空气中与在氧气中燃烧现象比较:反应物发生反应反应现象 ]生成物文字表达式[的条件在空气中在氧气中木炭跟氧气点燃持续红热,无烟,无焰剧烈燃烧,发出白光,放出热量,生成一种无色气体二氧化碳(能使澄清石灰水变浑浊)碳+氧气二氧化碳硫磺跟氧气点燃持续燃烧放热,有隐约可见的淡蓝色火焰,无烟发出明亮的蓝紫色火焰,放热,生成一种无色有刺激性气味的气体二氧化硫硫+氧气二氧化硫红磷跟氧气点燃黄色火焰,伴随放热和大量白烟剧烈燃烧,发出黄色火焰,放出热量,生成大量白烟,白烟易溶于水五氧化二磷磷+氧气五氧化二磷铁跟氧气点燃灼成红热,离火后变冷引燃后,能持续剧烈燃烧,火星四射,放出热量,生成黑色固体,熔化后溅落[ 四氧化三铁铁+氧气四氧化三铁蜡烛(主要是石蜡跟氧气)点燃黄白色光亮火焰,火焰分层,放出热量,稍有黑烟。
火焰十分明亮,分层,放出热量,瓶壁有雾珠,还有无色气体生成,能使石灰水变白色浑浊水和二氧化碳石蜡+氧气二氧化碳+水3 . 分析氧气与木炭、硫磺、红磷、铁等物质的化学反应,有一个共同的特点,都是由两种物质起反应而生成另一种物质。
这类反应叫做化合反应。
化合反应:两种或两种以上的物质生成另一种物质的反应。
是化学反应的基本类型之一。
特点:“多”变“一”。
形式:a+b=ab4. 分析氧气与木炭、硫磺、红磷、铁、石蜡等物质的化学反应,其共同特点是都是物质跟氧气发生的反应,这些反应称氧化反应。
氧化反应:物质与氧发生的化学反应叫做氧化反应。
注意这里的氧包括氧气,但又不只限于氧气。
另注意:氧化反应与化合反应没有必然的联系,即化合反应不一定是氧化反应,而氧化反应也不一定是化合反应。
第二节氧气的性质和用途【知识讲解】一、氧气的物理性质1.氧气是一种无色、无味的气体。
2.标准状况下,氧气的密度是1.429g·L-1,比空气重。
(标准状况下,空气在的密度是1.29g·L-1)3.氧气不易溶于水。
4.氧气难于液化。
二、氧气的化学性质播放视频许多物质点燃条件下能与氧气反应。
下表对照了几种常见物质与空气中的氧气、纯净氧气反应的不同现象。
结论:氧气是一种化学性质比较活泼的气体,具有氧化性,是一种常用的氧化剂。
三、氧气的主要用途1.供给呼吸 如:医疗救护、登山、潜水、航空、宇航2.支持燃烧 如:炼钢、航天飞机、火箭、气焊、气割3.液氧炸药四、化合反应1.定义:由两种或两种以上的物质生成另一种物质的反应,叫做化合反应。
2.特征:多种物质-----→ 一种物质3.实例:碳+氧气 二氧化碳五、氧化反应1.定义:物质与氧发生的化学反应,叫做氧化反应。
2.特征:有氧参加。
(注意:不是氧气)3.实例:铁+氧气四氧化三铁扩展知识:烟和雾(科学上把:大量的细小固体微粒悬浮在空气中的现象叫做“烟”;大量的液体小液滴悬浮在空气中的现象叫做“雾”。
)【典型例题】例题1:下列物质在氧气中燃烧时,集气瓶底部要垫少量细沙或水的是()。
A.木炭 B.硫粉 C.铁丝 D.红磷分析:上述物质在氧气中燃烧时,木炭和硫粉生成物都气体,红磷燃烧产生的是大量的白烟,它们的逸散不会引起集气瓶的炸裂,而铁丝在氧气中燃烧,火星四射,生成一种黑色的固体物质,由于燃烧时放出大量的热,使生成的四氧化三铁熔化溅落到集气瓶底部,如果直接与集气瓶底部接触,则会炸裂瓶底,因此要预先在集气瓶底部放入少量水或细沙。
答案:C例题2:下列物质燃烧时,一定有火焰产生的是()。
A.木炭 B.镁条 C.铁丝 D.硫粉分析:可燃物燃烧,一定发光发热,但不一定有火焰。
只有可燃气体(或蒸汽)燃烧时,才有火焰产生。
四个选项中,木炭、镁条、铁丝燃烧时,既不挥发又不能分解产生可燃性气体,因此只发光而无火焰产生。
氧气的化学性质及用途氧气是地球上最常见的元素之一,化学符号为O,原子序数为8,是一种无色、无味、无臭的气体。
它在自然界中以氧气的形式存在,通常作为两个氧原子的分子(O2)存在。
氧气具有一系列的化学性质和用途,下面将详细介绍。
1. 氧气的化学性质(1) 反应性弱:氧气是一种稳定的气体,属于惰性气体,相对稳定不易与其他元素反应。
但是,在高温和高压的情况下,氧气会更加活泼,在一些条件下容易与物质发生反应。
(2) 支持燃烧:氧气是一种无法燃烧的气体,但它能够支持其他物质的燃烧。
在空气中,氧气与可燃物发生反应,促使燃烧反应进行。
例如,火焰是由可燃物与氧气的反应产生的。
(3) 氧化性强:氧气是常见的氧化剂,能够与其他物质反应,并使其氧化。
例如,金属与氧气反应会生成金属氧化物。
氧气还能氧化有机物,造成其腐烂或燃烧。
(4) 与水反应:氧气可以溶解于水中,形成溶解氧,对水体生物的生理机能具有重要影响。
此外,氧气还能与水反应形成过氧化氢等物质,具有一定的氧化性。
2. 氧气的用途(1) 呼吸供氧:氧气是人类和动物进行呼吸所必需的气体。
它参与新陈代谢过程,提供细胞所需的能量。
在医疗领域,氧气被用于病人的氧疗,帮助病人维持正常呼吸。
(2) 工业应用:氧气在工业上有广泛的应用。
例如,在冶金工业中,氧气被用于炼铁、炼钢等过程中,通过氧化反应促进金属的提取和纯化;在化工生产过程中,氧气可用作氧化剂;在污水处理中,氧气可以提供微生物生长所需的氧气。
(3) 化学实验:氧气被广泛应用于化学实验中。
它可以用来促进物质的燃烧,用于确定燃烧热和计算物质的化学计量比。
同时,氧气也可用作氧化试剂,参与一些氧化反应的实验。
(4) 液氧火箭燃料:液氧是一种将氧气冷却至-183而得到的液体氧气。
液氧被广泛应用于火箭发动机中,作为燃气的氧化剂,与燃料反应产生巨大的推力,推动火箭飞行。
(5) 化妆品和医疗领域:氧气在化妆品和医疗领域中也有应用。
例如,氧气可以用于医学美容领域,通过高浓度氧气的呼吸,促进皮肤的新陈代谢,改善皮肤质量。
氧气是一种广泛应用于工业、生活和医疗领域的重要气体。
它具有许多独特的性质和广泛的用途,对于人类的生活起着重要的作用。
本文将从氧气的物理性质、化学性质和用途等方面进行详细介绍。
首先,氧气的物理性质是我们了解它的基本特征。
氧气在常温常压下是一种无色、无味、无臭的气体。
它的密度比空气稍高,重于空气,因此可以用于浮力口呼吸。
氧气的沸点为-183℃,熔点为-218℃,在液态下氧气能够存储和运输。
此外,氧气的溶解度相对较低,不容易溶于水和其他溶液。
其次,氧气的化学性质对于它的许多重要用途起着决定性的作用。
氧气是一种高度活泼的元素,可以与许多物质发生化学反应。
它是许多燃烧过程中的必需物质,能够支持燃烧的继续进行,称为氧化剂。
例如,在常见的火焰中,氧气与燃料反应产生大量的热能,并释放出明亮的火焰。
此外,氧气还能够与其他元素形成氧化物,如与碳形成二氧化碳、与硫形成二氧化硫等。
在工业领域,氧气有着广泛的应用。
首先,它是许多工业过程中的重要氧化剂。
例如,在钢铁、有色金属和各种化工工艺中,氧气经常与燃料一起使用,提高反应速率和产物质量。
其次,氧气还被用于废气处理和污水处理过程中,能够对有毒气体和废水进行有效的去除和处理。
此外,氧气还广泛用于氧化反应、生物学发酵过程、制药和水处理等方面。
除了工业应用外,氧气在生活中也有重要用途。
首先,氧气是我们呼吸过程中必需的气体。
在医疗领域,氧气广泛用于呼吸困难、窒息、休克等急救处理中,能够有效地提供氧气供给,维持机体正常的生理功能。
其次,氧气还被用于氧吧、美容护肤和健康养生等方面。
氧气通常被用作促进新陈代谢、增强免疫功能和改善皮肤质量的手段。
氧气性质及用途
1 氧气的性质
氧气是一种稳定的气体,无色无味,在正常温度和压力下为无色透明气体,它的分子式为O2。
氧气是构成大气的组成部分,在大气中的含量约为21%,但是可以从空气中提取94%的纯净的O2气体。
2 氧气的用途
(1)用于医疗。
氧气是最常用的一种麻醉剂,常被用来给呼吸机病人注射,有助于疗效;氧气常被用来缓解各种呼吸性疾病,让病人及时获得充足的氧气供应。
(2)用于工业生产。
氧气是化学反应的重要辅助剂,在工业上常被用来加速反应的过程和提高反应的效率;氧气也用来加强火焰的热能,常用在钢铁炼铁中。
3 氧气的安全措施
(1)应学习了解氧气是怎样产生和使用的,要知道它具有高度爆炸性。
(2)确保氧气接口是清洁的,避免有任何油脂或其它有毒物质进入氧气水管。
(3)使用时要确保有足够的通风,不要在封闭的空间里使用。
(4)应知道氧气的最大压力,避免因过度加压发生灾害。