烷烃的结构与性质讲课讲稿
- 格式:doc
- 大小:138.50 KB
- 文档页数:4

烷烃的结构和性质1.认识烷烃的结构、通式和主要性质。
2.认识烷烃同系物物理性质的递变性与其微观结构的关系。
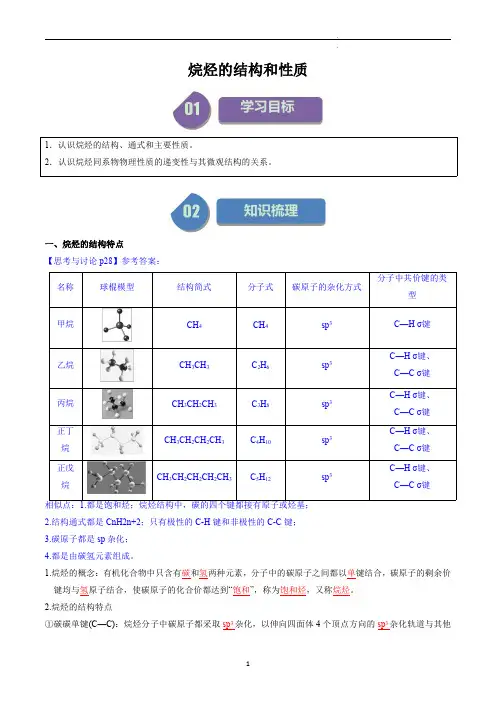
一、烷烃的结构特点【思考与讨论p28】参考答案:名称球棍模型结构简式分子式碳原子的杂化方式分子中共价键的类型甲烷CH4CH4sp3C—Hσ键乙烷CH3CH3C2H6sp3C—Hσ键、C—Cσ键丙烷CH3CH2CH3C3H8sp3C—Hσ键、C—Cσ键正丁烷CH3CH2CH2CH3C4H10sp3C—Hσ键、C—Cσ键正戊烷CH3CH2CH2CH2CH3C5H12sp3C—Hσ键、C—Cσ键相似点:1.都是饱和烃;烷烃结构中,碳的四个键都接有原子或烃基;2.结构通式都是CnH2n+2;只有极性的C-H键和非极性的C-C键;3.碳原子都是sp杂化;4.都是由碳氢元素组成。
1.烷烃的概念:有机化合物中只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”,称为饱和烃,又称烷烃。
2.烷烃的结构特点①碳碳单键(C—C):烷烃分子中碳原子都采取sp3杂化,以伸向四面体4个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
分子中的共价键全部是单键。
②呈链状(直链或带支链):多个碳原子相互连接成链状,而不是封闭式环状结构③“饱和”:每个碳原子形成4个共价键,碳原子剩余价键全部跟氢原子结合④烷烃空间结构中,碳原子(大于等于3时)不在一条直线上,直链烷烃中的碳原子空间构型是折线形或锯齿状。
3.烷烃的同系物①同系物的概念:结构相似,分子组成上相差一个或若干个CH 2原子团的化合物的互称。
②烷烃的通式:链状烷烃中的碳原子数为n ,氢原子数就是2n +2,分子通式可表示为C n H 2n +2,所含共价键(σ键)数为3n+1。
【易错提醒】(1)同系物的通式一定相同,但通式相同的有机物不一定互为同系物,如C n H 2n (n 为正整数)既是烯烃(n≥2)的通式,也是环烷烃(n≥3)的通式。



烷烃的结构与性质烷烃是一类基本有机化合物,由碳和氢原子构成。
它们的分子由碳原子构成的链或环连接而成,具有特定的结构和性质。
本文将探讨烷烃的结构以及与其相关的性质。
一、直链烷烃直链烷烃是最简单的烷烃类别,分子由一条直线状的碳链构成。
举个例子,正丁烷(CH3-CH2-CH2-CH3)是一种直链烷烃,其分子中包含四个碳原子。
直链烷烃的化学式可用CnH2n+2表示,其中n代表烷烃分子中碳原子的数量。
直链烷烃的物理性质包括沸点、熔点和密度等。
随着碳原子数量的增加,直链烷烃的沸点和熔点逐渐增加。
这是因为随着分子量的增加,分子间的范德华力也增强,使得分子间相互作用加强,需要更高的温度来克服这种相互作用。
此外,随着分子量的增加,直链烷烃的密度也逐渐增加。
二、支链烷烃支链烷烃的分子由一条或多条侧链连接到主链上,与直链烷烃相比,支链烷烃具有更多的碳原子连接方式。
举个例子,2-甲基丁烷(CH3-CH(CH3)-CH2-CH3)是一种支链烷烃,其中有一个甲基基团连接在主链上。
支链烷烃与直链烷烃在物理性质上有所不同。
由于支链的存在,支链烷烃分子具有更大的隔离度,分子间相互作用减少,从而导致其沸点和熔点相对较低。
支链烷烃的密度也较低,因为支链的存在减少了分子的紧密排列。
三、环烷烃环烷烃是由碳原子构成的环连接而成的分子结构。
与直链烷烃和支链烷烃相比,环烷烃的分子形状呈环状,因此具有特殊的性质。
环烷烃的一个例子是环己烷(C6H12),其中六个碳原子形成一个环状结构。
环烷烃的性质与其分子结构有密切关系。
由于环状结构的存在,环烷烃分子内部有较大的张力,导致其相对不稳定。
此外,由于环烷烃中碳原子的取向限制,它们往往比相应的直链烷烃熔点和沸点更高。
环烷烃还表现出一些特殊的化学反应,如环开裂和环化等。
总结起来,烷烃是一类碳和氢原子构成的有机化合物,根据其分子结构和性质,可以分为直链烷烃、支链烷烃和环烷烃。
直链烷烃由一条直线状的碳链构成,而支链烷烃则具有侧链连接到主链上的结构。


《烷烃》讲义一、烷烃的定义与通式烷烃是一类只含有碳(C)和氢(H)两种元素,且碳原子之间都以单键相连的有机化合物。
烷烃的通式为 CₙH₂ₙ₊₂(n 为整数,n≥1)。
从最简单的甲烷(CH₄)开始,随着碳原子数的增加,依次有乙烷(C₂H₆)、丙烷(C₃H₈)、丁烷(C₄H₁₀)等等。
二、烷烃的结构特点1、碳原子的成键方式烷烃中的碳原子均采取 sp³杂化,每个碳原子与四个其他原子(包括其他碳原子和氢原子)形成四面体结构。
这种结构使得烷烃的分子具有较高的稳定性。
2、碳链的形状烷烃的碳链可以是直链的,也可以是带有支链的。
直链烷烃的碳原子依次相连,形成一条直线;而支链烷烃则在主链上有一些碳原子分支出去,形成不同的结构。
三、烷烃的命名1、普通命名法对于碳原子数在 10 以内的烷烃,用天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)来表示其碳原子数,后面加上“烷”字,如甲烷、乙烷、丙烷等。
碳原子数在 10 以上的,则用汉字数字来表示,如十一烷、十二烷等。
2、系统命名法这是一种更为准确和规范的命名方法。
首先要选择最长的碳链作为主链,根据主链的碳原子数确定烷烃的名称。
然后,从距离支链最近的一端开始给主链上的碳原子编号,将支链的位置和名称写在前面,数字与名称之间用短线“”隔开。
例如,对于2,3-二甲基戊烷,我们先找到最长的碳链为5 个碳原子,称为戊烷;然后从左端开始编号,2 位和 3 位上各有一个甲基,所以命名为 2,3-二甲基戊烷。
四、烷烃的物理性质1、状态在常温常压下,甲烷到丁烷是气态,戊烷到十六烷是液态,十七烷及以上是固态。
2、溶解性烷烃一般难溶于水,但易溶于有机溶剂,如苯、乙醇等。
3、密度烷烃的密度都小于水的密度,且随着碳原子数的增加,密度逐渐增大。
4、沸点和熔点烷烃的沸点和熔点随着碳原子数的增加而升高。
在同碳数的烷烃中,支链越多,沸点越低。
五、烷烃的化学性质1、稳定性在常温下,烷烃一般不与强酸、强碱、强氧化剂等发生反应,表现出较高的稳定性。

烷烃的结构与性质烷烃是一类简单的有机化合物,由碳和氢原子构成,碳与碳之间通过共价键连接。
烷烃分子具有特定的结构和性质,本文将就烷烃的结构和性质展开讨论。
一、烷烃的结构烷烃的结构特点是碳原子通过单键连接起来,形成了碳链。
根据碳链的形状,烷烃可分为直链烷烃和支链烷烃两大类。
1. 直链烷烃:直链烷烃的碳链呈线性排列,每个碳原子都与相邻的碳原子相连,没有分支结构。
直链烷烃的通式为CnH2n+2,其中n代表该分子中碳原子的数量。
例如,甲烷(CH4)和乙烷(C2H6)就是两个典型的直链烷烃。
2. 支链烷烃:支链烷烃的碳链存在分支结构,其中至少有一个碳原子与其他两个碳原子相连。
支链烷烃的分子式通常为CnH2n+2,n仍然代表碳原子的数量。
举个例子,异丁烷(C4H10)就是一个常见的支链烷烃。
二、烷烃的性质1. 物理性质烷烃的物理性质主要涉及熔点、沸点和密度等。
一般来说,随着碳原子链的延长,烷烃的熔点和沸点也会逐渐增加。
这是因为长链烷烃具有更多的分子间力,而短链烷烃由于分子间力较小,所以熔点和沸点较低。
此外,烷烃的密度较小,通常会浮于水面。
2. 化学性质烷烃的化学性质较为稳定,一般不易发生化学反应。
然而,在高温或高能辐射的作用下,烷烃会发生燃烧反应。
此时,烷烃与氧气发生反应生成二氧化碳和水。
例如,甲烷在氧气存在下燃烧可产生二氧化碳和水蒸气。
3. 燃烧性质烷烃是一类良好的燃料,燃烧时能够释放出大量的能量。
烷烃燃烧的反应方程式可简化为:烷烃 + 氧气→ 二氧化碳 + 水4. 亲水性烷烃是一类非极性化合物,无法与水形成氢键。
因此,烷烃通常不溶于水。
但是,短链烷烃可以在一定条件下溶于水,尤其是碳原子数较少的烷烃。
5. 化学反应烷烃可以进行一些重要的化学反应,如卤素取代反应和裂解反应等。
卤素取代反应是一种常见的烷烃反应,其中烷烃中的氢原子被卤素元素取代。
裂解反应是指烷烃分子在高温下发生断裂,生成更小分子的反应。
综上所述,烷烃具有特定的结构和性质。
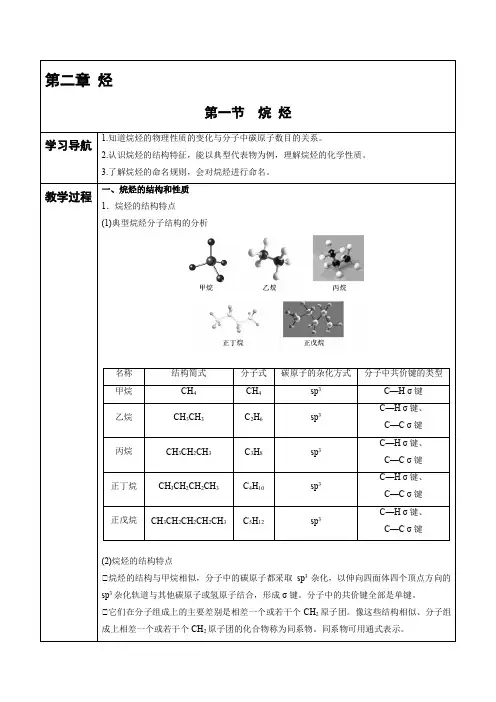
一、烷烃的结构和性质1.烷烃的结构特点(1)典型烷烃分子结构的分析名称结构简式分子式碳原子的杂化方式分子中共价键的类型甲烷CH4CH4sp3C—H σ键乙烷CH3CH3C2H6sp3C—H σ键、C—C σ键丙烷CH3CH2CH3C3H8sp3C—H σ键、C—C σ键正丁烷CH3CH2CH2CH3C4H10sp3C—H σ键、C—C σ键正戊烷CH3CH2CH2CH2CH3C5H12sp3C—H σ键、C—C σ键(2)烷烃的结构特点①烷烃的结构与甲烷相似,分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。
分子中的共价键全部是单键。
①它们在分子组成上的主要差别是相差一个或若干个CH2原子团。
像这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物称为同系物。
同系物可用通式表示。
①链状烷烃的通式:C n H 2n +2(n ≥1)。
2.烷烃的性质 (1)物理性质阅读教材表2-1并结合你已学知识内容,填写下表:物理性质 变化规律状态 烷烃常温下存在的状态由气态逐渐过渡到液态、固态。
当碳原子数小于或等于4时,烷烃在常温下呈气态溶解性 都难溶于水,易溶于有机溶剂熔、沸点 随碳原子数的增加,熔、沸点逐渐升高,同种烷烃的不同异构体中,支链越多,熔、沸点越低密度随碳原子数的增加,密度逐渐增大,但比水的小(2)化学性质①稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂、溴的四氯化碳溶液等都不发生反应。
烷烃之所以很稳定,是因为烷烃分子中化学键全是σ键,不易断裂。
①特征反应——取代反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
之所以可以发生取代反应,是因为C—H 有极性,可断裂,CH 3CH 2Cl 会继续和Cl 2发生取代反应,生成更多的有机物。

烷烃的结构与性质
烷烃的结构与性质
1.基本性质
1.1烷烃的结构特点
除甲烷外,还有一系列性质跟它很相似的烃,如乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等,这类烃称为烷烃。
(1)每个碳原子形成四个共价键,且碳原子之间只以单键相连成链状。
(2)碳原子的剩余价键均与氢原子结合。
(3)烷烃C n H2n+2分子中含有(n-1)个C-C,(2n+2)个C-H键,共含有
(3n+1)个共价键。
(4)超过三个碳原子的烷烃分子中的碳,并不在一条直线上,而是呈锯齿状。
(5)分子式(碳原子数)不同的烷烃一定互为同系物,分子式相同(结构不同)的烷烃一定互为同分异构体。
1.2烷烃的通式和物理通性
烷烃的通式为C n H2n+2(n≥1),甲烷是最简单的烷烃,也是氢含量最高(25%)的氢化物;烷烃中含氢的质量分数随着碳原子数的增多而减小,逐渐趋向于14.3%。
常温下,随着碳原子数的增多,烷烃由气态→液态→固态递变,其中C1~C4的烷烃为气态,新戊烷为气态,在标准状况下为液态。
由于烷烃结构相似,随着相对分子量的增大,熔、沸点和密度逐渐递增(甲烷、乙烷、丙烷的熔点稍有反常)。
烃基:烃分子去掉一个或几个氢原子后剩余的部分叫烃基。
常用“R-”表示,如果是一元饱和烃基,“R-”的通式为:-C n H2n+1(n≥1)。
2.性质应用
烷烃的化学性质与甲烷相似,除发生燃烧和取代反应外,与酸、碱和氧化剂一般不发生反应。
①能燃烧:C n H 2n+2+
3n 12
+O 2−−−→点燃
nCO 2+(n+1)H 2O ②易与X 2取代(生成一卤代物)
C n H 2n+2+Cl 2−−−→光照
C n H 2n+1Cl+HCl
(可能存在同分异构体)
③能发生裂化反应:(C 16H 34为例)
C 16H 34−−−→高温C 8H 18+C 8H 16
十六烷 辛烷 辛烯
说明:在烃的衍生物中存在的烷基在化学性质上与烷烃类似,但受相邻基团的影
响,有时与烷烃不同,例如:4nO ()
KM H +
−−−−−→
等。
3.综合应用
取代反应与置换反应的比较
+CuO
烷烃的取代物数目的判断技巧:
(1)“等效氢”法:判断烷烃的一元取代物(一个氢原子被取代)的数目关键是确定氢原子的不同位置,识别“等效氢”。
哪些是等效氢呢?-CH3上的3个氢原子;同一个碳原子上所连甲基中的氢原子[如(CH3)3C-];互为对称(处于镜面对称位置)的氢原子等。
简而言之,位置关系相同的氢原子即为等效氢,等效氢上的一元取代物只计一种。
(2)“互补”法:若某有机物分子中国总共含有a个氢原子,则某m元取代物的种类当n+m=a时相等。
如C5H12的五元取代物和七元取代物的种类相等。
C n H2n+2(1≤n≤10),一氯代物只有一种的物质有CH4、CH3-CH3、。