考研必备_100种有机化学反应2(51-100)
- 格式:pdf
- 大小:66.58 KB
- 文档页数:11
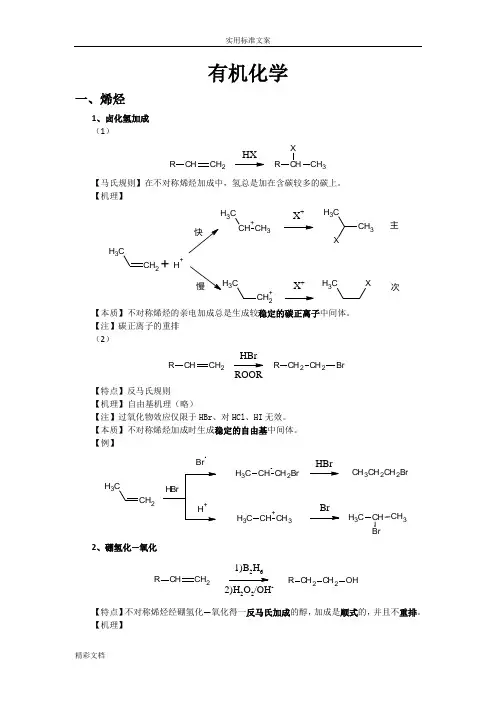
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr2/CCl4C CBrBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。

有机化学反应公式
有机化学反应式是一个比较广泛的题目,因为有机化学反应式包括了很多不同的反应类型和反应条件。
以下是一些常见的有机化学反应式,但请注意,这并不是完整的有机化学反应式列表。
烷烃的燃烧反应:CH4 + 2O2 →CO2 + 2H2O
烷烃的氯代反应:CH4 + Cl2 →CH3Cl + HCl
烯烃的加成反应:CH2=CH2 + H2 →CH3CH3
烯烃的氧化反应:CH2=CH2 + O2 →CH3CHO
烯烃的聚合反应:nCH2=CH2 →-[-CH2-CH2-]n-
苯的硝化反应:C6H6 + HNO3 →C6H5NO2 + H2O
苯的磺化反应:C6H6 + H2SO4 →C6H5SO3H + H2O
醇的酯化反应:CH3OH + CH3COOH →CH3COOCH3 + H2O
酮的还原反应:2CH3COCH3 + H2 →CH3CH(OH)CH3
醛的氧化反应:CH3CHO + O2 →CH3COOH
以上只是有机化学反应式的一部分,有机化学是一个非常广泛和复杂的领域,有许多其他的反应和机制。
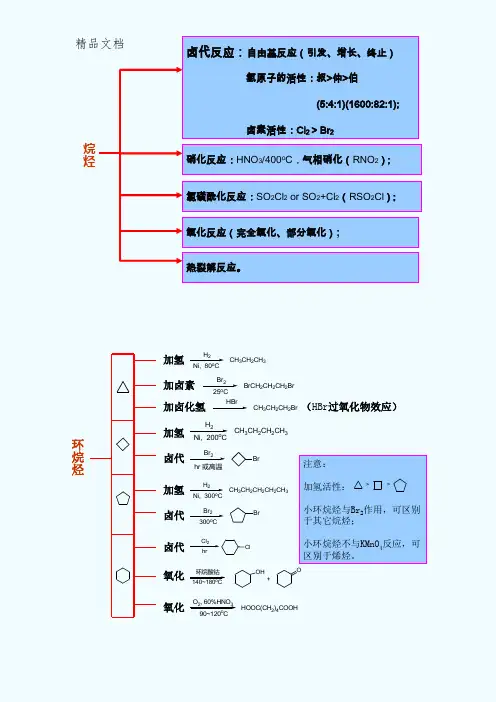
精品文档氧化反应(完全氧化、部分氧化); 热裂解反应。
烷烃环烷烃加氢加卤素加卤化氢(HBr 过氧化物效应)H 2Ni, 80o CCH 3CH 2CH 3Br 225o CBrCH 2CH 2CH 2Br HBrCH 3CH 2CH 2Br加氢卤代Br 2hr 或高温Br加氢卤代Br 2Br300o CH 2Ni, 300o CCH 3CH 2CH 2CH 2CH 3H 2Ni, 200o CCH 3CH 2CH 2CH 3Cl 2Clhr卤代氧化氧化140~180o C环烷酸钴+OHO90~120o CO 2, 60%HNO 3HOOC(CH 2)4COOH注意:加氢活性:小环烷烃与Br 2作用,可区别于其它烷烃;小环烷烃不与KMnO 4反应,可区别于烯烃。
>>卤代反应:自由基反应(引发、增长、终止)氢原子的活性:叔>仲>伯(5:4:1)(1600:82:1); 卤素活性:Cl 2 > Br 2硝化反应:HNO 3/400o C ,气相硝化(RNO 2);氯磺酰化反应:SO 2Cl 2 or SO 2+Cl 2(RSO 2Cl );亲电加成氧化反应X 2 HXH-OH/H 2SO 41. B 2H 62. NaOH/H 2O 2Hg(OAc)2/ROH 、H 2O 、RCOOH 等X-OH1. O 32. Zn/H 2O or R-S-R 其他催化氧化(PdCl 2-CuCl 2、NH 3)KMnO 4 or KCr 2O 7 or OsO 4 α-H 的取代、催化氢化、聚合马氏规则,反马氏(过氧化物or 强吸电子基)顺式加成、区域选择性马氏规则马氏规则卤代醇进一步反应生成环氧乙烷烯烃RCOOOH or H 2O 2 or Ag/O 2 亲电加成氧化反应α-H 的取代(NBS, Cl 2/加热)催化氢化聚合反应(铂黑,钯粉,Raney Ni )立体专一性反式加成,溴滃离子炔烃与烯烃相比:亲电加成反应:炔 < 烯RC CHRC CR'HC CH 聚合反应氧化反应还原反应活泼氢反应与醛酮加成亲核加成过氧化物效应硼氢化反应亲电加成二聚三聚多聚①O 3 ②H 2O KMnO 4/H+H 2/Ni Na/NH 3(l)H 2/Pd-BaSO 4Cu 2Cl 2, NH 4Cl反式顺式NaNH 2/NH 3(l)RC CNaAg(NH 3)2NO 3Cu(NH 3)2ClRC CAgRC CCu 鉴别分离端炔2X22HX (马氏)H 2O/Hg 2+, H +(反马氏)(反马氏)HZ Z RC=CH 2(Z=OR, CN, CH 3COO)R'CR''ORC C R''OH R'酸CH 2=CH-CH=CH 2聚合反应双烯合成亲电加成共聚反应E Zδδ(1,2-加成)(1,4-加成)CH 2=CHCHO O O OCHO O O O催化剂CH 2=C-CH=CH 2CHCH 2C 6H 5n 环烷酸镍三异丁基铝烯丙基碘化镍C CH 2C H CH 2Hn C CH 2C H H CH 2n取代萘的亲电取代反应定位规律:(1)原取代基为第一类定位基并在α-位,新取代基主要进入同环α-位,也有进入原取代亲电取代(定位规律)芳环氧化反应(O 2/V 2O 5/ 加热)α-H 的卤代单环芳烃卤代(X 2/FeX 3or I 2/HNO 3)磺化(可逆)硝化烷基化(RX/AlX 3or RCH=CH 2/H 3PO 4or ROH/HF )酰基化(RCOCl/AlCl 3or (RCO)2O/AlCl 3or RCOOH/H 2SO 4)氯磺化(ClSO 3H )氯甲基化(HCHO/ZnCl 2/HCl )加成反应(加氢、加氯)侧链氧化有重排现象萘环还原亲电取代萘环氧化X 2/Fe/PhH/(X= Cl, Br)XHNO 3 / H 2SO 4, 30~60oC NO 2H 2SO 4,165o C H 2SO 4,60oC SO 3HSO 3H 165o CCH 3COCl/ AlCl 3/ CS 2COCH 3COCH 3+75% 25%COCH 390%CH 3COCl/ AlCl 3/ C 6H 5NO 2CrO 3,CH 3COOH V 2O 5, 380o CNa/ C 2H 5OH/ NH 3(l)H 2/ Ni, 150o C H 2/ Ni, 200oC O OO O O消除反应亲核取代与活泼金属RX ( X= Cl, Br, I)卤代烷还原H 2O/ OH NaI/ CH 3COCH 3NaHSO 3RSO 3NaRIROHR' COO R' COORAgNO 3/ EtOH AgX + RONO 2活性NH 3R 4N XAg 2O/ H 2OR 4N OH PPh 3R-PPh 3 XCH(COOEt)2RCH(COOEt)2LiAlH 4 or H 2/Pd or HX/ZnRH Mg/Et 2ORMgX Li/Et 2ORLi NaR-RZn/EtOH/邻二卤消除X 2 ,得烯烃;1,3-二卤得环丙烷衍生物。

天津市考研化学复习资料有机化学常见反应总结有机化学是化学的重要分支之一,研究有机物的结构、性质和变化规律。
在考研化学的复习过程中,有机化学是一个重点和难点,掌握常见的有机化学反应对于考生来说十分关键。
本文将就天津市考研化学复习资料中常见的有机化学反应进行总结,帮助考生系统、全面地复习这一部分内容。
一、烃的反应1. 卤代烃的消除反应卤代烃在碱催化下发生消除反应,生成烯烃。
常见的消除反应有β-消除、α-消除和氧化脱卤。
2. 卤代烃的亲核取代反应卤代烃与亲核试剂(如醇、醚、胺等)发生亲核取代反应。
醇的亲核取代反应是最常见的,生成醚。
其他的亲核试剂还包括胺、叠氮化钠等。
3. 卤代烃的氧化反应卤代烃可以被氧化剂氧化成醛、酮、羧酸等。
常用的氧化剂有酸性高锰酸钾、醇酸法等。
4. 卤代烃的还原反应卤代烃可以通过还原反应生成烷烃,常用的还原试剂有金属(如锌、铝等)和还原剂(如氢气、亚磷酸酐等)。
二、醇的反应1. 醇的脱水反应醇在酸性条件下可以发生脱水反应,生成烯烃。
常用的酸催化剂有浓硫酸、浓磷酸等。
2. 醇的氧化反应一级醇可以通过氧化反应生成醛,二级醇可生成酮。
常见的氧化剂有酸性高锰酸钾等。
3. 醇的酯化反应醇与酸酐发生酯化反应,生成酯。
这是一个反应速率较快的反应。
4. 醇的酸化反应醇可以被酸氧化成酮或醛,常用的酸有浓硫酸、浓磷酸等。
三、酮的反应1. 酮的加成反应酮可以与亲电试剂(如溴化镁、氯化铝等)发生加成反应。
2. 酮的氧化反应酮可以通过氧化反应生成酸,常用的氧化剂有酸性高锰酸钾等。
3. 酮的还原反应酮可以通过还原反应生成醇,常用的还原试剂有金属(如锌、铝等)和还原剂(如氢气等)。
四、羧酸的反应1. 羧酸的酯化反应羧酸与醇反应生成酯,常用的酯化剂有酸氯化物等。
2. 羧酸的酰卤化反应羧酸与氯化亚砜等反应生成酰卤。
酰卤是合成醛、酮和酸衍生物的重要中间体。
3. 羧酸的酰化反应羧酸与醇在酸性条件下反应生成酰醇。
以上只是天津市考研化学复习资料中常见的一部分有机化学反应总结,考生需要根据具体的情况进一步扩展和深化知识。

有机化学反应类型总结1.亲电取代反应:亲电取代反应是有机化学中最常见的一类反应类型。
在这类反应中,一个亲电试剂攻击另一个有机化合物,取代其中一个官能团形成新的化学键。
经典的亲电取代反应包括醛和酮的取代、烯烃芳基取代和亲核取代反应等。
2.脱羧反应:脱羧反应是有机酸分子中羧基(COOH)被去除的反应。
这类反应可以通过酸催化、碱催化或酶催化来实现。
脱羧反应通常伴随着羧基碳骨架的重排或改变。
3.加成反应:加成反应是指在有机化合物中加入一个新的官能团的反应。
加成反应可以根据加成试剂的类型和形式来进行分类。
常见的加成反应包括醛酮加成、烯烃加成、亚硫酸盐加成等。
4.消除反应:消除反应是指有机化合物中一个或多个官能团被去除的反应。
消除反应的产物是由消失的官能团之间的化学键形成的。
常见的消除反应包括醇酯消除、烯烃消除和卤代烷消除等。
5. 重排反应:重排反应是指有机化合物中化学键的重新排列以形成新的分子结构的反应。
重排反应常常伴随着官能团的迁移和碳骨架的重构。
常见的有机重排反应包括烯烃重排、醇烷重排、Wagner-Meerwein重排等。
6.氧化还原反应:氧化还原反应是指有机化合物中的氧化态和还原态之间的转变。
在氧化还原反应中,氧化剂会接受电子,并使有机化合物的氧化态增加,而还原剂会提供电子,并使有机化合物的还原态增加。
通过以上的总结,我们可以看到有机化学反应涵盖了各种形式的化学变化。
熟练掌握这些反应类型,并了解其机理和应用范围,对于有机化学研究和合成有机化合物都具有重要的意义。

有机化学方程式汇总有机化学反应方程式汇总1.甲烷与氯气的反应:CH4 + Cl2 → CH3Cl + HClCH3Cl + Cl2 → CH2Cl2 + HClCH2Cl2 + Cl2 → CCl4 + HCl(分步取代)燃烧:CH4 + 2O2 → CO2 + 2H2O2.烷烃的燃烧通式:CnH2n+2 + (3n+1)O2 → nCO2 + (2n+2)H2O3.甲烷的热分解:CH4 高温 C + 2H24.烷烃的热分解:C4H10 → C2H4 + C2H6C4H10 → CH4 + C3H65.乙烯实验室制法:XXX H2SO4 → CH2=CH2 ↑(浓硫酸为催化剂和脱水剂)点燃:CH2=CH2 + 3O2 → 2CO2 + 2H2O6.乙烯的燃烧:CH2=CH2 + 3O2 → 2CO2 + 2H2O7.乙烯通入溴水中:CH2=CH2 + Br2 → CH2BrCH2Br8.乙烯和氢气加成:催化剂:CH3CH=CH2 + H2 → CH3CH2CH39.乙烯和HCl的反应:催化剂:CH2=CH2 + HCl → CH3CH2Cl10.乙烯水化制乙醇:CH2=CH2 + H2O → CH3CH2OH11.乙烯催化氧化制备乙醛:催化剂:2CH2=CH2 + O2 → 2CH3CHO加热加压:CH2―CH2―n―CH2―CH―12.乙烯的加聚反应:催化剂:n CH2=CH2 → (-CH2-CH2-)n13.制取聚丙烯:催化剂:n CH3CH=CH2 → (-CH2-CH(CH3)-)n14.1,3-丁二烯的加成反应:1,2加成:CH2=CH-CH=CH2 + Cl2 → CH2Cl-CH(Cl)-CH=CH2 Cl + Cl2 → Cl21,4加成:Cl完全加成+ 2Cl2 → Cl3CCCl315.1,3-丁二烯的加成反应:n CH2=C-CH=CH2 → (-CH2-C=CH-CH2-)n-CH316.乙炔的制取:CaC2 + 2H2O → C2H2 ↑ + Ca(OH)2点燃:2C2H2 + 5O2 → 4CO2 + 2H2O18.乙炔的燃烧公式为O(l) + 2600 kJ,表示在氧气存在下,乙炔会燃烧并释放出2600千焦的能量。

基本有机反应:烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%) ⒉硝化,磺化,氧化(略) 烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 有区域选择,符合马氏规则 ⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3 CH 3CH=CH 2+HOCl →CH 3CH (OH )-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH (OSO 3H)-CH 3−−→−OH 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH顺式加成,反马氏取向生成1醇⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 无此反应⒎催化加氢成烷烃:用Pt,Pd ,Ni 等 ⒏高锰酸钾氧化:酸性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH (OH )CH 2OH+MnO 2+KOH碱性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑⒐臭氧化: R ORRC=CHR’−→−3O C CHR’→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定−−−→−O璈O H 222RCOR+R’COOH −−→−O H -Zn 2RCOR+R'CHO −−→−4LiAlH RRCHOH+R'CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−−→−︒C300-Ag/200CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl ~PdCl CH 3CHO 多用于工业生产 ⒒—取代反应:氯代:CH 2=CHCH 3−−−−→−︒C600-/400Cl2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBSCH 2=CH -CH 2Br 两个反应均为自由基取代反应,NBS 即N-溴代琥珀酰亚胺⒓重排:(CH 3)3CCH=CH 2−−→−HCl(CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3〉2〉1,故在可能的情况下,它将以重排的方式趋于更稳定的状态。

山东省考研化学复习资料有机化学重点反应总结有机化学是化学领域中的重要分支,它研究的是碳元素及其化合物的结构、性质和反应。
在山东省考研化学考试中,有机化学占据了相当大的比重。
为了帮助考生更好地复习,下面将对有机化学的重点反应进行总结,并提供一些复习资料。
一、烃类反应1. 卤代烃与亲核试剂的取代反应例如,卤代烃与氢氧化钠的置换反应:R-X + NaOH → R-OH + NaX此类反应中,卤代烃上的卤素被亲核试剂取代,生成新的有机化合物。
2. 卤代烃的消除反应例如,卤代烃与碱性溶液的消除反应:R-X + OH- → R-H + X-此类反应中,卤代烃分子中的卤素和相邻的氢原子被消除,生成不饱和化合物。
3. 芳香化合物的取代反应例如,基于芳香核的硝化反应:Ar-H + HNO3 → Ar-NO2 + H2O此类反应中,芳香化合物中的氢被硝基取代,生成硝基芳香化合物。
二、醇、酚、醛和酮的反应1. 醇的酸碱性反应例如,烷基醇与酸的酸性反应:R-OH + HX → R-X + H2O此类反应中,醇分子中的羟基与酸反应生成醚,并放出水分子。
2. 醛和酮的加成反应例如,醛和酮与亲核试剂的加成反应:R1-C=O + R2-Nu → R1-C(=O)-R2-Nu此类反应中,醛或酮分子中的碳氧双键被亲核试剂加成,生成新的官能团。
3. 酸酐与醇、酚的酯化反应例如,酸酐与醇的酯化反应:R-C(=O)-O-C(=O)-R' + ROH → R-C(=O)-O-R' + RC(=O)-O-H此类反应中,酸酐和醇反应生成酯,伴随着水分子的生成。
三、酸、碱和盐的化学反应1. 酸的中和反应例如,强酸与强碱中和反应:H+ + OH- → H2O此类反应中,酸和碱反应生成水,同时放出热量。
2. 碳酸盐酸解反应例如,碳酸盐与酸的酸解反应:H2CO3 + 2HCl → 2H2O + CO2↑此类反应中,碳酸盐与酸反应生成水和二氧化碳气体,伴随着冒泡现象的发生。

光照光照 光照 光照 高温 CaO △ 催化剂加热、加压催化剂 △ 催化剂有机化学方程式汇总1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 312. nCH 2 = CH 2 ] n13. nCH 22-CH=CH-CH 2] n 14. 2CH 23CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+2337+3HBr38. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH32O↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2OO OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13. 14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结 1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。

光照光照光照光照 高温CaO△ 催化剂 加热、加压催化剂 △催化剂有机化学方程式汇总1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O醇△催化剂 △浓硫酸 170℃浓硫酸140℃△ 催化剂△24.+ 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC —CO OCH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结 1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。