2016年高考试题(化学)上海卷解析版
- 格式:doc
- 大小:2.99 MB
- 文档页数:26

2016上海高考化学真题(精编)1. 轴烯是一类独特的星形环烃。
三元轴烯()与苯A. 均为芳香烃B.互为同素异形体C.互为同系物 D .互为同分异构体【答案】D【解析】试题分析:轴烯与苯分子式都是C6H6 ,二者分子式相同,结构不同,互为同分异构体,故选项D正确。
考点:考查同系物、同素异形体、同分异构体概念。
2. 下列化工生产过程中,未涉及氧化还原反应的是A. 海带提碘 B .氯碱工业C.氨碱法制碱 D .海水提溴【答案】C【解析】试题分析:A.海带提碘是由KI变为∣2,有元素化合价的变化,属于氧化还原反应,错误;B .氯碱工业是由NaCl的水溶液在通电时反应产生NaoH、Cb、出,有元素化合价的变化,属于氧化还原反应,错误;C .氨碱法制取碱的过程中没有元素化合价的变化,是非氧化还原反应,正确;D .海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,错误。
故选项C 正确。
考点:考查氧化还原反应概念。
3. 硼的最高价含氧酸的化学式不可能是A. HBO2B. H2BO3C. H3BO3D. H2B4O7【答案】B【解析】试题分析:B原子最外层电子数是3个,所以其最高化合价是+3价,然后根据化合物中正负化合价的代数和等于0可知不可能是H2BO3,故选项B符合题意。
考点:考查元素化合价判断及化学式书写。
4. 下列各组物质的熔点均与所含化学键的键能有关的是A. CaO 与CO2B. NaCl 与HClC. SiC 与SiO2 D . Cl2与∣2 【答案】C考点:考查物质熔沸点高低比较方法。
5. 烷烃' 的命名正确的是A . 4-甲基-3-丙基戊烷B . 3-异丙基己烷C . 2-甲基-3-丙基戊烷D . 2-甲基-3-乙基己烷【答案】D【解析】试题分析:选择分子中含有碳原子数最多的碳链为主链,并从离支链较近的一端给主链的碳原子编号,该物质的名称是2-甲基-3-乙基己烷,故选项D正确。

上海高考模拟考试化学试卷附答案解析班级:___________姓名:___________考号:_____________一、单选题1.某些物质若混合使用可以增加使用效果,下列做法正确的是 ( ) A .氯化铵与草木灰混合使用提高肥效B .84消毒液与含盐酸的洁厕灵混合使用提高杀菌效果C .二氧化硫与新制氯水混合使用提高漂白效果D .高锰酸钾溶液和稀硫酸混合使用增加氧化性 2.下列化学用语表述正确的是( ) A .1-丁醇的键线式:B .甲醛的结构简式:HCOHC .苯分子的球棍模型:D .酚醛树脂的结构简式:3.下列表示正确的是( )A .CH 3Cl 的电子式B .钠原子最外层电子的电子云图::C .四氯化硅的比例模型:D .甲酸乙酯的结构简式:CH 3OOCCH 34.能说明Cl 的非金属性比S 的非金属性强的事实是( ) A .Cl 2与H 反应生成HCl ,S 与2H 反应生成2H S B .向2H S 的水溶液中通入Cl 2可得到淡黄色的固体S C .Cl 最高正价为+7价而S 最高正价为+6价D .Cl 原子最外电子层上有7个电子而S 原子最外电子层上有6个电子 5.下列除杂方法合理的是( ) A .除N 2中的NO 2:水,洗气B .除C 2H 5OH 中的H 2O :生石灰,分液 C .除HCl 中的Cl 2:饱和食盐水,洗气D .除C 2H 5Br 中的Br 2:NaHSO 3溶液,分液6.下列对于氯化氢和盐酸的叙述,错误的是( ) A .氯化氢和盐酸的化学式都能用HCl 表示,但性质有区别 B .氯化氢和盐酸都是共价化合物,都是电解质,都能导电 C .氯化氢和浓盐酸在潮湿的空气中都能形成酸雾D .氯化氢是无色气体,浓盐酸是无色溶液,它们都有刺激性气味 7.下列有机物中,一定条件下不能与H 2发生反应的是( ) A .乙醇B .乙烯C .苯D .丙酮8.下列极性共价键中,极性最强的是( ) A .H —NB .H —OC .H —FD .H —C9.下列离子方程式正确的是( ) A .氯气通入冷水中:22Cl H OCl ClO 2H --++++B .氨气通入醋酸溶液中:3334CH COOH NH CH CO =ONH +C .碳酸钙与稀盐酸反应制2CO :2322CO 2H =CO H O -++↑+ D .澄清石灰水与盐酸反应:2H OH =H O +-+10.常温下,实验Ⅰ和实验Ⅱ中,均有气体产生,下列分析错误的是( )A .饱和3NaHCO 溶液中()()2-323c CO <c H COB .0.1mol/L 3NaHSO 溶液中:()()2--4-10323c SO -c H SO =10-10C .Ⅱ中产生白色的3BaSO 沉淀D .I 和Ⅱ中溶液的pH 均增大11.有机物a 可以发生如下一系列变化,下列说法不正确的是( )A .b 中所有碳原子在同一平面内B .b 的一氯代物只有一种C .a 能发生加聚反应D .c 的分子式为 C 7H 8O12.下列属于氧化还原反应的,其中2SO 不做还原剂的是( ) A .2SO 溶于水生成不稳定的23H SO B .2SO 与2H S 气体混合反应C .2SO 通入到酸性4KMnO 溶液中,使4KMnO 溶液褪色D .在催化加热条件下与氧气反应生成3SO13.向含有Al 3+、Fe 2+、Na +和NH 4+的溶液中加入足量的NaOH 溶液,在空气中充分搅拌,再加入过量稀盐酸。

专题二化学计量考向一以物质的量为核心的基本概念、基本计算(1)考纲要求①理解相对原子质量、相对分子质量的含义,并能进行有关计算。
②理解摩尔(mol)、摩尔质量、气体摩尔体积(标准状况下)、物质的量浓度、并能进行有关计算。
③能运用化学方程式和离子方程式进行有关计算。
(2)命题规律化学常用计量是化学计算的基础,贯穿于高中化学始终,是每年高考的必考内容。
高考考查物质的量、物质的量浓度、阿伏加德罗定律、气体摩尔体积等概念的理解或利用物质的量在元素化合物、理论方面计算中的应用,近年来高考中考查化学计算的试题主要分成两类:一类是以选择题形式出现的小计算题,一类是以填空题出现的小综合计算题,一般意在考查元素化合物与化学实验、有机化合物基础知识相联系的综合问题。
高考试题将以化工生产、科学实验为背景,强调计算与化学基本理论、化学变化过程、工业流程、化学实验等结合,突出思维能力的考查和数学工具的应用,体现计算为化学应用服务,强化对化学方程式的量化理解。
【例1】【2016年高考上海卷】称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH31792ml(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为()A.1:1 B.1:2 C.1.87:1 D.3.65:1【答案】C【解析】132g/mol=0.0374mol。
因此(NH4)2SO4与NH4HSO4物质的量之比为:1.87:1 ,故选C。
【考点定位】考查有关化学反应计算的技巧和方法。
【名师点睛】根据化学方程式的计算,多以物质的量为核心,考查物质的量、阿伏伽德罗常数、物质的量浓度、物质的质量、摩尔质量、气体的体积、气体摩尔体积等相关物理量的转化关系,以及反应物的转化率或产物的产率的计算,同时还可以融入多种化学解题思想,比如极值法、差量法、守恒法、讨论法、特殊值法等,是历来高考的重点内容。
日常学习中要注意相关知识的积累,以便快速准确作答,题目难度中等。

1.【2017新课标2卷】阿伏加德罗常数的值为A N 。
下列说法正确的是A .1 L 0.1mol·1L -NH 4Cl 溶液中,4NH +的数量为0.1A N B .2.4g Mg 与H 2SO 4完全反应,转移的电子数为0.1A NC .标准状况下,2.24 L N 2和O 2的混合气体中分子数为0.2A ND .0.1 mol H 2和0.1mol I 2于密闭容器中充分反应后,其分子总数为0.2A N【答案】D【名师点睛】本题考查阿伏加德罗常数的应用,是高考的一个热点,主要从物质结构、水解、转移电子、可逆反应等角度考查,本题相对比较容易,只要认真、细心就能做对,平时多注意这方面的积累。
2.【2017新课标3卷】N A 为阿伏加德罗常数的值。
下列说法正确的是A .0.1 mol 的11B 中,含有0.6N A 个中子B .pH=1的H 3PO 4溶液中,含有0.1N A 个H +C .2.24L (标准状况)苯在O 2中完全燃烧,得到0.6N A 个CO 2分子D .密闭容器中1 mol PCl 3与1 mol Cl 2反应制备 PCl 5(g ),增加2N A 个P-Cl 键【答案】A【解析】A .B 的原子序数为5,即质子数为5,在质量数为11的B 原子中含有6个中子,0.1mol 11B 含有0.6N A 个中子,A 正确;B .溶液体积未定,不能计算氢离子个数,B 错误;C .标准状况下苯是液体,不能利用气体摩尔体积计算2. 24L 苯的物质的量,则无法判断其完全燃烧产生的CO 2分子数目,C 错误;D .PCl 3与Cl 2反应生成PCl 5的反应是可逆反应,反应物不可能完全转化为生成物,则1molPCl 3与1molCl 2反应生成的PCl 5小于1mol ,增加的P -Cl 键的数目小于2N A 个,D 错误。
答案选A 。
【名师点睛】考查与阿伏加德罗常数有关计算时,要正确运用物质的量的有关计算,同时要注意气体摩尔体积的使用条件;另外还要谨防题中陷阱,如讨论溶液里的离子微粒的数目时,要考虑:①溶液的体积,②离子是否水解,③对应的电解质是否完全电离;涉及化学反应时要考虑是否是可逆反应,如选项D涉及可逆反应,反应的限度达不到100%;其它如微粒的结构、反应原理等,总之要认真审题,切忌凭感觉答题。

化学-上海市浦东新区2016-2017学年高一上学期期末试卷(解析版)1.已知铱的原子质量数为Ir,则其191的表示为质子数。
2.当原子核外M电子层为最外层时,最多容纳的电子数为18.3.通过得电子或失电子形成与Ar原子相同电子层结构的是Na。
4.能形成简单阳离子的元素是Na。
5.海水晒盐的原理是利用阳光、风力蒸发水分使氯化钠成晶体析出。
6.存在氯离子的物质是盐酸。
7.做氯化氢喷泉实验后,烧瓶内的液体只占烧瓶容积的三分之一,其原因可能是HCl气体没有完全溶解。
8.玻璃导管通有H2,点燃后插入盛氯气的集气瓶中,产生的现象是安静燃烧。
9.溶解、过滤、蒸发这些操作中都需要使用的仪器是烧杯、漏斗、玻璃棒。
10.实验室中电解饱和食盐水溶液时,不能直接得到的物质是氢氧化钠。
11.能表示质量数是37的阴离子是18个质子,19个中子,18个电子。
12.检验氯化氢气体中是否混有Cl2,不能采用的方法是用湿润的有色布条。
13.氯气与水反应时,其中水是还原剂。
14.在足量NaI溶液中,加入少量氯水及四氯化碳,振荡后静置,出现的现象是溶液分两层,上层液体呈紫红色。
15.“足球烯”C60.1.关于C60的说法,错误的是()A.C60是一种新型的化合物 B.C60是相对分子量为720 C.C60和金刚石互为同素异形体 D.C60硬度比金刚石小。
2.化学键存在于()A.分子之间 B.物质中的原子之间C.分子或原子团中相邻的原子之间 D.构成物质的所有微粒之间。
3.离子键是()A.原子间的强烈的静电作用 B.阴、阳离子间的强烈的吸引作用 C.阴、阳离子间的强烈的静电作用D.阴、阳离子间的强烈的排斥作用。
4.构成氯化钠的微粒是()A.氯离子和钠离子 B.氯化钠分子 C.氯原子和钠原子 D.金属钠和非金属氯。
5.将HCl和NaCl分别溶于水,下列说法正确的是()A.HCl的离子键被破坏 B.NaCl的共价键被破坏 C.HCl和NaCl的化学键均遭破坏D.HCl和NaCl的化学键均未遭破坏。

)))))))2016 年一般高等学校招生全国一致考试(上海卷)生命科学考生注意:1.本试卷满分150 分,考试时间120 分钟。
2.本考试分设试卷和答题纸。
试卷包含两部分,第一部分所有为选择题,第二部分为综合题,包括填空题、选择题和简答题等题型。
3.答卷前,务必用钢笔、圆珠笔或署名笔在答题纸正面清楚地填写姓名、准考据号,并将核对后的条形码贴在指定地点上,在答题纸反面清楚地填写姓名。
4.作答一定所有涂或写在答题纸上,在试卷上作答一律不得分。
选择题的作答一定用2B 铅笔涂在答题纸上相应的地区,综合题的作答一定用钢笔、圆珠笔或署名笔写在答题纸上与试卷题号对应的地点。
一、选择题(共60 分,每题 2 分。
每题只有一个正确答案)1.SARS 病毒能够经过口腔分泌物进行流传,这类流传门路属于A. 媒介物流传B. 空气流传C.病媒流传D.接触流传D【答案】病毒经过口SARS【分析】病原体经过无生命的媒介物流传属于媒介流传。
由呼吸道进入空气属于空气流传,腔分泌物或身体的伤口处接触进行流传属于接触流传。
经过带有病原体的动物流传属于病媒流传。
【考点定位】此题考察传得病的流传方式。
【名师点睛】此题考察不同传染门路的识记、鉴别。
属于简单题。
解题重点是鉴别空气流传和接触流传。
此题易错选 B 项,错因在于未能掌握空气流传是指病原体由呼吸道进入空气。
2.在电子显微镜下,放线菌和霉菌中都能察看到的构造是 B. 线粒体和内质网 A. 核糖体和质膜线粒体和高尔基体 C.核糖体和拟核 D.A【答案】项正确;原核细胞不具A【分析】放线菌属于原核生物,霉菌属于真核生物,二者共有的构造式核糖体和质膜, B 项错误。
项错误;拟核是原核细胞独有的构造,、 DC 有膜构造细胞器如线粒体、内质网、高尔基体等,【考点定位】此题考察真核细胞与原核细胞的差别。
【名师点睛】此题考察放线菌、霉菌的种类及真核细胞与原核细胞的差别。
属于简单题。
解题重点明确放线菌属于原核细胞,霉菌属于真核细胞。


2016年普通高等学校招生全国统一考试(上海卷)政治一、选择题:本题共12小题,每小题4分,共48分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
一、单选选择题(共90分,每题3分。
每题只能选一个选项)1.习近平总书记始终强调:人民对美好生活的向往,就是我们的奋斗目标。
这是因为中国共产党()A.是我国的执政党B.以全心全意为人民服务为宗旨C.以工农联盟为基础D.是社会主义现代化建设的根本保证【答案】B【解析】中国共产党把人民对美好生活的向往作为自己的奋斗目标,这是由党的性质和宗旨决定的,故B符合题意;A与题意不构成因果关系;以工农联盟为基础指的是我国的人民民主专政,C项错误;坚持党的领导地位,坚持人民民主专政是社会主义现代化建设的根本保证,D项错误。
故选B【考点定位】共产党的宗旨【名师点睛】本题考查中国共产党的宗旨。
在学习中国共产党的相关知识时,要注意以下几个方面:中国共产党不是国家机关、不能履行国家职能、不是依法行政是依法执政、它与各民主党派的关系不是监督与被监督的关系,而是互相监督的关系。
2.在我国,由选民直接选举产生的是()A.全国人大代表B.上海市闵行区人大代表C.湖南省人大代表D.广西壮族自治区人大代表【答案】B【解析】我国的选举方式是直接选举和间接选举相结合的。
现阶段,全国、省、自治区、直辖市和设区的市、自治州的人大代表实行间接选举;不设区的市、市辖区、县、自治县、民族乡、镇的人大代表实行直接选举。
故B 是直接选举,符合题意;ACD都是间接选举,与题意不符。
故选B。
【考点定位】民主选举【名师点睛】本题考查人大代表的选举方式。
在明确这个知识的基础上,我们还要明确不同的选举方式各有利弊,我们不能笼统地说哪种方式更好,必须从多个角度认识影响选举方式的因素,并学会用历史发展的辩证观点分析、判断、理解我国的选举方式的选择。
3.以下代表全国人大行使最高监督权的是A.十二届全国人大一次会议根据国家主席习近平的提名,决定国务院总理的人选B.十二届全国人大二次会议审查、批准2014年国民经济和社会发展计划C.十二届全国人大三次会议听取、审议最高人民法院的工作报告D.十二届全国人大四次会议审议《中华人民共和国慈善法(草案)》【答案】C【解析】人大的监督权是指监督宪法和法律的实施,监督“一府两院”工作的权力,故C符合题意;A是任免权的体现;B是决定权的体现;D是立法权的体现,都与题意不符。

专题13 物质的检验、分离与提纯1.【2018新课标3卷】下列实验操作不当的是A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二【答案】B【解析】D.蒸馏时,为保证加热的过程中液体不会从烧瓶内溢出,一般要求液体的体积不超过烧瓶体积的三分之二,选项D正确。
分考点定位:本题考查的是化学实验的基本操作,涉及外界条件对反应速率的影响、中和滴定、焰色反应、蒸馏实验等。
【试题点评】本题选项B涉及的是滴定过程中指示剂的选择。
一般来说,应该尽量选择的变色点与滴定终点相近,高中介绍的指示剂主要是酚酞(变色范围为pH=8~10)和甲基橙(变色范围为pH=3.1~4.4)。
本题中因为滴定终点的时候溶液一定为酸性(二氧化碳饱和溶液pH约为5.6),所以应该选择甲基橙为指示剂。
对于其他滴定,强酸强碱的滴定,两种指示剂都可以;强酸滴定弱碱,因为滴定终点为强酸弱碱盐,溶液显酸性,所以应该使用甲基橙为指示剂;强碱滴定弱酸,因为滴定终点为强碱弱酸盐,溶液显碱性,所以应该使用酚酞为指示剂。
2.【2018北京卷】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确...的是A.对比②③,可以判定Zn保护了FeB.对比①②,K3[Fe(CN)6]可能将Fe氧化C.验证Zn保护Fe时不能用①的方法D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼【答案】D【解析】考点定位:考查牺牲阳极保护法、实验方案设计与评价。
【试题点评】思路点拨:本题应该从实验现象进行判断,如③实验中试管内生成蓝色沉淀,说明产生Fe2+,然后结合元素及其化合物的性质,进行判断即可。
3.【2018天津卷】由下列实验及现象推出的相应结论正确的是【答案】B【解析】考点定位:考查实验方案设计与评价。

2016年普通高等学校招生全国统一考试〔上海卷〕生命科学考生注意:1.本试卷总分值150分,考试时间120分钟。
2.本考试分设试卷和答题纸。
试卷包括两部分,第一部分全部为选择题,第二部分为综合题,包括填空题、选择题和简答题等题型。
3.答卷前,务必用钢笔、圆珠笔或签字笔在答题纸正面清楚地填写、准考证号,并将核对后的条形码贴在指定位置上,在答题纸反面清楚地填写。
4.作答必须全部涂或写在答题纸上,在试卷上作答一律不得分。
选择题的作答必须用2B铅笔涂在答题纸上相应的区域,综合题的作答必须用钢笔、圆珠笔或签字笔写在答题纸上与试卷题号对应的位置。
一、选择题〔共60分,每题2分。
每题只有一个正确答案〕1.SARS病毒可以通过口腔分泌物进行传播,这种传播途径属于【答案】D【解析】病原体通过无生命的媒介物传播属于媒介传播。
由呼吸道进入空气属于空气传播,SARS病毒通过口腔分泌物或身体的伤口处接触进行传播属于接触传播。
通过带有病原体的动物传播属于病媒传播。
【考点定位】此题考查传染病的传播方式。
【名师点睛】此题考查不同传染途径的识记、区分。
属于容易题。
解题关键是区分空气传播和接触传播。
此题易错选B项,错因在于未能把握空气传播是指病原体由呼吸道进入空气。
2.在电子显微镜下,放线菌和霉菌中都能观察到的结构是【答案】A【解析】放线菌属于原核生物,霉菌属于真核生物,二者共有的结构式核糖体和质膜,A项正确;原核细胞不具有膜结构细胞器如线粒体、内质网、高尔基体等,B、D项错误;拟核是原核细胞特有的结构,C项错误。
【考点定位】此题考查真核细胞与原核细胞的区别。
【名师点睛】此题考查放线菌、霉菌的种类及真核细胞与原核细胞的区别。
属于容易题。
解题关键明确放线菌属于原核细胞,霉菌属于真核细胞。
3.将紫色洋葱鳞叶外表皮细胞置于30%蔗糖溶液数分钟后,结果如图1所示,紫色分部的区域和影响色素分布的结构分别是A.①和细胞膜B.①和细胞膜、液泡膜C.②和细胞膜、液泡膜D.②和细胞膜、液泡膜、细胞壁【答案】C【考点定位】此题考查植物细胞质壁别离实验。
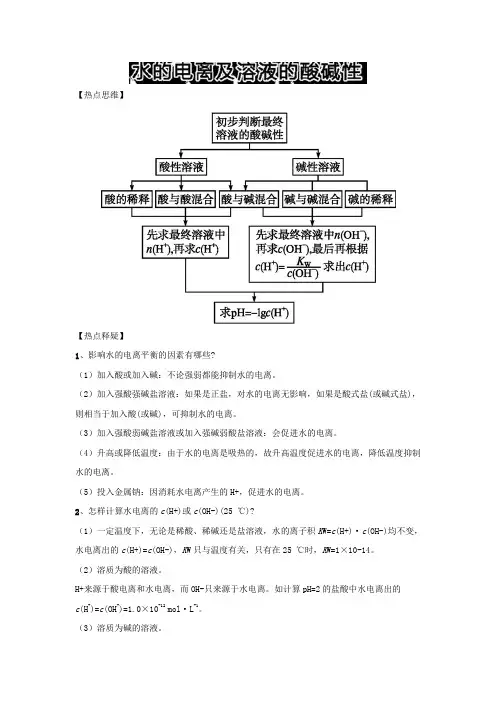
【热点思维】【热点释疑】1、影响水的电离平衡的因素有哪些?(1)加入酸或加入碱:不论强弱都能抑制水的电离。
(2)加入强酸强碱盐溶液:如果是正盐,对水的电离无影响,如果是酸式盐(或碱式盐),则相当于加入酸(或碱),可抑制水的电离。
(3)加入强酸弱碱盐溶液或加入强碱弱酸盐溶液:会促进水的电离。
(4)升高或降低温度:由于水的电离是吸热的,故升高温度促进水的电离,降低温度抑制水的电离。
(5)投入金属钠:因消耗水电离产生的H+,促进水的电离。
2、怎样计算水电离的c(H+)或c(OH-)(25 ℃)?(1)一定温度下,无论是稀酸、稀碱还是盐溶液,水的离子积K W=c(H+)·c(OH-)均不变,水电离出的c(H+)=c(OH-),K W只与温度有关,只有在25 ℃时,K W=1×10-14。
(2)溶质为酸的溶液。
H+来源于酸电离和水电离,而OH-只来源于水电离。
如计算pH=2的盐酸中水电离出的c(H+)=c(OH-)=1.0×10-12 mol·L-1。
(3)溶质为碱的溶液。
OH-来源于碱电离和水电离,而H+只来源于水电离。
如pH=12的NaOH溶液中,水电离出的c(OH-)=c(H+)=1.0×10-12mol·L-1。
(4)水解呈酸性或碱性的盐溶液。
H+和OH-均由水电离产生。
如pH=5的NH4Cl溶液中由水电离出的c(H+)=1.0×10-5mol·L-1;pH=9的Na2CO3溶液中由水电离出的c(OH-)=1.0×10-5mol·L-1。
【热点考题】【典例】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用负对数值。
如某溶液溶质的物质的量浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。
下列表达正确的是( )A.中性溶液中,pC(H+)+pC(OH-)=14B.pC(H+)=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1C.pC(OH-)=a的氨水,稀释10倍后,其pC(OH-)=b,则a=b-1D.pC(OH-)=3的NaOH溶液,稀释100倍,其pC(OH-)=5【答案】D【热点透析】【对点高考】【2012上海卷】水中加入下列溶液对水的电离平衡不产生影响的是()A.NaHSO4溶液 B.KF溶液 C.KAl(SO4)2溶液 D.NaI溶液【答案】D【解析】试题分析: A项电离出H+,抑制水的电离,A项错误;B项F-水解促进水的电离,B项错误;C项Al3+水解促进水的电离,C项错;D项中Na+、I-均不水解,对水的电离无影响,D项正确。
专题07 细胞核—系统的控制中心1.( 2017 年海南卷, 2)下列关于原核生物的叙述,错误的是()A .大肠杆菌的细胞内有核糖体 B.细胞对物质的吸收具有选择性C .拟核区中含有环状的D NA 分子D .蓝藻细胞的叶绿体中含有叶绿素【答案】 D2.( 2016 年新课标Ⅰ卷, 1)下列与细胞相关的叙述,正确的是()A .核糖体、溶酶体都是具有膜结构的细胞器B .酵母菌的细胞核内含有 DNA 和 RNA 两类核酸 C.蓝藻细胞的能量来源于其线粒体有氧呼吸过程D .在叶绿体中可进行 CO2 的固定但不能合成 ATP【答案】 B【解析】核糖体无膜结构,溶酶体具有单层膜结构, A 错误;酵母菌为真核生物,组成酵母菌的真核细胞的细胞核内含有 DNA 和 RNA 两类核酸, B 正确;蓝藻细胞为原核细胞,其细胞中无线粒体, C 错误;° 叶绿体的类囊体薄膜上所进行的光反应过程中,会有 ATP 的生成, D 错误。
3.( 2016 年四川卷, 2)下列有关细胞共性的叙述,正确的是()A .都具有细胞膜但不一定具有磷脂双分子层B .都具有细胞核但遗传物质不一定是 DNAC.都能进行细胞呼吸但不一定发生在线粒体中 D.都能合成蛋白质但合成场所不一定是核糖体【答案】 C 【解析】细胞根据有无成形有细胞核,分为原核细胞和真核细胞,不论是原核细胞还是真核细胞,细胞膜的主要成分就是磷脂和蛋白质,A 错误;原核细胞无细胞核,且具有细胞结构的生物遗传物质都是DNA ,B 错误;原核细胞无线粒体,但也能进行有氧呼吸,如蓝藻,真核细胞有氧呼吸的主要场所在线粒体,C 正确;原核细胞和真核细胞蛋白质的合成场所都是核糖体,D 错误。
学 & 科网4.( 2015 年上海卷, 2)原核生物都具有的结构是()A .质膜和核膜 B.线粒体和核膜C.质膜和核搪体 D .线粒体和核糖体【答案】 C【解析】原核细胞无核膜,也无线粒体; A 、 B 、D 错误。
2010-2016年全国普通高等学校招生统一考试上海化学试卷汇编及解析2010年全国普通高等学校招生统一考试上海化学试卷本试卷分为第Ⅰ卷(第1-4页)和第II卷(第5-12页)两部分。
全卷共12页。
满分150分,考试时问120分钟。
第Ⅰ卷(共66分)相对原子质量:H—l C—12 N—14 O—16 Na—23 P—31 S—32 Cl—35.5 K—39 Br—80 I—127一、选择题(本题共10分,每小题2分,只有一个正确选项,答案涂写在答题卡上。
) 1.下列做法不能体现低碳生活的是A.减少食物加工过程B.注意节约用电C.尽量购买本地的、当季的食物D.大量使用薪柴为燃料答案:D解析:此题考查了化学与生产生活的联系。
低碳生活的核心是减少二氧化碳的排放,减少食物加工过程,减少二氧化碳排放,能体现,排除A;目前电力的主要来源是火电,节约用电能减少二氧化碳排放,能体现,排除B;本地食物能减少运输消耗、当季食物能减少贮存的能量消耗,能体现,排除C;薪柴为燃料能产生大量二氧化碳,不能体现低碳思想,符合要求。
易错警示:解答此题的易错点是不能准确理解“低碳”的含义,而造成错误选择。
由于二氧化碳气体的大量排放,地球气候异常表现的越来越显著,对人类生活的影响也越来越大,故此在生产生活中要尽可能节约能源,减少二氧化碳排放。
2.下列有关物质结构的表述正确的是A.次氯酸的电子式B.二氧化硅的分子式SiO2C.硫原子的最外层电子排布式3s23p4D.钠离子的结构示意图答案:C解析:此题考查了物质结构中的原子的核外电子排布、原子结构的表示、化学键、物质的构成等知识点。
次氯酸的电子式为:,A错;二氧化硅是原子晶体,其结构中不存在分子,B错;S是16号元素,其核外电子排布为:1s22s22p63s23p4,C对;钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为:,D错。
技巧点拨:在分析电子排布式的对错时,可以首先写出相应的电子排布式一一对照,得出答案;也可以依次验证电子数目的正误、填充顺序的正误、填充电子数的正误进行判断。
2016年普通高等学校招生全国统一考试(上海卷)化学1.轴烯是一类独特的星形环烃。
三元轴烯()与苯A.均为芳香烃B.互为同素异形体C.互为同系物D.互为同分异构体【答案】D【解析】试题分析:轴烯与苯分子式都是C6H6,二者分子式相同,结构不同,互为同分异构体,故选项D正确。
【考点定位】考查同系物、同素异形体、同分异构体概念。
【名师点睛】有机物的概念是历次考试的主要考点儿之一,主要包括有机物的分类、有机反应类型、同分异构体等“四同”。
有机物所属类别主要由官能团决定,芳香烃是指分子中含有苯环的烃类物质。
同位素:是同种元素的不同种核素间的互称,是针对原子而言;同素异形体:是同种元素组成的不同种单质的互称,是针对单质而言;同系物:是指结构相似、组成上相差一个或若干“CH2”原子团的有机物的互称;同分异构体:是指分子式相同而结构不同的有机物的互称。
“四同”往往结合在一起考查,理解的基础上熟练掌握概念便可顺利解答,一般题目难度不大。
2.下列化工生产过程中,未涉及氧化还原反应的是A.海带提碘B.氯碱工业C.氨碱法制碱D.海水提溴【答案】C【解析】试题分析:A.海带提碘是由KI变为I2,有元素化合价的变化,属于氧化还原反应,错误;B.氯碱工业是由NaCl的水溶液在通电时反应产生NaOH、Cl2、H2,有元素化合价的变化,属于氧化还原反应,错误;C.氨碱法制取碱的过程中没有元素化合价的变化,是非氧化还原反应,正确;D.海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,错误。
故选项C正确。
【考点定位】考查氧化还原反应概念。
【名师点睛】氧化还原反应是历年高考必考知识点之一,重点是氧化还原反应的概念、氧化性和还原性强弱比较、氧化还原反应方程式配平、氧化还原反应有关计算等。
掌握氧化还原反应基本概念是解答的关键:失去(共用电子对偏离)电子、化合价升高、被氧化、发生氧化反应、本身做还原剂、转化为氧化产物;得到(共用电子对偏向)电子、化合价降低、被还原、发生还原反应、本身做氧化剂、转化为还原产物。
涉及氧化还原反应配平和计算时依据“质量守恒”、“电子守恒”便可解答,一般题目难度不大。
3.硼的最高价含氧酸的化学式不可能是A.HBO2B.H2BO3C.H3BO3D.H2B4O7【答案】B【解析】试题分析:B原子最外层电子数是3个,所以其最高化合价是+3价,然后根据化合物中正负化合价的代数和等于0可知不可能是H2BO3(其中B元素化合价为+4价),故只有选项B符合题意。
【考点定位】考查元素化合价判断及化学式书写。
【名师点睛】解决此类问题时首先注意审题“最高价”=主族元素的族序数=原子的最外层电子数。
其次注意含计算氧酸中中心原子化合价时H原子为+1价、O原子为-2价,且化合物正、负化合价代数和为0。
4.下列各组物质的熔点均与所含化学键的键能有关的是A.CaO与CO2B.NaCl与HCl C.SiC与SiO2D.Cl2与I2【答案】C【考点定位】考查物质熔沸点高低比较方法。
【名师点睛】物质熔点高低取决于熔化过程中需要破坏作用力类型和大小,一般来说原子晶体>离子晶体>分子晶体。
主要原因是原子晶体和离子晶体融化时分别破坏共价键和离子键,键能越大熔点越高,且原子晶体中原子间由共价键形成空间网状结构,需要破坏化学键数目大于离子晶体;而分子晶体熔化时只破坏分子间作用力,与化学键键能无关,且分子间作用力强弱远小于化学键。
因此,本题换个角度考虑,实质是在考查晶体类型,即两种物质全部是分子晶体的选项符合题意。
5.烷烃的命名正确的是A.4-甲基-3-丙基戊烷B.3-异丙基己烷C.2-甲基-3-丙基戊烷D.2-甲基-3-乙基己烷【答案】D【解析】试题分析:选择分子中含有碳原子数最多的碳链为主链,共6个碳原子称为“己烷”;并从离支链较近的一端给主链的碳原子编号,可见2号碳原子上有1个甲基、3号碳原子上有1个乙基,所以该物质的名称是:2-甲基-3-乙基己烷,故选项D正确。
【考点定位】考查烷烃的命名方法。
【名师点睛】有机物的命名有习惯命名法和系统命名法,考查重点是系统命名法。
烷烃中没有官能团,系统命名法可概括为以下步骤:选主链称某烷、编号为定支链、取代基写在前、标位置短线连、不同基简到繁、相同基合并算。
对于烯烃、炔烃及其他含有官能团的有机物命名时,选主链、给主链碳原子标序号时都要以官能团为主、其他与烷烃规则类似。
二、选择题(本题共36分,每小题3分,每题只有一个正确选项)6.能证明乙酸是弱酸的实验事实是A.CH3COOH溶液与Zn反应放出H2B.0.1mol/L CH3COONa溶液的pH大于7C.CH3COOH溶液与NaCO3反应生成CO2D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红【答案】B【解析】试题分析:A.只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B.该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C.可以证明乙酸的酸性比碳酸强,但是不能证明其酸性强弱,错误;D.可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。
【考点定位】考查酸性强弱比较的实验方法。
【名师点睛】强酸与弱酸的区别在于溶解于水时是否完全电离,弱酸只能部分发生电离、水溶液中存在电离平衡。
以CH3COOH为例,通常采用的方法是:①测定0.1mol/LCH3COOH溶液pH>1,说明CH3COOH没有完全电离;②将pH=1CH3COOH溶液稀释100倍后测定3>pH>1,说明溶液中存在电离平衡,且随着稀释平衡向电离方向移动;③测定0.1mol/L CH3COONa溶液的pH>7,说明CH3COONa是强碱弱酸盐,弱酸阴离子CH3COO-水解使溶液呈碱性。
7.已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。
下列说法一定正确的是A.原子半径:X>Y>Z>WB.W的含氧酸的酸性比Z的含氧酸的酸性强C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性D.若W与X原子序数差为5,则形成化合物的化学式为X3W2【答案】A【考点定位】考查元素周期表和元素周期律综合应用、原子半径比较方法。
【名师点睛】本题属于元素周期表和元素周期律综合应用题型,通常考查的重点是原子序数排在前20号的元素,依据题给信息准确推断元素种类是解题关键。
元素的非金属性越强,氧化性越强,与氢气化合越容易,形成气态氢化物越稳定,元素最高价氧化物对应水化物的酸性越强;元素的金属性越强,还原性越强,置换酸(或水)中的氢越容易,元素最高价氧化物对应水化物的碱性越强。
同周期元素,从左到右,随着原子序数逐渐增大,原子半径减小,金属性减弱,非金属性增强;同主族元素,从上到下,随着原子序数逐渐增大,原子半径增大,非金属性减弱,金属性增强。
8.图1是铜锌原电池示意图。
图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示A.铜棒的质量B.c(Zn2+)C.c(H+) D.c(SO42-)【答案】C【解析】试题分析:该装置构成原电池,Zn是负极,Cu是正极。
A.在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B.由于Zn是负极,不断发生反应Zn-2e-=Zn2+,所以溶液中c(Zn2+)增大,错误;C.由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,正确;D.SO42-不参加反应,其浓度不变,错误。
【考点定位】考查原电池基本原理和溶液中离子浓度变化。
【名师点睛】原电池原理无论在工业生产、日常生活和科学研究领域都有着重要用途,尤其在金属的腐蚀与防护、新能源的开发和利用方面有着不可替代的作用,因此也是历年高考必考知识点之一。
无论题型如何变化,如果把握原电池的工作原理、电极反应式和电池总反应方程式问题都会迎刃而解。
在原电池中,一般活泼金属做负极、失去电子、发生氧化反应(金属被氧化)、逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)做正极、发生还原反应、有金属析出(质量增加)或有气体放出;电子从负极流出经过外电路流回正极,电流方向正好相反;溶液中离子浓度变化及移动方向由电极反应决定。
9.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是A.碳酸钙粉末B.稀硫酸C.氯化钙溶液D.二氧化硫水溶液【答案】A【解析】试题分析:在氯水中存在反应:Cl2+H2O H++Cl-+HClO,若反应使溶液中c(HClO)增大,则溶液的漂白性会增强。
A.由于酸性HCl>H2CO3>HClO,所以向溶液中加入碳酸钙粉末,会发生反应:2HCl+CaCO3=CaCl2+H2O+CO2↑,使化学平衡正向移动,导致c(HClO)增大,则溶液的漂白性会增强,正确;B.若加入稀硫酸,使溶液中c(H+)增大,平衡逆向移动,溶液的漂白性减弱,错误;C.加入氯化钙溶液,不能发生反应,溶液的水对氯水起稀释作用,使溶液的漂白性减弱,错误;D.加入二氧化碳的水溶液,电离产生氢离子,使化学平衡逆向移动,溶液的漂白性减弱,错误。
【考点定位】考查氯水的性质。
【名师点睛】氯水的成分及其性质是中学化学的重要考点,在新制的氯水中存在下列关系:Cl2+H2O H++Cl-+HClO、HClO H++ClO-、H2O H++OH-,氯水中存在三分子:H2O、Cl2、HClO,四离子:H+、Cl-、ClO-、OH-。
所以,新制的氯水呈浅黄绿色,有刺激性气味,属于混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
①Cl2的强氧化性;②HCl的强酸性;③HClO的强氧化性(漂白性等)、弱酸性;④Cl-的性质等。
特别注意的是氯气和水的反应为可逆反应、HClO存在电离平衡,分析氯水的性质时要结合反应条件及平衡移动原理。
10.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和代表不同元素的原子。
关于此反应说法错误的是A.一定属于吸热反应B.一定属于可逆反应C.一定属于氧化还原反应D.一定属于分解反应【答案】A【考点定位】考查常见化学反应类型的判断。
【名师点睛】化学试题的呈现方式形式多样,可采用文字、数据、图表、示意图等多种方式的融合,增加试题信息的广度,考查学生从不同呈现方式中提取有用信息、加工信息,并利用信息进行思考或推理的能力。
这些信息蕴含着解决试题的重要思路、数据和方法,如物质性质、物质形态、反应条件、反应产物、结构特征以及变化趋势等。
这就要求考生通过“现场独立自学”的方式,从中概括抽象出新的知识或发现数据之间的关系,同时与学过的知识相组合,形成较全面的网络化的知识体系,将这些知识体系进一步应用到新的知识情境中,从而解决问题。
这种试题对具有自主学习和独立思考能力的培养和考查,将发挥非常重要的作用。