2021届高考二轮复习化学专题精品试卷 专题八 电化学基础 学生版(含答案)
- 格式:pdf
- 大小:955.35 KB
- 文档页数:10
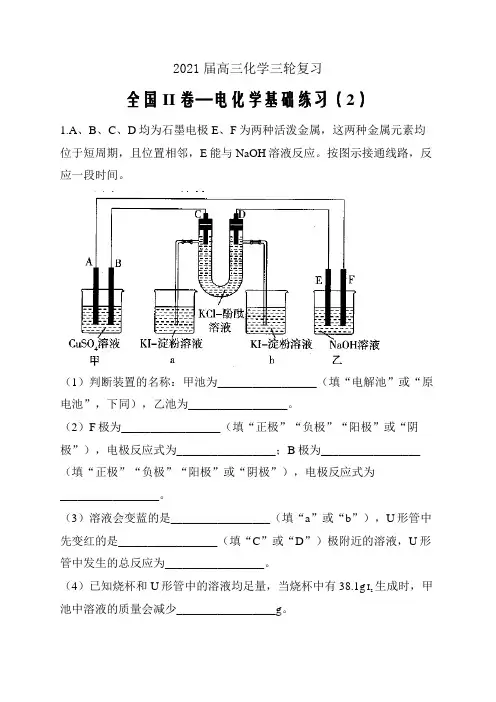
2021届高三化学三轮复习全国II卷—电化学基础练习(2)1.A、B、C、D均为石墨电极E、F为两种活泼金属,这两种金属元素均位于短周期,且位置相邻,E能与NaOH溶液反应。
按图示接通线路,反应一段时间。
(1)判断装置的名称:甲池为_________________(填“电解池”或“原电池”,下同),乙池为_________________。
(2)F极为_________________(填“正极”“负极”“阳极”或“阴极”),电极反应式为_________________;B极为_________________(填“正极”“负极”“阳极”或“阴极”),电极反应式为_________________。
(3)溶液会变蓝的是_________________(填“a”或“b”),U形管中先变红的是_________________(填“C”或“D”)极附近的溶液,U形管中发生的总反应为_________________。
(4)已知烧杯和U形管中的溶液均足量,当烧杯中有38.1gI生成时,甲2池中溶液的质量会减少_________________g。
2.已知铅酸蓄电池的工作原理为22442Pb PbO 2H SO 2PbSO 2H O +++放电充电。
现用如图装置进行电解实验,测得当铅酸蓄电池中转移0.4mol 电子时,铁电极的质量减少11.2g 。
请回答下列问题:(1)A 是铅酸蓄电池的__________________极,铅酸蓄电池正极的电极反应式为__________________,放电过程中电解液的密度(忽略电解液的体积变化)__________________(填“减小”“增大”或“不变”)。
(2)Ag 电极的电极反应式是__________________,该电极的电极产物有__________________g 。
(3)Cu 电极的电极反应式是__________________,4CuSO 溶液的浓度__________________(填“减小”“增大”或“不变”)。

2022年高考化学二轮复习重点专题常考点突破练专题八有机化学基础(必修)题型一同分异构体与同系物1.(2021湖南永州模拟)分子式为C8H8O2的含苯环有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体有(不考虑立体异构)()A.2种B.3种C.4种D.5种答案C2.(2021湖南长郡模拟)已知有机物和的邻二氯代物均只有一种,则有机物的一氯代物有()A.4种B.5种C.6种D.7种答案B3.(2021山东菏泽模拟)某有机物X的化学式为C5H12O,能与钠反应放出氢气。
X被氧化最终能生成羧酸Y(C5H10O2),若不考虑立体异构,X和Y组合生成的酯最多有()A.4种B.8种C.16种D.32种答案C4.(2021河北衡水模拟)有四种含氮的化合物a(吡咯)、b(吡啶)、c[哌啶(六氢吡啶)]、d(四氢吡啶),其结构简式如图所示。
下列有关叙述错误的是()A.a、b、c、d均由C、H、N三种元素组成B.a与b互为同系物,c与d互为同系物C.a、b分别与氢气完全加成后可生成d、cD.c的二氯代物多于d(不含立体异构)答案B5.(2021上海长宁区模拟)据报道,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品的说法错误的是()A.CH3CH2OH能与水互溶B.NaClO通过氧化灭活病毒C.过氧乙酸与乙酸是同系物D.氯仿又叫三氯甲烷答案C题型二反应类型判定及消耗问题1.(2021湖南怀化一模)有机化合物M的结构简式为,关于M的下列说法正确的是()A.该有机化合物的分子式为C14H14O9B.该有机化合物分子中含有3种含氧官能团C.该有机化合物在酸性条件下水解的有机产物有2种D.该有机化合物能发生氧化反应、取代反应、加成反应答案B2.(2021安徽高三月考)拉坦前列素的结构如图所示,它具有良好的降眼压作用。
有关该化合物,下列叙述错误的是()A.分子式为C26H40O5B.1 mol该有机物最多能消耗4 mol NaOHC.能发生水解反应、加成反应D.分子中不可能所有碳原子共平面答案B3.(2021辽宁朝阳模拟)山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如图所示。

元素及其化合物[考纲要求] 1.理解并能应用常见金属的活动顺序。
2.了解常见金属(如Na、Al、Fe、Cu等)及其重要化合物的主要性质和重要应用。
3.了解常见非金属(如H、C、N、O、S、Si、Cl等)及其重要化合物的主要性质和重要应用。
4.认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。
5.了解金属材料在生产和生活中的重要应用。
认识常见无机物在生产中的应用和对生态环境的影响。
考点一元素化合物基础知识及简单应用(一)钠及其化合物钠是“极其活泼”金属的代表,学习钠的性质可类比知道第ⅠA族、第ⅡA族活泼金属的一般性质,复习时应从以下几个方面掌握:1.(2021学年学科教研组复习备考编写)树立物质转化思想(1)理清知识主线Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3(2)形成网络构建2.重要反应规范书写用方程式回答下列问题(1)实验室怎样处理钠屑?2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
(2)写出Na与CuSO4溶液反应的离子方程式。
2Na+2H2O+Cu2+===Cu(OH)2↓+H2↑+2Na+。
(3)怎样将Na2CO3溶液转化为NaOH溶液(用化学方程式表示)。
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
(4)向NaOH、Na2CO3、NaHCO3溶液中逐滴加入盐酸,发生反应的离子方程式。
OH-+H+===H2O;CO2-3+H+===HCO-3;HCO-3+H+===H2O+CO2↑。
(5)怎样除去CO2中的SO2气体(用离子方程式表示)。
SO2+2HCO-3===2CO2↑+SO2-3+H2O。
(6)怎样除去Na2CO3溶液中的NaHCO3(用离子方程式表示)。
HCO-3+OH-===CO2-3+H2O。
(7)怎样除去NaHCO3溶液中的Na2CO3(用离子方程式表示)。
CO2-3+H2O+CO2===2HCO-3。

八、电化学-练习(北京卷)26.氯碱工业中电解饱和食盐水的原理示意图如右图所示(1)溶液A的溶质是;(2)电解饱和食盐水的离子方程式是(3)电解时用盐酸控制阳极区溶液的P H在2~3,用化学平衡移动原理解释盐酸的作用(4)电解所用的盐水需精制。
去除有影响的Ca2+、Mg2+、NH+3、SO2-2,[c(SO2-2)]>c(Ca2+)]。
精制流程如下(淡盐水和溶液A来电解池):①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg / L,则处理10m3 盐水b ,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计)。
(山东卷)29.科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为。
要清洗附着在试管壁上的硫,可用的试剂是。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+x S=Na2Sx,正极的电极反应式为。
M(由Na2O和Al2O3制得)的两个作用是。
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的倍。
(Pb:207)(3)Na2S溶液中离子浓度由大到小的顺序为,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为(用离子方程式表示)。
(江苏卷)18.Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。
反应方程式为2AgNO3+4KOH+K2S2O8=Ag2O2+2KNO3+2K2SO4+2H2O回答下列问题:(1)上述制备过程中,检验洗涤是否完全的方法是。
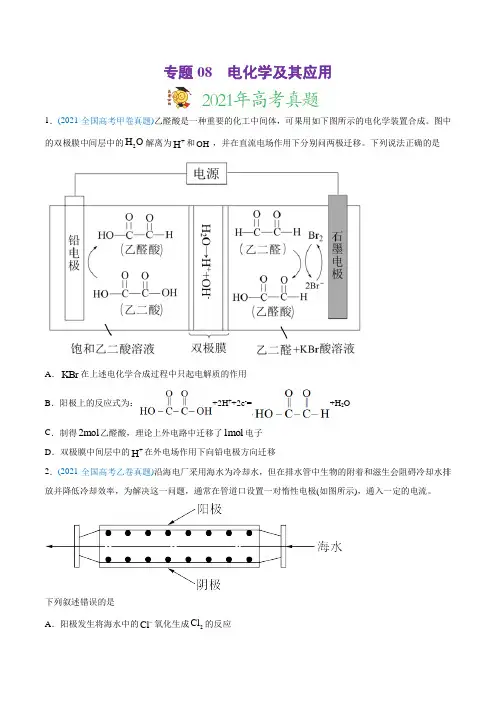
专题08 电化学及其应用1.(2021·全国高考甲卷真题)乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。
图中的双极膜中间层中的2H O 解离为+H 和-OH ,并在直流电场作用下分别问两极迁移。
下列说法正确的是A .KBr 在上述电化学合成过程中只起电解质的作用B .阳极上的反应式为:+2H ++2e -=+H 2OC .制得2mol 乙醛酸,理论上外电路中迁移了1mol 电子D .双极膜中间层中的+H 在外电场作用下向铅电极方向迁移2.(2021·全国高考乙卷真题)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是A .阳极发生将海水中的Cl 氧化生成2Cl 的反应B .管道中可以生成氧化灭杀附着生物的NaClOC .阴极生成的2H 应及时通风稀释安全地排入大气D .阳极表面形成的2Mg(OH)等积垢需要定期清理3.(2021·广东高考真题)火星大气中含有大量2CO ,一种有2CO 参加反应的新型全固态电池有望为火星探测器供电。
该电池以金属钠为负极,碳纳米管为正极,放电时 A .负极上发生还原反应 B .2CO 在正极上得电子 C .阳离子由正极移向负极D .将电能转化为化学能4.(2021·广东高考真题)钴(Co )的合金材料广泛应用于航空航天、机械制造等领域。
如图为水溶液中电解制备金属钴的装置示意图。
下列说法正确的是A .工作时,Ⅰ室和Ⅱ室溶液的pH 均增大B .生成1mol Co ,Ⅰ室溶液质量理论上减少16gC .移除两交换膜后,石墨电极上发生的反应不变D .电解总反应:222Co2H O++通电22Co O 4H ++↑+5.(2021·河北高考真题)K —O 2电池结构如图,a 和b 为两个电极,其中之一为单质钾片。

2017年高考化学二轮复习专题08 电化学(讲)(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017年高考化学二轮复习专题08 电化学(讲)(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017年高考化学二轮复习专题08 电化学(讲)(含解析)的全部内容。
专题08 电化学(讲)考向一原电池(1)考纲要求1.了解原电池的工作原理,能写出常见的电极反应和电池反应方程式。
2。
了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害、防止金属腐蚀的措施.(2)命题规律原电池作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位,在高考中主要考查原电池的工作原理、电极反应及电池反应的方程式、电池中溶液pH的变化以及有关电化学的计算等,由于能源问题已成为社会热点,从能源问题切入,结合新能源开发及新型电池仍将会出现在今后高考试题中.【例1】【2016年高考海南卷】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是()A.Zn为电池的负极B.正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2OC.该电池放电过程中电解质溶液浓度不变D.电池工作时OH 向负极迁移【答案】AD考点:考查原电池原理及化学电源【名师点睛】原电池原理是建立在氧化还原和电解质溶液基础上,借助氧化还原反应实现化学能与电能的相互转化,是高考命题重点,题目主要以选择题为主,主要围绕原电池的工作原理、电池电极反应的书写与判断、新型电池的开发与应用等进行命题。
【例2】【2016年高考新课标Ⅱ卷】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是 ( )A.负极反应式为Mg-2e-=Mg2+B.正极反应式为Ag++e—=AgC.电池放电时Cl—由正极向负极迁移D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑【答案】B【解析】试题分析:根据题意,电池总反应式为:Mg+2AgCl=MgCl2+2Ag,正极反应为:2AgCl+2e-= 2Cl—+ 2Ag,负极反应为:Mg—2e—=Mg2+,A项正确,B项错误;对原电池来说,阴离子由正极移向负极,所以电池放电时Cl-由正极向负极迁移,C项正确;由于镁是活泼金属,则负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑,D项正确;答案选B.【考点定位】考查原电池的工作原理。

2021-2022年高考化学二轮复习全国卷近5年模拟试题分考点汇编电化学基础(含解析)1、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为3Zn + 2K2FeO4+ 8H2O3Zn(OH)2+ 2Fe(OH)3+ 4KOH下列叙述正确..的是()A.放电时负极反应为:Fe(OH)3—3e— + 5 OH—= FeO42- + 4H2OB.电池的电解质溶液为酸性,负极为铁,正极为K2FeO4C.放电时每转移3 mol电子,正极有1mol K2FeO4被还原D.放电时正极附近溶液的碱性减弱【答案】C【解析】A:放电时负极是Zn,电极反应为3Zn-6e-+6OH-= 3Zn(OH)2;B:电解质溶液只有是碱性时该电池的反应物和产物才稳定存在,放电时Zn发生氧化反应,作负极,K2FeO4发生还原反应,作正极;C:当3 mol Zn反应时,有2mol K2FeO4被还原,转移电子6 mol,故C正确;D:放电时正极电极反应式:2FeO42- + 6e- + 8H2O=2Fe(OH)3+ 10 OH-,溶液碱性增强。
2、用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入( )A.Cu(OH)2 B. Cu C.CuSO4D. CuO【答案】D3、下列叙述正确的是( )A.电解饱和食盐水制烧碱时,Fe作阳极,石墨作阴极B.电解氯化铜时,阳极上产生的气体质量和阴极上析出的铜的质量相等C.钢铁在空气中发生电化腐蚀时,铁作负极D.原电池工作时,阳离子移向电池的负极【答案】C4、镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:由此可知,该电池放电时的负极材料是()A.Cd(OH)2 B.Ni(OH)2C.Cd D.NiO(OH)【答案】C5、【答案】C【解析】本题考查原电池原理的应用。
由图像可得,pH=2时气体的压强增大,发生析氢腐蚀,pH=4时气体的压强减小,发生的是吸氧腐蚀,无论析氢还是吸氧,负极反应都是铁失电子变成亚铁离子,由图像可得,吸氧腐蚀的速率大于析氢腐蚀,C错误。

2021年高考化学复习之专题突破训练《专题八:电化学基础》一、选择题(共30小题)1.(2020秋•松江区期末)在饱和氯化钠溶液浸润的滤纸上分别做甲、乙两个实验,如图所示,下列判断正确的是()A.a极上发生还原反应B.d为阴极,发生的反应为:Fe﹣2e→Fe2+C.铁片腐蚀速率:乙>甲D.b极上发生的反应为:O2+2H2O+4e→4OH﹣2.(2020秋•河北区期末)下列化学用语或说法正确的是()A.用铁作阳极电解熔融Al2O3生产金属铝B.钢铁吸氧腐蚀的正极反应:O2+4e﹣+2H2O═4OH﹣C.粗铜(含Zn、Fe、Ag、Au等杂质)精炼中产生的阳极泥的成分只有AuD.用石墨作电极电解饱和食盐水的离子方程式:2H++Cl﹣Cl2↑+H2↑3.(2020秋•通州区期末)将一块镀层破损的铁片置于海边潮湿环境中,一段时间后铁片如图所示。
下列说法正确的是()A.电子由镀层流向铁B.铁片凹陷深处产生了较多OH﹣C.镀层的金属性比铁弱D.对铁进行了牺牲阳极的阴极保护4.(2020秋•眉山期末)镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用。
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是()A.充电时阳极反应:Ni(OH)2+OH﹣﹣e﹣═NiOOH+H2OB.充电过程是化学能转化为电能的过程C.放电时负极附近溶液的碱性增强D.放电时电解质溶液中的K+向负极移动5.(2020秋•乐山期末)氯碱工业是以电解食盐水为基础的工业,电解食盐水同时得到两种气体(一种是密度最小的气体,一种是黄绿色气体)和一种强碱。
下列有关说法不正确的是()A.电解食盐水得到的两种气体分别是H2和Cl2B.实际生产中采用电解饱和食盐水,可以减少产品的损失C.氯碱工业的产品之一为烧碱D.工业常用光照H2和Cl2混合气体的方法制备HCl6.(2020秋•海淀区期末)下列化学用语对事实的表述不正确的是()A.工业上用乙醛催化氧化法制乙酸:2CH3CHO+O22CH3COOHB.向AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+C.用Na2S除去工业废水中的Hg2+:Hg2++S2﹣═HgS↓D.电镀铜的阴极反应:Cu2++2e﹣═Cu7.(2020春•信阳期末)液体燃料电池相比于气体燃料电池具有体积小、安全性高等优点。

【金版教程】(全国通用)高考化学大二轮专题复习专题八电化学基础两题即训课堂效果增L两题即训•课堂效果增1. [2014·北京高考]下列电池工作时,O2在正极放电的是()解析:氢燃料电池中,负极上H2放电,正极上O2放电,A、C、D中均不存在O2放电,故选B。
答案:B放电2. [2014·天津高考]已知:锂离子电池的总反应为LixC+Li1-xCoO2C+LiCoO2,充电放电Li2S。
锂硫电池的总反应为2Li+S充电有关上述两种电池说法正确的是()A. 锂离子电池放电时,Li+向负极迁移B. 锂硫电池充电时,锂电极发生还原反应C. 理论上两种电池的比能量相同D. 如图表示用锂离子电池给锂硫电池充电解析:A项,在原电池内部,阳离子应移向正极;二次电池充电过程为电解的过程,阴极发生还原反应,B项正确;C项,比能量是指这种电池单位质量或单位体积所能输出的电能,当二者质量相同时,转移电子的物质的量不相等,即比能量不同;D项,左边装置已经是放完电的电池,应为锂硫电池给锂离子电池充电。
答案:B3.[2012·福建高考]将如图所示实验装置的K闭合,下列判断正确的是()A. Cu电极上发生还原反应B. 电子沿Zn→a→b→Cu路径流动4)增大C. 片刻后甲池中c(SO2-D. 片刻后可观察到滤纸b点变红色解析:K闭合后,甲和乙装置通过盐桥形成原电池,Zn是负极,发生氧化反应,Cu是正极,发生还原反应,A选项正确;电子不经过溶液,B选项错误;在原电池中阴离子由正极移4)均不变,C选项向负极,盐桥中的Cl-向甲池移动,K+向乙池移动,两池中的c(SO2-错误;a是电解池的阴极,电极反应式为2H++2e-===H2↑,由于H+来自于水的电离,所以H+放电的同时溶液中产生了OH-,所以滤纸的a点变红,D选项错误。
答案:A4. [2012·山东高考]下列与金属腐蚀有关的说法正确的是( )A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的解析:A项,靠近海面溶解O2多,腐蚀速率大,A错误;B项,由M改置于N后,锌作原电池的负极,Cu-Zn合金应充当原电池的正极,受到了一定的保护,腐蚀速率减小,B 正确;C项,接通开关时,锌作原电池的负极,腐蚀速率变大,但是气体不在锌(负极)上产生,而是在铂(正极)上产生,C错误;D项,Zn-MnO2干电池发生放电反应,导致Zn被腐蚀,主要原因是锌发生氧化反应,体现了锌的还原性,D错误。

2021高考化学冲刺●电化学基础●化学反应速率与化学平衡●电解质溶液●化学实验●有机化学明确考试重点熟悉常见题型掌握解题方法沉着冷静应考2021高考化学冲刺——电化学基础常考考点:1.原电池电解池原理2.原电池正负极判断3.电极方程式、(电解)电池方程式书写4.原电池电解池中离子移动方向5.电荷守恒的应用6.二次电池充放电问题7.综合应用原电池原理、正负极判断、电极方程式书写、离子移动方向、电荷守恒1、(2021浙江高考10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是A.液滴中的Cl―由a区向b区迁移B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH-C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-Cu2+2.(2021安徽高考12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是:A.正极反应式:Ag+Cl--e-=AgClB.每生成1 mol Na2Mn5O10转移2 mol电子C.Na+不断向“水”电池的负极移动D. AgCl是还原产物3.(2021北京高考8)结合下图判断,下列叙述正确的是A.Ⅰ和Ⅱ中正极均被保护B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀4.(2021福建高考11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
八、电化学1.(最新·高考新课标全国卷Ⅰ)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。
根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。
下列说法正确的是( )A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al+3Ag2S===6Ag+Al2S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl解析:选B。
原电池原理及应用。
铝质容器、变黑的银器及食盐溶液构成原电池装置,铝作负极,变质的银器作正极。
负极反应式为Al-3e-===Al3+,正极反应式为Ag2S+2e-===2Ag+S2-。
Al3+与S2-在溶液中不能共存,能发生水解相互促进反应2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑,故原电池总反应为2Al+3Ag2S+6H2O===6Ag+2Al(OH)3+3H2S↑,故B项正确,C项错误。
A项,原电池反应是自发进行的氧化还原反应,银器中Ag2S被还原成Ag,质量减轻,故A项错误。
D项,黑色褪去的原因是黑色的Ag2S转化为Ag,故D项错误。
2.(最新·高考新课标全国卷Ⅱ)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是( )A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为:NiCl2+2e-===Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动解析:选B。
结合蓄电池装置图,利用原电池原理分析相关问题。
A项,在负极Na失电子生成Na+,正极反应为NiCl2+2e-===Ni+2Cl-,故电池反应中有NaCl生成;B项,电池的总反应是金属钠还原二价镍离子;C项,正极上NiCl2发生还原反应,电极反应为NiCl2+2e-===Ni+2Cl-;D项,钠在负极失电子,被氧化生成Na+,Na+通过钠离子导体在两电极间移动。