麦冬的含量测定方法
- 格式:doc
- 大小:24.50 KB
- 文档页数:1

苯酚-硫酸法与蒽酮-硫酸法测定麦冬中麦冬多糖含量的比较研究作者:张妍,刘太林来源:《现代食品》 2018年第18期摘要:比较苯酚- 硫酸法和蒽酮- 硫酸法测定麦冬多糖含量的差异,并对两种方法的测定条件进行优化。
结果表明:苯酚- 硫酸法最佳测定条件为苯酚质量分数6%、硫酸用量5 mL、反应温度50 ℃、反应时间20 min,测得麦冬中多糖含量为42.96%。
蒽酮- 硫酸法最佳测定条件为蒽酮- 硫酸用量4 mL、反应温度100 ℃、反应时间15 min,测得麦冬中多糖含量为38.56%。
在10 ~100 μg/mL范围内,苯酚- 硫酸法呈良好的线性关系(R2=0.999 1),明显优于蒽酮- 硫酸法线性关系(R2=0.996 4);苯酚- 硫酸法测定麦冬多糖精密度、重复性和加样回收率均优于蒽酮- 硫酸法,在0 ~ 120 min 内稳定性较蒽酮- 硫酸法差别不大。
综合考虑,苯酚- 硫酸法与蒽酮- 硫酸法均适用于麦冬多糖成分的测定,但苯酚- 硫酸法准确性与稳定性更好,故在麦冬中麦冬多糖含量测定时可优先考虑苯酚- 硫酸法。
关键词:麦冬多糖;苯酚- 硫酸法;蒽酮- 硫酸法麦冬[Ophiopogon japonicas (Thunb.) Ker-Gawl]为百合科沿阶草属多年生植物麦冬的干燥肉质块茎,主要分布于四川、浙江及江苏一带[1-3]。
《本草汇言》中记载:麦门冬,味甘、微苦,性微寒,归心、肺、胃经,可为清心润肺之药,常与其他中药配伍,用于治疗肺燥干咳、津伤口渴,心烦失眠、内热消渴以及肠燥便秘等[4]。
麦冬的有效成分包括甾体皂苷、多糖、异黄酮和氨基酸等,其中麦冬多糖含量较高,其药理作用主要表现为抗肿瘤、抗心肌缺血、抗氧化、抗过敏、降低血糖、增强机体免疫、润肺平喘并保护外分泌腺等[5-8]。
植物多糖的测定方法主要包括苯酚 - 硫酸法[9-11]、蒽酮 - 硫酸法[12-14]、还原糖测定法[15-16]、高效液相色谱法[17-18]、酶法[19-20] 等,当前文献报道植物多糖测定方法以苯酚- 硫酸法和蒽酮- 硫酸法较为多见。



HPLC同时测定麦冬中5个皂苷成分的含量建立测定麦冬药材中麦冬皂苷D,麦冬皂苷D′,ophiopojaponinC,去乙酰基ophiopojaponinA,3OαL鼠李糖(1→2)β葡萄糖麦冬苷元5种成分的HPLC方法。
采用HPLCELSD方法,色谱柱为Kromasil1005C18柱(4.6mm×250mm,5μm);流动相为乙腈(A)水(B)溶液,梯度洗脱0~45min,35%~55%A,体积流量1.0mL·min-1;柱温35℃,漂移管温度100℃,气体流速3.0L·min-1;进样量15μL。
结果表明5种成分均达到基线分离,各成分均有较宽的线性范围和良好的线性关系(r>0.999);回收率在95.75%~103.1%。
建立的麦冬皂苷含量测定方法准确灵敏、重复性好,可应用于麦冬药材质量评价中。
标签:麦冬;皂苷;HPLC;含量麦冬来源于百合科沿阶草属植物Ophiopogonjaponicus(L.f)KerGawl.的干燥块根,是常用中药材之一,主要用于治疗肺燥干咳,阴虚痨嗽,喉痹咽痛,津伤口渴,内热消渴等疾病[1]。
主产四川、浙江、湖北、山东、安徽等地,形成了川麦冬、杭麦冬[2]等道地品种。
麦冬中皂苷类成分为其代表有效成分[3],《中国药典》2010年版一部麦冬项下采用紫外可见光分光光度法对麦冬的总皂苷含量进行了测定,紫外可见分光光度测定总皂苷含量重现性和精密度均较低。
本文旨在建立同时测定麦冬中5个麦冬皂苷成分含量的高效液相色谱方法,为更好地控制麦冬的质量提供一种简便可行,准确、快速的检测方法,同时也为麦冬质量标准的提升提供方法学参考。
1材料Agilent1200高效液相色谱仪(美国安捷伦公司,包括二元泵,自动进样器,AlltechELSD2000蒸发光散射检测器),BP121S1/10万电子天平(德国赛多利斯公司),KQ500DB数控超声波清洗器(昆山市超声仪器有限公司)。

麦冬的含量测定方法
麦冬的含量测定方法
【含量测定】对照品溶液的制备取鲁斯可皂昔元对照品适量,精密称定,加甲醇制成每 1ml 含50μ g 的溶液,即得。
标准曲线的制备精密量取对照品溶液0.5ml 、1ml、2ml、3ml、4ml、5ml、6ml,分别置具塞试管中,于水浴中挥干溶剂,精密加入高氯酸lOml ,摇匀,置热水中保温l5 分钟,取出,冰水冷却,以相应的试剂为空白,照紫外 - 可见分光光
度法,在 397nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
测定法取本品细粉约3g,精密称定,置具塞锥形瓶中,精密加入甲醇 50ml,称定重量,加热回流 2 小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,
滤过,精密量取续滤液25ml,回收溶剂至干,残渣加水lOml 使溶解,用水饱和正丁醇振摇提取5 次,每次lOml ,合并正丁醇液,用氨试液洗涤 2 次,每次 5ml,弃去氨液,正丁醇液蒸干。
残渣用80%甲醇溶解,转移至50ml 量瓶中,加80%甲醇至刻度,摇匀。
精密量取供试品溶液2~5μl ,置 lOml 具塞试管中.照标
准曲线的制备项下的方法,自“于水浴中挥干溶剂”起,依法测定吸光度,从标
准曲线上读出供试品溶液中鲁斯可皂苷元的重量,计算,即得。
本品按干燥品计算,含麦冬总皂苷以鲁斯可皂苷元(C27H4204) 计,不得少于0.12%。
计算:公式?。
目的:规范药材的检验方法及操作程序。
范围:麦冬责任:质检员程序:1性状取本品,在光线明亮处观察其形状、大小、色泽、表面特征、质地、断面。
鼻闻口嗅其气味。
2鉴别2.1取本品横切面,照《中国药典》2005年版一部附录IIC所述方法制片,置显微镜下观察。
2.2取本品2g,剪碎,加三氯甲烷-甲醇(7:3)混合溶液20ml,浸泡3小时,超声处理30分钟,放冷,滤过,滤液蒸干,残渣加三氯甲烷0.5ml使溶解,作为供试品溶液。
另取麦冬对照药材2g,同法制成对照药材溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各10μl,分别点于同一硅胶GF254薄层板上,以甲苯-甲醇-冰醋酸(80:5:0.1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
3检查3.1水分。
3.1.1方法按“水分测定标准操作程序第一法”测定。
3.1.2计算公式:麦冬标准操作规程第2页m3-m2含量= ×100%m1m1:称取的本品重量(g)m2:恒重的称量瓶重(g)m3:干燥后的样品加称量瓶重。
(g)3.2总灰分3.2.1方法:按“灰分测定标准操作程序”测定。
3.2.2公式m3-m2×100%m1m1:称定的样品重量(g)m2:恒重的坩埚m3:灰化后,总灰分加坩埚重3.3酸不溶性灰分3.2.1方法照《中国药典》2005年版一部附录IXK方法操作。
3.2.2计算公式:m3-m2×100%m1m1:称取的供试品重量(g)m2:恒重的坩埚重gm3:灰化后,总灰分加坩埚重g4浸出物4.1方法:照《中国药典》2005年版一部附录XA水溶性浸出物测定法项下冷浸法测定(用溶剂100ml)。
4.2公式:m3-m2含量= ×25/100×100%m1m1:称取的本品重量(g)m2:恒重的蒸发皿(g)m3:蒸干后恒重的浸出物加蒸发皿重。



麦冬提取物中总黄酮的含量测定魏明【摘要】目的:建立麦冬中总黄酮的含量测定方法。
方法采用紫外分光光度法,以橙皮苷为对照品,在283nm 对麦冬总黄酮进行含量测定。
结果橙皮苷在3.1~18.6μg/mL 范围内线性关系良好,R2=0.9992,平均回收率为99.69%,RSD 为0.87%。
所测3批麦冬中总黄酮的平均含量分别为4.19%(RSD=1.85%)、4.31%(RSD=2.16%)、4.26%(RSD=2.39%)。
结论所建立的麦冬总黄酮测定方法操作简便,结果快速、准确、重复性好,可作为麦冬总黄酮含量测定方法。
%Objective To establish the determination methods of total flavonoids in Radix Ophiopogonis extracts. Methods To determine the total flavonoids in Radix Ophiopogonis extracts in UV of 283nm adopt UV spectrophotometry and use hesperidin as control sample. Results The linear relationship of hesperidin in (3.1~18.6)μg/mL was better, R2=0.9992, the average recovery rate was 99.69%, RSD was 0.87%. The average content of total flavonoids of the 3 batchs of Radix Ophiopogonis were4.19%(RSD=1.85%), 4.31%(RSD=2.16%), 4.26%(RSD=2.39%). Conclusion The determination methods of total flavonoids in Radix Ophiopogonis has simple operation, has fast and accurate result, has good reproducibility, could be used as the determination methods of total flavonoids in Radix Ophiopogonis.【期刊名称】《中国医药科学》【年(卷),期】2015(000)009【总页数】3页(P58-59,66)【关键词】麦冬;总黄酮;紫外分光光度法;含量测定【作者】魏明【作者单位】河南省宁陵县中医院传染科,河南宁陵 476700【正文语种】中文【中图分类】R284.2麦冬为百合科植物麦冬Ophiopogon japonicus(L.f) Ker-Gawl.的干燥块根。

HPLC法测定麦冬中麦冬皂苷D含量的方法研究雍琴,张坤,李唐友爱,梅雪[摘要]目的探寻麦冬中指标性成分,建立指标性成分的含量测定方法。
方法采用高效液相色谱法测定麦冬皂苷 D的含量。
色谱柱为十八烷基硅烷键合硅胶,以乙腈-水(48:52)溶液为流动相,检测波长为201 mn,柱温25T:。
结果麦冬皂苷D进样量在0.06400 ~ 0.6400网线性关系良好〇 =0. 9999);平均加样回收率为103. 4%(R S D为1.4%)。
结论该方法准确、可靠,可用于麦冬药材及相关产品中麦冬皂苷D的含量测定,为完善麦冬药材质量标准提供参考。
[关键词]麦冬;麦冬皂苷D;高效液相色谱法;方法学验证[中国图书资料分类号]R917 [文献标志码] A [DOI] 10. 16485/j. issn. 2095-7858. 2017. 04. 003Study on the determination method of Ophiopogonin D in Ophiopogonis RadixYONG Qin, ZHANG Kun^LI Biao,et al. School of Pharmacy, N orth Sichuan Medical College ,Nanchong, S ichuan637000, China [Abstract ]Objective To explore the ingredient index of Ophiopogonis Radix and establish a method for determining the index component. Methods HPLC was adopted to determine the content of Ophiopogonin D. The chromatographic column was eighteen alkyl silane bonded silica gel,and acetonitrile-water(48-52)was used as mobile phase. The detection wavelength was 201 nm and the column temperature was about 25 .Results Ophiopogonin D sample volume has linear relationship between 0. 06400 and 0. 6400 |jig( r = 0. 9999) ;the average recovery rate was 103. 4% ( RSD 1. 4% ). Conclusion The method is accurate and reliable,which can be used for the determination of Ophiopogonin D and related products in the root tuber of Ophiopogonis Radix and provides a reference for improving the quality control standard of Ophiopogonis Radix.[Key words ] Ophiopogonis Radix ; Ophiopogonin D ; HPLC ; Method validation麦冬为百合科的植物麦冬Ophiopogon japonicus (L.f)Ker-GawL的干燥块根。
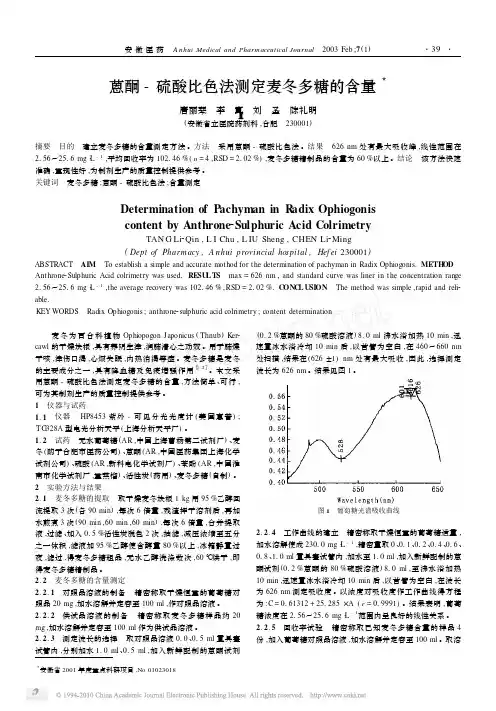
研究简报薄层扫描法测定麦冬皂甙类成分徐江滔 汤谷平 吴 敏 邹 韵(浙江医科大学药学系 310006) 摘要 用薄层色谱法测定了全国四大产区商品麦冬的皂甙元含量。
结果表明,不同产地麦冬的皂甙及皂甙元成分基本一致,但含量有一定的差异。
关键词:麦冬 皂甙 皂甙元 薄层色谱法 麦冬是常用药之一,有滋阴生津之功,据文献报道[1~3],麦冬类药材主含麦冬皂甙、异高黄酮、β-谷甾醇及其甙,皂甙元为假叶树皂甙元和薯蓣皂甙元。
本实验收集了全国四大产区的麦冬商品,经鉴定认为浙江慈溪、萧山和四川绵阳产品为药典收载品种,湖北襄阳、福建泉州、南安则分别为同科植物湖北山麦冬L ir io p e sp ica ta V ar .p ro lif era Y .T .M a 和短葶山麦冬L .m uscar i L.H.B ailey 的块根。
并用薄层扫描色谱法对它们的皂甙和皂甙元进行了定性、定量分析,为全面评价麦冬类药材提供一定的科学依据。
1 试药、仪器慈溪麦冬(购于浙江慈溪);萧山麦冬(购于浙江萧山);绵阳麦冬(由四川绵阳医药站代购);襄阳麦冬(由湖北省药检所代购);泉州麦冬(购于福建泉州);南安麦冬(购于福建南安)。
麦冬皂甙B (oph iopon i n B )、D (oph io-pogon in D ),假叶树皂甙元(ruscog enin ,由日本昭和大学药学部赠);薯蓣皂甙元(dio s-g en in,浙江医科大学植化教研室);β-谷甾醇(β-S ito stero l ,杭州市药检所中药室)。
各种试剂均为分析纯。
岛津CS —930型薄层扫描仪;硅胶板(德国M erck 公司)。
2 样品制备2.1 皂甙样品的制备[4,5] 准确称取麦冬粗粉25g ,用25%乙醇在水浴上回流1h ,趁热过滤,重复2次,合并滤液,减压回收至无醇味,残液用约20m L 乙醚提取,水层用10m L 正丁醇提取3次,合并乙醚液和正丁醇提取液,减压浓缩至干,用甲醇溶解并定容至25m L ,此为总皂甙的粗制品。
XXXXXXXX有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:麦冬1.2 汉语拼音:Mai dong2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7净药材质量标准:8 检验操作规程:8.1 试药与试剂:三氯甲烷、甲醇、麦冬对照药材、冰醋酸、甲苯、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
8.2 仪器与用具:电子天平、超声波处理器、水浴锅、硅胶GF254薄层板、紫外光灯、烘箱、马福炉、中药二氧化硫测定仪。
8.3 性状:取本品适量,在自然光下目测形态和色泽,并记录结果。
8.4 鉴别:8.4.1取本品横切面制片显微镜(10×10)观察组织结构特征。
8.4.2取本品2g,剪碎,加三氯甲烷-甲醇(7:3)混合溶液20ml,浸泡3小时,超声处理30分钟,放冷,滤过,滤液蒸干,残渣加三氯甲烷0.5ml使溶解,作为供试品溶液。
另取麦冬对照药材2g,同法制成对照药材溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各10μl,分别点于同一硅胶GF254薄层板上,以甲苯-甲醇-冰醋酸(80:5:0.1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
8.5 检查:8.5.1水分:不得过16.0%(附录15第二法)。
8.5.2总灰分:不得过5.0%(附录17)。
8.5.3二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
8.6 含量测定:对照品溶液的制备取鲁斯可皂苷元对照品适量,精密称定,加甲醇制成每1ml含50μg的溶液,即得。
标准曲线的制备精密量取对照品溶液0.5ml、1 ml、2 ml、3 ml、4 ml、5 ml、6 ml,分别置具塞试管中,于水浴中挥干溶剂,精密加入高氯酸10 ml,摇匀,置热水中保温15分钟,取出,冰水冷却,以相应的试剂为空白,照紫外-可见分光光度法(附录5),在397nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
HPLC同时测定麦冬中3种高异黄酮含量采用反相高效液相色谱法同时测定麦冬中6-甲酰基沿阶草酮甲、甲基沿阶草酮甲和沿阶草酮甲的含量,选用乙腈-0.5%磷酸溶液(58∶42)作为流动相,检测波长为296 nm(0~14 min),275 nm(14~22 min)。
6-甲酰基沿阶草酮甲、甲基沿阶草酮甲和沿阶草酮甲检测的线性范围分别为0.165~0.990(r=0.999 9),0.153~0.918(r=0.999 9),0.270~1.620 μg(r=0.999 9),平均加样回收率分别为99.76%(RSD 0.95%),99.86%(RSD 0.82%),99.41%(RSD 1.1%)。
研究所建立的反相高效液相色谱法法简便快速、准确度高,可用于麦冬药材的质量控制。
标签:麦冬;高效液相色谱;6-甲酰基沿阶草酮甲;甲基沿阶草酮甲;沿阶草酮甲;含量测定[参考文献][1] 肖培根. 新编中药志,第1卷[M]. 北京:化学工业出版,2002:482.[2] 江洪波,黄静,郭明娟,等. 天然高异黄酮的研究进展[J]. 药学学报,2007,42(2):118.[3] Min Ye,Dean Guo,Guan Ye,et al. Analysis of homoisoflavonoids in Ophiopogon japonicus by HPLC,DAD,ESI,MS[J]. J Am Soc Mass Spectrom,2005,16:234.[4] Yining Lin,Danni Zhu,Jin Qi,et al. Characterization of homoisoflavonoids in different cultivation regions of Ophiopogon japonicus and related antioxidant activity[J]. J Pharm Biomed Anal,2010,52:757.[5] 谢明华,蔡鑫君,陈稀烦. 超声提取麦冬总黄酮的工艺研究[J]. 海峡药学,2008,20(11):15.[6] Guan Ye,Min Ye,Dean Guo,et al. Determination of Homoisoflavonoids in Ophiopogon japonicus by RP-HPLC[J]. Chromatographia,2005,61:121.[7] 唐晓清,程志红,余伯阳. 麦冬的质量控制方法研究[J]. 中国中药杂志,1999,24(7):390.[8] 张义萍,陈建真,敖志辉. 麦冬不同种属、产地和部位的活性成分研究进展[J]. 中国实用医药,2008,3(10):191.[9] 万军,周霞,吴纯洁. 麦冬及其制剂中有效成分含量的测定方法[J]. 职业卫生与病伤,2005,20(2):108.[10] 梁辉,张兴国,程方叙,等. 直立型川麦冬叶片数·块根产量及黄酮·皂苷含量的相关性研究[J]. 安徽农业科学,2009,37(33):16361.[11] 马军守,别继明. 川麦冬及其须根中多糖和黄酮类有效成分定量分析[J]. 西南科技大学学报,2008,23(1):83.[12] 吕惠卿. 麦冬新药用部位探索[J]. 中药材,2008,30(3):270.[13] 杨清林,顾月翠,姜荣兰. 川麦冬及其炮制品总黄酮和微量元素的比较[J]. 华西药学杂志,1995,10(2):77.。
麦冬多糖的提取分离及含量测定目的:将传统提取工艺与膜分离技术联用对麦冬多糖进行分离纯化,并考察其多糖含量。
方法:采用L9(43)正交试验对麦冬多糖的提取工艺进行优化;采用不同分子量级别的超滤膜对麦冬多糖进行精制分离研究。
结果:麦冬多糖最佳提取条件为95°C,提取2次,每次2h。
Sevage法蛋白脱除率高。
检测了超滤膜分级研究所得的各组分多糖含量。
结论:本研究优选的工艺在技术上是合理的、可行的,合适的超滤膜可以将麦冬多糖进行很好的分级纯化。
标签:麦冬;膜分离;多糖Extraction,separation and content determination of Polysaccharide from Ophiopogon japonicus【Abstract】Objective:The polysaccharide of Ophiopogon japonicus was separated and purified by the combination of traditional extraction technology and membrane separation technology,and the content of polysaccharide was investigated.MethodsL9 (43)orthogonal test was used to optimize the extraction process of Ophiopogon japonicus polysaccharide. The purification and separation of Polysaccharide from Ophiopogon japonicus was studied by ultrafiltration membrane with different molecular weight.ResultThe best extraction condition of Ophiopogon japonicus polysaccharide was 95 °C,2 times,2 hours each time. High protein removal rate of Sevage method. The content of polysaccharide in each component of ultrafiltration membrane was determined.ConclusionThe optimal technology of this study is reasonable and feasible,and the suitable ultrafiltration membrane can carry out a good classification and purification of Ophiopogon japonicus polysaccharide.【Key words】Ophiopogon japonicus; Membrane separation; polysaccharides中藥麦冬(Ophiopogon japonicus (Linn. f.)Ker-Gawl.)为百合科沿阶草属多年生常绿草本植物干燥块根,味苦、微苦、性微寒。
麦冬的含量测定方法
【含量测定】对照品溶液的制备取鲁斯可皂昔元对照品适量,精密称定,加甲醇制成每1ml含50μg的溶液,即得。
标准曲线的制备精密量取对照品溶液0.5ml、1ml、2ml、3ml、4ml、5ml、6ml,分别置具塞试管中,于水浴中挥干溶剂,精密加入高氯酸lOml,摇匀,置热水中保温l5分钟,取出,冰水冷却,以相应的试剂为空白,照紫外-可见分光光度法,在397nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
测定法取本品细粉约3g,精密称定,置具塞锥形瓶中,精密加入甲醇50ml,称定重量,加热回流2小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液25ml,回收溶剂至干,残渣加水lOml使溶解,用水饱和正丁醇振摇提取5次,每次lOml,合并正丁醇液,用氨试液洗涤2次,每次5ml,弃去氨液,正丁醇液蒸干。
残渣用80%甲醇溶解,转移至50ml量瓶中,加80%甲醇至刻度,摇匀。
精密量取供试品溶液2~5μl,置lOml具塞试管中.照标准曲线的制备项下的方法,自“于水浴中挥干溶剂”起,依法测定吸光度,从标准曲线上读出供试品溶液中鲁斯可皂苷元的重量,计算,即得。
本品按干燥品计算,含麦冬总皂苷以鲁斯可皂苷元(C
27H
42
4
)计,不得少于
0.12%。
计算:公式?。