度线( × )
[解析]浓硫酸要在烧杯中稀释,待冷却后再转移到容量瓶中。
(3)将称取的NaOH固体加水溶解后,立即转移到容量瓶中定容( × )
[解析]NaOH固体溶解会放热,应冷却至室温后再转移至容量瓶。
(4)称量NaCl固体时,砝码有锈蚀,导致所配溶液的物质的量浓度偏大( √ )
(5)未用蒸馏水洗涤烧杯内壁和玻璃棒,导致所配溶液的物质的量浓度偏小( √ ) (6)将烧杯中溶液转移到容量瓶时不慎洒到容量瓶外,要重新配制( √ ) (7)定容时,仰视容量瓶上的刻度线,最后得到溶液的浓度偏大( × )
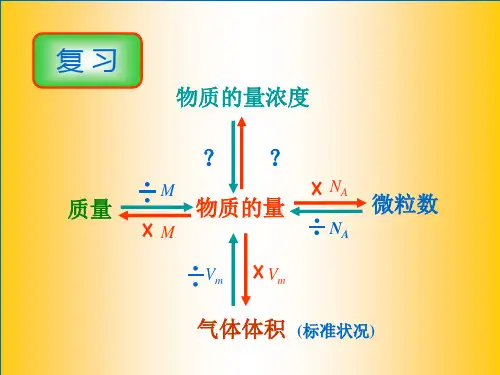
1.判断正误(正确的打“√”,错误的打“×”) (1)配制240 mL 1 mol·L-1 NaOH溶液,称取NaOH固体的质量为9.6 g( × )
[解析]配制240 mL 1 mol·L-1 NaOH溶液,要选取250 mL容量瓶,故称取NaOH 固体的质量为0.25 L×1 mol·L-1×40 g·mol-1=10.0 g。 (2)配制一定物质的量浓度的稀硫酸时,将量取的浓硫酸倒入容量瓶中加水稀释至刻
[易错警示]
(1)溶液稀释或混合时,溶液的体积一般不可直接相加,而是应根据溶液的质 量和密度求算,但溶液密度的单位一般是g·mL-1,而溶液体积的单位是L,要注 意单位的换算。 (2)应用物质的量浓度进行计算时,要注意质量守恒和电荷守恒的应用。
1.容量瓶的构造及使用
(1)容量瓶的构造及选取
250 mL 500 mL
③定容时,加蒸馏水超过了刻度线,再用胶头滴管吸出多 容量瓶 余液体
④定容后,轻轻振荡、摇匀、静置,液面下降再加蒸馏水 ⑤定容时,俯视刻度线 ⑥定容时,仰视刻度线
减小
不变 不变 不变
不变
增大 减小 增大