荧光量子点法降钙素原(PCT)试剂盒的研制
- 格式:doc
- 大小:289.50 KB
- 文档页数:15
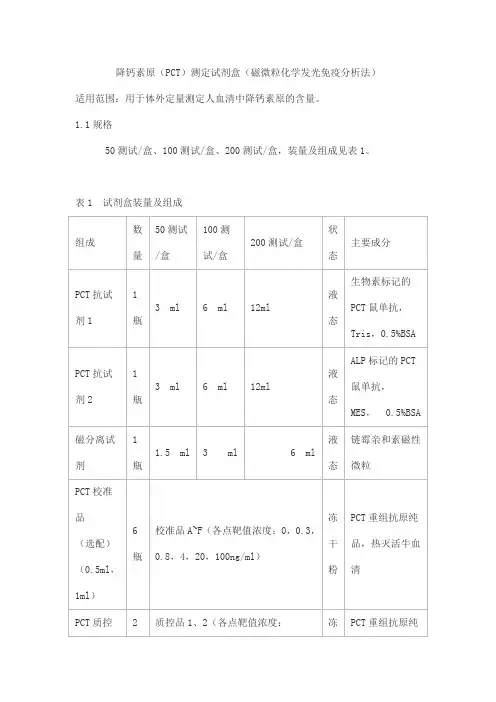
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中降钙素原的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒,装量及组成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度将已知浓度的PCT抗原加入到样本中,其回收率应在(85%~115%)范围内。
2.3空白检测限应不大于0.02ng/ml。
2.4线性在(0.02,100)ng/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5重复性变异系数(CV)应不大于10%。
2.6质控品测值测值应在质控范围内。
2.7批间差批间变异系数(CV)应不大于15%。
2.8校准品瓶间差校准品的瓶间变异系数(CV)应不大于10%。
2.9分析特异性2.9.1 浓度不低于5000pg/ml白介素(IL-6)的零浓度PCT样本,在本试剂盒上测定结果应不高于0.03ng/ml。
2.9.2 浓度不低于10ng/ml降钙素(CT)的零浓度PCT样本,在本试剂盒上测试结果应不高于0.02ng/ml。
2.10稳定性2.10.1效期稳定性:试剂盒在2℃~8℃贮存,有效期为12个月,到效期后的试剂盒检测外观、准确度、空白检测限、线性、重复性和质控品测值,应符合2.1~2.6的要求。
2.10.2复溶稳定性:校准品与质控品复溶后,在2℃~8℃环境下保存3天后进行以下检测:a)校准品:进行准确度、质控品测值的检测,结果应符合2.2,2.6的要求。
b)质控品:进行质控品测值的检测,结果应符合2.6的要求。

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)1.产品型号/规格及其划分说明1.1包装规格25人份/盒。
1.2主要组成成分由PCT测试卡、降钙素原(PCT)质控品、ID卡组成。
其中,PCT测试卡由试纸条、塑料盒组成;试纸条上的主要成分有硝基纤维素膜、吸水纸、样本垫、偶合物垫及PVC板;硝基纤维素膜包被有鼠抗人PCT抗体和羊抗鸡IgY抗体;样本垫上有鼠抗人红细胞抗体;偶合物垫上有荧光标记的鼠抗人PCT抗体和荧光标记的鸡IgY抗体。
降钙素原(PCT)质控品:重组人PCT蛋白。
ID卡:内含校准曲线信息。
1.3适用范围:用于体外定量测定人全血、血浆或血清中降钙素原(PCT)的含量。
临床上主要用于细菌感染性疾病的辅助诊断。
2.产品性能指标2.1试剂盒性能指标2.1.1外观a)试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
b)测试卡外观应平整、色泽均匀、边缘无毛刺,无色斑或污渍,卡固定紧密。
2.1.2膜条宽度膜条宽度应不小于 1.4mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4准确度测定具有溯源性的PCT工作校准品,测量结果与标定浓度的相对偏差应不超过±10%。
2.1.5空白限应不大于0.04ng/mL。
2.1.6线性范围在0.05ng/mL~100ng/mL区间内,线性相关系数r≥0.9900。
2.1.7批内精密度用同一批次的试剂盒,两个浓度工作校准品测定结果的变异系数CV<10.0%。
2.1.8批间精密度用三个不同批次的试剂盒测试,两个浓度工作校准品测定结果的变异系数CV<15.0%。
2.2质控品性能指标2.2.1外观无色澄清透明液体。
2.2.2装量质控品装量为0.5mL,应不少于标示值。
2.2.3准确度和赋值程序质控品测试结果应在靶值范围之内,赋值程序见附录1。
2.2.4均一性对一瓶质控品重复10次检测,对同一批号的10瓶质控品进行检测,批内瓶间差CV应≤15%。
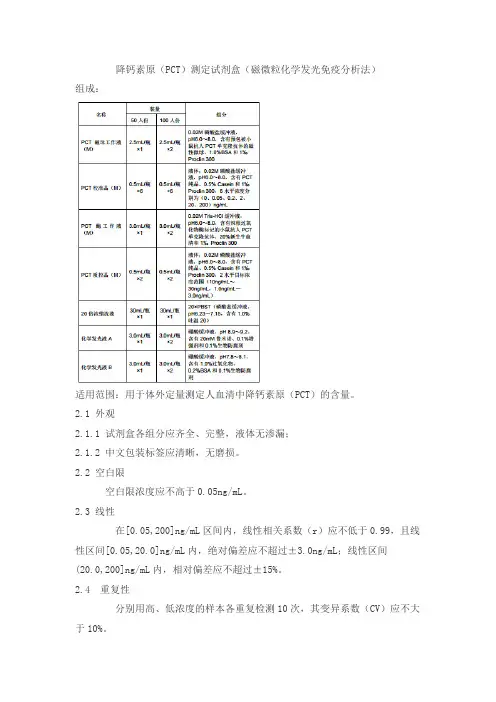
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)组成:适用范围:用于体外定量测定人血清中降钙素原(PCT)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.05ng/mL。
2.3 线性在[0.05,200]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.05,20.0]ng/mL内,绝对偏差应不超过±3.0ng/mL;线性区间(20.0,200]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度将纯品配制的溶液(A)加入到人源样本(B)中,其回收率应在85%~115%之间。
2.6 分析特异性将下表规定浓度的干扰物质用试剂盒进行测定,检测结果的浓度值不得超过0.05ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至企业工作校准品,并与已上市产品比对赋值。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。
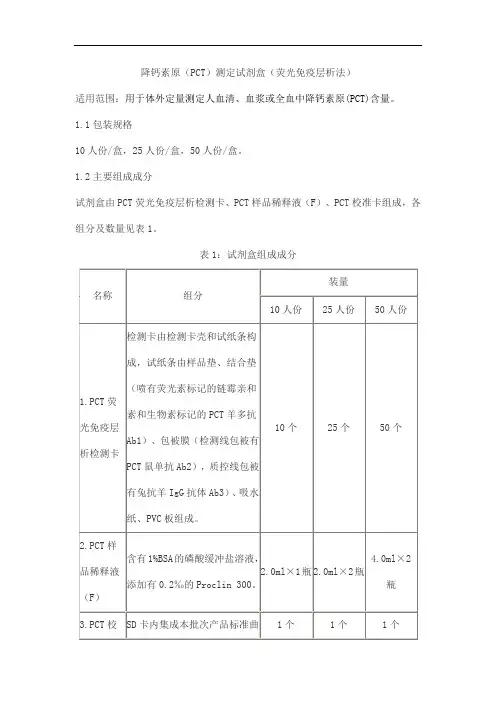
降钙素原(PCT)测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清、血浆或全血中降钙素原(PCT)含量。
1.1包装规格
10人份/盒,25人份/盒,50人份/盒。
1.2主要组成成分
试剂盒由PCT荧光免疫层析检测卡、PCT样品稀释液(F)、PCT校准卡组成,各组分及数量见表1。
表1:试剂盒组成成分
2.1外观
外包装盒应完整,无破损;单包铝箔袋应完整,无破损,保持密封包装;液体组分应澄清透明,无沉淀、无渗漏。
2.2物理性状
2.2.1 试纸条的宽度:应不超于(
3.40±0.10)mm 。
2.2.2 液体移行速度:应不低于5mm/min。
2.3空白检出限
空白检出限浓度应不高于0.05ng/ml。
2.4线性范围
在[0.05,40]ng/ml范围内线性相关系数r≥0.990。
2.5精密度
2.5.1 重复性
变异系数CV不超于15%。
2.5.2 批间差
变异系数CV不超于20%。
2.6准确度
回收率应在85%~115%之间。
2.7分析特异性
测试按表2规定浓度范围的降钙素、白介素-6、C反应蛋白的样品,检测结果应不超过0.1ng/ml。
表2:交叉反应物及浓度列表
2.8效期稳定性试验
试剂盒2℃~30℃保存,铝箔袋密封状态下存放,取有效期满后两个月内的产品进行检测,结果应符合2.2、2.3、2.4、2.5.1、2.6项要求。

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量测定人全血中降钙素原的含量。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分每人份包括1个检测卡、1包干燥剂、1个铝箔袋,每盒试剂包括1个校准信息U盘,(内含校准曲线、产品批号、生产日期、“有效期至”信息)。
其中,检测卡:硝酸纤维素膜,检测线(T线)包被鼠抗人的降钙素原单克隆抗体A、质控线(C线)包被羊抗鼠IgG多克隆抗体、金标垫(材质:玻璃纤维)上固定胶体金标记的鼠抗人降钙素原单克隆抗体B、金标垫的下端装配有玻璃纤维材质的滤血膜。
2.1 外观2.1.1 外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2 膜条宽度为4mm±0.2mm;2.1.3 液体移行速度应不低于10mm/min。
2.2 空白限不高于0.1μg/L。
2.3 定量限测定0.2μg/L的降钙素原样本,变异系数(CV)应不大于10%。
2.4 线性2.4.1 线性范围为[0.2,100.0]μg/L,线性相关系数r不低于0.9900;2.4.2 [0.2,2.0]μg/L绝对偏差不超过±0.2μg/L,(2.0,100.0]μg/L线性偏差在±10%范围内。
2.5 重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10%。
2.6 准确度将已知浓度的降钙素原加入到人全血基质或其它体液成分中, 回收率在85%~115%。
2.7 分析特异性测定浓度为100.0μg/L C反应蛋白,结果应小于0.2ug/L。
2.8 批间差用3个不同批号的试剂盒检测25.0ug/L高浓度样本,相对极差应在±10%范围内。
2.9量值溯源根据GB/T 21415规定了校准曲线的溯源情况,溯源至公司内部工作校准品,并与已上市产品比对赋值。
2.10稳定性:10℃~30℃保存,有效期12个月。
过有效期后进行检测,应符合2.2、2.3、2.4、2.5、2.6的要求。

降钙素原测定试剂盒(荧光免疫层析法)适用范围:本产品用于体外定量测定全血、血清或血浆中降钙素原(PCT)含量。
1.1包装规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分每盒含10/20/50人份的试纸条、样品缓冲液(主要成分:0.01 mol/L的PBS缓冲液,pH:7.4±0.2,装量:至少2mL×1支/3mL×1支/6mL×1支)和标曲信息卡。
每人份的试纸条含1份检测卡、1套取样滴管(选配)、1支离心管(选配)和1包干燥剂。
检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗降钙素原单克隆抗体;C线包被羊抗鼠多克隆抗体)、荧光垫(包被荧光标记的鼠抗降钙素原单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1外观测定试剂应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2膜条宽度测定试剂的膜条宽度≥2.5mm。
2.1.3液体移行速度液体移行速度应不低于10 mm/min。
2.2空白限空白限应不高于0.2ng/mL。
2.3重复性分别检测低、中2个浓度的样本,变异系数(CV)应不高于15.0%。
2.4批间差用3个批号试剂分别检测低、中浓度的样本,变异系数(CV)应不高于15.0%。
2.5线性在[0.2,40]ng/mL的范围内,线性相关系数应不低于0.990。
2.6准确度回收率应在85%~115%之间。
2.7分析特异性含浓度为35mg/mL白蛋白的零浓度PCT样本,检测结果不高于0.2ng/mL。
2.8稳定性将测定试剂在4℃~30℃的环境中放置18个月后,取样分别检测2.1.3、2.2、2.3、2.5、2.6、2.7项,结果应符合各项目的要求。
2.9溯源性按照GB/T 21415-2008及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准曲线信息溯源至公司内部工作校准品。
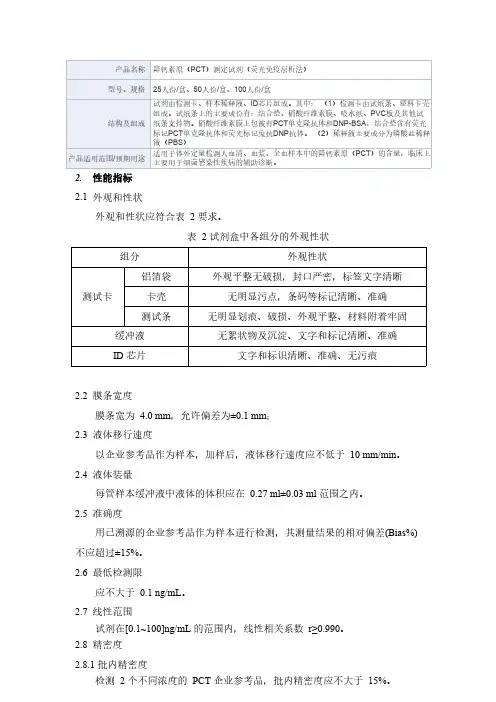
2.性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2试剂盒中各组分的外观性状组分外观性状
测试卡
铝箔袋外观平整无破损,封口严密,标签文字清晰
卡壳无明显污点,条码等标记清晰、准确
测试条无明显划痕、破损、外观平整、材料附着牢固缓冲液无絮状物及沉淀、文字和标记清晰、准确ID芯片文字和标识清晰、准确、无污痕
2.2膜条宽度
膜条宽为 4.0mm,允许偏差为±0.1mm;
2.3液体移行速度
以企业参考品作为样本,加样后,液体移行速度应不低于10mm/min。
2.4液体装量
每管样本缓冲液中液体的体积应在0.27ml±0.03ml范围之内。
2.5准确度
用已溯源的企业参考品作为样本进行检测,其测量结果的相对偏差(Bias%)不应超过±15%。
2.6最低检测限
应不大于0.1ng/mL。
2.7线性范围
试剂在[0.1~100]ng/mL的范围内,线性相关系数r≥0.990。
2.8精密度
2.8.1批内精密度
检测2个不同浓度的PCT企业参考品,批内精密度应不大于15%。
2.8.2批间精密度
检测2个不同浓度的PCT企业参考品,批间精密度应不大于15%。

《专业课程设计》荧光量子点法降钙素原(PCT)试剂盒的研制学院专业指导老师班级姓名学号摘要本产品运用免疫层析法的夹心免疫技术将量子点与PCT单克隆抗体结合,建立一种新型的免疫分析法进行特异性定性检测人血清或血浆中的PCT,使灵敏度显著提高,达到或超过某些酶联免疫吸附法(ELISA)的水平。
由于待检测PCT与PCT抗体的反应,使得水溶性量子点的荧光强度产生变化,通过测定水溶性量子点荧光强度变化的量来实现对待检测PCT浓度的高选择性定量检测。
本发明中的降钙素原(PCT)检测试剂盒具有制备低廉、稳定性好、易于保存,利用荧光量子点标记方法检测灵敏度高、特异性强的优点,比较容易的在临床进行推广。
1.研究背景目前临床和科研实验室中均用免疫学方法检测PCT浓度,包括胶体金法、ELISA法和免疫化学发光法等。
所有这些方法的前提都是制备PCT特异性抗体,且健康人血浆中含量极低,在200pg/mL以下,对抗体的亲和力等参数要求很高。
迄今为止这些检测体系所用的抗体均来自国外大公司,价格昂贵。
因此,制备PCT特异性单克隆抗体,为PCT的免疫检测提供具有自主知识产权的关键原料,对于扩大其临床应用,降低医疗成本,具有重要意义。
目前应用化学发光免疫分析技术建立人血清中降钙素原定量检测方法,采用固相包被降钙素原单克隆抗体,生物素标记另一降钙素原单克隆抗体,建立人血清中降钙素原的双抗体夹心化学发光免疫定量检测方法。
在此基础上,荧光免疫分析技术是利用荧光物质标记抗体或者抗原分子,通过与待分析物的特异性结合后,检测荧光信号的强度变化,实现对目标分析物的定性和定量检测。
制备荧光信号强、免疫活性好的量子点-抗体(QD-Ab)复合物是将量子点应用于荧光免疫检测的关键。
QD-Ab的荧光信号放大效率主要是由量子点—抗体偶联比例以及量子点本身的荧光量子效率决定,而其免疫活性则由QD表面偶联的抗体分子的量效决定,除了抗体自身亲和力对复合物的免疫活性产生影响外,抗体与量子点间的偶联位点和抗体分子在量子点表面的空间构象也对QD—Ab复合物的免疫活性有重要影响。

降钙素原测定试剂盒(荧光免疫层析法)适用范围:本试剂盒与厦门万泰沧海的免疫荧光定量检测仪配套使用,用于体外定量测定人血清或血浆中降钙素原(PCT)的含量。
1.1 包装规格:10人份/盒,50人份/盒1.2 主要组成成分检测卡:附着荧光标记鼠抗人PCT单克隆抗体的玻璃纤维、包被有鼠抗人PCT 单克隆抗体的硝酸纤维素膜、玻璃纤维、塑料背衬。
样本稀释液:0.05M pH9.6碳酸盐缓冲液。
定标代码:贮存有试剂盒批号及对应定标曲线信息。
2.1 外观外包装完整、无破损;液体试剂无杂质、无絮状物、无渗漏,标签应清晰,易识别。
2.2 膜条宽度应不小于2.5mm。
2.3 液体移行速度液体移行速度应不低于10mm/min。
2.4 净含量液体组分的净含量与标示值相对偏差不超过±10%。
2.5 线性范围在线性范围[0.05,20]ng/mL内,线性相关系数r应不低于0.9900;[0.05,4]ng/mL浓度线性绝对偏差不超过±0.6ng/mL;(4,20]ng/mL浓度线性相对偏差应不超过±15%。
2.6 定量限检测0.05ng/mL定量限参考品,变异系数(CV,%)应均不超过20%。
2.7 准确度试剂盒回收率在80%~120%范围内。
2.8 重复性检测低、高两个浓度重复性参考品CV1和CV2,变异系数(CV,%)应均不超过15%。
2.9 批间差用3个批号试剂盒检测低、高两个浓度重复性参考品CV1和CV2,其结果相对偏差(R)应均不超过±15%。
2.10 稳定性效期稳定性:取2℃~30℃干燥处保存18个月以上的留样试剂盒,检测2.1~2.8,2.11项,结果应符合各项目规定的要求。
2.11 特异性检测特异性参考品T1~T4,结果应均<0.5ng/mL。
其中T1为(30±5)ng/mL的降钙激素,T2为(10±2)ng/mL的降钙素,T3为(10±2)μg/mL的CGRPα,T4为(10±2)μg/mL的CGRPβ。

文件名称: 降钙素原(PCT)测定试剂盒(荧光免文件编号:疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控编制人:日期:年月日审核人:日期:年月日批准人:日期:年月日生效日期:年月日颁发部门:质量部颁发份数: 2 份分发部门:生产部、质量部受控编号:降钙素原(PCT)测定试剂盒(荧光免疫层析法)1.产品名称、剂型、注册分类、规格、定义、组成及用途中文名称:降钙素原(PCT)测定试剂盒(荧光免疫层析法)规格:25人份/盒、40人份/盒剂型:诊断试剂注册分类:二类6840体外诊断试剂定义、组成及预期用途:本产品采用高度特异性的抗原抗体反应及免疫层析分析技术,通过夹心法检测原理来体外定量测定人血清、血浆样本中降钙素原(PCT)的含量。
依据:《降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求》文件名称: 降钙素原(PCT)测定试剂盒(荧光免文件编号:疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控目录1.生产工艺流程图2.试剂卡制备生产工艺3.质量控制点4.主要原辅料、包装材料消耗定额、能源消耗定额、物料平衡的计算方法5.包装要求、标签、说明书(附样本)与产品贮存方法及有效期6.设备一览表7.技术安全及劳动保护文件名称: 降钙素原(PCT )测定试剂盒(荧光免疫层析法)工艺规程文件编号:版本/修改状态: V1.0/00受控状态: 受 控1. PCT 生产工艺流程图羊抗兔IgG 抗体鼠抗PCT抗体包被液配制(C 线)包被液配制(T 线)划线(NC 膜)BSA 及其他化学试剂贴膜组装探针稀释液配制样品垫制作 # ★BSA 及其他化学试剂样本稀释液配制分装★切条样品垫处理NC 膜干燥 # ★压卡装袋贴签、组装成品检验烧数据卡化学试剂不合格合格入库不合格品控制不合格十万级洁净区十万级洁净区干燥环境#★:关键工序◇:质量控制点#:湿度≤30%半成品检验十万级洁净区干燥环境#不合格品控制合格合格兔IgG 抗体微球偶联物鼠抗人PCT 抗体微球偶联物BSA 及其他化学试剂样品垫处理液配制不合格品控制探针配制....半成品检验半成品检验不合格品控制不合格合格标准曲线制作万级洁净区不合格文件名称: 降钙素原(PCT )测定试剂盒(荧光免疫层析法)工艺规程文件编号:版本/修改状态: V1.0/00受控状态: 受 控2. 试剂卡制备生产工艺2.1工序一:样品垫制作 2.2工序二:NC膜制备 2.3工序三:样本稀释液制备 2.4工序四: 贴膜组装 2.5工序五: 切条 2.6工序六:压卡装袋 2.7工序七:烧数据卡2.8工序八:降钙素原(PCT )测定试剂盒(荧光免疫层析法)试剂盒组装2.1 工序一:样品垫制作 2.1.1 探针稀释液 2.1.1.1 标准配方名称 物料名称 配制1000ml 使用量75人份使用量探针稀释液三羟甲基氨基甲烷2.4228g0.12ml调节PH=8.4±0.2 蔗糖 150g 牛血清白蛋白 5g 吐温-20 5ml Proclin3000.3ml纯化水定容至1000ml2.1.1.2 配制方法按照标准配方准确称取三羟甲基氨基甲烷2.4228g ,放入洁净烧杯中,加纯化水800ml ,放入1个洁净的磁力搅拌子,置磁力搅拌器上搅拌至充分溶解后,使用多参数测试仪测量PH 值应在8.4±0.2范围内,再依次加入蔗糖150g 、牛血清白蛋白5g 、吐温-20 5ml 、Proclin300 0.3ml ,置磁力搅拌器上搅拌至充分溶解后,将溶液缓缓倒入容积为1000ml 的容量瓶中,用纯化水反复冲洗3次烧杯,所有溶液倒入上述容量瓶中,用纯化水定容至1000ml 。
医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(荧光免疫层析法)2 性能指标2.1 试剂盒性能指标2.1.1 外观试剂盒外观应整洁,文字符号标识清晰、准确、牢固;检测卡整体应牢固,内部试纸条应表面平整、无缺角、无明显划痕、无污染物等明显可见缺陷;样品稀释液为无色透明液体。
2.1.2 净含量应符合表2的要求。
表2 净含量要求组分允许范围样品稀释液0.091±0.005mL2.1.3 试纸条宽度检测卡内部试纸条宽度应为4.0mm±0.1mm。
2.1.4 液体移行速度液体移行速度应不低于10mm/min。
2.1.5 空白限空白限应小于0.01ng/mL。
2.1.6 精密度2.1.6.1 重复性用两个不同浓度水平的质控品对同一批号试剂盒进行重复检测10次,其变异系数(CV)应不大于15%。
2.1.6.2 批间差用两个不同浓度水平的质控品对三个批号试剂盒各重复检测10次,其批间变异系数(CV)应不大于20%。
2.1.7 线性范围测试血浆/血清样本,线性范围在0.02ng/mL~80.00 ng/mL,线性相关系数(r)应不小于0.990;测试全血样本,线性范围在0.04ng/mL~100.00 ng/mL,线性相关系数(r)应不小于0.990。
2.1.8 准确度检测2个不同浓度水平的内部校准品,其相对偏差(B)应不超过±15%。
2.2 质控品性能指标2.2.1 外观质控品外观应整洁,封盖应紧密,文字符号标识清晰、准确、牢固;质控品为冻干粉,冻干粉复溶后应为澄清透明液体。
2.2.2 装量质控品冻干粉的实际瓶装量应不少于标识瓶装量的95%,每个水平的标示装量为0.036g (0.5mL)。
2.2.3 准确度取同一批号3个水平的降钙素原(PCT)质控品作为样本进行检测,复溶后测得的复溶液检测结果应符合该批质控品包装盒内靶值表上的要求。
2.2.4 均一性2.2.4.1 瓶内均一性:CV ≤15%。
《专业课程设计》荧光量子点法降钙素原(PCT)试剂盒的研制学院专业指导老师班级姓名学号摘要本产品运用免疫层析法的夹心免疫技术将量子点与PCT单克隆抗体结合,建立一种新型的免疫分析法进行特异性定性检测人血清或血浆中的PCT,使灵敏度显著提高,达到或超过某些酶联免疫吸附法(ELISA)的水平。
由于待检测PCT 与PCT抗体的反应,使得水溶性量子点的荧光强度产生变化,通过测定水溶性量子点荧光强度变化的量来实现对待检测PCT浓度的高选择性定量检测。
本发明中的降钙素原(PCT)检测试剂盒具有制备低廉、稳定性好、易于保存,利用荧光量子点标记方法检测灵敏度高、特异性强的优点,比较容易的在临床进行推广。
1.研究背景目前临床和科研实验室中均用免疫学方法检测PCT浓度,包括胶体金法、ELISA法和免疫化学发光法等。
所有这些方法的前提都是制备PCT特异性抗体,且健康人血浆中含量极低,在200pg/mL以下,对抗体的亲和力等参数要求很高。
迄今为止这些检测体系所用的抗体均来自国外大公司,价格昂贵。
因此,制备PCT特异性单克隆抗体,为PCT的免疫检测提供具有自主知识产权的关键原料,对于扩大其临床应用,降低医疗成本,具有重要意义。
目前应用化学发光免疫分析技术建立人血清中降钙素原定量检测方法,采用固相包被降钙素原单克隆抗体,生物素标记另一降钙素原单克隆抗体,建立人血清中降钙素原的双抗体夹心化学发光免疫定量检测方法。
在此基础上,荧光免疫分析技术是利用荧光物质标记抗体或者抗原分子,通过与待分析物的特异性结合后,检测荧光信号的强度变化,实现对目标分析物的定性和定量检测。
制备荧光信号强、免疫活性好的量子点-抗体(QD-Ab)复合物是将量子点应用于荧光免疫检测的关键。
QD-Ab的荧光信号放大效率主要是由量子点—抗体偶联比例以及量子点本身的荧光量子效率决定,而其免疫活性则由QD表面偶联的抗体分子的量效决定,除了抗体自身亲和力对复合物的免疫活性产生影响外,抗体与量子点间的偶联位点和抗体分子在量子点表面的空间构象也对QD—Ab复合物的免疫活性有重要影响。
降钙素原(P C T)测定试剂盒(荧光免疫层析法)产品技术要求普菲本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March降钙素原(PCT)测定试剂盒(荧光免疫层析法)结构组成:预期用途:用于体外定量测定人血清、血浆样本中降钙素原的含量。
2.1.物理性状2.1.1.外观试剂卡外观平整,材料附着牢固;样本稀释液为无色透明液体,无悬浮物及沉淀物;2.1.2.净含量样本稀释液净含量应在标示值的90%~110%之间。
2.1.3.膜条宽度膜条宽度应不小于3.9mm。
2.1.4.液体移行速度液体移行速度应不低于25mm/min。
2.2.空白限空白限≤0.1ng/mL。
2.3 .线性范围试剂的线性范围为 [0.1,60] ng/mL,在此线性范围内,线性相关系数r应不小于0.990。
2.4.测量精密度2.4.1.重复性用质控品重复测试,所得结果的变异系数(CV)≤15%;2.4.2.批间差用质控品重复测试3个批号的试剂盒,所得结果的变异系数(CV)≤15%。
2.5.准确度回收率在85%~115%之间。
2.6 .稳定性试剂在4℃~30℃密封避光保存,原包装存放的试剂有效期为12个月;取效期末的样品检测外观、膜条宽度、液体移行速度、空白限、线性范围、重复性、准确度,应分别符合2.1.1、2.1.3、2.1.4、2.2、2.3、2.4.1、2.5的要求。
2.7.溯源性根据GB/T21415-2008的要求,本产品标准曲线可溯源至企业工作校准品。
专利名称:一种降钙素原(PCT)定量检测试剂盒专利类型:实用新型专利
发明人:杨帆,邱青芳,尚永明,韩光辉,马富明
申请号:CN201520540839.4
申请日:20150723
公开号:CN205049575U
公开日:
20160224
专利内容由知识产权出版社提供
摘要:本实用新型专利公开了一种降钙素原(PCT)定量检测试剂盒,包括检测缓冲液、检测板和ID芯片,其特征是:所述检测缓冲液为荧光染料标记的PCT单克隆抗体;检测板包括外包装板块和试纸条;外包装板块分为加样区、反应区和吸水区;试纸条为多层膜结构且包被有PCT单克隆抗体和羊抗鼠抗体。
检测时用荧光免疫定量分析仪对结果进行定量检测,具有检测灵敏度高,准确性好等优点。
申请人:青岛汉唐生物科技有限公司
地址:266000 山东省青岛市高新技术产业开发区河东路369号
国籍:CN
更多信息请下载全文后查看。
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202011094579.4(22)申请日 2020.10.14(71)申请人 芜湖森爱驰生物科技有限公司地址 241100 安徽省芜湖市芜湖县安徽新芜经济开发区南次一路369号(72)发明人 王晓波 (74)专利代理机构 合肥律众知识产权代理有限公司 34147代理人 龙海丽(51)Int.Cl.G01N 33/533(2006.01)G01N 33/543(2006.01)G01N 33/558(2006.01)G01N 33/577(2006.01)(54)发明名称一种降钙素原(PCT )荧光检测试剂盒及其制备工艺(57)摘要本发明公开了一种降钙素原(PCT )荧光检测试剂盒及其制备工艺,一种降钙素原(PCT )荧光检测试剂盒,包括NC膜和荧光垫,所述NC膜与所述荧光垫部分重叠;一种降钙素原(PCT )荧光检测试剂盒的制备工艺,包括以下步骤:S101、预准备:准备样品垫、吸样垫和PVC底板以及抗降钙素原(PCT)单克隆抗体、荧光微球溶液和羊抗鼠IgG;S103、荧光垫制备。
有益效果:本发明通过双抗体夹心法免疫荧光层析技术,与配套荧光免疫层析读数仪使用,实现对血清中降钙素原(PCT )的定量检测,通过检测线荧光的强弱在一定范围内能够反应样本中降钙素原(PCT )的含量,不仅操作简便,而且准确度和稳定性好,抗干扰性强,可以满足临床需求。
权利要求书1页 说明书4页 附图1页CN 112083161 A 2020.12.15C N 112083161A1.一种降钙素原(PCT )荧光检测试剂盒,其特征在于,包括NC膜(2)和荧光垫(1),所述NC膜(2)与所述荧光垫(1)部分重叠,其中;所述NC膜(2)下部包被抗降钙素原(PCT )单克隆抗体形成检测线(3);所述NC膜(2)上部包被羊抗鼠IgG抗体形成质控线(4);所述荧光垫(1)为抗降钙素原(PCT )单克隆抗体与荧光微球溶液吸附结合的标记荧光微球制备的荧光垫干样。
《专业课程设计》荧光量子点法降钙素原(PCT)试剂盒的研制学院专业指导老师班级姓名学号摘要本产品运用免疫层析法的夹心免疫技术将量子点与PCT单克隆抗体结合,建立一种新型的免疫分析法进行特异性定性检测人血清或血浆中的PCT,使灵敏度显著提高,达到或超过某些酶联免疫吸附法(ELISA)的水平。
由于待检测PCT与PCT抗体的反应,使得水溶性量子点的荧光强度产生变化,通过测定水溶性量子点荧光强度变化的量来实现对待检测PCT浓度的高选择性定量检测。
本发明中的降钙素原(PCT)检测试剂盒具有制备低廉、稳定性好、易于保存,利用荧光量子点标记方法检测灵敏度高、特异性强的优点,比较容易的在临床进行推广。
1.研究背景目前临床和科研实验室中均用免疫学方法检测PCT浓度,包括胶体金法、ELISA法和免疫化学发光法等。
所有这些方法的前提都是制备PCT特异性抗体,且健康人血浆中含量极低,在200pg/mL以下,对抗体的亲和力等参数要求很高。
迄今为止这些检测体系所用的抗体均来自国外大公司,价格昂贵。
因此,制备PCT特异性单克隆抗体,为PCT的免疫检测提供具有自主知识产权的关键原料,对于扩大其临床应用,降低医疗成本,具有重要意义。
目前应用化学发光免疫分析技术建立人血清中降钙素原定量检测方法,采用固相包被降钙素原单克隆抗体,生物素标记另一降钙素原单克隆抗体,建立人血清中降钙素原的双抗体夹心化学发光免疫定量检测方法。
在此基础上,荧光免疫分析技术是利用荧光物质标记抗体或者抗原分子,通过与待分析物的特异性结合后,检测荧光信号的强度变化,实现对目标分析物的定性和定量检测。
制备荧光信号强、免疫活性好的量子点-抗体(QD-Ab)复合物是将量子点应用于荧光免疫检测的关键。
QD-Ab的荧光信号放大效率主要是由量子点—抗体偶联比例以及量子点本身的荧光量子效率决定,而其免疫活性则由QD表面偶联的抗体分子的量效决定,除了抗体自身亲和力对复合物的免疫活性产生影响外,抗体与量子点间的偶联位点和抗体分子在量子点表面的空间构象也对QD—Ab复合物的免疫活性有重要影响。
简介及临床意义PCT(降钙素原,procalcitonin)是一种无激素活性的降钙素前肽物质,来自于定位11号染色体上的单拷贝基因,该基因由2800个碱基对组成,含6个外显子和5个内含子,相对分子质量约为13×103。
在正常代谢下,甲状腺C细胞产生PCT并分泌激素活性的降钙素。
正常人血中PCT浓度极低,当严重细菌、真菌、寄生虫感染以及脓毒症和多脏器功能衰竭时它在血浆中的水平升高。
在自身免疫、过敏和病毒感染时PCT不会升高;局部有限的细菌感染、轻微的感染和慢性炎症也不会导致其升高。
自1993年Assicot等首次报道PCT可作为细菌感染的早期标志物以来,PCT作为一个新的炎症指标广泛应用于细菌感染的诊断与鉴别诊断,2001年国际脓毒症会议的脓毒症诊断标准已把PCT作为诊断指标之一。
PCT水平的升高出现在严重休克、全身性炎症反应综合征(SIRS)和多器官功能紊乱综合征(MODS),即使没有细菌感染或细菌性病灶。
但是,在这些病例中PCT水平通常低于那些有细菌性病灶的患者。
从肠道释放细胞因子或细菌移位可能诱导其升高。
PCT是诊断和监测细菌炎性疾病感染的一个参数。
它的测定可以作为一个急性的参数来鉴别诊断细菌性和非细菌性感染和炎症。
3.量子点技术简介及研究进展量子点(quantum dots,QDs)是纳米尺寸的半导体微粒,又称为半导体纳米晶体(nanocrystals,NCs),是一种由Ⅱ~Ⅵ族或Ⅲ~Ⅴ族元素组成的、稳定的、溶于水的、直径在2~10nm之间的纳米晶粒。
当半导体材料减小到纳米尺寸时,它与大块材料相比具有独特的光学特性。
目前,量子点最有前途的应用领域是在生物体系中作为荧光探针。
QD的光学特性比传统的荧光染料探针有明显的优越性:(1)量子点被激发后可得到波长范围宽且光谱可调的荧光。
(2)量子点粒径大小不同,所激发的荧光也不相同。
(3)不同大小的量子点可以用同一波长的光激发而发出不同颜色的光,这将给生物学的研究带来很大的方便。
由于量子点半峰宽较窄,这就允许使用不同光谱特征的量子点,而发光色谱不发生重叠或重叠较小,可用于多种标记物的同时检测生物体内的几种组分。
量子点具有很多的优点,如能解决量子点与生物分子的偶联问题,就可以用量子点代替有机荧光染料,在细胞器定位、信号传导、原位杂交、胞内分子的运动和迁移等研究中发挥巨大的作用。
量子点的制备方法有很多,用于生物荧光探针的量子点通常采用胶体化学法——按所用的原料不同可以分为金属有机溶剂热分解和巯基分子作稳定剂的水相合成两种路线。
对用于生物检测的纳米晶体的要求是可溶于水或缓冲溶液,粒径分布均匀,量子产率高,并且稳定。
因此制备发光效率高、发光颜色可调性好、对光热稳定性好的量子点,尤其是制备对于生物检测十分重要的受激发能在红外区发光的量子点已成为近年来的研究热点。
量子点作为荧光探针使用时,其表面需要修饰生物分子,如抗体、多肽、糖类等。
如何将生物分子有效的偶联在量子点表面并保持其生物活性,是量子点生物学应用中极为关键的一步。
到目前为止,已经有一些类型的偶联技术在量子点抗体偶联中应用。
量子点的制备方法通常分为物理方法和化学方法两种。
用于生物探针的量子点的合成方法主要采用胶体化学法,通过在胶体溶液中进行纳米晶体的制备,一类是在高沸点的有机溶剂中利用前驱体(烷基(非)金属)热分解来合成,另一类是利用稳定剂(巯基小分子)在水溶液中合成。
采用胶体化学法在有机溶剂中合成的量子点在用于生物标记时必须对量子点进行表面修饰,使其具有一定的水溶性和生物相容性,同时在量子点表面连接上可与生物分子连接的功能性基团,可引入极性的官能团(如氨基或羧基等),再通过交联剂NHS(N-羟基琥珀酰亚胺)或EDC(乙基-3-(二甲基氨丙基)碳二亚胺),完成量子点与生物大分子(蛋白质、核酸、酶等)的共价偶联。
目前量子点标记最为活跃的领域是在荧光免疫方面。
借助于抗原—抗体、生物素—亲和素等之间的特异性识别作用完成各种研究。
QDs稳定性好,荧光杂质少,连接于生物分子后不影响其活性,特异性高。
4.产品技术及待解决问题本项目参考CN1A中的方法将降钙素原检测试纸,作为一种量子点标记免疫定量检测试纸,包括底衬以及依次搭接地粘贴于底衬上的样品垫、过滤垫、结合垫、层析膜和吸水垫从而形成多层膜结构,各层膜结构之间部分重叠;所述结合垫上包被有量子点标记的降钙素原特异性抗体I、以及量子点标记的兔IgG;所述层析膜上有一条包被降钙素原特异性抗体II的检测线、以及一条包被羊抗兔IgG抗体的质控线。
该试纸可方便快捷、准确定量地同时检测降钙素原。
本发明同时参考一种降钙素原的化学发光定量检测试剂盒及其制备方法和检测方法,用以巯基丙酸(MPA)作为稳定剂合成的水溶性量子点CdSe纳米粒子,用N-羟基琥珀酰亚胺(NHS)将量子点活化,用EDC(乙基-3-(二甲基氨丙基)碳二亚胺)完成量子点与PCT抗体的共价偶联。
CdSe量子点表面覆盖有巯基乙酸,在水溶性缩合剂EDC的作用下与抗体的氨基反应,使抗体以共价键连到量子点表面。
用修饰过的QDs标记单抗,而此标记不影响PCT单抗与多克隆抗体的反应,标记后的PCT抗体仍然具有生物活性。
EDC与羧基反应形成氨基反应活性的中间体—O-酰基脲,该中间体很不稳定,在水中会很快水解释放出羧基,以及一N-酰基脲。
该副反应所产生的N-酰基脲会结合在蛋白疏水区域的羧基上,而NHS 介入的反应,可以使形成的中间体在水溶液中保持稳定。
整个偶联过程简单,条件温和,量子点的荧光强度几乎不受影响。
偶联过程中,会有小部分量子点和抗体发生交联,生成大颗粒物,反应后离心即可去除。
降钙素原测定试剂盒(荧光量子点法)项目设计方案1 设计目的和依据:目的:本发明目的在于提供一种利用荧光量子点法定量检测降钙素原(PCT)的试剂盒,PCT作为一种能直观反映全身炎症反应的活跃程度的蛋白而备受关注。
目前市场上运用荧光量子点法检测降钙素原(PCT)的产品较少,而该种方法相较于其他化学检测方法拥有更加灵敏准确的优势,相较于其他物理检测方法也有着对设备加工工艺要求较低的优势。
依据:专利:[1]、CN103558400A 一种降钙素原乳胶增强免疫比浊法检测试剂盒[2]、CN102384902A 基于量子点荧光检测的酶芯片及其制备方法和应用[3]、CN104122401A 降钙素原和C反应蛋白的检测试纸及其制备方法和检测方法[4]、CN103901203A 一种降钙素原的化学发光定量检测试剂盒及其制备方法和检测方法[5]、CN102053156A 一种基于荧光量子点检测炭疽芽孢杆菌的方法[6]、CN102707071A PCT/CRP联合检测用胶体金试纸条及其制备方法文献:[1]宋健,范佳,宋大千,毕丽荣,周广宇,张皓,魏景艳,杨柏. 量子点偶联抗体型夹心免疫传感法检测心肌肌钙蛋白I[J]. 高等学校化学学报,2009,10:1940-1944.[2]郑怡麟,何莹,陈安,易维京,胡川闽. 抗人降钙素原特异性单克隆抗体的制备鉴定及初步应用[J]. 第三军医大学学报,2013,06:523-526.[3]张鹏飞,宋杰,陈佳,陆慧琦,韩焕兴. 量子点与抗乙肝表面抗原(HBsAg)抗体的偶联研究[J]. 分析化学,2013,06:846-850.[4]邢仕歌,熊齐荣,钟强,张悦,卞素敏,金涌,储晓刚. 量子点抗体偶联技术研究进展[J]. 分析化学,2013,06:949-955.[5]马慧莲. 发光CdTe量子点生物偶联产物制备、性质及应用研究[D].东北大学,2005.[6]白亚龙. 一种基于量子点荧光微球的高灵敏度免疫层析技术初步研究[D].上海师范大学,2010.[7]谢颖,徐静娟,于俊生,陈洪渊. 水溶性的CdSe/ZnS纳米微粒的合成及表征[J]. 无机化学学报,2004,06:663- 667.[8]邱婷,彭洪亮,何治柯. 水溶性量子点CdSe/ZnS与蛋白质非特异性相互作用研究[J]. 化学传感器,2007, 02:26-30.[9]胡晓武,李之珍,田雪,刘辉宇. 胶体金法测定降钙素原试剂盒的研究[J]. 中华全科医学,2014,02:271-273.[10]谢玉玲,戴振贤,柳丽娟,许胜,薛正翔,吴玉水. 降钙素原化学发光免疫定量检测方法的建[11]Shehabi Yahya,Seppelt Ian. Pro/Con debate: is procalcitonin useful for guiding antibiotic decision making in critically ill patients[J]. Critical Care (Online),2008,123:211.[12] Xiao-Feng Hua,Tian-Cai Liu,Yuan-Cheng Cao,Bo Liu,Hai-Qiao Wang,Jian-Hao Wang,Zhen-Li Huang,Yuan-Di Zhao. Characterization of the coupling of quantum dots and immunoglobulin antibodies[J]. Analytical and Bioanalytical Chemistry,2006,3866:1665-1671.[13]Snider R H,Nylen E S,Becker K L. Procalcitonin and its component peptides in systemic inflammation: immunochemical characterization.[J]. Journal of investigative medicine : the official publication of the American Federation for Clinical Research,1998,459:552-600.立及临床应用价值[J]. 福建医药杂志,2013,06:10-12.说明书:参照罗氏厂家试剂盒说明书。