杂交瘤细胞生成抗体技术
- 格式:doc
- 大小:15.50 KB
- 文档页数:2

抗体的制备方法与原理-单克隆抗体的制备1975年Kohler和Milstein发现将小鼠骨髓瘤细胞与和绵羊红细胞免疫的小鼠脾细胞进行融合,形成的杂交瘤细胞既可产生抗体,又可无性繁殖,从而创立了单克隆抗体杂交瘤技术。
这一技术上的突破使血清学的研究进入了一个高度精确的新纪元。
免疫细胞化学的技术关键之一是制备特异性强、亲合力大、滴度高的特异性抗体,由于每种抗原都有几个抗原决定簇,用它免疫动物将产生对各个决定簇的抗体,即多克隆抗体。
单克隆抗体则是由一个产生抗体的细胞与一个骨髓瘤细胞融合而形成的杂交廇细胞经无性繁殖而来的细胞群所产生的,所以它的免疫球蛋白属同一类型,质地纯一,而且它是针对某一抗原决定簇的,因此特异性强,亲合性也一致。
单克隆抗体(McAb)的特性和常规血清抗体的特性比较见2-3。
表2—3 单克隆抗体(McAb)和常规免疫血清抗体的特性比较单克隆抗体的制备方法如下。
(一)动物的选择与免疫1.动物的选择纯种BALB/C小鼠,较温顺,离窝的活动范围小,体弱,食量及排污较小,一般环境洁净的实验室均能饲养成活。
目前开展杂交瘤技术的实验室多选用纯种BALA/C小鼠。
2.免疫方案选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb 至关重要。
一般在融合前两个月左右根据确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定。
(1)可溶性抗原免疫原性较弱,一般要加佐剂,半抗原应先制备免疫原,再加佐剂。
常用佐剂:福氏完全佐剂、福氏不完全佐剂。
初次免疫抗原1~50μg加福氏完全佐剂皮下多点注射或脾内注射(一般0.8~1ml,0.2ml/点)↓3周后第二次免疫剂量同上,加福氏不完全佐剂皮下或ip(腹腔内注射)(ip剂量不宜超过0.5ml)↓3周后第三次免疫剂量同一,不加佐剂,ip(5~7天后采血测其效价)↓2~3周加强免疫,剂量50~500μg为宜,ip或iv(静脉内注射)↓3天后取脾融合目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如:①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。
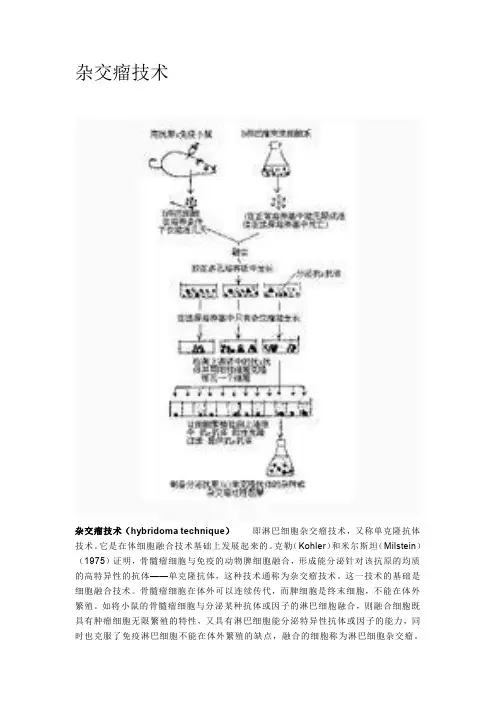
杂交瘤技术杂交瘤技术(hybridoma technique)即淋巴细胞杂交瘤技术,又称单克隆抗体技术。
它是在体细胞融合技术基础上发展起来的。
克勒(Kohler)和米尔斯坦(Milstein)(1975)证明,骨髓瘤细胞与免疫的动物脾细胞融合,形成能分泌针对该抗原的均质的高特异性的抗体——单克隆抗体,这种技术通称为杂交瘤技术。
这一技术的基础是细胞融合技术。
骨髓瘤细胞在体外可以连续传代,而脾细胞是终末细胞,不能在体外繁殖。
如将小鼠的骨髓瘤细胞与分泌某种抗体或因子的淋巴细胞融合,则融合细胞既具有肿瘤细胞无限繁殖的特性,又具有淋巴细胞能分泌特异性抗体或因子的能力,同时也克服了免疫淋巴细胞不能在体外繁殖的缺点,融合的细胞称为淋巴细胞杂交瘤。
杂交瘤技术的基本原理是通过融合两种细胞而同时保持两者的主要特征。
这两种细胞分别是经抗原免疫的小鼠脾细胞和小鼠骨髓瘤细胞。
被特异性抗原免疫的小鼠脾细胞(B淋巴细胞)的主要特征是它的抗体分泌功能,但不能在体外连续培养,小鼠骨髓瘤细胞则可在培养条件下无限分裂、增殖,即具有所谓永生性。
在选择培养基的作用下,只有B细胞与骨髓瘤细胞融合的杂交细胞才能具有持续培养的能力,形成同时具备抗体分泌功能和保持细胞永生性两种特征的细胞克隆。
其原理从下列3个主要步骤阐明。
(一)细胞的选择与融合建立杂交瘤技术的目的是制备对抗原特异的单克隆抗体,所以融合细胞一方必须选择经过抗原免疫的B细胞,通常来源于免疫动物的脾细胞。
脾是B细胞聚集的重要场所,无论以何种免疫方式刺激,脾内皆会出现明显的抗体应答反应。
融合细胞的另一方则是为了保持细胞融合后细胞的不断增殖,只有肿瘤细胞才具备这种特性。
·选择同一体系的细胞可增加融合的成功率。
多发性骨髓瘤是B细胞系恶性肿瘤,所以是理想的脾细胞融合伴侣。
使用细胞融合剂造成细胞膜一定程度的损伤,使细胞易于相互粘连而融合在一起。
最佳的融合效果应是最低程度的细胞损伤而又产生最高频率的融合。

单克隆抗体制备的杂交瘤技术XXX,YYY,ZZZ(版权所有,仅限个人)一、实验目的:1.掌握杂交瘤技术的基本原理和基本操作方法。
2.能运用杂交瘤技术来制备自己的单克隆抗体。
二、实验原理:(一)动物免疫动物体内的B淋巴细胞在特定外来抗原的刺激下,可以大量增殖变成浆细胞以分泌针对于该抗原的抗体。
脾内不同的B淋巴细胞克隆可分泌针对不同抗原的抗体。
当受到特定外来抗原刺激时,相应的B淋巴细胞克隆便大量增殖以分泌相应的特异性抗体。
动物免疫的作用就是用特定外为抗原对动物进行一次或多次免疫,以刺激能分泌针对于该抗原抗体的B淋巴细胞大量增殖,从而得到大量产生专一的B淋巴细胞。
(二)细胞融合B淋巴细胞受外来抗原刺激后可以分泌抗体,但它在体外存活很短时间(最多两周)后即死亡;而骨髓瘤细胞不分泌任何免疫球蛋白,却能在体外长期存活。
如果能将这两种细胞的特性结合起来,我们就能得到既能分泌抗体又能在体外长期存活的细胞。
脾脏是动物体内B淋巴细胞集中的最大免疫器官,取出脾细胞(B淋巴细胞)和骨髓瘤细胞融合后,能产生五种细胞类型;未融合的脾细胞和骨髓瘤细胞,自身融合的脾细胞和骨髓瘤细胞,以及脾细胞和骨髓瘤细胞融合形成的杂交瘤细胞。
其中杂交瘤才是我们需要的,因此就要设法将此杂交瘤细胞从上述细胞混合液中挑选出来。
(三)杂交瘤细胞的筛选在细胞融合后,要从上述五种细胞中筛选出杂交瘤细胞,一般使用HAT培养进行筛选,HAT养基中含有次黄嘌呤(H)、氨基喋呤(A)和胸腺嘧啶(T)三种成分。
细胞的DNA合成有内源性途径(主要途径)和外源性途径(旁路途径)两种方式。
内源性途径就是利用谷氨酰胺或单磷酸尿苷酸在二氢叶酸还原酶的催化下来合成DNA;而外源性途径则是利用次黄嘌呤或胸腺嘧啶在次嘌呤鸟嘌呤磷酸核糖转移酶(Hypoxanthine guznine phosphoribosyl transferase,HGPRT)或胸腺嘧啶激酶(thymidine kinase,TK)的催化下来补救合成DNA,HAT培养基中氯基喋呤是二氢叶酸还原酶的抑制剂,能有效地阻断DNA合成的内源性途径。

利用杂交瘤技术制备单克隆抗体的基本原理一、引言单克隆抗体(Monoclonal Antibody,mAb)是由单一B细胞克隆产生的抗体,具有高度特异性和亲和力。
其制备方法主要有杂交瘤技术、酶联免疫吸附试验法(ELISA)、荧光激发技术等。
其中,杂交瘤技术是制备单克隆抗体最重要的方法之一。
二、杂交瘤技术基本原理1. B细胞与肿瘤细胞的融合杂交瘤技术的基本原理是将体内产生的特异性抗体B细胞与无限增殖能力的肿瘤细胞进行融合,形成可分泌大量同种特异性抗体的杂交瘤细胞。
在此过程中,B细胞提供了高度特异性的抗体基因组,而肿瘤细胞提供了无限增殖能力。
2. 杂交瘤细胞筛选和分离将获得的杂交瘤细胞进行筛选和分离,以获取单一同种特异性抗体产生的杂交瘤细胞株。
这里需要注意的是,筛选和分离的条件需要严格控制,以确保所得到的单克隆抗体具有高度特异性和亲和力。
3. 单克隆抗体的大规模制备通过对单克隆抗体杂交瘤细胞株进行培养和扩增,可以大规模制备单克隆抗体。
此过程中需要注意对培养条件、生长因子、营养物质等进行优化,以提高单克隆抗体的产量和质量。
三、杂交瘤技术的优点1. 高度特异性和亲和力通过杂交瘤技术制备的单克隆抗体具有高度特异性和亲和力,可以用于检测、诊断、治疗等领域。
2. 无限复制能力杂交瘤细胞具有无限复制能力,可以大规模制备同种特异性抗体。
3. 可重复性好由于单一B细胞产生的同种特异性抗体都是完全相同的,因此通过杂交瘤技术制备出来的单克隆抗体具有良好的可重复性。
四、杂交瘤技术存在的问题及解决方法1. 杂交瘤细胞的稳定性杂交瘤细胞的稳定性对于单克隆抗体的制备至关重要。
为了提高杂交瘤细胞的稳定性,可以采用多种方法,如对培养条件进行优化、添加生长因子等。
2. 克隆选择在杂交瘤技术中,克隆选择是一个非常重要的环节。
为了确保所得到的单克隆抗体具有高度特异性和亲和力,需要对杂交瘤细胞进行筛选和分离。
这里需要注意的是,筛选和分离的条件需要严格控制。

什么是杂交瘤技术?杂交瘤技术的原理及步骤杂交瘤技术(hybridoma technique)即淋巴细胞杂交瘤技术,又称单克隆抗体技术。
它是在体细胞融合技术基础上发展起来的。
克勒(Kohler)和米尔斯坦(Milstein)(1975)证明,骨髓瘤细胞与免疫的动物脾细胞融合,形成能分泌针对该抗原的均质的高特异性的抗体——单克隆抗体,这种技术通称为杂交瘤技术。
这一技术的基础是细胞融合技术。
骨髓瘤细胞在体外可以连续传代,而脾细胞是终末细胞,不能在体外繁殖。
如将小鼠的骨髓瘤细胞与分泌某种抗体或因子的淋巴细胞融合,则融合细胞既具有肿瘤细胞无限繁殖的特性,又具有淋巴细胞能分泌特异性抗体或因子的能力,同时也克服了免疫淋巴细胞不能在体外繁殖的缺点,融合的细胞称为淋巴细胞杂交瘤。
杂交瘤技术原理及步骤:杂交瘤技术的基本原理是通过融合两种细胞而同时保持两者的主要特征。
这两种细胞分别是经抗原免疫的小鼠脾细胞和小鼠骨髓瘤细胞。
被特异性抗原免疫的小鼠脾细胞(B淋巴细胞)的主要特征是它的抗体分泌功能,但不能在体外连续培养,小鼠骨髓瘤细胞则可在培养条件下无限分裂、增殖,即具有所谓永生性。
在选择培养基的作用下,只有B细胞与骨髓瘤细胞融合的杂交细胞才能具有持续培养的能力,形成同时具备抗体分泌功能和保持细胞永生性两种特征的细胞克隆。
其原理从下列3个主要步骤阐明。
(一)细胞的选择与融合建立杂交瘤技术的目的是制备对抗原特异的单克隆抗体,所以融合细胞一方必须选择经过抗原免疫的B细胞,通常来源于免疫动物的脾细胞。
脾是B细胞聚集的重要场所,无论以何种免疫方式刺激,脾内皆会出现明显的抗体应答反应。
融合细胞的另一方则是为了保持细胞融合后细胞的不断增殖,只有肿瘤细胞才具备这种特性。
·选择同一体系的细胞可增加融合的成功率。
多发性骨髓瘤是B细胞系恶性肿瘤,所以是理想的脾细胞融合伴侣。
使用细胞融合剂造成细胞膜一定程度的损伤,使细胞易于相互粘连而融合在一起。

单克隆抗体的制备及应用单克隆抗体是由淋巴细胞杂交瘤产生的、只针对复合抗原分子上某一单个抗原决定簇。
单克隆抗体技术(monoclonal antibody technique):一种免疫学技术,将产生抗体的单个B淋巴细胞同骨髓肿瘤细胞杂交,获得既能产生抗体,又能无限增殖的杂种细胞,并以此生产抗体。
是仅由一种类型的细胞制造出来的抗体,对应于多克隆抗体、多株抗体——由多种类型的细胞制造出来的一种抗体。
1 单克隆抗体的优点与局限性:1.1 单克隆抗体的优点:(1)杂交瘤可以在体外“永久〞地存活并传代,只要不发生细胞株的基因突变,就可以不断地生产高特异性、高均一性的抗体。
(2)可以用相对不纯的抗原,获得大量高度特异的、均一的抗体。
(3)由于可能得到“无限量〞的均一性抗体,所以适用于以标记抗体为特点的免疫学分析方法,如IRMA和ELISA等。
(4)由于单克隆抗体的高特异性和单一生物学功能,可用于体内的放射免疫显像和免疫导向治疗。
总体来说,即:高特异性、高纯度、重复性好、敏感性强、本钱低和可大量生产等。
1.2 单克隆抗体的局限性:(1)单克隆抗体固有的亲和性和局限的生物活性限制了它的应用范围。
由于单克隆抗体不能进行沉淀和凝集反响,所以很多检测方法不能用单克隆抗体完成。
(2)单克隆抗体的反响强度不如多克隆抗体。
(3)制备技术复杂,而且费时费工,所以单克隆抗体的价格也较高。
2 单克隆抗体的制备:单克隆抗体的制备原理:应用细胞杂交技术使骨髓瘤细胞与免疫的淋巴细胞二者合二为一,得到杂种的骨髓瘤细胞。
这种杂种细胞继承两种亲代细胞的特性,它既具有B淋巴细胞合成专一抗体的特性,也有骨髓瘤细胞能在体外培养增殖永存的特性,用这种来源于单个融合细胞培养增殖的细胞群,可制备抗一种抗原决定簇的特异单克隆抗体。
单克隆抗体的制备过程:抗原准备、动物的选择与免疫、细胞融合、选择杂交瘤细胞及抗体检测、杂交瘤的克隆化、杂交瘤细胞的冻存与复苏、单克隆抗体的纯化等步骤。

杂交瘤技术的基本原理和单克隆抗体的主要
制备步骤
一、杂交瘤技术的基本原理
杂交瘤技术也称免疫杂交或抗体杂交,是用生物学和化学原理创造出人造抗体,也可以称之为“免疫抗体杂交”。
它通过将特定基因段无细胞化学合成抗体与正常正常抗体不同种型的B细胞经免疫球蛋白结合物外溶胶连接起来,从而锁定它们在杂交抗体分子内部而形成杂交细胞,它们同时具有正常抗体结构的灵活性,并将合成的抗体的特异性的目的物结合到杂交抗体分子上,诱导杂交细胞生长,从而获得特异性的抗体。
二、单克隆抗体的主要制备步骤
(1)筛选实验:将目标蛋白质与抗原结合,合成抗原——抗体复合物,获得具有抗原识别能力的抗体解析表型细胞。
(2)定向克隆:在筛选步骤的B细胞中采用定向克隆技术,将抗原识别能力特异的B细胞从其他不特异的B细胞中挑选出来,使它们成为抗体库中的杂交瘤。
(3)表达克隆抗体:将各自的表达株根据特定蛋白质的表达量分类,并从抗体库中培养出单克隆表达株。
(4)纯化抗体:从单个杂交瘤表达抗体株中分离,纯化抗体,获得纯净的单克隆抗体。

杂交瘤细胞单克隆抗体的生产方法引言:单克隆抗体是通过细胞融合技术利用小鼠或其他哺乳动物的B细胞和体外培养的瘤细胞,产生具有高度特异性和亲和力的抗体。
这项技术是单抗药物的重要生产途径,广泛应用于疾病诊断、治疗、科学研究等领域。
本文将详细介绍杂交瘤细胞单克隆抗体的生产方法。
1.免疫原制备:根据所需的特异抗原,选择合适的免疫原制备方法,如蛋白质纯化、细胞提取物、多肽合成等等。
2.动物免疫:将免疫原与适宜的佐剂混合后接种于小鼠等哺乳动物体内,以激发免疫细胞产生特异性抗体。
3.细胞融合:-收集小鼠脾细胞:在免疫充分激活后,取出小鼠脾脏,用RPMI-1640培养基洗涤脾脏,收集脾细胞。
-人工瘤细胞准备:选择一株常用的髓母细胞瘤比如SP2/0-AG14,也可选择其他合适的细胞系,使其处于良好的生长状态。
-融合操作:将脾细胞与瘤细胞以一定比例混合,使用聚乙二醇(PEG)等化学试剂促使细胞融合。
接种融合细胞于选择性培养基上,培养6-8天,直至异源杂交瘤细胞形成。
1.筛选:将培养的杂交瘤细胞转移到96孔板中,每孔一个细胞。
利用ELISA等方法检测培养上清中是否含有目标抗体。
2.克隆:将阳性细胞转移至96孔板中进行单克隆培养,待细胞生长至一定程度后,进行二次筛选,直至获得单一细胞克隆。
3.培养和扩增:将筛选出的阳性单克隆细胞培养至足够数量,以供后续大规模生产。
单克隆抗体的纯化和鉴定:1.上清收集:将培养上清收集,去除细胞残渣和沉淀,得到含有目标抗体的液体。
2.亲和层析:利用免疫亲和层析柱,如蛋白A或蛋白G层析柱,将目标抗体与杂交瘤细胞上其他蛋白质分离开。
3.纯化:将抗体溶液经过洗脱等步骤,纯化目标抗体。
4. 鉴定:利用免疫电泳、Western blot等方法验证纯化得到的单克隆抗体的特异性和纯度。
单克隆抗体的应用和储存:1.应用:将纯化后的单克隆抗体用于疾病诊断、治疗等领域,在实验室科研中用于免疫组化、免疫沉淀、免疫荧光等实验。

杂交瘤细胞生产抗体技术细胞筛选杂交瘤细胞在融合后2周左右即可筛选,即把分泌所需抗体的杂交瘤孔从众多的孔中选出来,通常也称为抗体检测。
抗体检测的方法很多,通常根据所研究的抗原和实验室的条件而定。
但作为杂交瘤筛选的抗体检测方法必须具有快速、准备、简便,便于一次处理大量样品等特点。
因为往往有几百个样品需要在短短几个小时就报告结果,以便决定杂交瘤细胞的取舍。
所以选用抗体检测方法的原则是快速、敏感、特异、可靠、花费小和节省人力。
一般说来,在融合之前就必须建立好抗体检测方法,并克服可能存在的问题。
另一个重要问题是抗体检测方法所需要的“动力学范围”,即检出背景以上的最强与最弱信号之比,依所用的检测抗原是否纯净而定。
如杂交瘤抗体是针对纯化的蛋白质抗原的,100%的抗原参与反应,一个阳性/阴性判别系统就够了。
另一方面,如果杂交瘤抗体是针对细胞表面微量的蛋白抗原,检测系统可能需要能测出微弱信号,则动力学范围至少应为10:1,最好为100:1。
另外,检测方法的选择还受所需杂交瘤抗体的类型和预定的用途的影响。
结合补体的抗体可以用基于细胞毒性反应的检测方法来选出。
如需结合A蛋白的杂交瘤抗体,就要用结合蛋白A的检测方法。
杂交瘤细胞的冻存与复苏(1)杂交瘤细胞的冻存在建立杂交瘤细胞的过程中,有时一次融合产生很多“阳性”孔,来不及对所有的杂交瘤细胞作进一步的工作,需要把其中一部分细胞冻存起来;另一方面,为了防止实验室可能发生的意外事故,如停电、污染、培养箱的温度或CO2控制器失灵等给正在建立中的杂交瘤带来灾难,通常尽可能早地冻存一部分细胞作为种子,以免遭到不测。
在杂交瘤细胞建立以后,更需要冻存一大批,以备今后随时取用。
细胞冻存的原理是细胞在加血清和二甲基亚砜的培养基中以一定的缓慢速度下降温度(0℃—— -20℃,每分钟下降1℃;-20℃—— -40℃每分钟下降2℃),可在-196℃液氮或液氮蒸气中长期保存。
下面介绍我们实验室的细胞冻存方法,经几年来对多种细胞的使用,细胞复苏存活率均在80%以上。

简述利用杂交瘤细胞制备单克隆抗体的基本原理杂交瘤细胞制备单克隆抗体是一种重要的生物技术手段。
本文将介绍杂交瘤细胞制备单克隆抗体的基本原理、流程及其应用。
一、原理单克隆抗体是指来自同一B细胞克隆的抗体,它具有高度的特异性和稳定性,广泛应用于生物医学、生命科学和工业等领域。
杂交瘤细胞制备单克隆抗体的基本原理是将体外免疫的B细胞与骨髓瘤细胞融合成杂交瘤细胞,使其继承了B细胞产生抗体的能力和骨髓瘤细胞的不死性,从而长期稳定的产生单克隆抗体。
二、流程制备单克隆抗体的流程主要分为以下五个步骤:1. 免疫动物:将抗原注射于小鼠等哺乳动物体内,诱导其产生抗体。
2. 分离B细胞:从免疫动物体内获取脾脏,制备成单细胞悬浮液。
3. 融合细胞:将分离的B细胞与骨髓瘤细胞融合,形成杂交瘤细胞。
4. 筛选杂交瘤细胞:用选择性培养液筛选并纯化杂交瘤细胞,使其长期稳定的产生单克隆抗体。
5. 鉴定鉴定单克隆抗体:对产生的单克隆抗体进行鉴定,并获取其蛋白质序列,以便制备大规模的单克隆抗体。
三、应用杂交瘤细胞制备的单克隆抗体已广泛应用于许多领域。
在医学上,单克隆抗体已成为重要的诊断和治疗工具。
例如,抗癌单克隆抗体可以选择性地靶向癌细胞,疗效显著。
在生命科学领域,单克隆抗体也广泛应用于分子生物学、组织学和免疫学等方面。
在工业领域,单克隆抗体可以用于生化工业、食品工业和环保等方面。
综上所述,杂交瘤细胞制备单克隆抗体是一种重要的生物技术手段。
它的原理简单、流程清晰,经过鉴定的单克隆抗体具有高度的特异性和稳定性,有着广泛的应用前景。

单克隆抗体杂交瘤细胞筛选技术1986年,美国FDA批准了第一个单克隆抗体药物上市,距今已快30年。
目前,全世界共有超过40个治疗用抗体药物被批准上市,每年实现超过600亿美元的销售额。
在国际及国内形成了抗体药物开发热潮。
巨大的市场前景和现存的技术问题及壁垒并存的现实不可避免地引发抗体药物新一轮技术革命。
而其结果又将毫无疑问地改变抗体药物的市场格局。
但是,抗体不管是作为检测试剂,还是作为具有巨大市场前景的治疗药物。
首先,我们都需要通过筛选找到单克隆抗体。
传统的单克隆抗体制备方法主要是杂交瘤技术。
这是目前比较成熟,技术难度比较低,大多数实验室仍然在使用的方法。
在单克隆抗体制备过程中,有两次筛选过程,第一次是使用选择性培养基选出杂交瘤细胞;第二次就是进一步选出能产生我们需要的抗原特异性抗体的杂交瘤细胞。
利用杂交瘤技术制备单克隆抗体的基本原理是根据以下三个原则:1、一种淋巴细胞克隆只产生一种抗体;2、细胞融合技术产生的杂交瘤细胞可以保持双方亲代细胞的特性;3、利用代谢缺陷补救机理筛选出杂交瘤细胞,并进行克隆化,然后大量培养增殖, 制备所需的单克隆抗体。
第一次筛选的原理和方法:细胞融合后,杂交瘤细胞的选择性培养是第一次筛选的关键。
普遍采用的HAT选择性培养液是在普通的动物细胞培养液中加入次黄嘌呤、氨基蝶呤和胸腺嘧啶核苷酸。
其依据是细胞中DNA的合成有两条途径:一条途径是生物合成途径(D途径),即由氨基酸及其他小分子化合物合成核苷酸,为DNA分子的合成提供原料。
在此合成过程中,叶酸作为重要的辅酶参与这一过程,而HAT培养液中氨基蝶呤是一种叶酸的拮抗剂,可以阻断DNA合成的“D途径”。
另一条途径是应急途径或补救途径(S途径),它是利用次黄嘌呤-鸟嘌呤磷酸核苷转移酶(HGPRT)和胸腺嘧啶核苷激酶(TK)催化次黄嘌呤和胸腺嘧啶核苷生成相应的核苷酸,两种酶缺一不可。
因此,在HAT培养液中,未融合的B细胞及两个B细胞的融合产物的D途径被氨基蝶呤阻断,虽S途径正常,但因缺乏在体外培养液中的增殖能力,一般在10天左右会死亡。
杂交瘤抗体技术的基本原理杂交瘤抗体技术(Hybridoma technology)是一种重要的细胞生物学技术,用于在体外大量生产单克隆抗体。
该技术的基本原理是通过将具有特异抗原识别能力的B淋巴细胞与癌细胞(骨髓瘤细胞)融合成杂交瘤细胞,从而获得既具有B 淋巴细胞的特异抗原识别能力,又具有癌细胞的无限增殖能力的混合细胞。
通过培养这些杂交瘤细胞,可以获取大量生产特异性单克隆抗体的能力。
具体来说,杂交瘤抗体技术主要包括以下几个步骤:原生抗原免疫、细胞融合、筛选和克隆化。
首先,需要用原生抗原对小鼠(或其他合适的动物)进行免疫。
免疫过程中,将原生抗原注入小鼠体内,使得小鼠的免疫系统产生特异性抗体。
原生抗原可以是具有特定抗原性的蛋白质、多肽、多糖或其他小分子。
接下来,需要采集小鼠的脾脏细胞,其中包括B淋巴细胞。
这些细胞是体内产生抗体的主要细胞类型。
然后,将获得的小鼠脾脏细胞与特定的癌细胞(骨髓瘤细胞)进行融合。
癌细胞具有高度增殖能力,但是缺乏自身产生抗体的功能。
通过融合,可将两者的优势结合起来,形成杂交瘤细胞。
融合细胞的关键步骤是融合剂的添加,常用的融合剂包括聚乙二醇(polyethylene glycol,PEG)或电融合等方法。
融合后的细胞经过培养,形成杂交瘤细胞系或克隆。
接下来,需要进行对杂交瘤细胞的筛选。
杂交瘤细胞融合后,细胞状态杂乱,包括混合细胞和单个细胞。
为了筛选出合适的杂交瘤细胞,通常会采用HAT选择培养基。
HAT选择培养基含有嘌呤、嘧啶和大环酸(aminopterin)。
此种培养基筛选基于杂交瘤细胞同时需要三种成分合成DNA和RNA,但正常骨髓细胞无法合成这些成分,从而导致正常骨髓细胞死亡,只有杂交瘤细胞可以生存和增殖。
经过适当的筛选,能够获得产生特异性单克隆抗体的杂交瘤细胞系。
杂交瘤细胞系具有很强的生长和增殖能力,同时也保留了母细胞所特有的特异性抗原识别能力。
在杂交瘤细胞系的培养中,需要采用适当的培养基和条件来维持细胞的稳定生长和抗体的产生。
专利名称:一种基于杂交瘤细胞的单链抗体的制备方法
专利类型:发明专利
发明人:孙远明,董洁娴,王弘,雷红涛,李振峰,徐振林,杨金易,沈玉栋
申请号:CN201110420334.0
申请日:20111215
公开号:CN103160515A
公开日:
20130619
专利内容由知识产权出版社提供
摘要:本发明公开了一种基于杂交瘤细胞的单链抗体的制备方法。
本发明的制备方法,步骤为:以杂交瘤细胞总mRNA为模板反转录得cDNA,选用简并性低的通用引物扩增全套抗体重链可变区和轻链可变区基因;将扩增出的重、轻链可变区基因序列输入IMGT数据库进行分析,排除来源瘤细胞的抗体基因和无义基因,得到候选重链和轻链可变区基因;将该基因翻译成氨基酸序列后进行三维结构同源模建,获得单链抗体的三维模拟结构,与相应抗原靶标分子进行分子对接分析;分析结果正确的候选重链和轻链通过重叠延伸PCR法拼接成单链抗体基因,进行表达及抗体活性鉴定。
本发明的制备方法适合所有源于单克隆杂交瘤细胞的单链抗体制备,过程简易、快速,产品质量高。
申请人:华南农业大学
地址:510642 广东省广州市天河区五山路483号
国籍:CN
代理机构:广州粤高专利商标代理有限公司
代理人:林丽明
更多信息请下载全文后查看。
C-myc杂交瘤细胞培养及抗体纯化(骆洁)细胞培养培养基:Iscove’s DMEMFBS 10%Gentamicin (终浓度0.05 mg/ml )相当于10 mg/ml的抗生素加0.5% 细胞形态:圆形,半悬浮状态,贴壁部分细胞比较大,圆,透明。
传代:细胞复苏后让它在6 cm plate 中生长,两天左右后,细胞开始快速分裂生长,隔天1:4传代。
传代时不需要胰酶,用移液枪将贴壁部分细胞轻轻吹下来后,连同上清一起离心,1200 rpm,5min。
沉淀下来的细胞用10%FBS完培悬浮后1:4传代。
在传代过程中得到的上清培养液可以转移到另外一个容器中冻到-80度保存,最后一起进行抗体纯化。
抗体收集:当细胞扩增到足够的数量,用含5%FBS的培养基培养来分泌蛋白,通常养3-5天后收集上清用于纯化,此时的细胞已经很老,因此收集上清后就弃之。
收集到的上清用作进一步的抗体纯化。
冻存:含10%FBS培养基90%+DMSO10%抗体纯化柱子:内径0.5-1 cm自备柱子填充物:Protein A或protein G 0.6-1 ml 也有现成的protein A柱子买Wash buffer::100 mM Tris-HCL( pH 8.0)Elution buffer:100 mM Glycine (pH 3.)TBS(pH7.6):Tris 20 mMNaCl 137 mM1.装柱时先将流出口堵住,装满wash buffer后再打开,赶尽下部的气泡,柱子不能流干,装入填充物,使均匀沉降,用10个体积以上的wash buffer平衡柱子。
2.将上清(9000 rpm,10 min)离心后,上柱,反复通过柱子2-3次,使充分结合。
3.用wash buffer洗柱子30 ml以上,4.准备接收用离心管,每管中加入100 mM Tris 0.1 ml。
5.洗脱时,每加0.9 ml Elution buffer接收一管,相当于每个EP管中含10% wash buffer,90% Elution buffer.6.测一下每管中的蛋白浓度,将浓度高的合并起来。
杂交瘤细胞生成抗体技术
(一)杂交瘤技术的诞生
淋巴细胞杂交瘤技术的诞生是几十年来免疫学在理论和技术两方面发展的必然结果,抗体生成的克隆选择学说、抗体基因的研究、抗体结构与生物合成以及其多样性产生机制的揭示等,为杂交瘤技术提供了必要理论基础,同时,骨髓瘤细胞的体外培养、细胞融合与杂交细胞的筛选等提供了技术贮备。
1975年8月7日,Kohler和Milstein在英国《自然》杂志上发表了题为“分泌具有预定特异性抗体的融合细胞的持续培养”(Continuous cultures of fused cells secreting antibody of predefined specificity)的著名论文。
他们大胆地把以前不同骨髓瘤细胞之间的融合延伸为将丧失合成次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthine guanosine phosphoribosyl transferase,HGPRT)的骨髓瘤细胞与经绵羊红细胞免疫的小鼠脾细胞进行融合。
融合由仙台病毒介导,杂交细胞通过在含有次黄嘌呤(hypoxanthine,H)、氨基喋呤(aminopterin,A)和胸腺嘧啶核苷(thymidine,T)的培养基(HAT)中生长进行选择。
在融合后的细胞群体里,尽管未融合的正常脾细胞和相互融合的脾细胞是HGPRT+,但不能连续培养,只能在培养基中存活几天,而未融合的HGPRT-骨髓瘤细胞和相互融合的HGPRT-骨髓瘤细胞不能在HAT培养基中存活,只有骨髓瘤细胞与脾细胞形成的杂交瘤细胞因得到分别来自亲本脾细胞的HGPRT和亲本骨髓瘤细胞的连续继代特性,而在HAT培养基中存活下来。
实验的结果完全像起始设计的那样,最终得到了很多分泌抗绵羊红细胞抗体的克隆化杂交瘤细胞系。
用这些细胞系注射小鼠后能形成肿瘤,即所谓杂交瘤。
生长杂交瘤的小鼠血清和腹水中含有大量同质的抗体,即单克隆抗体。
这一技术建立后不久,在融合剂和所用的骨髓瘤细胞系等方面即得到改进。
最早仙台病毒被用做融合剂,后来发现聚乙二醇(PEG)的融合效果更好,且避免了病毒的污染问题,从而得到广泛的应用。
随后建立的骨髓瘤细胞系如SP2/0-Ag14,X63-Ag8.653和NSO/1都是既不合成轻链又不合成重链的变种,所以由它们产生的杂交瘤细胞系,只分泌一种针对预定的抗
原的抗体分子,克服了骨髓瘤细胞MOPC-21等的不足。
再后来又建立了大鼠、人和鸡等用于细胞融合的骨髓瘤细胞系,但其基本原理和方法是一样的。
(二)基本程序和方法
杂交瘤技术在具体操作上,各实验室使用的程序不尽一致。
本节中介绍的方法是作者所在实验室采用的、实践证明成熟的程序,该程序适合国内大多数实验室。
在开展杂交瘤技术制备单抗之前,培养骨髓瘤和杂交瘤细胞必须具备下列主要仪器设备:超净工作台、CO2恒温培养箱、超低温冰箱(-70℃)、倒置显微镜、精密天平或电子天平、液氮罐、离心机(水平转子,4000r/min)、37℃水浴箱、纯水装置、滤器、真空泵等。
其需要的主要器械包括:100ml、50ml、25ml细胞培养瓶,10ml、1ml刻度吸管,试管,滴管(弯头、直头),平皿,烧杯,500ml、250ml、100ml盐水瓶,青霉素小瓶,10ml、5ml、1ml注射器等,96孔、24孔细胞培养板,融合管(50ml圆底带盖玻璃或塑料离心管),眼科剪刀,眼科镊,血细胞计数板,可调微量加样器(~50ul,~200ul,~1000ul),弯头针头,200目筛网,小鼠固定装置等。
此外,杂交瘤细胞的筛选与检测的仪器设备,依据检测单抗的方法不同而各异。
淋巴细胞杂交瘤技术的主要步骤包括:动物免疫、细胞融合、杂交瘤细胞的筛选与单抗检测、杂交瘤细胞的克隆化、冻存、单抗的鉴定等,概括了淋巴细胞杂交瘤技术研制单抗的主要过程。
相关帮助
本文由探生网技术人员提供,如果您想了解更多的信息,可以访问全球抗体搜索引擎查找相关抗体,希望对您有帮助!
相关实验试剂和器材: 。