免疫组化技术常见问题及处理方法
- 格式:ppt
- 大小:5.14 MB
- 文档页数:60

免疫组化技术要点与常见问题在免疫组化过程中,为了更好的说明问题和查找原因,最好设置阳性对照片(已知的高表达相应抗原的组织)和阴性对照组织片(不加一抗但是加二抗系统/不加任何抗体两组),所有操作过程应完全一致。
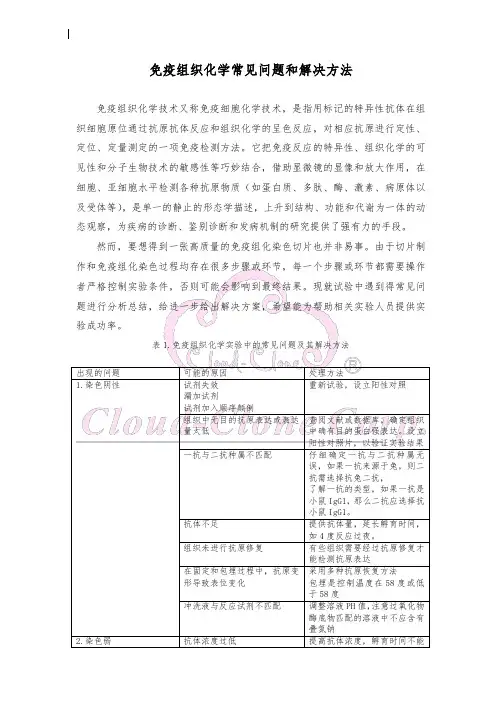
染色弱或者没有染色(按照先后顺序,先排除一些简单的原因):可能原因解决办法试剂使用顺序错误或者漏加试剂重复实验,保证每一步均正确二抗和一抗不匹配选择匹配的二抗底物和酶不匹配选用匹配的底物酶失活换用新的酶(将酶和底物混合,看是否显色?)组织中没有待测抗原表达或者表达水平低使用阳性对照片抗体浓度太低增加抗体浓度.最好使用不同浓度的抗体,决定最佳浓度抗体孵育时间不充分延长抗体孵育时间底物孵育不充分延长底物孵育时间抗体储存不当,导致失效将抗体分装,低温保存 (-20 to -70 C) ,避免反复冻溶。
稀释抗体在4保存1-2周,避免时间过长。
或者根据说明书进行恰当的保存一抗失效换用新的一抗二抗失效换用新的抗体(能否成功与其它一抗配合?)脱石腊不充分延长脱腊时间或者换用新的二甲苯组织固定不充分或者不当增加固定时间或者改用不同的固定方法组织固定过度减少固定时间。
若已固定过度,则需使用正确的或者推荐的抗原修复方法复染试剂与底物系统不匹配选择正确的复染试剂(不加复染剂,看是否有组织染色?)封片剂不正确选择正确的封片剂染色背景高:可能原因解决办法洗片不充分每步之间至少洗片3次组织含有内源性的酶,如HRP/AP 在加入一抗之前使用3%的H2O2甲醇封闭内源性HRP 活性,使用左旋咪唑(levamisole)溶液阻断内源性AP活性。
或者换用葡萄糖氧化酶系统组织含有内源性生物素(尤其是肾脏、肝和脾)在加入一抗之前,血清封闭之后使用avidin/biot in阻断试剂。
或者避免使用biotin-avidin系统或改用IF方法(直接将酶和底物加到组织片上,看是否显色?)一抗的非特异性结合或者抗体浓度过高增加一抗的稀释度二抗和组织非特异性结合使用与二抗来源相同的正常动物血清(一般是1 0%)封闭,必要时可以将血清浓度加大组织固定不充分,抗原扩散Increase duration of postfixation使用小鼠来源的二抗检测小鼠组织在加一抗之前使用MouseOnMouse封闭试剂干片染色过程中避免出现干片现象染色强度过大:可能原因解决办法一抗或者二抗浓度过高降低抗体浓度。



免疫组化(IHC)常见问题解析2162 人阅读发布时间:2020-10-22 15:54免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究。
然而理想是丰满的,实际操作起来却是骨感的,作为一种分析方法,常常会存在非特异着色的背景问题。
下图中靶点均为胞膜定位,左边背景着色严重,右边染色效果优良。
01 抗体质量问题抗体本身在靶点设计上如果特异性不够,会导致非特异着色。
一般来说,单抗在特异性上相比多抗是具有优势的,但多抗由于识别任一抗原上的多个表位,多抗可放大低表达水平靶蛋白的信号,对微小抗原变化(例如多态性、糖基化异质性或者轻微变性)的包容性更强,可用于非免疫原物种的靶蛋白的检测实验。
具体实验时,还应根据实际需要选择合适的抗体。
另外,抗体保存也应注意防腐及防止反复冻融。
02 内源性酶和生物素当选用肝、肾,脾组织作为样本时,由于这些组织本身含有较高含量的过氧化酶和生物素,对于使用Hrp或生物素-亲和素显色系统的实验都会造成非特异性染色。
对于内源性过氧化物酶,可以用0.9% 的双yang水来灭活。
对于内源性生物素,染色前将切片浸于25 μg/mL 亲和素溶液中15 分钟,PBS 清洗15 分钟后即可染色。
也可以24 mg/mL 的卵白素封片15 分钟。
03 抗体浓度过高获得良好的染色结果,一般应优化一抗的使用浓度,可参考供应商提供的说明书,但预实验也是必不可少的,摸索出最理想的工作浓度。
04 DAB 染色时间太长/变质DAB 的作用时间过长,同样会造成背景。
DAB 的显色时间不是一成不变的,实验时应及时镜检,出现浅棕色时,马上冲洗。
出现棕色的时间过短,表明抗体浓度过高;出现棕色的时间过长,表明抗体有效浓度过低。
DAB 要保存于避光干燥的地方,现用现配,临用前才加入H2O2。

免疫组化操作方法、原理、步骤以及常见问题处理大总结1、方法操作不难,最大的难处是出现异常结果时如何解决?这就需要掌握免疫组化实验原理,每一步知道为什么这样做,这样你才敢大胆地改革先前的不对的方法步骤。
如抗体孵育条件主要是抗体浓度、温度、时间,这三者一般是相互成反比的(相对),其中浓度是最重要的先决条件,温度决定反应的速度、时间决定反应的量。
就拿温度来说,可以有4度、室温、37度,我推荐4度最佳,反应最温和,背景较浅;而37度反应速度较快,时间较短;室温我不太提倡,除非你每次都把环境温度控制在一定的范围,否则,尽量选择前两者。
2、免疫组化最大的优势是定位和定性。
相比于其他蛋白检测方法,免疫组化具有定性灵敏度高、定位较直接准确,是定位检测分析首选方法。
尤其对于有些因子的转位研究十分有用。
3、免疫组化结果定量分析的前提是高质量的染色切片。
免疫组化结果也能定量分析,但必须是背景染色浅而特异性染色较深的情况下,分析最为准确,这种原则可能也是我们日常审稿时判定研究结果的必备条件。
4、免疫组化实验一定要设置阳性对照和阴性对照。
阳性对照一般是用肯定表达这种抗原的切片来做;阴性对照一般是用PBS或非一抗替代一抗来进行反应,其余步骤均一致。
前者是排除方法和实验系统有无问题;后者是排除有无一抗外的非特异性染色。
5、免疫组化的应用广泛,是当前实验研究的最重要方法之一。
如今发SCI论文时,明显感觉仅靠量化的数据来发文章很难,加一些形态学数据或图片,老外十分欢迎,可能是怕你学术造假吧。
当然也不能做假阳性或假阴性结果。
6、免疫组化技术掌握与否的鉴定标准是同一切片或不同切片中不同抗原均从摸索浓度或条件而做出优良的染色切片。
我在平时带教中就发现许多研究生把我已经摸索很成熟的反应条件、浓度、方法步骤,重复运用于同一性质的切片和同一种抗体,做出来后就觉得自己已经掌握了免疫组化方法,更换一种抗体后,居然连二抗的种属来源都拿错了。
失败往往促进你去思考试验原理和过程,成功有时也加快你自傲。


免疫组化实验步骤及常见问题分析免疫组化实验步骤及常见问题分析免疫组化实验流程1.样品制备2.组织固定:根据要求收集人或动物的组织用于IHC分析,冲洗并用固定剂(一般用甲醛)进行固定3.组织包埋:将经甲醛固定的组织嵌入石蜡,以长期保持其天然形状和组织结构4.切片安装:将组织样品在切片机上切片,并转移至载玻片上干燥保持其形态5.脱蜡水化:因切片上的石蜡会妨碍染色,所以需将切片上的石蜡溶出,并水化。
脱蜡或水化不全容易造成非特异性背景着色(一般的脱蜡水化步骤是:将切片依次浸入二甲苯Ⅰ10min-二甲苯Ⅱ10min-无水乙醇5min-95%无水乙醇5min-90%无水乙醇5min-80%无水乙醇5min-70%无水乙醇5min-50%无水乙醇5min-蒸馏水5min×3,进行脱蜡水化)。
6.抗原修复:由于组织在甲醛固定过程中,蛋白之间发生了交联及醛基的封闭从而掩盖抗原决定簇。
可以通过高压加热修复抗原,使细胞内抗原决定族暴露,从而提高抗原检测率。
7.非特定位点封闭:为了防止一抗的非特异性结合造成假阳性,可以选用BSA、羊血清等封闭非特异性结合位点。
封闭血清来源一般与二抗保持一致,室温封闭10-30min。
8.样品染色一抗、二抗孵育:抗体孵育时间、温度及浓度等因素对染色结果都存在很大影响。
在4℃下反应缓慢,背景较浅;37℃反应较快时间较短;而室温介于两者之间,选择室温有利于实验的进行。
二抗一般室温孵育30min。
底物显色:基于与酶缀合的二抗,抗原通过生色或荧光方式直接检测。
复染封片:组化染色后进行复染可以衬托出组织形态结构,常用的复染剂有苏木精、曙红、甲基绿、DAPI和Hoechst荧光染色。
观察结束后使用中性树胶进行封片,可以长久保存。
免疫组化实验常见问题分析1. IHC实验结果显色过深一抗浓度过高或孵育时间过长——降低一抗浓度或减少孵育时间孵育温度过高——选择4℃或室温孵育2. 实验结果存在非特异性显色石蜡切片脱蜡不够——延长脱蜡时间蛋白封闭不充分——增加蛋白封闭时间组织富含内源性生物素与过氧化物酶——使用相关试剂进行封闭3. 实验结果显色弱或无染色一抗浓度过低或孵育时间过短——增加一抗浓度或延长孵育时间组织中无目的抗原的表达:一抗种属来源与二抗不匹配免疫组化实验注意事项切片脱蜡和水化要充分,加反应液时要覆盖组织充分;每次加液前甩干洗涤液,同时防止干片。

组化常见问题及解决办法当免疫组化染色没有出现预期结果时,应系统地查找原因,而每一次只能排除一种可能的原因。
对照/标本无染色① 确认是否忽略了应该加的某种试剂,包括一抗、二抗、三抗及底物等。
② 确认所有的试剂是否按正确的顺序加入,是否孵育了足够的时间。
③对照抗体的标签确认是否使用了正确的抗体,以及所用的检测系统是否和一抗匹配,这一点是非常重要的。
比如,如果一抗是兔来源的抗体,二抗一定要用抗兔的二抗来匹配;或一抗是小鼠的IgM一抗,二抗必须是山羊/兔抗小鼠的IgM(不是IgG)二抗。
④ 检查抗体所使用的稀释度及稀释溶液。
⑤ 检查抗体的有效期和保存条件,尤其是标记了酶或荧光素的抗体,现在大多数试剂公司的抗体均要求在4~8℃条件下保存,应避免反复冻融,试剂保存时一定要避免与挥发性有机溶剂同放一室,以免降低抗体的效价。
⑥ 检查标本的储存条件,最好用已知阳性的标本来同时做阳性对照。
弱阳性如果阴性对照没有染色而阳性对照标本弱阳性,除了考虑上述因素外,还应考虑:①不适当的抗原修复方式,由于石蜡切片在制作的过程中固定剂对抗原的封闭作用,必须用抗原热修复或酶消化或两种同时使用的抗原双暴露法,至于使用哪一种方法,应参照生产厂家的说明,同时结合标本的具体情况而定。
②切片上遗留了过多的冲洗液,当抗体加至切片上时,等于人为地对抗体进行了进一步的稀释。
③ 抗体的稀释度是否过高或者孵育的温度/时间是否正确。
一般试剂生产厂家都会对试剂给出一定的使用范围,但是由于使用者的标本来自各种组织,处理过程也不尽相同,所以应参照使用范围,对所使用的一抗进行梯度测试,找出最佳的使用浓度。
④孵育时切片是否放置水平,否则会导致抗体流失。
非特异性染色① 是否有效地去除了内源性酶和生物素。
应注意的是,并不是每一种组织均需要进行此步骤,但对于内源性酶或生物素丰富的组织,如肝脏、肾脏等,需考虑此原因。
②一抗的使用浓度是否过高。
③清洗是否充分。
应严格操作规程。

免疫组化关键步骤常见问题和解决方案范文精品论文参考文献1.3脱蜡至水洗中应注意的问题脱蜡液应经常更换,必须保证脱蜡干净,彻底,水洗充分,水洗之后切片应放在蒸馏水中清洗1~2遍,脱蜡不干净,不彻底时,就会出现非特异性着色,影响染色效果,即阳性强度也会减低。
1.4抗原修复中应注意的问题目前常用的抗原修复液有两种:即0.01M柠檬酸缓冲液(PH6.0)和1mM的EDTA缓冲液(PH9.0或PH8.0).对于一些胞浆阳性或胞膜阳性的抗体,选择柠檬酸缓冲液比较好,而对于一些胞核阳性的抗体,选择EDTA缓冲液比较好。
配置修复液时必须用蒸馏水,否则染色会失败,大部分抗体都会出现假阴性。
抗原修复方法目前比较常用的是高压锅喷气2~3分钟,中火(120℃~140℃)。
自然冷却,如果要节省时间,可用自来水冲洗高压锅外面,等到压力降下,再把高压锅锅盖打开,放在冷水中冷却,中途可换一次水,这样既节省用水,又可节约时间,等到高压锅中水温接近常温,就可直接用自来水冲洗切片[1]。
1.5滴加抗体前和滴加抗体时应注意的问题切片冲洗好后,应放在蒸馏水中,拿出画圈,画圈时应注意圆圈与组织必须保持一点距离,否则会产生边缘效应,即圆圈旁组织会产生非特异性染色。
画好圈后,用PBS冲洗切片,注意画完圈后尽量不要让切片干燥,画完圈后也不能立时冲洗,要等油干燥后再冲洗,否则油就冲掉了,就不能起到防止抗体外溢的效果。
用蒸馏水配置PBS时,需加一些吐温或去垢剂,有利于冲洗的更干净,也有利于滴加完抗体后抗体的弥散速度,抗体弥散速度快,操作简便,节约时间。
一抗孵育可选择37℃温箱1小时或4℃冰箱过夜,而二抗的孵育一般都是室温,添加二抗前和显色前,PBS都必须彻底冲洗干净,否则会产生非特异性着色。
1.6显色时应注意的问题在保证显色液配制浓度准确的情况下,显色时间应严格把握。
当制作大批切片时,可以批量滴加显色液,先用肉眼观察组织是否变黄,若变黄时,可在镜下控制,每种抗体的显色时间,背景着色能都不太一样,具体可在镜下控制,积累经验。

免疫组织化学技术常见问题分析及对策阳性对照标本和待测标本均无着色1. 可能原因分析1.1 抗体选择不当,不适合做IHC。
抗体保存不当,超过有效期或反复冻融导致抗体效价过低或失活。
1.2 抗体工作浓度过低,特别是一抗的浓度过低。
同时也有可能是抗体孵育时间过短、温度偏低。
1.3 二抗与一抗种属不匹配,如一抗为鼠源性抗体,二抗没有使用抗鼠的抗体。
1.4 贴片法IHC染色有可能是抗体流失导致切片干燥。
1.5 石蜡切片未进行抗原修复或酶消化等前处理时间过长破坏了待检测抗原决定簇。
1.6 缓冲液PH值不当或含有酶活性抑制剂,如叠氮钠是过氧化物酶活性抑制剂。
1.7 DAB显色时间过短;显色底物不应该含有叠氮钠;在DAB显色时,显色液应该新鲜配制。
1.8 复染、脱水和封片剂的选择与显色系统不匹配。
1.9 阳性对照标本选择不合适,该标本不含有待检测抗原或与所用一抗试剂不匹配。
2. 处理方法2.1 确认使用抗体的各类抗体试剂的正确保存方法,保证其效价。
如果确认抗体已经失效,及时更换。
2.2 检查二抗是否与一抗种属匹配。
2.3 适当提高抗体浓度,优化孵育条件。
保证抗体孵育箱温度为37℃,或增加孵育时间,如4℃孵育48小时。
2.4 标本孵育盒平稳放置,防止孵育液流失。
2.5 参考文献选择标本类型适合的蛋白酶消化方法和抗原修复处理方式与条件。
2.6 调节缓冲液至对应正常的PH值,保证不含酶活性抑制剂。
2.7 重新配制DAB显色液,并保证配制方法、浓度、正确、有效,适当延长显色时间。
2.8 选择正确的阳性对照切片。
阴性对照标本未着色,而阳性对照标本和待测标本呈弱阳性1. 可能原因1.1 标本固定方式不正确,如固定不及时、固定液量太少、固定液失效或组织处理方式不当。
1.2 抗体保存不当,超过有效期或反复冻融导致抗体效价过低或失活。
1.3 抗体浓度太低,特别是一抗的浓度过低,或者抗体孵育时间过短、温度偏低。
1.4 贴片法染色时标本上含有缓冲液,导致抗体浓度稀释。
免疫组化实验遇到的问题分析及改进方法1石蜡切片在染色过程中出现脱片现象1)烤片时间不够,或温度不够,可以延长烤片时间和提高烤片温度;2)用含有多聚赖氨酸的玻片,可以购买到或这自己做;3)有些组织本身就容易掉片,如骨组织等,操作时冲PBS不要直接冲到组织上,冲到组织上方,让它流下冲洗组织;4)用高温修复时,温度骤冷也可能引起。
2边缘效应1)组织边缘与玻片粘贴不牢,边缘组织松脱漂浮在液体中,每次清洗不易将组织下面试剂洗尽所致。
解决办法:制备优质的胶片(APES或多聚赖氨酸),切出尽量薄的组织切片,不厚于4微米,组织的前期处理应规范,尽量避免选用坏死较多的组织。
2)切片上滴加的试剂未充分覆盖组织,边缘的试剂容易首先变干,浓度较中心组织高而致染色深。
解决办法:试剂要充分覆盖组织,应超出组织边缘2mm。
用组化笔画圈时,为了避免油剂的影响,画圈应距组织边缘3-4mm。
3产生组织切片非特异性染色1)抗体孵育时间过长、抗体浓度高易增加背景着色。
这可通过缩短一抗/二抗孵育时间、稀释抗体来控制。
这是最重要的一条;2)一抗用多克隆抗体易出现非特异性着色,建议试用单克隆抗体看看;3)内源性过氧化物酶和生物素在肝脏、肾脏等组织含量很高(含血细胞多的组织),需要通过延长灭活时间和增加灭活剂浓度来降低背景染色;4)非特异性组分与抗体结合,这需要通过延长二抗来源的动物免疫血清封闭时间和适当增加浓度来加强封闭效果;5)DAB孵育时间过长或浓度过高;6)PBS冲洗不充分,残留抗体结果增强着色,在一抗、二抗或SP孵育之后的浸洗尤为重要;7)标本染色过程中经常出现干片,这容易增强非特异性着色。
4免疫组化染色呈阴性结果1)抗体浓度和质量问题以及抗体来源选择错误;2)抗原修复不全,对于甲醛固定的组织必须用充分抗原修复来打开抗原表位,以利于与抗体结合;建议微波修复用高火4次*6min试试。
有人做过实验,这是最佳的时间和次数。
若不行,还可高压修复;3)组织切片本身这种抗原含量低;4)血清封闭时间过长;5)DAB孵育时间过短;6)细胞通透不全,抗体未能充分进入胞内参与反应;7)开始做免疫组化,我建议你一定要首先做个阳性对照片,排除抗体等外的方法问题。
免疫化学染色技术常见问题及解决方法染色不足
2. 阳性对照有足够的特异性染色,背景干净;组织显示很少或没有特异性染色,但在几种组织成分中有不同的程度的背景染色。
背景染色
1. 背景染色见于所有对照组织和标本组织,或在一些组织成分,如结缔组织、脂肪和上皮组
2. 标本组织和阴性试剂对照玻片显示背景染色,阳性和阴性对照组织显示正确的特异性染色;
局灶性背景染色
1. 在对照、标本和玻片的局部区域出现染色不一致
2.标本中的脂肪或结缔组织、阴性对照组织和阳性对照试剂玻片中,背景染色出现在结缔组织和上皮组织中
3. 标本中的上皮组织、阴性对照组织、阳性对照组织和阴性对照试剂玻片中,特别在上皮呈中至强染色;背景染色出现在结缔组织和上皮组织中
7. 应用生物素—链菌素卵白素染色系统时,在所有对照和标本组织中均见背景染色
不正确的“特异性”染色
1.在标本组织、阳性对照、阴性组织对照和阳性试剂对照的白细胞胞膜出现阳性染色。
免疫组化常见问题及其解决办法1、一抗从4度拿出后,为什么要进行37度复温?(1)一方面,防止切片从4度直接放入PBS易脱片;(2)另一方面,使抗原抗体结合更稳定。
一般不需要,但对表达较弱的抗原可能有用,4度和37度时分子运动方式不同,前者分子碰撞机率和运动速度小于后者,后者结合更快,但敏感性也提高了并易造成非特异染色。
(3)其实,我更赞同后一种说法,由于我尝试把肝脏或睾丸片子从4度过夜拿出后,直接用PBS洗没发生过脱片现象。
2、切片染色后背景太深,如何区分特异性与非特异性着色?全片着色是指整个切片全都染上了颜色,着色的强度可深可浅,总之,分不清那些组织是阳性那些组织是阴性。
消失这种现象的缘由有:(1)抗体浓度过高:一抗浓度过高是常见的缘由之一。
解决方法是,每次使用新抗体前应当对其工作浓度进行测试,使每一抗体个体化,找到适合自己试验室的抱负工作浓度,既使是即用型的抗体也应如此,不能只简洁的按说明书进行染色。
(2)抗体孵育时间过长或温度较高:解决方法是,严格执行操作规程,最好随身佩带报时表或报时钟,准时提示,避开因遗忘而造成时间延长。
现在流行的二步法(Polymer)敏感性很高,要求一抗孵育的时间不是传统的1小时,而是30分钟,因此,要依据染色结果进行调整。
(3)DAB变质和显色时间太长:DAB最好现用现配,如有沉渣应进行过滤后再用。
配制好的DAB不应存放时间太长,由于在没有酶的状况下,过氧化氢也会游离出氧原子与DAB产生反应而降低DAB的效力,未用完的DAB存放在冰箱里几天后再用这种好像节省的方法是不行取的。
DAB的显色最好在显微镜下监控,达到抱负的染色程度时马上终止反应。
不过当染色片太多时或用染色机时,这样做好像不现实,但至少应对一些新的或少用的抗体显色时进行监控,避开显色时间过长。
(4)组织变干:修复液溢出后未准时补充液体、染色切片太多、动作太慢、遗忘滴液、滴液流失等都是造成组织变干的缘由。
解决的方法是操作要仔细认真,采纳DAKO笔或PAP Pen在组织四周画圈,可以有效的避开液体流失,也能提高操作速度。
良好的免疫组化染色切片是正确判断染色结果的基础和前提。
由于免疫组化染色过程要经过很多步骤和环节,而每一个步骤环节都可能影响到染色的最终结果,因此,要做一张高质量的免疫组化切片并不是一件非常容易的事,这需要病理技术人员和病理医师的密切配合、相互协调、共同努力才能完成。
虽然免疫组化染色可以存在各种问题,但从染色结果看一般可分为两类:无色片(无阳性信号)和“杂音”染色片(有阳性信号)。
l 无色片即染色结束后,切片中见不到任何阳性信号。
这是常规工作中比较常见的现象,有两种可能。
1.1 真阴性结果整个染色过程没有出现问题,组织或细胞中与抗体相关的抗原确实不表达。
1.2 假阴性结果即此阴性结果不是真实的反映。
1.2.1 切片中根本就不包含所预期检查的组织或细胞。
出现这种情况,可能是病理医师对切片或抗体的选择错误。
或是技术员选错蜡块,所以获得正确的切片进行染色是获得正确结果的前提。
故制作出合格的免疫组化切片不仅是技术员的事,病理医师也起着不可或缺的作用。
1.2.2 染色过程中的某一或某些环节出了问题。
如:①组织未进行抗原修复,有的组织必须经过抗原修复才能检测抗原表达;②抗体选用不当,选用了只能用于冷冻组织而不能用于石蜡包埋组织的抗体;③一抗失效。
虽然抗体失效在理论上是一个逐渐的过程,但偶尔也会遇到突然失效的情况,抗体长期不用和/或已超过有效期是主要原因;④染色过程中漏掉了某一环节。
如忘记加二抗或三抗。
或用了两次二抗而缺少三抗,或配制DAB时少了过氧化氢。
有一种简单的方法可避免这种错误,在三抗孵育结束时,将切片上的三抗甩在一张白纸上。
再将配制好的DAB滴一滴在白纸的三抗上。
观察是否出现棕色。
如果出现则证明三抗和DAB 的配制过程没有错误;如果这种DAB再滴到切片上没有出现任何阳性信号,问题一定是出在三抗以旆;如果纸上不出现棕色反应,问题肯定在三抗或DAB及其配制过程。
这种方法能迅速地帮助我们找出问题的原因;⑤抗体未完全覆盖测试组织,当多块散开的小组织染色时,可能漏掉某块组织。
免疫组化实验步骤、常见问题及解决方案免疫组化实验虽然看上去非常简单,然而做起来却容易“花样百出”,让实验人员的精神备受摧残。
因此,今天小编在这里跟大家详细介绍一下免疫组化实验的步骤以及常见问题和解决方案,让大家的免疫组化实验更加顺畅。
免疫组化实验主要包括石蜡切片的免疫组化技术(IHC-P)和冰冻切片的免疫组化技术(IHC-F),今天主要讲的是IHC-P。
实验步骤详解:1,取材颈椎脱臼法处死小鼠,打开腹腔,剪取所需的组织,切取的组织块不宜太大,以利于固定剂穿透。
注意取材动作要迅速,不宜作太久的拖延以免组织细胞的成分、结构等发生变化,切片材料应根据需要观察的部位进行选择,尽可能不要损伤所需要的部分。
2,切片制备(1)固定将切好的组织(<5mm3)用生理盐水组织洗一下,立即投入4%多聚甲醛(PFA)或10%中性福尔马林(NBF)中固定,根据组织大小和松密程度室温4-48h。
若取材是小鼠大脑或神经组织,可以采用灌流的方式进行固定。
(2)洗涤材料经固定后,水或酒精(若采用含有苦味酸的固定剂bouin,就用酒精洗涤)冲洗,数小时或过夜,目的是去除组织内固定液及结晶沉淀。
(3)脱水目的是因为透明剂多是苯类,苯和水不互溶,用到的材料是酒精,将组织依次经70%、80%、90%各级乙醇溶液脱水,各30min,再放入95%、100%各2次,每次20min。
(4)透明由于乙醇与石蜡不相溶,而二甲苯既能溶于乙醇又能溶于石蜡,所以脱水后还要经过二甲苯以过渡。
当组织中全部被二甲苯占有时,光线可以透过,组织呈现出不同程度的透明状态。
一般是用纯酒精、二甲苯等量混合液浸润材料1-2h,再换纯透明剂(二甲苯、苯、氯仿、正丁醇)。
(5)浸蜡和包埋透蜡的目的是除去组织中的透明剂(如二甲苯等),使石蜡渗浸到组织内部达到饱和程度以便包埋。
先放入二甲苯和石蜡各半的混合液,再放入熔化的石蜡中浸润,透蜡时间根据组织大小而定。
浸蜡之后放入包埋盒用石蜡进行包埋。