医疗器械生物相容性评价要求.ppt
- 格式:ppt
- 大小:4.98 MB
- 文档页数:57






医疗器械生物相容性评价要求引言医疗器械的生物相容性评价是确保器械与人体组织和生物体相容的重要步骤。
它对于确保器械的质量、安全性和效能至关重要。
本文旨在介绍医疗器械生物相容性评价的要求,包括评价标准、实验方法和技术要求。
评价标准医疗器械生物相容性评价的标准通常依据ISO 10993系列标准来制定。
ISO 10993系列标准包含了一系列评价项目和方法,用于评估医疗器械与人体之间的相互作用。
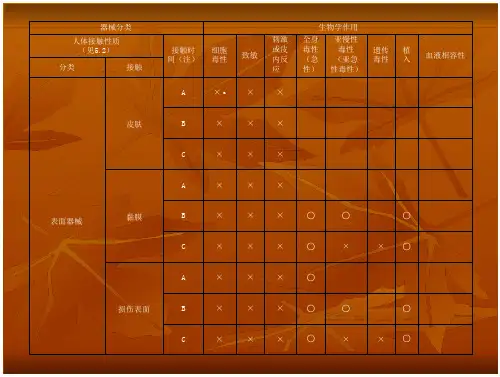
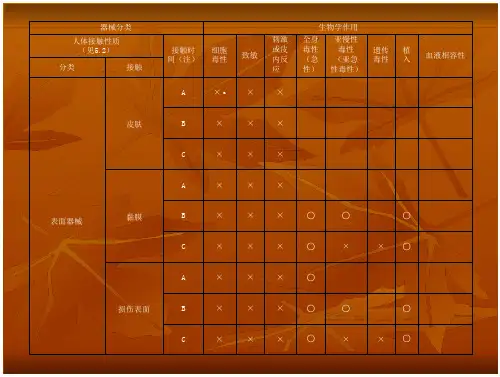
根据ISO 10993标准,器械的生物相容性评价需要考虑以下几个方面:1.毒性评价:评估器械对生物体的毒性作用,包括急性毒性、亚慢性和慢性毒性。
2.局部刺激和过敏原评价:评估器械对组织的刺激性和过敏原性。
3.整体系统毒性评价:评估器械在全身水平上对生物体的影响。
4.免疫学评价:评估器械对免疫系统的影响。
5.遗传学评价:评估器械对遗传物质的影响。
6.感染性评价:评估器械的感染风险。
7.其他特殊评价:根据器械的特殊属性,可能需要进行其他特殊评价。
实验方法为了评估医疗器械的生物相容性,需要进行一系列实验。
常用的实验方法包括但不限于以下几种:1.细胞毒性实验:通过培养细胞与器械接触,观察细胞生长、代谢和形态等指标的变化,以评估器械对细胞的毒性作用。
2.刺激性实验:将器械接触到动物体表面或者注射到动物体内,观察皮肤炎症、红肿、溃疡等指标的变化,以评价器械对组织的刺激性。
3.过敏原实验:通过接触器械,观察动物是否产生过敏反应,如皮肤红疹、瘙痒等。
4.免疫学实验:通过调节免疫系统的指标,评估器械对免疫系统的影响。
5.感染性实验:通过培养器械与微生物接触,观察细菌、真菌等的生长情况,以评估器械的感染风险。
技术要求医疗器械生物相容性评价需要遵循严格的技术要求,以确保结果的准确性和可靠性。
以下是一些常见的技术要求:1.实验室条件:评价实验需要在符合相关规范的实验室条件下进行,包括温度、湿度、洁净度等要求。
2.试剂选择:选择符合相关标准的试剂,避免对实验结果的影响。

医疗器械生物相容性评价要求1. 引言生物相容性评价是医疗器械研发过程中的重要环节,它对于确定生物材料与组织是否能够相互接受、相互适应起着关键作用。
本文档将介绍医疗器械生物相容性评价的要求,确保医疗器械的安全性和有效性。
2. 相容性评价的目的医疗器械生物相容性评价的目的是评估器械与人体组织之间的相容性,包括材料的毒性、刺激性和过敏性等特性。
通过评价,可确定器械是否适合用于临床应用,并且能够预测可能的风险,以保证患者的安全。
3. 相容性评价的内容医疗器械生物相容性评价包括以下内容:3.1 材料的选择与分类在评价之前,需要明确所使用材料的特性。
常见的材料包括金属、聚合物、陶瓷等。
根据使用目的和材料的特性,将其分类,并合理选择使用的材料。
3.2 毒性评价毒性评价是评估材料对人体有害作用的过程。
材料可能通过直接接触或间接释放有害物质对人体产生毒性作用。
采用合适的方法评估材料的毒性,并确定其无毒或可接受范围。
3.3 刺激性评价刺激性评价是评估材料对人体产生刺激反应的能力。
材料可能引起炎症、免疫反应等刺激性反应。
通过体外实验和体内实验,评估材料的刺激性,并确定其安全性。
3.4 过敏性评价过敏性评价是评估材料是否会引起过敏反应的能力。
某些人可能对特定材料或其成分过敏,因此需要进行相应的过敏性评价。
通过体外实验和临床观察,评估材料的过敏性,并确定其是否适用于人体。
3.5 免疫反应评价免疫反应评价是评估材料对免疫系统产生影响的能力。
材料可能会引起免疫反应,影响人体的免疫功能。
通过体外实验和体内实验,评估材料的免疫反应,并确定其对人体的影响。
3.6 其他评价根据实际需要,还可以进行其他评价,如血液相容性评价、细胞相容性评价等,以进一步确定材料与组织的相容性。
4. 评价方法与标准医疗器械生物相容性评价需要遵循相应的评价方法和标准。
常见的评价方法包括体外实验、动物实验和临床观察等。
评价标准包括国际标准、行业标准和法规规定等。

