血红蛋白的分离和提取
- 格式:ppt
- 大小:1003.00 KB
- 文档页数:20

血红蛋白的提取和分离一、教材分析在DNA提取和鉴定的基础上,本节课继续生物大分子——血红蛋白的提取和分离,对生物大分子的提取方法进行补充和完善。
在分离大分子蛋白质的方法中,重点介绍凝胶色谱法和电泳法,为学生展示依据不同原理分离蛋白质得到的结果完全不同,在学习过程中建立选择与结果的区别。
之后,课本重点介绍利用凝胶色谱法纯化血红蛋白,对理论知识加以利用。
二、教学目标1.知识与技能(1)理解色谱法、电泳法等分离生物大分子的基本原理;(2)了解缓冲液的组成及其作用。
2.过程与方法结合教材图解分析色谱法、电泳法等分离生物大分子的基本原理,进行比较进一步理解。
3.情感、态度与价值观领悟重要科学实验的发明,提高自己的科学素养。
三、教学重难点1.重点:凝胶色谱法的原理和方法。
2.难点:电泳法分离大分子的原理。
四、教学准备多媒体课件。
五、课时安排1课时。
六、教学过程【课程导入】DNA通过控制蛋白质的合成来控制生物的性状,蛋白质是生命活动的主要承担者和体现者,是细胞中含量最高的有机化合物。
之前,我们学习了从鸡血细胞液中提取DNA并加以鉴定,而对蛋白质的研究有助于人们对生命过程的认识和理解。
那么,如何从细胞中提取蛋白质呢?应该注意哪些事项呢?【基础知识】蛋白质分离和提取的原理:根据蛋白质各种特性(理化性质)的差异,如分子的形状和大小、所带电荷的性质和多少、溶解度、吸附性质和对其他分子的亲和力等等来分离不同种类的蛋白质。
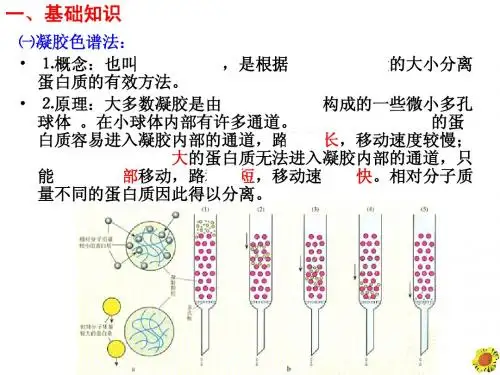
(一)凝胶色谱法1.概念:也称分配色谱法,是根据被分离的蛋白质相对分子质量的大小,利用具有网状结构的凝胶的分子筛作用,来进行分离蛋白质的有效方法。
2.大多数凝胶是由多糖类化合物(如葡聚糖或琼脂糖)构成的多孔小球体。
3.具体过程:当不同的蛋白质通过凝胶时,相对分子质量较小的蛋白质容易进入凝胶内部的通道,路程较长,移动速度较慢,而相对分子质量较大的蛋白质无法进入凝胶内部的通道,只能在凝胶外部移动,路程较短,移动速度较快,相对分子质量不同的蛋白质因此得以分离。

血红蛋白的分离和提取血红蛋白的分离和提取是一个复杂却又充满魅力的过程。
它不仅关乎科学,也与生命息息相关。
想象一下,血液中那闪烁的红色,仿佛在诉说着每一个细胞的故事。
血红蛋白,作为携氧的英雄,承担着生命的重任。
在这个过程中,首先要明确分离的目标。
你得知道,血红蛋白的结构并不是简单的。
它是由四个亚基构成的,每个亚基都有自己的个性。
比如,α亚基和β亚基之间的相互作用,就像朋友间的默契,缺一不可。
分离时,采用的方法多种多样,比如盐析、透析和色谱技术等。
盐析是个经典手法。
它就像是聚会时的筛子,把不必要的“嘉宾”排除在外。
加入盐后,蛋白质的溶解度变化,最终分离出你想要的血红蛋白。
接着透析,简单来说,就是用半透膜把小分子杂质过滤掉。
想象一下,你在海边捞水,想把沙子留在外面,只让清水流进桶里。
再来就是色谱技术,真的是个科学的魔法。
根据分子大小和亲和力,血红蛋白会在色谱柱中“走出”不同的轨迹。
你只需耐心等待,最终就能得到纯净的血红蛋白。
每一步都需要细致的观察和实验者的直觉,心态要稳。
接下来,提取的步骤也很重要。
提取后,血红蛋白会被溶解在缓冲液中。
这个缓冲液就像是血红蛋白的家,让它保持稳定。
记得在这一过程中,要控制好温度和pH值。
过高的温度会让血红蛋白变性,就像你把冰淇淋放在阳光下,瞬间化为一滩水。
从分离到提取,这一系列的操作需要技巧。
你得时刻保持警觉,观察每一个变化。
哪怕是微小的细节,都可能决定最终的结果。
每一个实验都是一次新发现,充满了期待和惊喜。
最后,谈谈收获。
提取到的血红蛋白可以用于多种研究,甚至是临床应用。
它帮助我们理解许多疾病,像贫血或氧合能力不足等。
科学的探索如同一场旅程,虽然艰辛,却能收获无数的知识和感动。
总之,血红蛋白的分离和提取是一个充满挑战的过程。
它需要耐心、技巧和对科学的热爱。
每一步都透着生命的力量。
通过这一过程,我们不仅了解了血红蛋白的奥秘,也感受到了科学的美妙与神奇。
探索的旅程从未止步,期待着下一次的发现与启迪。

血红蛋白的分离和提取血红蛋白是一种存在于红细胞中的重要蛋白质,它负责运输氧气到身体的各个部位。
对于血红蛋白的分离和提取,无论是在医学研究、疾病诊断还是生物技术领域,都具有重要的意义。
要进行血红蛋白的分离和提取,首先需要了解它的基本性质。
血红蛋白由珠蛋白和血红素组成,相对分子质量约为 64500,等电点在 7 左右。
准备工作是必不可少的。
我们需要新鲜的血液样本,通常可以从健康的志愿者或者实验动物身上获取。
采集到血液后,要尽快进行处理,以防止血红蛋白的变性和降解。
第一步是红细胞的分离。
将采集到的血液加入抗凝剂,如肝素或柠檬酸钠,然后通过离心的方法,将红细胞从血浆中分离出来。
离心的速度和时间需要根据具体情况进行调整,一般来说,以较低的转速离心一段时间,就可以使红细胞沉淀在离心管的底部。
得到红细胞后,接下来就是裂解红细胞以释放出血红蛋白。
常用的方法是低渗裂解法,将红细胞置于低渗溶液中,如蒸馏水,红细胞会因为吸水而膨胀破裂,释放出其中的内容物,包括血红蛋白。
然后是去除杂质。
裂解后的溶液中含有大量的其他细胞成分和杂质,需要通过过滤、离心等方法进行去除。
例如,可以再次离心,使较大的细胞碎片沉淀下来,然后取上清液。
接下来就是血红蛋白的初步分离。
常用的方法有盐析法。
向溶液中逐渐加入适量的中性盐,如硫酸铵,随着盐浓度的增加,蛋白质的溶解度会逐渐降低而沉淀出来。
不同的蛋白质在不同的盐浓度下沉淀,通过控制盐的浓度,可以初步分离出血红蛋白。
经过初步分离后,还需要进一步的纯化。
层析法是常用的手段之一。
比如凝胶过滤层析,根据蛋白质分子大小的不同进行分离;离子交换层析,依据蛋白质的带电性质差异来分离。
在分离和提取的过程中,要始终注意保持适当的温度、pH 值等条件。
温度过高或过低、pH 值不适宜都可能导致血红蛋白的变性和失活。
另外,实验过程中的操作要规范、细致,尽量减少人为因素造成的误差和损失。
例如,在转移溶液时要避免洒出,使用的仪器要经过严格的清洗和消毒。

血红蛋白的提取和分离教案教案一: 血红蛋白的提取和分离教学目标:- 理解血红蛋白的结构和功能。
- 学习血红蛋白的提取和分离方法。
- 掌握实验室中分离血红蛋白的步骤和操作技巧。
教学步骤:引入活动:在开始实验之前,首先向学生介绍血红蛋白的结构和功能,以及为什么需要提取和分离血红蛋白。
1. 血红蛋白的提取:a. 实验材料准备:- 鲜血样本- 磷酸缓冲溶液(pH 7.4)- 离心管- 离心机- 冷藏器b. 实验步骤:1) 将鲜血样本取出,用磷酸缓冲溶液稀释。
2) 将稀释后的样本置于离心管中,离心10分钟。
3) 将离心后的上清液转移至新的离心管中,置于冷藏器中。
2. 血红蛋白的分离:a. 实验材料准备:- 血红蛋白样本- 离心管- pH 4.7缓冲溶液- pH 5.2缓冲溶液- pH 6.0缓冲溶液- pH 7.0缓冲溶液b. 实验步骤:1) 将血红蛋白样本转移到离心管中。
2) 分别加入pH 4.7、pH 5.2、pH 6.0和pH 7.0缓冲溶液,使其达到不同的酸碱度。
3) 转动离心管,使其充分混合。
4) 将混合溶液置于冰箱中冷藏一段时间。
5) 通过离心,收集上层液体,然后分别加入酸、碱溶液,使其达到酸碱中和。
6) 重复以上步骤,直到获得纯净的血红蛋白。
实验注意事项:- 实验过程中要注意安全,佩戴实验室衣物和手套。
- 实验器材要严密封闭,避免反应物外泄。
- 实验后要彻底清理实验场地。
教学总结:通过本次实验,学生可以了解血红蛋白的结构和功能,并掌握了提取和分离血红蛋白的方法。
同时,学生也了解了实验室实验的注意事项和操作技巧。


血红蛋白提取和分离的四步血红蛋白是存在于人类血液中的一种重要蛋白质,它承担着将氧气从肺部输送到身体各个组织和器官的重要功能。
因此,对血红蛋白的提取和分离具有重要的生物学意义和医学应用前景。
接下来将介绍血红蛋白提取和分离的四个步骤。
第一步:血样采集首先需要采集含有血红蛋白的血样。
一般来说,静脉采血是最常用的方法。
在采集血样之前,需要确保采血器具干净无菌,以避免外部微生物的污染。
同时,还要确保采集到的血样足够新鲜,以保证血红蛋白的活性和稳定性。
第二步:红细胞裂解将采集到的血样进行红细胞裂解,将红细胞膜破坏,释放血红蛋白。
一般可以使用生理盐水等溶液进行红细胞裂解。
在裂解的过程中,需要注意温度和pH值的控制,以确保血红蛋白的完整性和稳定性。
第三步:血红蛋白提取在红细胞裂解后,血液中的血红蛋白被释放出来,需要进行进一步的提取。
常用的提取方法包括离心、凝胶过滤、离子交换层析等。
通过这些方法,可以将血红蛋白从其他蛋白质和杂质中分离出来,得到比较纯净的血红蛋白样品。
第四步:血红蛋白分离最后一步是对提取到的血红蛋白进行分离。
根据血红蛋白的性质和不同的应用需求,可以选择不同的分离方法。
例如,可以利用凝胶电泳、高效液相色谱等技术对血红蛋白进行分离和纯化。
通过这些方法,可以得到高纯度的血红蛋白样品,为后续的研究和应用提供基础。
通过以上四个步骤,我们可以完成血红蛋白的提取和分离工作。
这些工作不仅有助于深入了解血红蛋白的生物学功能和结构特性,还为相关疾病的诊断和治疗提供了重要的基础。
希望在未来的研究中,可以进一步完善血红蛋白提取和分离的技术,为人类健康事业做出更大的贡献。

细胞为材料,学习初步分离血红蛋白的方法。
样品处理及粗分离1.红细胞的洗涤洗涤红细胞的目的是去除杂蛋白,以利于后续步骤的分离纯化。
采集的血样要及时分离红细胞,分离时采用低速短时间离心,如500 r/min离心2 min,然后用胶头吸管吸出上层透明的黄色血浆,将下层暗红色的红细胞液体倒入烧杯,再加入五倍体积的生理盐水(质量分数为0.9%的NaCl溶液),缓慢搅拌10 min,低速短时间离心,如此重复洗涤三次,直至上清液不再呈现黄色,表明红细胞已洗涤干净。
❖为防止血液凝固,在采血容器中要预先加入抗凝血剂柠檬酸钠,比例是每100mL血液加入3.0g柠檬酸钠。
2.血红蛋白的释放将洗涤好的红细胞倒入烧杯中,加蒸馏水到原血液的体积,再加40%体积的甲苯,置于磁力搅拌器上充分搅拌10 min。
在蒸馏水和甲苯的作用下,红细胞破裂,释放出血红蛋白。
3.分离血红蛋白溶液将搅拌好的混合液转移到离心管中,以2000r/min的速度离心10min后,可以明显看到试管中的溶液分为4层(图5-18)。
从上往下数,第1层为无色透明的甲苯层,第2层为白色薄层固体,是脂溶性物质的沉淀层,第3层是红色透明液体,这是血红蛋白的水溶液,第4层是其他杂质的暗红色沉淀物。
将试管中的液体用滤纸过滤,除去脂溶性沉淀层,于分液漏斗中静置片刻后,分出下层的红色透明液体。
4.透析取1mL的血红蛋白溶液装入透析袋中,将透析袋放入盛有300 mL的物质的量浓度为20 mmol/L的磷酸缓冲液中(pH为7.0),透析12h。
❖透析袋一般是用硝酸纤维素(又称玻璃纸)制成的。
透析袋能使小分子自由进出,而将大分子保留在袋内。
透析可以去除样品中分子量较小的杂质,或用于更换样品的缓冲液。
凝胶色谱操作可以自己制作色谱柱,有条件的学校也可以直接购买商品色谱柱。
1.凝胶色谱柱的制作取长40 cm,内径为1.6 cm的玻璃管,两端磨平。
柱底部的制作方法如下(图5-19)。
首先选择适合封堵玻璃管口的橡皮塞,中间打孔,孔径大小要能够紧密插入0.5 mL的移液管。


血红蛋白的分离和提取在探索血红蛋白的分离和提取时,我们仿佛打开了一扇通往生命奥秘的大门。
血红蛋白,这个在我们体内默默工作的英雄,负责运送氧气,维持生命的火焰。
今天,我们就来深入探讨一下,如何从头到尾把它分离出来。
首先,了解血红蛋白的基本结构很重要。
它由四个亚基构成,每个亚基里都有一个铁离子,正是这个小小的铁离子让血红蛋白有了“吸氧”的能力。
嘿,想想看,这铁可是血液的灵魂。
我们提取它的第一步就是要把这些亚基给分开。
通常,我们使用盐析法。
这是一种古老却有效的方法。
简单来说,就是用不同浓度的盐水,使血液中的蛋白质沉淀下来。
盐的浓度高了,蛋白质就沉底了。
这个过程像是在筛选出珍珠,越是纯粹的成分,越容易浮出水面。
接下来,我们要进行离心。
听起来挺高大上的,其实就是把样品放进一个高速旋转的机器里。
你可以想象一下,像个旋转的过山车。
这样,重的成分会被甩到底部,而轻的成分则会悬浮在上面。
经过几轮离心,我们就能获得较为纯净的血红蛋白。
这一步确实需要耐心,毕竟急于求成可不行。
接着,我们还可以使用层析法。
这种方法就像在看一场精彩的魔术表演。
通过使用不同的色谱柱,血红蛋白会被分成不同的成分,层层剥离,最终呈现出它的真面目。
我们可以使用亲和层析或者离子交换层析,具体选择哪种方法,得看实际情况和目标而定。
无论怎样,成功提取的瞬间总是令人兴奋。
之后,我们必须验证提取的血红蛋白是否有效。
通常,我们会用紫外光谱法来测量它的吸收光谱,确保其波长符合标准。
这可不是马虎的事,稍有不慎,可能会错失重要的实验数据。
检查后,如果一切正常,那就可以进行后续的研究或应用了。
在这个过程中,温度和pH值的控制同样至关重要。
想想看,如果温度过高,蛋白质就会变性,失去活性。
这就像一朵美丽的花,失去了阳光和水分,最终枯萎。
保持适宜的环境条件,才能让我们的血红蛋白焕发活力。
总结来说,血红蛋白的分离和提取是一门复杂却充满乐趣的科学。
每一个环节都需要细致入微的操作,绝不能掉以轻心。
