离子方程式书写中常见错误例析
- 格式:doc
- 大小:63.00 KB
- 文档页数:7

离子方程式判断常见错误及原因分析专题
李新华
【期刊名称】《学苑教育》
【年(卷),期】2011(000)004
【摘要】错误原因:(1)违背反应客观事实。
如:Fe2O3与氢碘酸:Fe2O3+6H+=2Fe3++3H2O错因:忽视了Fe3+与I-发生氧化还原反应。
(2)违反质量守恒或电荷守恒定律及电子得失平衡。
如:FeCl2溶液中通Cl2:Fe2++
Cl2=Fe3+=2Cl-错因:电子得失不相等,离子电荷不守恒。
(3)化学式不能正确拆写。
如:NaOH溶液中通入HI:OH-+HI=H2O+I-错因:HI误认为弱酸。
【总页数】1页(P59-59)
【作者】李新华
【作者单位】宁夏中卫一中
【正文语种】中文
【中图分类】G633.8
【相关文献】
1.离子方程式正误判断试题中常见错误类型归纳 [J], 白俊杰
2.离子方程式常见错误的归纳 [J], 盛锡铭
3.离子方程式常见错误例析 [J], 王星元
4.离子方程式误判断——离子个数比的检查 [J], 祝辉
5.“离子共存”解题法应用——以“离子方程式正误判断”一题中物质少量、过量选项的辨析为例 [J], 张明;李占成
因版权原因,仅展示原文概要,查看原文内容请购买。

书写须知:一、难溶物不拆例l:向碳酸钙中加入过量盐酸。
错误:CO32- + 2H+= CO2 +H2O原因:CaCO3难溶于水,像BaSO4、.AgCl、Cu(0H)2、H2SiO3等在书写离子方程式时均不能拆开,应写成化学式.正确:CaCO3 + 2H+ = CO2 + Ca2+ + H2O二、微溶物作生成物不拆例2:向氯化钙溶液中加入硫酸钠溶液。
错误:该反应不能发生.原因:CaSO4是微溶物,像Ag2SO4、MgCO3、Ca(OH)2等微溶物,若作为生成物在书写离子方程式时均不能拆开,应写成化学式。
正确:SO42- + Ca2+ = CaSO4说明:微溶物作反应物,浓度较小时拆成离子式,浓度较大时应写成化学式。
三、弱电解质不拆‘.例3:向氯化铝溶液中加入过量氨水。
错误:Al3+ + 30H- = Al(0H)3原因:氨水为弱电解质,像H2O、HF、CH3COOH等弱电解质在书写离子方程式时均不能拆开,应写成化学式。
正确:Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+四、氧化物不拆例4:将氧化钠加入水中。
错误:O2- + H20 = 20H-原因:Na2O是氧化物,氧化物不论是否溶于水在书写离子方程式时均不能拆开,应写成化学式。
正确:Na2O + H2O = 2Na + + 20H-五、弱酸的酸式酸根不拆例5:向碳酸氢钠溶液中加入稀盐酸。
错误:2H+ + CO32- = CO2 + H2O原因.HCO3-是弱酸H2C03的酸式酸根,像HSO3-,、HS-、H2PO4-等离子在书写离子方程式时均不能拆开,应写成化学式。
正确:HCO3- + H+ = C02 + H20注意:对于强酸的酸式盐,如NaHSO4其阴离子在稀溶液中应拆开写成H+与SO42-形式,在浓溶液中不拆开,仍写成HSO4-。
六、固相反应不拆例6:将氯化铵固体与氢氧化钙固体混合加热。
错误:NH4+ + OH- = NH3 + H20原因:写离子反应的前提是在水溶液中或熔融状态下进行的反应,固体与固体的反应尽管是离子反应,只能写化学方程式,不写离子方程式。



判断离子方程式的正误的几个方面例1.下列离子方程式正确的是()A.钠投入硫酸铜溶液中:2Na+Cu2+==Cu+2Na+B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+C.稀盐酸中加入铁粉:2Fe+6H+==2Fe3++3H2↑D.CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO2-4+2OH-+Ba2+===BaSO4↓+Cu(OH)2↓【解析】A项不符合事实,Na要先与水反应,生成的NaOH再与CuSO4反应,无Cu析出同,A 项错;向CaCl2溶液中通入CO2,H2CO3是弱酸,HCl是强酸,弱酸不能制强酸,故不发生反应,B选项错误;铁和稀盐酸的反应产物为Fe2+,应写为Fe+2H+==Fe2++H2↑,C项错;D项,生成两种沉淀,正确。
【答案】D例2.能正确表示下列反应的离子方程式是()A.NaHCO3与NaOH溶液作用:H++OH−=H2OB.CO2通入石灰乳中:Ca2++2OH−+CO2===CaCO3↓+H2OC.金属钠和水反应:2Na+2H2O=2Na++2OH−+H2↑D.硅酸钠溶液与醋酸溶液混合:SiO2-3+2H+==H2SiO3↓【解析】离子方程式书写的正误判断至少应注意以下三个方面:(1)反应本身是否符合反应实际;(2)反应是否遵循质量守恒、元素守恒和电荷守恒;(3)离子或分子的符号是否遵循书写规律。
A.NaHCO3在水中电离生成钠离子和碳酸氢根离子,反应的离子方程式为:HCO−3+OH−=CO2−3+H2O,选项A错误;B.CO2通入石灰乳中生成碳酸钙沉淀,石灰乳应该保留化学式,正确写法为:Ca(OH)2+CO2=CaCO3+H2O,故B错误;D.醋酸是弱电解质,不能拆写。
故选C。
【答案】C例3.下列离子方程式正确的是()A.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO−3=Fe3++2H2O+NO↑B.0.01mol·L−1 NH4Al(SO4)2溶液与0.02mol·L−1 Ba(OH)2溶液等体积混合:NH+4+Al3++2SO2-4 +2Ba2++4OH−==2BaSO4↓+Al(OH)3↓+NH3·H2OC.溴化钠溶液与氯气反应:Br−+Cl2=Cl−+Br2D.钠与水反应:Na++2H2O=Na++2OH−+H2↑【解析】A中离子方程式电荷不守恒,3Fe2++4H++NO−3=3Fe3++2H2O+NO↑,是错误的;B中反应物的物质的量之比为1∶2,将所有的离子按量写出来:NH+4+Al3++2SO2-4+2Ba2++4OH−,分析量的关系发现它们恰好完全反应,生成2BaSO4↓+Al(OH)3↓+NH3·H2O,故B正确;C中原子不守恒,应是2Br−+Cl2=2Cl−+Br2,故C错误;D.钠离子与水也不反应,该离子方程式电荷也不守恒,应是2Na+2H2O=2Na++2OH−+H2↑,故D错误。

例析条件型离子方程式的书写方法作者:胡建树来源:《广东教育·高中》2013年第01期离子方程式的书写及正误判断在每年高考试题中屡见不鲜,是高考试题中的一棵常青树。
其中条件型离子方程式是一个重点,更是一个难点。
所谓条件型离子方程式是指在一个或多个条件下书写的离子方程式,常考查的有过量型,定量型,目标型等。
笔者对该题型进行分析归纳,针对不同类型提出不同的有效书写方法,供大家参考。
一、过量型离子方程式的书写该类型的特点是题干中常出现“少量”、“过量”、“足量”等条件。
应对策略采用定“1”规则,即把不足的物质定为1,该物质中参与反应的各离子按化学式组成比例全部反应,而过量(足量)的物质溶液中的离子(分子)可取任意值来确定系数。
【例1】向NaHCO3溶液中加入少量Ba(OH)2溶液时反应的离子方程式为;向NaHCO3溶液中加入过量Ba(OH)2溶液时反应的离子方程式为。
分析:这是典型的过量型离子方程式的书写,把少量的Ba(OH)2定为1,电离的Ba2+和OH-全部反应且符合组成比例1Ba2++2OH-,反应消耗[2HCO3][-],即Ba2++2OH-+[2HCO3][-]=2H2O+[CO3][2-]+BaCO3↓。
把少量的NaHCO3定为1,电离的[1HCO3][-]只消耗1OH-,即[HCO3][-]+OH-+Ba2+=H2O+BaCO3↓答案:Ba2++2OH-+[2HCO3][-]=2H2O+[CO3][2-]+BaCO3↓[HCO3][-]+OH-+Ba2+=H2O+BaCO3↓总结:这种酸式盐与碱反应的考查还有NaHCO3与Ca(OH)2,Ca(HCO3)2与NaOH,NaHSO4与Ba(OH)2几种。
【例2】向FeBr2溶液中通入少量Cl2时反应的离子方程式为;向FeBr2溶液中通入过量Cl2时反应的离子方程式。
分析:Cl2能氧化Fe2+,也能氧化Br-,由于还原性Fe2+>Br-,则Fe2+先被氧化,Br-后被氧化。
备战2023年高考化学二轮复习精讲精练第五专题 离子方程式的正误判断离子反应和氧化还原反应是“化学巨人”的两条腿,要想化学行而致远,则我们必须学好离子反应和氧化还原反应。
掌握离子方程式的书写方法及正误判断,是离子反应的核心。
高考对本专题内容的考查不均,其中离子共存和离子方程式的正误判断考查频率较低,而离子方程式的书写每年必考,但不单独命题,而是分散在非选择题中的某个设问中,题目位置不固定,内容上多以书写信息型离子方程式为主,体现出新课标对化学学习能力和学科素养的重视。
但是,离子方程式正误判断题型是训练离子反应知识点的最好素材。
掌握离子方程式的书写方法及正误判断,初步掌握离子大量共存的判断方法,促进证据推理与模型认知化学核心素养的发展。
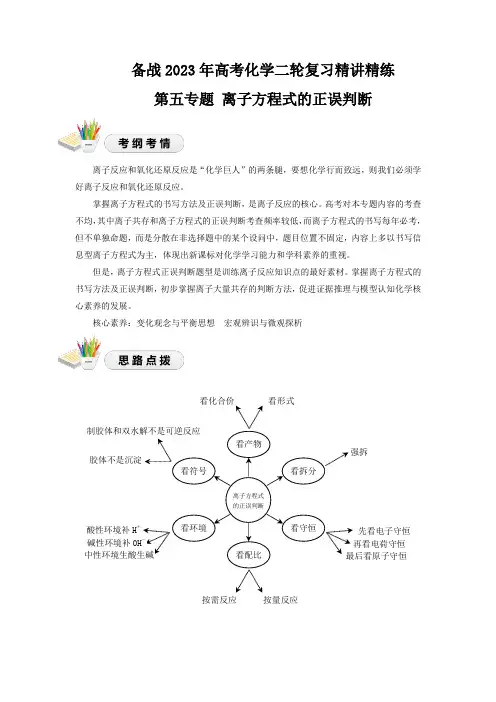
核心素养:变化观念与平衡思想 宏观辨识与微观探析看守恒 离子方程式的正误判断 看环境 看产物看拆分看配比 看符号看形式 看化合价强拆 按量反应 按需反应 先看电子守恒 再看电荷守恒 最后看原子守恒酸性环境补H +碱性环境补OH -中性环境生酸生碱 胶体不是沉淀制胶体和双水解不是可逆反应1.看产物。
① 产物化合价记忆:变价金属:Fe 、FeO 、FeS 、Fe 2O 3、Fe 3O 4、Fe(OH)3、Cu 2O ;非氧化性酸:稀HCl 、稀H 2SO 4;氧化性酸:浓HNO 3、稀HNO 3、浓H 2SO 4、HClO ;还原性酸:浓HCl 、HI 、H 2S ;② 产物形式记忆:NH +4与OH -反应,浓碱或加热均生成NH 3和H 2O 。
例1.请同学们判断下列离子方程式是否正确。
a .浓盐酸与铁屑反应:2Fe +6H +=2Fe 3++3H 2↑( )b .钠与CuSO 4溶液反应:2Na +Cu 2+=Cu↓+2Na + ( )c .浓硝酸中加入过量铁粉并加热:Fe +3NO -3+6H +=Fe 3++3NO 2↑+3H 2O ( )d .硫化亚铁溶于稀硝酸中:FeS +2H +=Fe 2++H 2S↑( )e .Fe(OH)3溶于氢碘酸:Fe(OH)3 +3H +=Fe 3++3H 2O ( )f .次氯酸钙溶液中通入过量的二氧化硫气体:ClO -+H 2O +SO 2=HSO -3+HClO ( )g .NH 4HCO 3溶于过量的浓KOH 溶液中:NH +4+ HCO -3+2OH -=CO 2-3+NH 3↑+2H 2O ( )答案:a .(×)b .(×)c .(×)d .(×)e .(×)f .(×)g .(√)解析:a .不能生成Fe 3+,生成Fe 2+。

一、离子方程式离子方程式书写的基本规律要求。
(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“=”“ ”“→”“↑”“↓”等符号符合实际。
(4)两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
(5)明类型:依据离子反应原理,分清类型,总结方法技巧。
(6)检查细:结合书写离子方程式过程中易出现的错误,细心检查。
二、离子共存1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN -、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
*(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+ 3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。


离子方程式的书写及正误判断是中学化学的重点及难点,也是每年高考的热点。
离子方程式的书写及正误判断经常涉及到关于一种物质的少量和过量问题,这就更增加了书写离子方程式的难度,常常使学生对这类型的题目望而生畏。
现根据教学经验谈谈化学反应在什么条件下存在量的问题并分类讨论这类与量有关的离子方程式书写的技巧:一、中和类反应1.存在范围一般一元酸或碱与二元碱或酸反应时,酸碱用量的多少会使反应结果不同,离子方程式的书写也就不同。
但一元与一元酸碱或二元与二元酸碱反应物之间一般按物质的量1:1反应,不存在量多量少的问题。
如HCl溶液与NaOH溶液反应,H2SO4溶液与Ba(OH)2溶液反应与反应物的用量没关系,均按计量数1:1反应。
2.书写技巧例1:CO2通入到NaOH溶液中(CO2在水溶液中可考虑为H2CO3)。
若H2CO3少量:以H2CO3为基准,将H2CO3前面计量数定为1,让H2CO3尽可能充分参与反应,量多的NaOH根据H2CO3反应的需要将前面计量数确定为2,故反应方程式为CO2(少量)+2NaOH=== Na2CO3+ H2O;离子方程式为CO2(少量)+2OH-=== CO32-+ H2O;若H2CO3过量:以NaOH为基准,将NaOH前面计量数定为1,让NaOH尽可能充分参与反应,量多的H2CO3根据NaOH反应的需要将前面计量数确定为1,故反应方程式为CO2+NaOH(少量)=== NaHCO3;离子方程式为CO2+OH-(少量)=== HCO3-。
根据此类反应的特点得出以下结论: CO2通入到碱性溶液中,CO2少量生成正盐,CO2过量则生成酸式盐。
3.应用推广①将SO2通入到澄清的Ca(OH)2溶液中(SO2作为酸性氧化物时性质类似于CO2)SO2(少量)+ Ca 2++2OH-=== CaSO3↓+H2O;SO2(过量)+ OH-=== HSO3-。
②将CO2通入到Ca(ClO)2溶液中CO2(少量)+ H2O+Ca 2++2ClO-=== CaCO3↓+2HClOCO2(过量)+ H2O +ClO-=== HCO3-+ HClO③HCl溶液与Na2CO3溶液反应酸碱质子理论认为,凡是给出质子(H+)的物质都是酸,能接受质子的物质都是碱。

离子方程式的正误例析湖北省汉川市第一高级中学鲁志超离子方程式的书写步骤并不太复杂:就是写(写化学方程式)、改(易溶且易电离的物质改写成离子形式)、删(删去没有参加反应的离子)、查(检查是否配平、计量数是否为最简整数比)。
关键是第二步的把握,特别是对微溶物的处理:如果微溶物为产物,当沉淀处理;如果微溶物为反应物,要看是浊液还是溶液。
如果为浊液,如石灰乳,应该写化学式;如果是溶液,如澄清石灰水,应该改写成离子形式。
判断一个离子方程式是否正确的依据是:①是否符合事实。
②是否配平。
配平的依据是原子守恒和电荷守恒(双守恒)。
③是否漏写难溶、难电离、易挥发的产物。
④是否拆错了物质。
一般说来,出现在离子方程式中的,应该是物质的主要存在形式。
如果物质易溶且易电离,那么它在溶液中完全电离,以离子形式存在,因此拆成离子形式;如果是沉淀,难电离的物质,它们主要以分子或者固体的形式存在,因而写化学式。
⑤反应物或产物的配比是否正确。
⑥非溶液中的离子反应无离子方程式。
下面我们来分析一下几个具体的错误离子方程式的例子:(1)铝片跟NaOH (aq):Al+2OH-=AlO+H2↑(电荷不守恒。
正确的为:2Al+2OH-+2H2O =2AlO+3H2↑)(2)MgSO4 (aq)+Ba(OH)2 (aq):SO+ Ba2+= BaSO4↓(漏掉了Mg(OH)2沉淀。
正确的为:Mg2++SO+ Ba2++2OH-= BaSO4↓+Mg(OH)2↓)(3)CaCO3 + CH3COOH (aq):CaCO3 + 2CH3COOH = Ca2++2CH3COO-+H2O(未查,漏掉了产物CO2。
正确的为:CaCO3 + 2CH3COOH = Ca2++2CH3COO-+H2O+CO2↑)(4)Fe +HCl (aq):2Fe +6H+ = 2Fe3+ + 3H2↑(不合事实。
正确的为:Fe+2H+=Fe2++H2↑)(5)石灰乳中加Na2CO3 (aq):Ca2++ CO= CaCO3↓(微溶物的处理不当。
专题一、离子方程式的书写和正误判断【例1】(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式。
答案(1)SO2-4+2H++2OH-+Ba2+===BaSO4↓+2H2O(2)Ba2++SO2-4===BaSO4↓解析(1)Na+不参加反应,溶液呈中性时,HSO-4中的H+与Ba(OH)2中的OH-皆无剩余:2H++SO2-4+Ba2++2OH-===2H2O+BaSO4↓。
(2)上面所得中性溶液,实为Na2SO4(aq),继续滴加Ba(OH)2(aq)发生以下反应:Ba2++SO2-4===BaSO4↓。
该题类型为给定条件的离子方程式的书写,NaHSO4===Na++H++SO2-4、Ba(OH)2===Ba2++2OH-。
欲使NaHSO4溶液呈中性,只需将其中H+恰好中和即可。
而此时溶液中SO2-4显然过量,反应的离子方程式为:2H++SO2-4+Ba2++2OH-===BaSO4↓+2H2O。
由这一离子方程式可见,溶液中的SO2-4只反应了一半,当继续滴加Ba(OH)2时,发生以下反应:SO2-4+Ba2+===BaSO4↓。
【变式训练】(1)思考下列反应的离子方程式:①在NaHSO4溶液中加过量的Ba(OH)2溶液②Ba(OH)2溶液中加入过量的NaHSO4溶液提示①两溶液混合后,H+与OH-、SO2-4与Ba2+反应,由于NaHSO4少量,所以参与反应的H+与SO2-4的化学计量数之比为1∶1,故参与反应的OH-与Ba2+个数比也为1∶1:H++SO2-4+OH-+Ba2+===H2O+BaSO4↓。
②Ba(OH)2溶液不足时,Ba2+与OH-按物质的量之比为1∶2参加反应:Ba2++2OH-+2H++SO2-4===BaSO4↓+2H2O。
(2)①NaHCO3和Ba(OH)2两种固体中,________属于盐类,________属于碱类,将二者分别溶于水,其电离方程式分别为____________________,____________________。
离子反应易错点1:离子方程式正误判断的常见误区[典例剖析]1. 下列离子方程式中正确的是A.铁与CuSO4溶液反应:Fe+Cu2+=Fe3++CuB.小苏打与NaOH溶液反应:HCO3-+OH-=CO2↑+H2OC.CaCl2溶液与 KHCO3溶液混合:Ca2++CO32-=CaCO3↓D.CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH -+Ba2+=BaSO4↓+Cu(OH)2↓或C[错因分析错选B项是主观臆断,误认为HCO3-与OH-反应生成CO2;错选C项是拆写不正确导致误判。
A、B项不符合实际情况,电荷也不守恒,正确的离子方程式分别为Fe+Cu2+=Fe2++Cu、HCO3-+OH-=H2O+CO32;C项中CaCl2与 KHCO3不反应,故C项错误。
√正解D易错点津误区1 主观臆断,不符合反应的客观事实。
书写离子方程式与书写化学方程式一样,必须以客观事实为依据,不可主观臆造不存在的产物或反应。
如铁与稀硫酸反应的离子方程式不能写成2Fe+6H+=2Fe3++3H2↑,因为二者反应时只能生成 Fe2+;反应Cu+2H+=Cu2++H2↑是错误的,因为在金属活动性顺序中铜排在氢后面,不能置换出酸中的氢。
误区2 化学式的拆分不当。
难溶于水的物质、单质、氧化物和气体必须写化学式。
例如,将CaCO3与稀盐酸反应的离子方程式写为 Ca2++CO32-+2H++2C1-=CaCl2+H2O+CO2↑,是错误的,因为CaCO3是难溶物,不能写成离子形式,而CaCl2是易溶、易电离的物质,必须写成离子形式,因此正确的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。
误区3 没有注意反应物的用量或滴加顺序,错写生成物。
同样的反应物,若用量不同或滴加顺序不同,则生成物可能不同,因此离子方程式也可能不同。
例如,向澄清石灰水中通入少量CO2(生成CaCO3),正确的离子方程式为Ca+2OH-+CO2=CaCO3↓+H2O;若通入过量CO2[生成易溶、易电离的Ca(HCO3)2],则正确的离子方程式为OH-+CO2=HCO3-。
怎样正确书写离子方程式陕西省靖边中学张耀锋离子方程式的书写及其正误判断是中学化学的重难点,也是高考的热点。
现对该知识点进行总结,以供学生学习和教师教学参考。
一、离子反应的前提是要看是否在溶液中进行离子反应是在溶液中或熔融状态时进行的反应,亦即没有自由移动离子参加的反应,不能写离子方程式。
如实验室用NH4Cl 和Ca(OH)2固体混合加热制NH3,虽然也有离子参加反应,但不能写离子方程式,只能写化学方程式。
即2 NH4Cl + Ca(OH)2=CaCl2+ 2NH3↑+ 2H2O二、要遵循客观事实如:2Fe + 6H+ = 2Fe3+ + 3H2↑是错误的,因H+为弱氧化剂,只能将Fe 氧化为Fe2+。
三、反应体系中参与反应的微粒的化学表达式是否拆写1、强酸、强碱和可溶性盐应写成离子形式2、单质、氧化物、气体、弱酸(HF、 H2S、 HClO、 H2SO3)弱碱(NH3·H2O)等难电离的物质,难溶于水的物质[CaCO3、 BaSO3、FeS、 BaSO4、Fe(OH)3]必须写成化学式。
3、多元弱酸的酸式酸根离子不能拆开写如:NaHCO3溶液与 H2SO4反应:HCO3- + H+ = SO2↑+H2O4、对微溶物的处理,有三种情况:(1)在生成物中有微溶物析出时,用化学式表示:如:Na2SO4溶液中加入AgNO3溶液: 2Ag+ + SO42- = Ag2SO4↓(2)在反应物中有微溶物处于溶液状态(稀溶液),应写成离子形式:如:CO2通入澄清石灰水中:CO2+ Ca2+ +2OH- = CaCO3↓+ H2O(3)在反应物中有微溶物处于悬浊液或固态时,应写成化学式;如:石灰乳与纯碱反应: Ca(OH)2 + CO32- = CaCO3↓+ 2OH-四、书写要完整如向H2SO4溶液中加入 Ba(OH)2溶液,将其离子方程式写为Ba2+ + SO42- =BaSO4↓或 H+ + OH- =H2O都是不完整的。
非常道Җ㊀甘肃㊀石兴龙㊀㊀在高中化学离子反应 教学和高考复习中,常要借助教材中 部分酸㊁碱和盐的溶解性表(室温) (以下简称 表 )中物质溶解性书写离子方程式,从学生平时练习和考前检测中常出现的错误可以看出,学生在使用 表 时常感到困惑,出现了不少问题.现以近几年部分高考选择题解答为例,进行问题讨论,点评小结,让学生明晰产生错误的原因,以减少问题的发生.1㊀应用物质溶解性书写离子方程式1 1㊀注意微溶物处理例1㊀下列离子方程式书写是否正确(㊀㊀).(2017年浙江卷)澄清石灰水中通入过量C O 2:C O 2+OH -=H C O -3.分析㊀澄清石灰水中微溶物C a (O H )2电离成C a2+和OH -,书写离子方程式时要改写成离子.通入少量C O 2离子方程式为C a 2++2O H -+C O 2=C a C O 3ˌ+H 2O ;通入过量C O 2时,C O 2与H 2O ㊁C O 2-3反应生成H C O -3,使c (C O 2-3)减小,C a C O 3沉淀溶解平衡移动,生成能溶于水的C a (H C O 3)2,离子方程式为C O 2+OH -=H C O -3,该离子方程式正确.B a (O H )2溶液通入少量㊁足量C O 2㊁S O 2的离子方程式写法与本题相似.教材中的 表 显示M g C O 3㊁C a S O 4㊁A g 2S O 4是微溶物,如纯碱溶液中滴入氯化镁溶液,离子方程式为M g 2++C O 2-3=M g C O 3ˌ;硫酸钠溶液加入澄清石灰水,离子方程式为C a 2++S O 2-4=C a S O 4ˌ;硝酸银溶液中加入硫酸钾溶液,离子方程式为2A g ++S O 2-4=A g 2S O 4ˌ.表 中没有列出的物质(如M g S O 3㊁P b C l 2㊁H g 2S O 4)也是微溶物,一些没有列出或说明溶解性的(如C a (H C O 3)2㊁C a (H S O 3)2㊁B a (H C O 3)2㊁B a (H S O 3)2㊁磷酸氢盐(除B a H P O 4㊁C a H P O 4)㊁磷酸二氢盐等能溶于水),这些物质的溶解性在书写离子方程式时要注意学习应用.写离子方程式时,反应物中微溶物的澄清溶液要改写成离子,悬浊液写化学式,生成物中的微溶物写化学式;如果弱酸酸式盐溶于水,要改写成离子,但弱酸酸式酸根不能拆写;强酸酸式盐(如N a H S O 4)在水中完全溶解电离,要拆写成离子(N a +㊁H +㊁S O 2-4).1 2㊀注意难溶物沉淀转化例2㊀下列离子方程式书写是否正确(㊀㊀).(2018年江苏卷)饱和N a 2C O 3溶液与C a S O 4固体反应:C O 2-3+C a S O 4=C a C O 3+S O 2-4.分析㊀C a C O 3是难溶物,C a S O 4是微溶物,结合C a 2+能力:C O 2-3>S O 2-4,使c (C a 2+)和c (C O 2-3)减小,促使微溶物C a S O 4沉淀溶解平衡移动,生成难溶的C a C O 3,离子方程式为:C O 2-3+C a S O 4=C a C O 3+S O 2-4,反应前后均出现微溶物或难溶物,不标ˌ,该离子方程式正确.相似的离子反应有,向F e C l 3溶液中加入M g (O H )2:3M g (O H )2+2F e 3+=2F e (O H )3+3M g 2+.反应中M g (O H )2和F e (O H )3都是难溶物,但K s p [F e (O H )3]更小,F e (O H )3溶解性更小,所以生成更难溶的F e (O H )3.C a 2+㊁M g 2+的碳酸氢盐与碱溶液(如澄清石灰水㊁B a (O H )2等)也会发生沉淀转化,产物与碱的用量有关.如M g (H C O 3)2溶液加入少量石灰水:M g 2++2OH -=M g (O H )2ˌ;M g (H C O 3)2溶液加入足量石灰水虽有M g C O 3微溶物生成,但在O H -足量时转化为M g (O H )2;比较K s p 大小,M g (O H )2㊁C a C O 3比M g C O 3更难溶㊁更稳定,所以离子方程式为M g 2++2H C O -3+2C a 2++4O H -=M g (O H )2ˌ+2C a C O 3ˌ+2H 2O.C a (H C O 3)2溶液中加入少量B a (O H )2溶液:C a 2++2H C O -3+B a 2++2O H -=C a C O 3ˌ+B a C O 3ˌ+2H 2O ;C a (H C O 3)2溶液加入足量B a (O H )2溶液:B a 2++H C O -3+OH -=B a C O 3ˌ+H 2O.B a 2+过量时,主要生成B a C O 3沉淀.表 中没有列出或说明的除含K +㊁N a +㊁N H +4的硅酸盐㊁亚硫酸盐㊁硫化物㊁磷酸盐能溶于水外,其他金属离子的盐大多难溶于水,这些物质的溶解性,在学习中要逐步掌握应用.应用 表 时要把 表 中标 不 的物质理解为难 ,因难溶物在水中存在沉淀溶解平衡,溶解量虽少,但总能溶解一部分,要把物质溶解性大小与碱性强弱㊁电解质强弱区分开来.如在 表 中标 不 的76非常道M g (O H )2,难溶于水,事实上M g (OH )2是中强碱,也是强电解质; 表 中标 不 的B a C O 3㊁B a S O 4等难溶物,虽难溶于水,但都是强电解质.若反应中出现几种难溶物,要考虑沉淀溶解平衡移动和沉淀转化,依据物质在常温下水中溶度积常数K s p 来比较溶解性大小,K s p 越小,溶解性越小.2㊀水解反应的离子方程式书写2 1㊀注意水解规律的应用例3㊀下列反应的离子方程式是否正确(㊀㊀).(2019年天津卷)向沸水中滴加饱和氯化铁溶液得到红褐色液体:F e 3++3H 2O=F e (O H )3+3H +.分析㊀F e (O H )3是难溶物,含F e 3+的可溶性强酸盐溶液水解显弱酸性,p H<7,存在水解平衡,受热水解反应加剧,形成胶体,两边用 ә连接,离子方程式为F e 3++3H 2O әF e (O H )3(胶体)+3H +,该离子方程式错误.明矾净水原理为A l 3++3H 2O⇌A l (O H )3(胶体)+3H +.含C O 2-3㊁S O 2-3㊁P O 3-4㊁H P O 2-4可溶性强碱盐溶液水解显弱碱性,主要以第一步为主,两边用 ⇌连接;如N a 2C O 3溶液中C O 2-3水解,分步写为C O2-3+H 2O⇌H C O -3+O H -,H C O -3+H 2O ⇌H 2C O 3+O H -,由此可判断出N a 2C O 3溶液中离子种类和浓度大小.含H C O -3㊁H 2P O -4的可溶性强碱盐溶液中存在微弱水解和电离,水解程度大于电离程度,溶液显弱碱性,p H>7,离子方程式写法相似;但H S O -3可溶性强碱盐溶液显弱酸性,因溶液中H S O -3的电离程度大于水解程度.表 中没有列出N a 2S ㊁K 2S ㊁B a S ㊁C a S 在水溶液中易水解,放出有毒H2S 气体,要注意密封保存.含弱碱根㊁弱酸根或弱酸酸式根离子的可溶性盐在溶液中发生水解,水参加反应,离子方程式两边用 ⇌ 连接;书写时注意水解规律(如谁强显谁性㊁越弱越水解㊁越热越水解)应用.2 2㊀注意溶液中发生的双水解反应例4㊀下列反应的离子方程式是否正确(㊀㊀).(2017年海南卷)向硫酸铝溶液中滴加碳酸钠溶液:2A l 3++3C O 2-3=A l 2(C O 3)3ˌ.分析㊀C O 2-3是二元弱酸根,与A l 3+在溶液中发生双水解反应:2A l 3++3C O 2-3+3H 2O =2A l (O H )3ˌ+3C O 2ʏ,双水解较为彻底,用 = 连接,沉淀标ˌ,气体标ʏ,该离子方程式错误.表 中标 - 的含F e 3+㊁F e 2+㊁A l 3+㊁C O 2-3或H C O -3的盐在溶液中发生双水解;在 表 中没有列出的(N H 4)2S ,在溶液中发生双水解,放出N H 3和有毒H 2S 气体,取用时要注意密封保存. 表 中标 - 的含C u 2+与C O 2-3的盐在溶液中既生成沉淀,又发生水解;生成沉淀:C u 2++C O 2-3=C u C O 3ˌ;发生双水解:C u 2++C O 2-3+H 2O =C u (O H )2ˌ+C O 2ʏ,总反应为2C u 2++2C O 2-3+H 2O=C u 2(O H )2C O 3ˌ+C O 2ʏ. 表 中标 - 的金属阳离子(如H g +㊁H g 2+㊁A g +)与O H -反应,产物不稳定,发生分解.如A g +与O H -生成白色沉淀,能短暂存在,久置分解成棕褐色A g 2O ,离子方程式为A g ++O H -=A g OHˌ,2A g O H=A g 2O+H 2O.含弱碱根㊁弱酸根或弱酸酸式根离子组成的盐在溶液中发生双水解反应,反应较为彻底,仍用 = 连接,沉淀标ˌ,气体标ʏ,H 2O 参加反应,不能漏写.3㊀反应物浓度、性质影响反应产物的离子方程式书写例5㊀下列反应的离子方程式是否正确(㊀㊀).(2019年天津卷)氧化亚铁溶于稀HN O 3:F e O+2H +=F e 2++H 2O.分析㊀H N O 3表现酸性和氧化性,稀HN O 3被还原,放出无色N O 气体,浓H N O 3被还原,放出红棕色N O 2气体;F e O 溶于稀H N O 3㊁浓H N O 3离子方程式分别为3F e O+10H ++N O -3=3F e 3++N Oʏ+5H 2O ,F e O+4H ++N O -3=F e 3++N O 2ʏ+2H 2O ,该离子方程式错误.随浓度增大,H N O 3的氧化性增强,HN O 3的性质如强氧化性㊁不稳定性㊁挥发性都是考试的热点,要引起重视.在 表 中盐酸㊁碳酸㊁硝酸用 溶㊁挥 标示,但要根据具体性质理解应用.把浓盐酸㊁浓硝酸试剂瓶盖打开,瓶口出现 白雾 ,说明具有挥发性;盐酸挥发放出H C l 气体,盐酸要密封低温保存;实际反应中C O 2-3与少量H +反应生成H C O -3,与足量H +反应生成不稳定的H 2C O 3,挥发放出的是H 2C O 3分解后的C O 2;HN O 3见光或受热易分解,实际上硝酸挥发气体成分中有HN O 3蒸气㊁N O 或N O2气体,硝酸要密封低温避光保存.受反应物浓度㊁性质影响,反应现象㊁生成物也会发生变化;书写时注意元素化合物性质知识的应用;涉及氧化还原反应,书写时注意检查是否符合 三守恒 规律.86非常道4㊀反应物用量影响反应产物的离子方程书写例6㊀下列反应的离子方程式是否正确(㊀㊀).(2020年浙江卷)(N H 4)2F e (S O 4)2溶液与少量B a (O H )2溶液反应:S O 2-4+B a 2+=B a S O 4ˌ.分析㊀(N H 4)2F e (S O 4)2溶于水,完全电离,与少量B a (O H )2溶液反应:F e 2++S O 2-4+Ba 2++2O H -=B a S O 4ˌ+F e (O H )2ˌ;与足量B a (O H )2溶液反应时,O H -与N H +4生成N H 3 H 2O :2NH +4+F e 2++2S O 2-4+2B a 2++4O H -=2B a S O 4ˌ+F e (O H )2ˌ+2N H 3 H 2O ,该离子方程式错误.N H +4与O H -的反应产物,在 表 中用 溶㊁挥 标示.实际上N H+4与足量O H -反应,稀溶液中产物主要是N H 3 H 2O ,浓度很大或加热时挥发放出的是N H 3,标ʏ.含A l3+的可溶性盐溶液与含O H -的碱溶液反应,生成 表 中标 不 的难溶物A l (O H )3,实际反应与O H -量有关.O H -少量时,生成物为A l (O H )3,当O H -过量时,A l (O H )3发生酸式电离,生成偏铝酸盐而溶解;A l (O H )3与强酸发生碱式电离,生成铝酸盐而溶解,表现两性[Z n (O H )2性质与A l (O H )3相似,也表现两性].A l (O H )3难溶于弱酸(如H 2C O 3)㊁弱碱(如N H 3 H 2O ),可用于制取A l (O H )3,分解后的A l 2O 3,在熔融状态电解得到金属A l .一些特殊的离子反应与用量有关,虽然 表 中没有列出或标示,但在学习中要注意掌握应用.如A g +㊁C u 2+与浓氨水,A g O H ㊁C u (O H )2溶于过量浓氨水发生配位反应,生成[A g (N H 3)2]+和[C u (N H 3)4]2+,产物与氨水浓度和用量有关.书写与量有关的离子方程式,把少量反应物化学计量数设定为 1,再判定另一种足量反应物化学计量数;拆写时,注意反应物用量㊁反应现象和产物对应关系;与量有关的氧化还原反应,注意强先弱后规律应用.5㊀相同类型反应的离子方程式书写例7㊀下列反应的离子方程式是否正确(㊀㊀).(2017年江苏卷)向氢氧化钡溶液加入稀硫酸:B a 2++O H -+H ++S O 2-4=B a S O 4ˌ+H 2O.分析㊀反应中O H -㊁H +和H 2O 计量数都是2,但B a 2+㊁S O 2-4㊁B a S O 4计量数是1,不能将2约去,离子方程式应写为B a 2++2O H -+2H ++S O 2-4=B a S O 4ˌ+2H 2O ,该离子方程式错误.若N a H S O 4溶液中滴入B a (O H )2溶液反应至中和B a 2++2O H -+2H ++S O 2-4=B a S O 4ˌ+2H 2O ;N a H S O 4溶液中滴入B a (O H )2溶液至S O 2-4完全沉淀,O H -过量,应写为B a 2++OH -+H ++S O 2-4=B a S O 4ˌ+H 2O.含B a 2+和S O 2-4可溶性盐反应生成 表 中标 不 的难溶物B a S O 4,可用B a C l 2㊁B a (N O 3)2溶液与N a 2S O 4或K 2S O 4溶液反应,也可用B a (O H )2溶液与稀H 2S O 4㊁B a (O H )2溶液与N a H S O 4或K H S O 4溶液反应生成.同样,N a H C O 3溶液中加入足量B a (O H )2溶液反应㊁B a (H C O 3)2溶液中加入少量N a O H 溶液反应的离子方程式相同,都写为H C O -3+B a 2++O H -=B a C O 3ˌ+H 2O.N a H C O 3溶液中加入足量的澄清石灰水㊁C a (H C O 3)2溶液中加入少量Na O H 溶液反应的离子方程式相同,都为H C O -3+C a 2++O H -=C a C O 3ˌ+H 2O.含B a 2+和C O 2-3可溶性盐反应生成 表 中标 不 的难溶物B a C O 3,可采用N a 2C O 3㊁K 2C O 3溶液与B a C l 2或B a (N O 3)2溶液反应生成,也可采用N a H C O 3溶液与B a (O H )2溶液反应生成.生成难溶物C a C O 3的方法与此相似.不同反应物交换离子成分,虽反应物用量不同,但产物㊁离子方程式相同,书写时灵活应用表 ,注意反应物用量与产物对应关系.对离子反应方程式相同的离子反应,可写出反应物不同的化学方程式.生产中可应用物质性质设计出制取某种物质的可行途径.学生进入高中化学学习阶段,教材内容拓展加深,要掌握的知识点多,而现行高中化学实验教材中表 的内容少,有些物质的溶解性在 表 中没有标示或说明,需要在平时进一步学习掌握.学生在使用 表 书写离子方程式时既要参考,又不能依赖,更不能照搬,要结合所掌握知识,灵活应用;不仅要比较反应物质溶解性差异,还要具体分析判断参加反应物质的不同浓度㊁用量㊁性质㊁反应现象等;要仔细拆写,掌握规律方法,平时多练习体会,提高准确率,以避免或减少问题的发生.(作者单位:甘肃省高台县第一中学)96。
离子方程式书写中常见错误例析离子方程式是基本化学用语之一,它的书写与正误辨析是中学阶段学生应掌握的一种基本技能。
通过对离子方程式的正误判断,不仅能考查学生对离子方程式书写规则的掌握情况,对物质性质的氧化还原性、溶解性、电解质的强弱等知识的熟悉程度,而且也能考查分析判断、迅速作出选择的解题能力,因而也是会考、高考的“热点”。
下面对离子方程式书写中常见错误例析如下:1、将生成物写错例1:把金属铁放入稀硫酸中。
错:2Fe+6H+=2Fe3++3H2↑析:稀硫酸中H+只能表现弱氧化性,只能使铁氧化成Fe2+(其它非氧化性强酸同此)。
正:Fe+2H+=Fe2++H2↑(其它非氧化性强酸同此)。
例2:向碳酸氢镁溶液中加入石灰水。
错:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3+2H2O析:因Mg(OH)2比MgCO3更难溶。
正:Mg2++2HCO3-+2Ca2++4OH-=CaCO3↓+Mg(OH)2↓+2H2O(同理长时间加热碳酸氢镁溶液为Mg2++2HCO3-Mg(OH)2↓+2CO2↑)。
例3:向次氯酸钙溶液中通入SO2气体。
错:Ca2++2ClO-+H2O+SO2=CaSO3+3HClO析:ClO-具有强氧化性,能将SO2氧化成SO42-或H2SO4。
正:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++SO42-+2Cl-例4:苯酚钠溶液中通入二氧化碳。
错:2C6H5O-+CO2+H2O=2C6H5OH+CO32-析:产物C6H5OH和CO因反应而不能共存。
正:C6H5O-+CO2+H2O=C6H5OH+HCO3-例5:钠投入到CuSO4溶液中。
错:2Na+Cu2+=2Na++Cu析:由于钠与水反应很剧烈,所以钠先与水反应;产物NaOH又继续与CuSO4反应。
两反应相加即得。
正:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑2、电解质的拆写不合理例1:醋酸与氢氧化钠溶液反应。
错:H++OH-=H2O析:醋酸是弱酸,为难电离物质,在溶液中的主要存在形式为CH3COOH分子,不该拆。
正:CH3COOH+OH-=H2O+CH3COO-例2:碳酸氢钙溶液跟盐酸反应。
错:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑析:Ca(HCO3)2为可溶性盐,在溶液中的主要存在形式为对应离子,该拆。
正:HCO3-+H+=H2O+CO2↑例3:硫化氢气体通入到醋酸铅溶液中。
错:Pb2++2CH3COO-+H2S=PbS↓+2CH3COOH析:醋酸铅虽为可溶性盐,但难电离。
正:(CH3COO)2Pb+H2S=PbS↓+2CH3COOH3、微溶物处理不当例1:将CO2通入足量澄清石灰水中。
错:Ca(OH)2+CO2=CaCO3↓+H2O析:澄清石灰水中Ca(OH)2为离子形式,该拆。
正:Ca2++2OH-+CO2=CaCO3↓+H2O例2:将Na2CO3溶液加入到石灰乳中。
错:Ca2++CO32-=CaCO3↓析:石灰乳中氢氧化钙主要为分子形式,不该拆。
正:Ca(OH)2+CO32-=CaCO3↓+2OH-4、电荷不守恒例1:铜片插入硝酸银溶液。
错:Cu+Ag+=Cu2++Ag正:Cu+2Ag+=Cu2++2Ag例2:氯化亚铁液溶中通入氯气。
错:Fe2++Cl2=Fe3++2Cl-正:2Fe2++Cl2=2Fe3++2Cl-5、电子不守恒例:酸性高锰酸钾溶液中加入双氧水。
错:2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10H2O析:此反应中化合价变化为:Mn+7→+2得5e,H2O2中20-1→0失2e,依电子守恒即得。
正:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O6、错约方程式中物质系数例:稀硫酸和氢氧化钡溶液反应。
错:H++SO42-+Ba2++OH-=BaSO4↓+H2O正:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O7、遗漏离子反应例1;碳酸氢铵溶液中加入氢氧化钠溶液。
错:NH4++OH-=NH3·H2O或HCO3-+OH-=CO32-+H2O析:两个反应同时发生正:NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O例2:硫酸铜中加入氢氧化钡溶液。
错:Ba2++SO42-=BaSO4↓或Cu2++2OH-=Cu(OH)2↓析:两个反应同时发生,正:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓8、错将非离子反应或通常不用离子反应表示的反应写成离子反应例1:铜与浓硫酸共热。
错:Cu+4H++SO42-Cu2++SO2↑+2H2O析:因浓硫酸中水很少,硫酸及产物CuSO4主要也应以分子形式存在。
正:Cu+2H2SO4CuSO4+SO2↑+2H2O例2:氯化铵与消石灰粉末混合共热制氨气。
错:NH4++OH-NH3↑+H2O析:此反应不在溶液中进行。
正:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O(此外中学常见的还有:实验室制CH4、HCl、O2)9、忽视了反应条件对反应的影响例1:0.1mol/L的NH4Cl溶液与稀NaOH溶液常温下反应。
错:NH4++OH-=NH3↑+H2O析:NH3极易溶于水,常温时主要生成难电离的NH3·H2O,受热时(或浓溶液)才会分解生成NH3和H2O。
正:NH4++OH-=NH3·H2O例2:在饱和碳酸钠溶液中通入足量CO2气体错:CO32-+H2O+CO2=2HCO3-析:因NaHCO3的溶解度比Na2CO3的小,且水减少,所以NaHCO3析出。
正:2Na++CO32-+H2O+CO2=2NaHCO3↓10、错判反应物间用量关系例1:向碳酸氢钙溶液中加入足量NaOH溶液。
错:Ca2++HCO3-+OH-=CaCO3↓+H2O析:此反应实质为先中和(HCO3-+OH-=H2O+CO32-)后沉淀(Ca2++CO32-=CaCO3↓),按着少量物质的需要(符合化学式配比),来确定另一物质中实际参加反应的离子的量,最后配平即可。
正:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-例2:向Na2CO3溶液中滴加几滴稀盐酸.错:CO32-+2H+=CO2↑+H2O析:CO32-与H+首先生成HCO3-,H+过量时才生成CO2。
正:CO32-+H+=HCO3-例3:向明矾溶液中滴加Ba(OH)2溶液至SO42-恰好完全沉淀。
错:Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓。
析:首先该反应中Al3+和SO42-物质的量之比为1∶2,SO42-恰好完全沉淀时,Al3+和OH-的物质的量之比为1∶4,产物离子为AlO2-。
正:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O例4:在标准状况下,将2.24LCl2通入2L0.1mol/L的FeBr2溶液中。
错:3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl-析:此反应中Cl2不足量,又由于还原性Fe2+>Br-,所以Fe2+优先反应。
正:Cl2+2Fe2+=2Fe3++2Cl-(与量有关的反应还有很多,望大家依以上分析方法去“悟”)。
11、忽视了电解反应中水的来源例1:石墨阳极铁阴极电解饱和NaCl溶液。
错:2H++2Cl-H2↑+Cl2↑析:在阴极放电的H+来自于H2O的电离,H2O为弱电解质,不该拆正:2H2O+2Cl-H2↑+Cl2↑+2OH-例2:惰性电极电解AgNO3溶液。
错:4Ag++4OH-4Ag+O2↑+2H2O析:在阳极放电的OH-来自于H2O的电离,H2O为弱电解质,不该拆正:4Ag++2H2O4Ag+O2↑+4H+12、不能正确使用“↑”和“↓”符号。
例1:硫氢化钠水解。
错:①HS-+H2O H2S↑+OH-或②HS-+H2O H3O++S2-析:①弱离子水解程度很小,生成的H2S不能逸出;②为电离式。
正:HS-+H2O H2S+2OH-例2:硫化钠水解。
错:S2-+2H2O H2S↑+2OH-析:多元弱酸根分步水解且第一步水解为主。
正:S2-+H2O HS-↑+OH-例3:向沸水中逐滴加入氯化铁溶液。
错:Fe3++3H2O Fe(OH)3↓+3H+析:此时得到的为Fe(OH)3↓胶体溶液,胶体是透明的。
正:Fe3++3H2O Fe(OH)3(胶体)+3H+13、不能正确使用“=”和“”例1:氯化铵溶于水。
错:NH4++H2O=NH3·H2O+H+析:因水解程度小,所以为可逆的。
正:NH4++OH-NH3·H2O例2:向饱和碳酸氢钠溶液中滴加氯化铝溶液。
错:3HCO3-+Al3+Al(OH)3↓+3CO2↑析:HCO3-和Al3+是相互促进的水解反应,能够进行到底,应用等号。
正:3HCO3-+Al3+=Al(OH)3↓+3CO2↑14、错将不能发生的反应写出例1:将H2S气体通入硫酸亚铁溶液中。
错:H2S+Fe2+=FeS↓+2H+析:FeS能溶于稀硫酸,即此反应的逆反应能迅速发生,所以此反应不能发生。
15、忽视了隐含反应例1:氧化铁粉末与氢碘酸反应。
错:Fe2O3+6H+=2Fe3++3H2O析:忽视了反应生成的Fe3+与I-能发生氧化还原反应。
正:Fe2O3+6H++2I-=2Fe2++3H2O+I2例2:SO2气体通入到硝酸钡溶液中。
错:Ba2++H2O+SO2=BaSO3↓+2H+析:因通入SO2气体后溶液呈酸性,此时溶液中又有NO3-,溶液的氧化性增强,所以生成的沉淀为BaSO4而不是BaSO3。
正:3Ba2++2H2O+2SO2+2NO3-=3BaSO4↓+4H++2NO↑通过以上例子,告诉我们在书写和判断离子方程式时,必须注意以下几点:第一,遵循客观事实,据物质的性质与反应条件,准确把握反应实质。
第二,书与与判断的关键:据该物质在反应体系中的主要存在形式来决定写成离子形式还是写成分子形式;熟记物质的溶解性、电离情况及常见气体和氧化物。
第三,是否满足三个“守恒”:(1)质量守恒;(2)电荷守恒;(3)电子守恒(是氧化还原反应的)。
第四,“↑”“↓”“=”“”使用是否正确。
第五,书写和判断与量有关离子方程式时,要按“以少定多”的原则,即按照少量物质中实际参加反应的离子在化学式中的配比来确定过量物质有关离子的量。