第九章分子结构
- 格式:pdf
- 大小:109.76 KB
- 文档页数:3

第九章分子结构(9-2)(1)如果分子构型为直线形,其中心原子有可能为sp杂化,也有可能为sp3d 杂化(中心原子共有五对价电子),因此HgCb中Hg以sp杂化轨道与配位原子Cl成键。
(2)正四面体构型的分子或离子,其中心原子只可能为sp3杂化。
SiF4中Si 以SP3杂化成键。
(3)平面三角形构型的分子或离子,中心原子为sp2杂化。
BCI3中B以sp2杂化轨道成键。
sp3不等性杂化轨道成键,并具有(4)三角锥形的分子或离子,其中心原子以一对孤对电子,NF3正是这种情形。
(5)V形分子或离子的中心原子有可能是sp2杂化(只有一对孤对电子)或sp3 杂化(有2对孤对电子)。
画出N02-的点式结构,N上只有一对孤对电子,所以NO2中N为sp2杂化轨道成键。
*解答本题时,只是从中心原子的杂化轨道类型、孤对电子数与分子(或离子)空间构型的关系入手,并没有直接运用价层电子对互斥理论;也可以从分子构型和中心原子的成键特征来确定中心原子的杂化轨道。
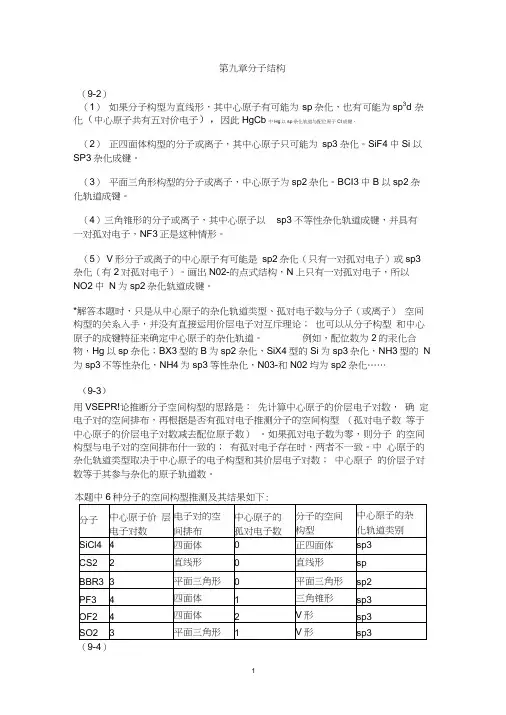
例如,配位数为2的汞化合物,Hg以sp杂化;BX3型的B为sp2杂化,SiX4型的Si为sp3杂化,NH3型的N 为sp3不等性杂化,NH4为sp3等性杂化,N03-和N02均为sp2杂化……(9-3)用VSEPR!论推断分子空间构型的思路是:先计算中心原子的价层电子对数,确定电子对的空间排布,再根据是否有孤对电子推测分子的空间构型(孤对电子数等于中心原子的价层电子对数减去配位原子数)。
如果孤对电子数为零,则分子的空间构型与电子对的空间排布什一致的;有孤对电子存在时,两者不一致。
中心原子的杂化轨道类型取决于中心原子的电子构型和其价层电子对数;中心原子的价层子对数等于其参与杂化的原子轨道数。
本题中6种分子的空间构型推测及其结果如下:本题的解题思路与上题相同。
不同之处在于如何计算离子的中心原子的价层电子对数,请见内容要点部分。
这里再补充d轨道参与的杂化。
7种离子的空间构型的推测用及其结果如下:自行完成(9-5 )和(9-6 )两个习题,应用VSEPR!论推测分子或离子构型时1几何构型为T形的分子或离子,其中心原子的价层电子对数应为5,配位原子数应为3。


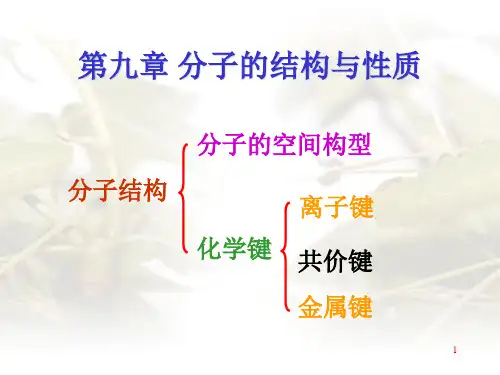
第九章 分子结构∙教学基本要求∙⑴熟悉化学键的分类,熟悉共价键的价键理论的基本要点、共价键的特征和类型。
⑵熟悉杂化轨道的概念和类型,能用杂化轨道理论解释简单分子或原子离子的几何构型。
⑶了解价层电子对互斥理论的要点以及用该理论推测简单分子或多原子离子的几何构型的方 法。
⑷了解分子轨道的概念以及第二周期同核双原子分子的能级图和电子在分子轨道中的分布,推 测其磁性和稳定性。
⑸了解键能、键长、键角、键级等键参数的概念,熟悉键的极性和分子的极性。
∙重点内容概要∙在通常条件下,各种物质都以分子或晶体的形式存在。
分子或晶体中相邻原子间的强烈吸引作用叫做化学键。
化学键的类型有共价键、离子键和金属键。
本章主要讨论共价键、分子的空间构型。
1.价键理论价键理论的基本要点是:①在成键原子间要有旋转方式相反的未成对价电子进行配对成键;②形成共价键的原子轨道要进行最大重叠,成键原子间电子出现的概率密度愈大,形成的共价 键愈牢固。
根据上述基本要点可以知道共价键具有饱和性和方向性。
可以从不同的角度考虑将共价键进行分类。
根据原子轨道重叠方式的不同, 可以把共价键分为s 键和p 键。
两个原子轨道沿核间连线方向以“头碰头”的方式进行同号重叠所形成的共价键为s 键。
两个原子轨道垂直于核间连线相互平行以 “肩并肩” 的形式进行同号重叠所形成的共价键称为p 键。
根据共用电子对来源的不同,可将由一个原子提供电子对所形成的共价键归类为配位键。
根据共价键有无极性可将其分为极性键和非极性键。
例如,在 CO 分子中形成三个共价键,C 和 O 的电负性不同形成的共价键为极性键;C 有一个 空轨道,O 有一孤对电子,可形成一个配位键;如果 C 与 O 沿x 轴成键, x p 轨道具有s 对称性, 故 x x p p - 键为s 键,而 y p 与 y p , z p 与 z p 所形成的键则为p 键。
2.杂化轨道理论分子的空间构型是讨论分子结构理论的重要内容之一。


第九章双原子分子结构与化学键理论第九章双原子分子结构与化学键理论(下)主要讲述了双原子分子的能量和电子结构,包括分子轨道理论和离化能。
在双原子分子中,原子间的相互作用将导致分子的结合和分裂,这种作用被称为化学键。
分子轨道理论被用来描述能量和电子结构,而离化能则是用来度量化学键的强度。
分子轨道理论是基于量子力学的。
在这个理论中,分子中的原子轨道将组合成分子轨道,这些分子轨道可以是成键轨道或反键轨道。
成键轨道具有较低的能量,而反键轨道具有较高的能量。
当原子轨道重叠时,将形成成键电子密度,从而使分子稳定。
分子轨道的数量与原子轨道的数量相等,分子轨道可以用波函数来描述,这些波函数可以用来计算分子的性质。
离化能是指将一个电子从一个原子中移动到另一个原子中所需的能量。
离化能越大,说明化学键越强。
离化能的大小取决于分子的电子结构和分子大小。
较小的分子通常具有较大的离化能,因为它们的电子云更接近核心,更难离开。
在分子轨道理论中,键的强度可以通过排斥能来衡量。
排斥能是指电子间的相互斥力,它越大,表示键越强。
排斥能的大小取决于成键和反键电子的数量和能量。
本章还介绍了氢分子离子(H2+)和氢分子(H2)的结构和能量。
在氢分子离子中,一个原子损失了一个电子,形成一个正离子和一个负离子。
在氢分子中,两个氢原子共用一个电子,形成化学键。
此外,本章还包括分子的振动和旋转以及分子光谱学。
分子的振动是指分子中原子之间相对于它们的平衡位置的周期性运动。
分子的旋转是指分子以其轴心为中心的旋转运动。
分子光谱学是研究分子吸收和发射光的过程。
总的来说,本章通过双原子分子的能量和电子结构、分子轨道理论和离化能的介绍,深入讲述了双原子分子的结构和化学键的理论基础。
并且讨论了分子的振动、旋转和分子光谱学,为后续的分子结构和化学键理论的学习打下了基础。