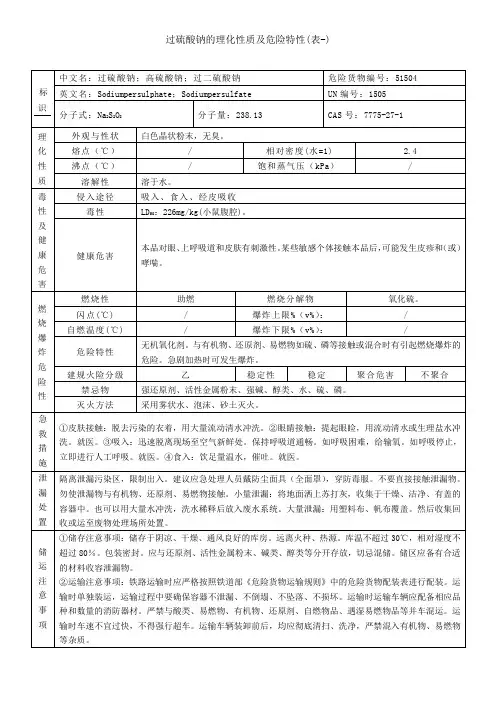
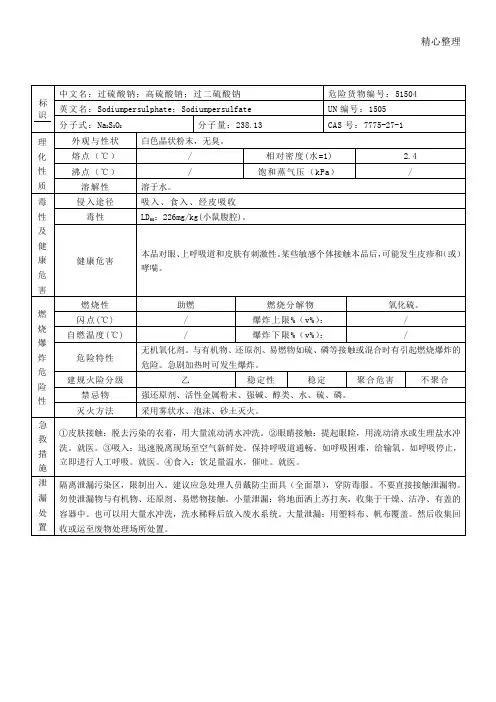
过硫酸钠的理化性质及危险特性 表
- 格式:docx
- 大小:14.15 KB
- 文档页数:2

硫酸钠危险化学品安全技术说明书第一部分化学品名称化学品中文名称:硫酸钠化学品英文名称:sodium sulfate,anhydrous中文名称:无水芒硝英文名称:技术说明书编码:1330CAS No.:7757-82-6第三部分危险性概述危险性类别:侵入途径:健康危害:对眼睛和皮肤有刺激作用。
基本无毒。
环境危害:对环境有危害,对大气可造成污染。
燃爆危险:本品不燃,具刺激性。
第四部分急救措施皮肤接触:脱去污染的衣着,用大量流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
吸入:脱离现场至空气新鲜处。
如呼吸困难,给输氧。
就医。
食入:饮足量温水,催吐。
就医。
第五部分消防措施危险特性:未有特殊的燃烧爆炸特性。
受高热分解产生有毒的硫化物烟气。
有害燃烧产物:硫化物。
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。
灭火时尽可能将容器从火场移至空旷处。
第六部分泄漏应急处理应急处理:隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,置于袋中转移至安全场所。
若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
第七部分操作处置与储存操作注意事项:密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。
避免产生粉尘。
避免与酸类接触。
搬运时轻装轻卸,防止包装破损。
配备泄漏应急处理设备。
倒空的容器可能残留有害物。

硫化钠理化特性表硫化钠是一种常见的化学物质,它的理化特性广泛应用于许多领域。
本文将以3000字的篇幅介绍硫化钠的理化特性,以期帮助读者更好地了解和应用这种物质。
首先,让我们来了解硫化钠的物理性质。
硫化钠是一种无色结晶固体,其晶体结构属于立方晶系。
它的密度约为1.856 g/cm³,熔点约为1183°C,沸点约为1689°C。
硫化钠在常温下是稳定的,不易与空气中的氧气和水蒸气反应,但在高温下会分解释放出有刺激性气味的硫化氢气体。
硫化钠在水中具有良好的溶解性,每100克水可溶解121克硫化钠。
这种溶液呈碱性,pH值约为11。
当溶液浓度较高时,硫化钠呈现浑浊的外观,这是由于与水反应产生的硫化氢气体产生沉淀。
在化学反应方面,硫化钠具有一些重要的特性。
它是一种强还原剂,可以与许多金属离子发生反应,生成相应的硫化物沉淀。
例如,当硫化钠与锌离子反应时,会生成黑色的锌硫化物:2Na2S + Zn2+ → ZnS + 2Na+ + S2-硫化钠也可以与一些非金属元素反应,例如与氧气反应生成硫酸钠和硫化氢气体:2Na2S + 3O2 → 2Na2SO4 + 2H2S此外,硫化钠还被广泛应用于制备其他化合物。
例如,它可以用于制备二硫化碳,这是一种重要的有机溶剂和化学中间体。
硫化钠与二氧化碳反应可以制备碳酸钠,这是一种常用的工业化学品。
在工业领域,硫化钠也有许多应用。
其中最常见的是作为皮革工业的脱毛剂。
由于硫化钠的强还原性和碱性,可以帮助去除动物皮革中的毛发,并与蛋白质发生反应,从而改善皮革品质。
此外,硫化钠还被广泛应用于制备硫酸钠、次氯酸钠和酒石酸钠等化学品。
它还可用作铂盐和金盐的显色试剂,用于检测和分析金属离子的存在。
最后,还需要注意的是,由于硫化钠具有一定的腐蚀性和毒性,使用时需要注意安全操作。
避免与皮肤接触,避免吸入其粉尘或气体,切勿食用。
总之,硫化钠是一种在化学领域广泛应用的物质,它具有一些重要的理化特性。

目录5.1类氧化剂过氧化氢的理化性质及危险特性(表-) (1)过氧化钠的理化性质及危险特性(表-) (2)高氯酸[含酸50%~72%]的理化性质和危险特性(表-) (3)高氯酸钠的理化性质和危险特性(表-) (4)氯酸钠的理化性质和危险特性(表-) (5)氯酸钾的理化性质和危险特性(表-) (6)亚氯酸钠的理化性质及危险特性(表-) (7)高锰酸钠的理化性质及危险特性(表-) (8)高锰酸钾的理化性质及危险特性(表-) (9)硝酸钠的理化性质及危险特性(表-) (10)硝酸钾的理化性质和危险特性(表-)............. 错误!未定义书签。
硝酸钙的理化性质和危险特性(表-) . (12)硝酸锶的理化性质和危险特性(表-) (13)硝酸钡的理化性质及危险特性(表-) (14)硝酸锌的理化性质和危险特性(表-) (15)硝酸银的理化性质及危险特性(表-) (17)硝酸铅的理化性质及危险特性(表-) (18)亚硝酸钾的理化性质及危险特性(表-) (19)过(二)碳酸钠的理化性质及危险特性(表-) (20)过硫酸铵的理化性质及危险特性(表-) (21)过硫酸钾的理化性质及危险特性(表-) (23)过硼酸钠的理化性质及危险特性(表-) (24)漂白粉的理化性质及危险特性(表-) (25)溴酸钠的理化性质和危险特性(表-) (26)溴酸钾的理化性质和危险特性(表-) (27)高碘酸的理化性质和危险特性(表-) (28)高碘酸钠的理化性质和危险特性(表-) (29)高碘酸钾的理化性质和危险特性(表-) (30)碘酸钠的理化性质和危险特性(表-) (31)碘酸钾的理化性质和危险特性(表-) (32)三氧化铬[无水]的理化性质及危险特性(表-) (33)重铬酸钾的理化性质及危险特性(表-) (34)硝酸镁的理化性质和危险特性(表-) (35)硝酸铁的理化性质和危险特性(表-) (36)硝酸镍的理化性质和危险特性(表-) (37)硝酸钴的理化性质及危险特性(表-) (38)硝酸铝的理化性质和危险特性(表-) (39)硝酸锰的理化性质和危险特性(表-) (40)硝酸铜的理化性质和危险特性(表-) (41)硝酸铋的理化性质和危险特性(表-) (42)硝酸镧的理化性质和危险特性(表-) (43)硝酸铈铵的理化性质和危险特性(表-) (45)亚硝酸钠的理化性质及危险特性(表-) (46)氧化银的理化性质及危险特性(表-) (47)5.2类有机过氧化物过氧化二异丙苯[含量>42%,带有惰性固体]的理化性质和危险特性(表-)48 过氧化(二)苯甲酰[77%<含量<95%,含水]的理化性质和危险特性(表-) 49 过氧化乙酸的理化性质及危险特性(表-) (50)高氯酸[含酸50%~72%]的理化性质和危险特性(表-)高氯酸钠的理化性质和危险特性(表-)氯酸钠的理化性质和危险特性(表-)亚氯酸钠的理化性质及危险特性(表-)硝酸钠的理化性质及危险特性(表-)硝酸银的理化性质及危险特性(表-)过硼酸钠的理化性质及危险特性(表-)溴酸钠的理化性质和危险特性(表-)重铬酸钾的理化性质及危险特性(表-)硝酸钴的理化性质及危险特性(表-)氧化银的理化性质及危险特性(表-)。


过硫酸钠的化验方法
1. 理化性质,过硫酸钠是白色结晶性固体,在空气中稳定,但
易受潮。
它可以溶解在水中,生成过硫酸根离子和钠离子。
这些性
质可以帮助我们进行化验。
2. 硫酸根离子的检测,过硫酸钠中含有硫酸根离子(SO4^2-)。
我们可以使用硝酸银溶液进行检测,加入硝酸银溶液后会生成白色
的硫酸银沉淀,从而确认硫酸根离子的存在。
3. 过氧化氢的检测,过硫酸钠在水溶液中可以分解产生过氧化氢。
我们可以使用含有铁离子的铁离子试剂来检测过氧化氢的生成,加入铁离子试剂后,如果出现蓝色或紫色的变化,则可以确认过硫
酸钠中存在过氧化氢。
4. 漂白性质,过硫酸钠常被用作漂白剂,可以将其与染料或有
机物混合,观察其漂白效果来确认其纯度和活性。
5. 安全注意事项,在进行化验过程中,需要注意过硫酸钠的腐
蚀性和氧化性,避免与有机物或易燃物质接触,避免产生有毒气体。
总的来说,过硫酸钠的化验方法包括对硫酸根离子和过氧化氢的检测,以及观察其漂白性质,同时需要严格遵守安全操作规程。
希望以上回答能够全面地解答你的问题。




过硫酸钠相对原子质量
过硫酸钠的化学式为Na2S2O8,根据化学元素的相对原子质量,我们可以计算过硫酸钠的相对原子质量。
首先,我们需要查找每个
元素的相对原子质量。
钠的相对原子质量约为22.99,硫的相对原
子质量约为32.07,氧的相对原子质量约为16.00。
然后,我们将每个元素的相对原子质量乘以其在分子中的个数,并将结果相加。
对于过硫酸钠(Na2S2O8),钠的相对原子质量为22.99,硫的相对原子质量为32.07,氧的相对原子质量为16.00。
因此,过硫酸钠的相对原子质量为22.992 + 32.072 + 16.008 = 46.00 + 64.14 + 128.00 = 238.14。
因此,过硫酸钠的相对原子质量约为238.14。
这个值可以帮助
化学家在实验室中准确地计量和使用过硫酸钠,以及在化学方程式
中进行平衡和计算反应物和生成物的质量。
硫酸钠的理化性质
硫酸钠〔Na₂SO₄〕是硫酸根与钠离子化合生成的盐,硫酸钠溶于水且其水溶液呈弱碱性,溶于甘油而不溶于乙醇。
无机化合物,十水合硫酸钠又名芒硝、高纯度、颗粒细的无水物称为元明粉,暴露于空气容易吸水生成十水合硫酸钠,十水合硫酸钠俗称芒硝。
元明粉,白色、无臭、有苦味的结晶或粉末,有吸湿性。
单斜晶系,晶体短柱状,集合体呈致密块状或皮壳状等,无色透明,有时带浅黄或绿色,易溶于水。
外形为白色、无臭、有苦味的结晶或粉末,有吸湿性。
外形为无色、透明、大的结晶或颗粒性小结晶。
硫酸钠是含氧酸的强酸强碱盐。
硫酸钠溶液为无色溶液。
熔点884℃〔七水合物于℃转无水,十水合物为℃〕沸点1404℃,相对密度cm3,热力学函数〔,100Pa〕,不溶于乙醇,溶于水,溶于甘油。
稳定,不溶于强酸、铝、镁,吸湿。
暴露于空气中易吸湿成为含水硫酸钠。
241℃时转变成六方型结晶。
高纯度、颗粒细的无水物称为元明粉。
极易溶于水。
有凉感。
味清凉而带咸。
在潮湿空气中易水化,转变成粉末状含水硫酸钠覆盖于外表。
无水芒硝产于含硫酸钠卤水的盐湖中,与芒硝、钙芒硝、泻利盐、白钠镁矾、石膏、盐镁芒硝、石盐、泡碱等共生;也可由芒硝脱水而成;火山喷气孔周围有少量产出。