等效平衡原理及规律.
- 格式:ppt
- 大小:47.50 KB
- 文档页数:3
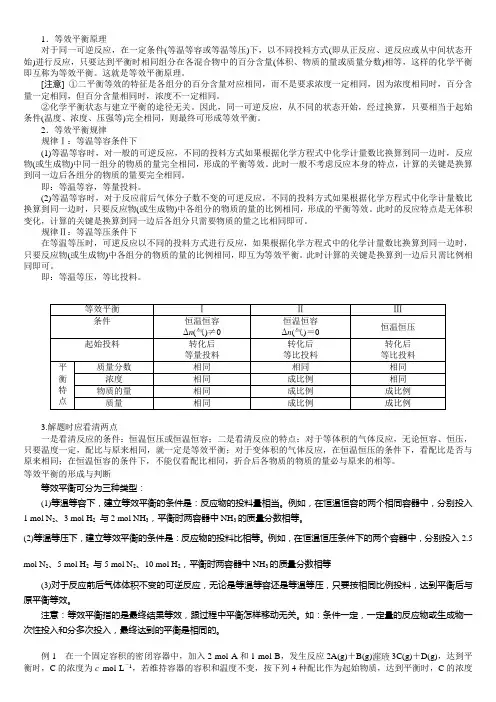
1.等效平衡原理对于同一可逆反应,在一定条件(等温等容或等温等压)下,以不同投料方式(即从正反应、逆反应或从中间状态开始)进行反应,只要达到平衡时相同组分在各混合物中的百分含量(体积、物质的量或质量分数)相等,这样的化学平衡即互称为等效平衡。
这就是等效平衡原理。
[注意] ①二平衡等效的特征是各组分的百分含量对应相同,而不是要求浓度一定相同,因为浓度相同时,百分含量一定相同,但百分含量相同时,浓度不一定相同。
②化学平衡状态与建立平衡的途径无关。
因此,同一可逆反应,从不同的状态开始,经过换算,只要相当于起始条件(温度、浓度、压强等)完全相同,则最终可形成等效平衡。
2.等效平衡规律规律Ⅰ:等温等容条件下(1)等温等容时,对一般的可逆反应,不同的投料方式如果根据化学方程式中化学计量数比换算到同一边时,反应物(或生成物)中同一组分的物质的量完全相同,形成的平衡等效。
此时一般不考虑反应本身的特点,计算的关键是换算到同一边后各组分的物质的量要完全相同。
即:等温等容,等量投料。
(2)等温等容时,对于反应前后气体分子数不变的可逆反应,不同的投料方式如果根据化学方程式中化学计量数比换算到同一边时,只要反应物(或生成物)中各组分的物质的量的比例相同,形成的平衡等效。
此时的反应特点是无体积变化,计算的关键是换算到同一边后各组分只需要物质的量之比相同即可。
规律Ⅱ:等温等压条件下在等温等压时,可逆反应以不同的投料方式进行反应,如果根据化学方程式中的化学计量数比换算到同一边时,只要反应物(或生成物)中各组分的物质的量的比例相同,即互为等效平衡。
此时计算的关键是换算到一边后只需比例相同即可。
即:等温等压,等比投料。
3.解题时应看清两点一是看清反应的条件:恒温恒压或恒温恒容;二是看清反应的特点:对于等体积的气体反应,无论恒容、恒压,只要温度一定,配比与原来相同,就一定是等效平衡;对于变体积的气体反应,在恒温恒压的条件下,看配比是否与原来相同;在恒温恒容的条件下,不能仅看配比相同,折合后各物质的物质的量必与原来的相等。

等效平衡(1)概念:在一定条件下,同一可逆反应的两个不同的起始状态(一般是各组分起始加入量不同)分别达到平衡时,同种组分的含量都相同,这样的两个平衡叫等效平衡。
(2)规律:①对于一般的可逆反应,在定温定容的条件下,只改变起始时加入物质的物质的量,若通过可逆反应的化学计量数比例换算成同一半边的物质的物质的量(终态假设)与原平衡相同,这样的平衡就是等效平衡。
②在定温定容的条件上,对于反应前后气体分子数不变的可逆反应,只要反应物(生成物)的物质的量的比例与原平衡相同,两平衡即是等效平衡。
③在同温同压条件下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
等效平衡相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,达到平衡时,任何相同物质的含量(体积分数、质量分数或物质的量分数)都相同的化学平衡互称等效平衡。
可分为“全等效”平衡和“相似等效”平衡。
判断等效平衡的方法:使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的数量是否相当。
在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,起始时加入物质的物质的量不同,达平衡时的状态规律如下表:1.在定T、V条件下,对于反应前后气体体积改变的反应:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
2.在定T、V条件下,对于反应前后气体体积不变的反应:只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
二、恒温恒压(定T、P)的等效平衡在定T、P条件下:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量之比。
即:对于反应前后气体体积发生变化的可逆反应而言,恒容容器中要想达到同一平衡状态,投料量必须相同;恒压容器中要想达到同一平衡状态,投料量可以不同,但投入的比例得相同。

等效平衡原理及规律总结1. 什么是等效平衡原理?等效平衡原理,听起来是不是有点高大上?其实它的意思就是把复杂的事情简化,找到两者之间的平衡点,就像我们平常说的“各取所需”。
咱们生活中常常会遇到这样的情况,比如说,朋友之间互相借东西,彼此之间都希望能够不亏。
这个原则在科学、经济甚至人际关系中都能找到身影。
1.1 这个原理在科学里是怎么用的呢?我们常常看到物理公式,比如力、能量这些东西,都是在寻找一种平衡状态。
就好比一辆车在行驶时,前后、左右的力要均衡,不然可就容易翻车了。
1.2 在经济学上,等效平衡原理也大显身手。
市场供需关系就是个经典案例,需求上去了,价格就跟着涨,供给上去了,价格又会掉。
人们在这场“博弈”中追求一种心理上的平衡,就像玩游戏,必须找准自己的位置才能赢。
2. 等效平衡的应用实例说到这儿,大家可能会问,这个原理具体应用在哪儿呢?别急,我这就给你讲几个生动的例子。
2.1 比如说,家庭日常开支。
大家都知道,家庭开支就像是一个大锅,锅里要放什么材料,放多少,得讲究讲究。
如果每个月工资都用来吃喝玩乐,那没几天就得喝西北风。
为了保持家里的“经济平衡”,咱们得合理规划支出,把钱用在刀刃上,这样才能“财源滚滚来”。
2.2 再说说职场上的事情。
你可能听过“工作与生活平衡”这个词,实际上就是在说等效平衡原理。
工作上拼命加班,结果身体累得像个瘫,生活中也没啥乐趣。
咱们要做到工作与生活两手抓,才能活得开心,这样才能长久。
3. 等效平衡的规律接下来,我们聊聊等效平衡原理的几个小规律。
虽然名字听起来像科学家发明的,但其实很接地气。
3.1 第一个规律是“均衡取舍”。
在任何情况下,都得学会放下点东西,才能得到更多。
比如你在选择工作时,可能要在高薪和兴趣之间做出取舍。
要是总想把所有的好处都捞到手,那最后可能啥都没了。
3.2 第二个规律是“动态平衡”。
就像骑自行车一样,如果不往前走,那就很容易摔倒。
生活中也是,环境在变化,我们的选择也要不断调整,才能保持平衡。

等效平衡原理及规律等效平衡原理是物理学中的一个基本原理,它是指在一些特定条件下,一些物理量之间的等效关系。
根据这个原理,我们可以用一些已知的物理量来推导和计算其他未知的物理量。
等效平衡规律是指在等效平衡条件下,物理系统所满足的关系。
在物理学中,等效平衡原理有很多具体的应用,下面我们分别来介绍一些常见的等效平衡原理和规律。
1.电阻的串并联等效原理根据欧姆定律,电阻和电流之间的关系可以用电阻的阻值来描述。
在串联电路中,多个电阻相连,电流通过每个电阻都相同,而总电阻等于每个电阻的阻值之和;在并联电路中,多个电阻并连,总电流分成多条路径通过每个电阻,而总电阻等于所有电阻阻值的倒数之和的倒数。
这就是电阻的串并联等效原理。
2.电容的串并联等效原理电容的电量和电压之间的关系可以用电容的电容量来描述。
在串联电路中,多个电容相连,总电压分为多个电容之间的电压之和,而总电容等于每个电容的电容量之和;在并联电路中,多个电容并连,总电压相同,而总电容等于所有电容电容量的和。
这就是电容的串并联等效原理。
3.电压的分配和电流的合成规律在串联电路中,总电压等于每个电阻上的电压之和;在并联电路中,总电流等于每个电阻上的电流之和。
这就是电压的分配和电流的合成规律。
4.质点的力的合成和分解原理当一个质点受到多个力的作用时,可以采用力的合成和分解原理来求解结果力。
力的合成原理指的是,如果一个质点受到多个力的作用,可以用一个单一的力来代替这些力的合力,合力等于各个力的矢量和;力的分解原理指的是,可以将一个力分解为多个力的合力,合力等于原力。
这个原理可以用来推导和计算各种物体受力的情况。
5.力矩的平衡和转动定律力矩是力对物体产生转动效应的物理量。
根据动力学中的平衡条件,当处于平衡状态时,物体所受合外力和合外力矩都为零。
利用力矩的平衡条件,我们可以推导出转动定律,即力矩等于物体的转动惯量和角加速度的乘积。
综上所述,等效平衡原理和规律在物理学中有着广泛的应用,能够帮助我们理解和解决各种物理问题。


等效平衡原理、规律及应用〖目标与要求〗运用对比的方法掌握等效平衡的基本原理规律和计算方法〖内容与要点〗等效平衡原理、规律、例题和习题一、等效平衡原理在一定条件下(定温定容或定温定压),对于同一可逆反应,不管从正反应开始,还是从逆反应开始,只是起始时加入物质的情况不同,而达到平衡时,任何相同组分的含量均相同,这样的化学平衡互称为等效平衡。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而,同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
如,常温常压下,可逆反应:2SO2 + O22SO2①2mol 1mol 0mol②0mol 0mol 2mol③①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡。
二、等效平衡规律①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比值与原平衡相同,则两平衡等效。
③在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
反之,等效平衡时,物质的量之比与原建立平衡时相同。
三、等效平衡投料方案的设计(1)“站点法”设计恒温恒容下的等效平衡3H2 + N2 2NH3原始站 A 4 1 0中途站 B: a b c平衡站P [] [] []中途站 C: a’b’c’终极站 D 0 2显然,从初始到平衡态的过程中,反应要经历中间的许多站点B、C... 若以此站点值为起始投料方案,都能建立等效平衡.A和D 是达到平衡站点(P)两个极端.A 站点要经正向右移而达到平衡点P; D 站点要经逆向左移而达到平衡点P. 该例中,H2的取值在4mol-1mol之间.从一个站点到另一个站点各物质的变化量之比等于化学方程式计量数之比.如有:(4-a):(1-b): (0+c)=3:1:2 (1+a’): (0+b’):2-c’)=3:1:2 等等.(2) “扩缩法”设计恒温恒压下的等效平衡恒温恒压下,将各物质的量增扩(或减缩)同样倍数都能建立相同的平衡态.因恒压,气体总体积要随之扩大(或缩小)相应的倍数,致使气体浓度没变,平衡没发生移动,所以这样建立的都是等效平衡。

等效平衡原理及规律一、等效平衡原理在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。
如,常温常压下,可逆反应:2SO2 + O2 2SO3 SO2、O2、SO2的物质的量分别为①2mol 1mol0mol②0mol 0mol 2mol③①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡二、等效平衡规律根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类:I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
例1.在一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应2A(g)+B(g)3C(g)+D(g),达到平衡,c的浓度为w mol/L。
若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c 的浓度仍为w mol/L的是A. 4 mol A +2 mol BB. 1 mol A+ mol B+ mol C+ mol DC. 3 mol C+1 mol D +1 mol BD. 3 mol C+1 mol D解析:根据题意:2A(g)+B(g)==3C(g)+D(g) (反应1)<==> 2A(g)+B(g)==3C(g)+ D(g)(反应2)2mol 1mol 0 0 0 0 3mol 1mol2A(g)+B(g)==3C(g)+D(g) (反应3)<==> 2A(g)+B(g)== 3C(g) + D(g)(反应4)1mol 0 0 0 0所以,以3 mol C+1 mol D或以1mol A+ mol B+ C+ mol D作为起始物质均可形成与反应(1)等效的平衡。

等效平衡原理及规律一、等效平衡原理在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。
如,常温常压下,可逆反应:2SO2+O22SO3SO2、O2、SO2的物质的量分别为①2mol1mol0mol②0mol0mol2mol③0.5mol0.25mol1.5mol①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡二、等效平衡规律根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类:I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
例1.在一固定体积的密闭容器中,加入2molA和1molB发生反应2A(g)+B(g)3C(g)+D(g),达到平衡,c的浓度为wmol/L。
若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c的浓度仍为wmol/L的是A.4molA+2molBB.1molA+0.5molB+1.5molC+0.5molDC.3molC+1molD+1molBD.3molC+1molD解析:根据题意:2A(g)+B(g)==3C(g)+D(g)(反应1)<==>2A(g)+B(g)==3C(g)+D(g)(反应2)2mol 1mol 0 0 0 0 3mol 1mol2A(g)+B(g)==3C(g)+D(g)(反应3)<==>2A(g)+B(g)==3C(g)+D(g)(反应4) 1mol 0.5mol 0 0 0 0 1.5mol 0.5mol所以,以3molC+1molD 或以1molA+0.5molB+1.5molC+0.5molD 作为起始物质均可形成与反应(1)等效的平衡。

等效平衡原理及规律一、等效平衡原理在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。
如,常温常压下,可逆反应:2SO2 + O22SO3 SO2、O2、SO2的物质的量分别为①2mol1mol 0mol②0mol 0mol2mol③0、5mol 0、25mol1、5mol①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡二、等效平衡规律根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类:I、在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
例1.在一固定体积的密闭容器中,加入2 mol A和1 mol B 发生反应2A(g)+B(g)3C(g)+D(g),达到平衡,c的浓度为wmol/L。
若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,c的浓度仍为w mol/L的是A、4 mol A +2 mol BB、1 mol A+0、5 mol B+1、5 mol C+0、5 mol DC、3 mol C+1 mol D +1 mol BD、3 mol C+1 mol D解析:根据题意:2A(g)+B(g)==3C(g)+D(g)(反应1)<==>2A(g)+B(g)==3C(g)+ D(g)(反应2)2mol 1mol 00 03mol 1mol2A(g)+B(g)==3C(g)+D(g)(反应3)<==>2A(g)+B(g)==3C(g)+ D(g)(反应4)1mol 0、5mol 00 1、5mol 0、5mol所以,以3 mol C+1 mol D或以1mol A+0、5 mol B+1、5mol C+0、5 mol D作为起始物质均可形成与反应(1)等效的平衡。

等效平衡原理及规律一、等效平衡原理在一定条件(定温、定压或定温、定容)下,对于同一可逆应,只要起始时加入物质的物质的量不同,而达到平衡时,同种物质的物质的量或物质的量分数(或体积分数)相同,这样的平衡称为等效平衡。
如,常温常压下,可逆反应:2SO2 + O2 2SO2①2mol 1mol 0mol②0mol 0mol 2mol③0.5mol 0.25mol 1.5mol①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡二、等效平衡规律根据反应条件(定温、定压或定温、定容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成三类:I.在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
【例1】练习1:有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g) + B(g) 3C(g) + D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是()A.4mol A + 2mol BB.2mol A + 1mol B + 3mol C + 1mol DC.3mol C + 1mol D +1mol BD.3mol C + 1mol DE、1molA+0.5molB+1.5molC+0.5molDII.在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量之比与原平衡相同,则两平衡等效。
【例2】恒容下,可逆反应2HI H2+I2(气)达平衡。
下列四种投料量均能达到同一平衡,请填写:半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。

等效平衡原理、规律及应用重庆市涪陵第五中学校何明太〖目标与要求〗运用对比的方法掌握等效平衡的基本原理规律和计算方法〖内容与要点〗等效平衡原理、规律、例题和习题一、等效平衡原理在一定条件下(定温定容或定温定压),对于同一可逆反应,不管从正反应开始,还是从逆反应开始,只是起始时加入物质的情况不同,而达到平衡时,任何相同组分的含量均相同,这样的化学平衡互称为等效平衡。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而,同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
如,常温常压下,可逆反应:2SO2 + O2 2SO2①2mol 1mol 0mol②0mol 0mol 2mol③0.5mol 0.25mol 1.5mol①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡二、等效平衡规律①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比值与原平衡相同,则两平衡等效。
③在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
反之,等效平衡时,物质的量之比与原建立平衡时相同。
三、等效平衡投料方案的设计(1)“站点法”设计恒温恒容下的等效平衡3H2 + N2 2NH3原始站 A 4 1 0中途站 B 3.4 0.8 0.4: a b c平衡站P [2.5] [0.5] [1.0]中途站 C 1.6 0.2 1.6: a’ b’ c’终极站 D 1.0 0 2显然,从初始到平衡态的过程中,反应要经历中间的许多站点 B、C... 若以此站点值为起始投料方案,都能建立等效平衡.A和D 是达到平衡站点(P)两个极端.A 站点要经正向右移而达到平衡点P; D 站点要经逆向左移而达到平衡点P. 该例中,H2的取值在4mol-1mol之间.从一个站点到另一个站点各物质的变化量之比等于化学方程式计量数之比.如有:(4-a):(1-b): (0+c)=3:1:2 (1+a’): (0+b’):2-c’)=3:1:2 等等.(2) “扩缩法”设计恒温恒压下的等效平衡恒温恒压下,将各物质的量增扩(或减缩)同样倍数都能建立相同的平衡态.因恒压,气体总体积要随之扩大(或缩小)相应的倍数,致使气体浓度没变,平衡没发生移动,所以这样建立的都是等效平衡。
等效平衡原理及规律1、等效平衡原理相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,起始时加入物质的物质的量不同(只要初始浓度相同),而达到化学平衡时,同种物质的百分含量(质量分数或物质的量分数或体积分数)相同。
2、等效平衡规律(1)恒温恒容时对于反应前气体分子数改变的可逆反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算成同一半边的物质,若各物质的物质的量,与原平衡相同,则两平衡等效。
对于反应前气体分子数不变的可逆反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算成同一半边的物质,若各物质的物质的量的比值与原平衡相同,则两平衡等效。
(2)恒温恒压时改变起始时加入物质的物质的量,通过可逆反应的化学计量数之比换算成同一半边的物质,若各物质的物质的量的比值与原平衡相同,则两平衡等效。
1密闭容器中,进行如下反应:N2(g) + 3H2(g) 2NH3(g) ,请填空:密闭容器中,对于H2(g)+H2(g) == 2HI(g)反应:1、密闭容器中,保持一定温度,进行如下反应:N2(g) + 3H2(g) 2NH3(g) 已知加入1molN2和3molH2,在恒压条件下,达到平衡时生成a molNH3[见下表编号(1)的一行];在恒容条件下,达到平衡时生成b molNH3[见下表编号(4)的一行]。
2、某温度下,在1L密闭容器中加入1molN2和3molH2,,使反应:N2(g) + 3H2(g) 2NH3(g)达平衡,测得平衡混合气体中N2、H2、NH3的浓度分别为Mmol/L、Nmol/L、Gmol/L。
如果温度不变,只改变初始物质的加入量,而要求M、N、G总保持不变,则N2、H2、NH的加入量用x、y、z表示时,应满足的条件是:(1)若x=0,y=0,则z= 。
(2)若x=0.75mol,则y= ,z= 。
〖目标与要求〗运用对比的方法掌握等效平衡的基本原理规律和计算方法〖内容与要点〗等效平衡原理、规律、例题和习题一、等效平衡原理在一定条件下(定温定容或定温定压),对于同一可逆反应,不管从正反应开始,还是从逆反应开始,只是起始时加入物质的情况不同,而达到平衡时,任何相同组分的含量均相同,这样的化学平衡互称为等效平衡。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而,同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
如,常温常压下,可逆反应:2SO2 + O2 2SO2①2mol 1mol 0mol②0mol 0mol 2mol③①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡。
二、等效平衡规律①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比值与原平衡相同,则两平衡等效。
③在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
反之,等效平衡时,物质的量之比与原建立平衡时相同。
三、等效平衡投料方案的设计(1)“站点法”设计恒温恒容下的等效平衡3H2 + N2 2NH3A 4 1 0中途站 B: a b c平衡站 P [] [] []中途站 C: a’ b’ c’终极站 D 0 2显然,从初始到平衡态的过程中,反应要经历中间的许多站点 B、C... 若以此站点值为起始投料方案,都能建立等效平衡.A和D 是达到平衡站点(P)两个极端.A 站点要经正向右移而达到平衡点P; D 站点要经逆向左移而达到平衡点P. 该例中,H2的取值在4mol-1mol之间.从一个站点到另一个站点各物质的变化量之比等于化学方程式计量数之比.如有:(4-a):(1-b): (0+c)=3:1:2 (1+a’): (0+b’):2-c’)=3:1:2 等等.(2) “扩缩法”设计恒温恒压下的等效平衡恒温恒压下,将各物质的量增扩(或减缩)同样倍数都能建立相同的平衡态.因恒压,气体总体积要随之扩大(或缩小)相应的倍数,致使气体浓度没变,平衡没发生移动,所以这样建立的都是等效平衡。
有关等效平衡问题原理及规律的探讨“等效平衡”的问题在每年各地的模拟考试或高考试题中常常出现,但在教学实践中教师和学生还是感到困难重重,我在教学实践中得出要解决此问题关键是:一要弄清楚“等效平衡及任何相同组分的含量相同”的含义;二是“等效平衡”在恒温恒容条件下或在恒温恒压条件下的解题三规律;三是在计算中的应用。
下面我就这三个问题逐一进行分析。
一、什么是等效平衡?等效平衡的含义:在一定条件(恒温恒容或恒温恒压)下,只是起始时加入物质的量不同的同一可逆反应达到平衡后,任何相同组分的含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称为等效平衡。
在等效平衡中,还有一类特殊的平衡,不仅任何相同组分的分数(体积、物质的量)均相同,而且相同组分的物质的量也均相同,这类等效平衡又互称为同一平衡。
同一平衡是等效平衡的特例。
二、等效平衡三规律:规律一:①:.恒温恒容下....,如果起始加入物质的量不同,.....,对于反应前后气体体积不同的可逆反应按化学方程式中的的化学计量关系折算成同一方向的物质(即“一边倒”)后,各组分的物质的量与原平衡各组分的物质的量分别相等,则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度、物质的量均相同。
例如:按下列三条途径,在恒温、恒容下建立的平衡,则平衡Ⅰ和平衡Ⅱ等效吗?若平衡Ⅰ和平衡Ⅲ等效,则平衡Ⅲ中:a== b== 。
平衡Ⅰ3mol 1mol 0平衡Ⅱ 0 0 2mol平衡Ⅲ a b c解析:平衡Ⅰ和平衡Ⅱ是等效的。
平衡时,同种组分的体积分数、物质的量浓度、物质的量均相同。
而Ⅲ,应满足:a==3-3C/2 b==1- C/2 。
②:恒温恒容下..........的可逆反应,如果起始加入物质的量不同,.....,对于反应前后气体体积相同按化学方程式中的的化学计量关系“一边倒”后,各组分的物质的量之比与原平衡各组分的物质的量之比相同,两平衡等效,平衡时,同种组分的体积分数相同,但物质的量浓度、物质的量均不相同。