麦红吸浆虫保幼激素含量测定
- 格式:pdf
- 大小:446.70 KB
- 文档页数:3

安阳市小麦吸浆虫幼虫期防治试验报告作者:冯丽萍来源:《河南农业·综合版》 2013年第13期安阳市植保植检站冯丽萍小麦吸浆虫是安阳市小麦田的主要害虫,近年来在部分地区为害严重。
2012年5月我们选用48%毒死蜱乳油等6种药剂进行了防治小麦吸浆虫幼虫的试验。
一、试验设计(一)试验田块试验选在林州市姚村镇三孝村水肥条件较好、小麦吸浆虫发生为害比较严重而且田间分布较均匀的麦田。
(二)选用药剂处理试验药剂有48%毒死蜱乳油、80%敌敌畏乳油、40%氧化乐果乳油、1%苦皮藤素乳油、10%吡虫啉可湿性粉剂、35%氯虫苯甲酰胺可分散性粒剂等6种。
根据生产实际和试验目的,每种药剂设2~6个处理浓度,试验设19个药剂处理,1个空白对照,不设重复,见表1。
(三)试验小区试验共设20个小区,小区面积52m2不等,各小区在田间随机排列。
(四)施药方法5月6日,在小麦扬花末期至灌浆初期,小麦吸浆虫卵孵化盛期进行试验施药。
根据小区面积及处理类别,选取相应量的药剂,用2~3kg的水稀释后,用背负式工农16型喷雾器均匀喷洒在小麦植株上。
试验喷药后3d内没有降水,天气晴好,对药剂效能的发挥没有不利影响。
(五)调查方法5月25日,在小麦吸浆虫幼虫老熟脱穗前,在各小区内棋盘式10点随机取样,每点在不同小麦株系上随机采取中等麦穗3~5穗,分别装入白色塑料袋内,标记。
带到室内,剥穗检查麦粒表面幼虫数,记录每穗麦粒数和幼虫数。
按照剥穗结果,计算损失率和防治效果。
损失率(%)=检查穗虫数/(检查穗粒数×4)×100%防治效果(%)=(对照区损失率-处理区损失率)/对照区损失率×100%二、结果与分析根据剥穗数据,统计各处理的损失率、虫口减退率、防治效果等数据,见表2。
由表2可以看出,空白对照处理区,平均百穗有虫217.0头,百粒有虫12.1头,损失率为3.0%。
其他各药剂处理区,平均百穗有虫1.9~245.2头,百粒有虫0.1~10.7头,损失率为0.0%~2.7%,百穗虫口减退率为-13.0%~99.1%,防治效果11.1%~99.3%。






小麦吸浆虫的测报及防治方法摘要从“二看二定”、查化蛹进度、查蛹数等方面阐述了小麦吸浆虫的测报方法,并提出了防治方法,以期为小麦吸浆虫的防治提供参考。
关键词小麦吸浆虫;测报方法;防治方法小麦吸浆虫是一种毁灭性害虫,有麦红吸浆虫、麦黄吸浆虫2种。
在五河县境内发生危害的是麦红吸浆虫,其成虫体长2.0~2.5 mm,翅展5 mm左右。
1年发生1代。
15~20 ℃为成虫羽化的适宜温度,下1次雨便羽化1批成虫,羽化后当天就交配产卵在麦穗护颖与外颖之间或小穗上。
4月下旬孵化出的幼虫潜伏在颖壳内吸食正在灌浆的麦粒汁液,造成秕粒、空壳,从而造成小麦大幅度的减产甚至于绝收,影响经济效益。
1 小麦吸浆虫的测报方法1.1 “二看二定”一是看成虫,定防治适期。
在五河县当地栽培的小麦品种中,从最早的品种开始有个别抽穗时起到最晚的品种灌浆时止,约在5月上旬至5月下旬,各选择不同播种期的代表性田块,每1~2 d调查1次,白天在麦垄或麦沟中蹲下,向麦株中部轻轻扒开麦株,每块田块检查5~10处,当一眼(约0.11 m2范围内)看到有3~5头成虫起飞时,即成虫盛发期的开始,也就是防治时期。
在无风的天气时,傍晚防治效果最好;遇有风雨,适当推迟1~2 d防治。
二是看麦穗,查虫数,定防治田块。
成虫盛发开始后,立即普查所有麦田。
开始抽穗至扬花前的麦田,又是抗虫性较弱的品种,每天扒查麦株2~3次;或用口径33.33 cm的捕虫网,傍晚在麦穗上部兜捕10次。
如扒看,一眼平均看到成虫5~10头以上;或10次兜捕成虫数在20~30头以上的田块,应立即进行分批防治。
早抽穗、早见虫的先防治,抗虫品种或早扬花以及迟抽穗,虫量少的田块不防治。
1.2 查化蛹进度预测成虫发生盛期。
在小麦孕穗期开始选择重点发生地段,有代表性的麦田2块,连续淘土3~5次,每次每块田均匀取土样3个(简称方样),每个方样规格为17 cm×17 cm、深20 cm,检查土中幼虫数和蛹数。

昆虫保幼激素是一类特殊的激素,能够促进昆虫的生长发育和保护昆虫免受环境胁迫的影响。
昆虫保幼激素的生物测定方法主要包括生物试剂盒测定法、生物活体测定法和生物分子测定法。
1.生物试剂盒测定法:这种方法使用特殊的生物试剂盒,通过观察昆虫在该试剂盒中
的反应情况来测定昆虫保幼激素的含量。
2.生物活体测定法:这种方法使用昆虫的活体来测定昆虫保幼激素的含量。
通常使用
昆虫的体质量、体长、发育时间等生理指标作为参考,来评估昆虫保幼激素的含量。
3.生物分子测定法:这种方法通过对昆虫保幼激素的分子进行测定,来确定昆虫保幼
激素的含量。
常用的生物分子测定方法包括免疫测定法、质谱测定法等。

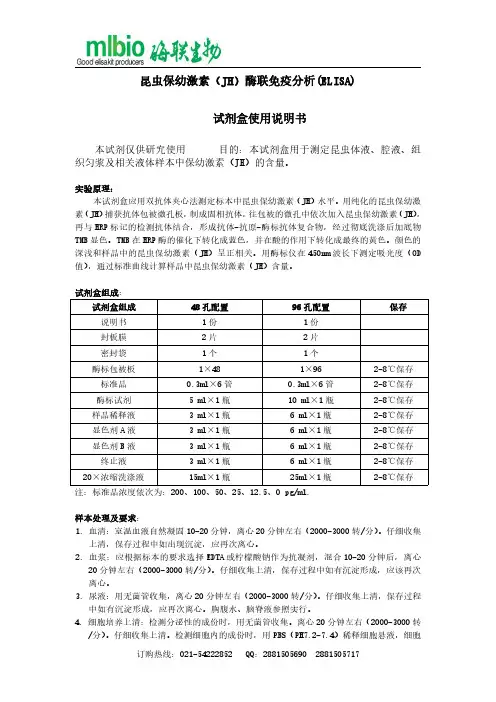
昆虫保幼激素(JH)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定昆虫体液、腔液、组织匀浆及相关液体样本中保幼激素(JH)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中昆虫保幼激素(JH)水平。
用纯化的昆虫保幼激素(JH)捕获抗体包被微孔板,制成固相抗体,往包被的微孔中依次加入昆虫保幼激素(JH),再与HRP标记的检测抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的昆虫保幼激素(JH)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中昆虫保幼激素(JH)含量。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片2片密封袋1个1个酶标包被板1×481×962-8℃保存标准品0.3ml×6管0.3ml×6管2-8℃保存酶标试剂5ml×1瓶10ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存20×浓缩洗涤液15ml×1瓶25ml×1瓶2-8℃保存注:标准品浓度依次为:200、100、50、25、12.5、0pg/ml.样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。

西北农业学报 2006,15(4):73~75A cta A g riculturaeB oreali2occi dentalis S inica麦红吸浆虫保幼激素含量测定李英梅,仵均祥3,成卫宁,李怡萍,侯娟娟(植保资源与病虫害治理教育部重点实验室,西北农林科技大学植物保护学院,陕西杨凌 712100)摘 要:用气相色谱法对麦红吸浆虫S itodi plosis mosellna(G ehin)成虫、麦穗幼虫、秋季滞育幼虫、冬季滞育幼虫和翌年春季活动幼虫保幼激素滴度进行了检测。
结果显示,在麦红吸浆虫成虫和幼虫的不同阶段,都可检测到保幼激素Ⅲ的存在。
比较而言,成虫保幼激素Ⅲ的滴度高于麦穗幼虫和秋季滞育幼虫,但明显低于冬季滞育幼虫和翌年出土幼虫。
关键词:小麦吸浆虫;气相色谱;保幼激素中图分类号:S435.122+.1 文献标识码:A 文章编号:100421389(2006)0420073203Determination of Juvenile H ormone in Wheat BlossomMidge,Sitodi plosis mosell a na(G ehin)L I Y ing2mei,WU J un2xiang3,C H EN G Wei2ning,L I Y i2ping and HOU J uan2juan (Key Laboratory of Plant Protection Resources and Pest Management,Ministry of Education,College of PlantProtection,Nort hwest A&F University,Yangling Shaanxi 712100,China)Abstract:The tit res of juvenile hormoneⅢ(J H3)in adult,wheat2ear2larva,over2aut umning2larva,o2 ver2wintering2larva and over2wintered larva of t he wheat blossom midge,S itodi plosis mosell ana(Ge2 hin)are detected by gas chromatograp hy.Result s showed t hat J HⅢcould be detected in bot h adult and larva of t he wheat blo ssom midge.The J HⅢtitre in adult is higher t han t hat in wheat2ear2larva and over2aut umning2larva,but it is obviously lower t han t hat in over2wintering2larva and over2win2 tered larva.A initial analysis on t he p henomenon is given.K ey w ords:Wheat blosso m midges;Gas chromatograp hy;J uvenile hormone 麦红吸浆虫S itodi plosis mosell ana(Gehin)是小麦生产中间歇性、团块不均匀性猖獗成灾的害虫,广泛分布于欧洲、亚洲与北美洲;美国、加拿大、英国、德国、芬兰等国家均有严重成灾的记录[1]。
昆虫保幼激素是一类重要的生物活性物质,它们能够调节昆虫的生长发育过程。
研究昆虫保幼激素的方法通常包括以下几种:
化学合成:通过化学反应合成保幼激素,并进行纯化和鉴定。
分离纯化:从昆虫体内或体外分离保幼激素,并进行纯化和鉴定。
免疫学方法:使用免疫技术,如免疫印迹法或免疫流式细胞术,来检测保幼激素的存在和分布。
分子生物学方法:使用分子生物学技术,如转录组分析、蛋白质组分析和基因组学分析,来研究保幼激素的基因表达和调节。
功能分析:使用生物学和生理学实验,比如荧光共振能量转移实验、激素敏感性实验和生长发育实验,来研究保幼激素的生物学功能。
西北农业学报 2006,15(4):73~75A cta A g riculturaeB oreali2occi dentalis S inica麦红吸浆虫保幼激素含量测定李英梅,仵均祥3,成卫宁,李怡萍,侯娟娟(植保资源与病虫害治理教育部重点实验室,西北农林科技大学植物保护学院,陕西杨凌 712100)摘 要:用气相色谱法对麦红吸浆虫S itodi plosis mosellna(G ehin)成虫、麦穗幼虫、秋季滞育幼虫、冬季滞育幼虫和翌年春季活动幼虫保幼激素滴度进行了检测。
结果显示,在麦红吸浆虫成虫和幼虫的不同阶段,都可检测到保幼激素Ⅲ的存在。
比较而言,成虫保幼激素Ⅲ的滴度高于麦穗幼虫和秋季滞育幼虫,但明显低于冬季滞育幼虫和翌年出土幼虫。
关键词:小麦吸浆虫;气相色谱;保幼激素中图分类号:S435.122+.1 文献标识码:A 文章编号:100421389(2006)0420073203Determination of Juvenile H ormone in Wheat BlossomMidge,Sitodi plosis mosell a na(G ehin)L I Y ing2mei,WU J un2xiang3,C H EN G Wei2ning,L I Y i2ping and HOU J uan2juan (Key Laboratory of Plant Protection Resources and Pest Management,Ministry of Education,College of PlantProtection,Nort hwest A&F University,Yangling Shaanxi 712100,China)Abstract:The tit res of juvenile hormoneⅢ(J H3)in adult,wheat2ear2larva,over2aut umning2larva,o2 ver2wintering2larva and over2wintered larva of t he wheat blossom midge,S itodi plosis mosell ana(Ge2 hin)are detected by gas chromatograp hy.Result s showed t hat J HⅢcould be detected in bot h adult and larva of t he wheat blo ssom midge.The J HⅢtitre in adult is higher t han t hat in wheat2ear2larva and over2aut umning2larva,but it is obviously lower t han t hat in over2wintering2larva and over2win2 tered larva.A initial analysis on t he p henomenon is given.K ey w ords:Wheat blosso m midges;Gas chromatograp hy;J uvenile hormone 麦红吸浆虫S itodi plosis mosell ana(Gehin)是小麦生产中间歇性、团块不均匀性猖獗成灾的害虫,广泛分布于欧洲、亚洲与北美洲;美国、加拿大、英国、德国、芬兰等国家均有严重成灾的记录[1]。
我国曾在20世纪50年代和80年代两次大面积暴发成灾,对小麦生产造成了严重影响[2]。
研究表明,麦红吸浆虫越冬幼虫所具有的滞育率高、滞育能力强、高度延长滞育和2次滞育特点与小麦吸浆虫的间歇性、团块不均匀性猖獗成灾有密切的关系[3]。
多年来,人们对麦红吸浆虫的滞育习性及其调控机理进行了不懈的研究[3]。
由于该虫一年仅发生一代,个体小,一年中的绝大部分时间隐蔽在土壤中,人工大量饲养繁殖技术尚未解决,所以,在滞育机理研究方面虽然做了大量的工作,但至今未能得出一个科学的答案。
保幼激素是由昆虫咽侧体分泌的一类高萜类化合物,在昆虫的变态发育过程中起着重要的作用[4]。
大量研究表明,保幼激素含量的变化是调节昆虫滞育维持和终止的重要因子之一[5~7]。
国内外尚未见有关小麦吸浆虫滞育与保幼激素滴度变化之间关系的研究报道。
鉴于此,本研究采用气相色谱分析测定了麦红吸浆虫成虫和不同滞育阶段幼虫的保幼激素滴度。
收稿日期:2006202216 修回日期:2006203202基金项目:国家自然科学基金项目(30370936)和教育部重点项目(105165)资助。
作者简介:李英梅(1975-),女,硕士研究生,主要从事植物保护研究工作。
3通讯作者:junxw@1 材料与方法1.1 实验材料2004年6月初,在河北保定选择麦红吸浆虫大发生田块,采集幼虫尚未脱穗的麦穗运回西北农林科技大学,撒于地面并喷水保湿,使幼虫落地入土。
在不同时间采用淘土法[8]获得不同滞育和发育阶段的麦红吸浆虫幼虫,保存在低温冰箱(-70℃)中备用。
供试成虫系于2005年5月初从河北保定麦田网捕获得。
1.2 实验试剂J H Ⅲ标准品为美国Sigma 公司产品,浓度为75%,正己烷为国产分析纯。
A :J H III 标准品The Standard of J HIII ;B :成虫Adult ;C :麦穗幼虫Wheat 2ear 2larva ;D :秋季滞育幼虫Over 2aut umning 2larva ;E :春季出土幼虫Over 2wintered larva ;F :冬季滞育幼虫Over 2wintering 2larva.图1 JH III 标准品及各虫态JH III 气相色谱图Fig.1 The chrom atography of JHIII stand ard samples and adult and larva1.3 实验仪器日本岛津公司GC 216A 气相色谱仪,氢火焰离子化检测器,TL9000(金羊)色谱工作站,小型玻璃匀浆器(0.5mL ),B230型超声波破碎仪,美国Beckman J 2221型高速冷冻离心机,离心浓缩系统,电子天平及其他实验室常用仪器。
表1 麦红吸浆虫成虫及幼虫不同滞育阶段保幼激素Ⅲ的含量Fig.1 The JHIII content determinated in adult and larva of Sitodi plosis mosellana at different stage 虫态或滞育阶段Different stage diapauses and individuals试虫数/头Number of insect试虫重/mgWeight of insect J H Ⅲ峰面积The peak area of J H ⅢJ H Ⅲ含量(ng ・mg -1)J H Ⅲcontent成虫Adult30040.0574290.0201675麦穗幼虫Wheat 2ear 2larva20060.7643140.0148830秋季滞育幼虫Over 2autumning 2larva 26074.3739400.0139798冬季滞育幼虫Over 2wintering 2larva 11018.3561430.0430923春季出土幼虫Over 2wintered larva15036.61132060.04345081.4 样品预处理取供试成虫或幼虫,用超纯水洗掉虫体表面杂质,滤纸吸干水分,电子天平称重后移入玻璃匀浆器中,加10.5mL 正己烷冰浴匀浆5min ,超声波细胞破碎仪破碎5min (超声设置:40次,每次5s ,间隔5s ),在9000rp m ,4℃条件下离心10min 取上清液。
正己烷重复提取5次,合并上清液。
上机前用离心浓缩系统进行浓缩近干,正己烷定容至25μL ,以峰面积定量。
1.5 色谱条件DBS 2MS 毛细管柱;150℃开始升温,每分钟升温20℃,到280℃止,进样口温度280℃,检测器温度280℃,分流比20∶1;进样量1μL 。
2 结果与分析2.1 不同虫态保幼激素Ⅲ滴度测定测定结果表明,小麦吸浆虫像大多数昆虫一样,体内含有保幼激素Ⅲ。
成虫和幼虫均含有一・47・西 北 农 业 学 报 15卷定量的保幼激素Ⅲ,其中成虫的保幼激素Ⅲ的含量为0.0201675ng/mg,幼虫保幼激素Ⅲ的含量则随滞育阶段而变化。
2.2 不同滞育阶段幼虫保幼激素III含量比较从表1和图1可以看出,不同滞育阶段幼虫保幼激素III的含量明显不同。
麦穗幼虫和秋季滞育幼虫保幼激素III的含量比较接近,两者的含量仅分别为0.0148830ng/mg和0.0139798 ng/mg;冬季滞育幼虫与翌年春季出土幼虫保幼激素III的含量比较接近,两者的含量分别为0.0430923ng/mg和0.0434508ng/mg。
3 结论与讨论3.1 J H作为一种重要的发育调控激素,在昆虫个体发育的某一特定时期的滴度高低,决定该个体“选择”何种发育途径以产生相应的变态(Ni2 jhout&Wheeler,1982)。
前人对昆虫滞育发生、维持或深度变化、解除等与保幼激素含量变化关系的研究表明,滞育是由外界环境条件诱导,昆虫内分泌系统调节的一种发育现象[9],其中保幼激素的作用最为重要[6]。
但在不同的昆虫种类中,各种激素对滞育的发生、维持及终止所起的作用并不完全相同[10]。
王瑜等(1994)对三带喙库蚊(Culex t ritaeniorhy nchus)滞育成蚊应用保幼激素或类保幼激素处理,可使其解除滞育[11~13];王满囷等(2002)研究表明,鞭角华扁叶蜂(Chi nol y2 da f l a gellicornis)在滞育期间,预蛹血淋巴中J H III的滴度高达20ng/mL左右,这表明其预蛹咽侧体仍保持较高的活性,分泌J H来调节P T T H 和M H分泌活动来维持滞育[10]。
苏天运(1994)等对淡色库蚊(Culex pi piens p allens)滞育成虫保幼激素含量的研究表明,蚊虫生殖滞育的发生主要是由于体内J H的缺乏,用保幼激素类似物可以解除卵泡的滞育状态,并存在量效关系[5]。
3.2 本研究结果表明,麦红吸浆虫成虫和幼虫体内均含有一定量的保幼激素III,说明麦红吸浆虫像绝大多数昆虫种类一样,保幼激素在其发育变态过程中起着重要的调节作用。
不同滞育阶段的幼虫,体内保幼激素含量明显不同,麦穗幼虫与秋季滞育幼虫保幼激素III的含量比较接近,两者的含量均较低;冬季滞育幼虫与翌年春季出土幼虫保幼激素III的含量比较接近,两者的含量均较高。