铁、铜及其化合物的性质
- 格式:doc
- 大小:59.50 KB
- 文档页数:5

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,通常具有良好的电导性、热导性、延展性和可塑性。
金属元素被广泛应用于各个领域,例如建筑、电子、冶金、汽车等。
下面将为您介绍一些常见金属元素及其化合物。
铁(Fe)是一种常见的金属元素,其化合物主要有氧化铁、硫化铁、碳酸铁等。
氧化铁是一种红棕色的固体物质,在建筑和石材制作中常用作颜料。
硫化铁是一种黑色的矿石,常用于制备铁和钢。
碳酸铁是一种白色的结晶物质,常见于自然界中的石灰岩和大理石。
铜(Cu)是另一种常见的金属元素,其化合物主要有氧化铜、硫化铜、碳酸铜等。
氧化铜是一种黑色的固体物质,在电子和电器制造中常用作导电材料。
硫化铜是一种蓝色的矿石,常用于制备铜和铜合金。
碳酸铜是一种绿色的结晶物质,常见于自然界中的矿石和矿山。
铝(Al)是一种轻便耐腐蚀的金属元素,其化合物主要有氧化铝、氯化铝、硫酸铝等。
氧化铝是一种白色的固体物质,在建筑和电子制造中常用作绝缘材料和搅拌器。
氯化铝是一种无色的液体,常用于制备有机化合物。
硫酸铝是一种无色的液体,常用于制备矾石和其他铝盐。
锌(Zn)是一种重要的金属元素,其化合物主要有氧化锌、硫化锌、氯化锌等。
氧化锌是一种白色的固体物质,常见于生活用品和化妆品中。
硫化锌是一种白色的矿石,常用于制备锌和锌合金。
氯化锌是一种无色的固体,常用作催化剂和腐蚀抑制剂。
钠(Na)是一种常见的金属元素,其化合物主要有氯化钠、碳酸钠、亚硝酸钠等。
氯化钠是一种无色的晶体,是普通食盐的主要成分。
碳酸钠是一种白色的晶体,常用于制备碱性溶液和中和酸性物质。
亚硝酸钠是一种无色的晶体,常用于食品加工和防腐剂。
钢是一种由铁和碳组成的合金,常用于建筑和制造业。
除了碳,钢中还可以含有其他金属元素,如锰、铬、钼等。
这些金属元素能够提高钢的强度、硬度和耐腐蚀性。
总结起来,常见的金属元素及其化合物有铁(氧化铁、硫化铁、碳酸铁)、铜(氧化铜、硫化铜、碳酸铜)、铝(氧化铝、氯化铝、硫酸铝)、锌(氧化锌、硫化锌、氯化锌)、钠(氯化钠、碳酸钠、亚硝酸钠)等。

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,常见金属元素包括铁、铜、铝、锌、镁、钙、锡等。
这些金属元素具有良好的导电性、导热性、延展性、韧性等特点,被广泛应用于工业、建筑、电子、汽车等领域。
以下将对常见金属元素及其化合物进行介绍。
铁是最常见的金属元素之一,它在地壳中含量很丰富。
铁具有良好的韧性和可塑性,广泛应用于钢铁制造、建筑、机械加工、电子设备等领域。
铁的化合物有很多,常见的有氧化铁(Fe2O3)和硫化铁(FeS2)等。
氧化铁是一种重要的无机颜料,用于制造红、橙、黄等颜色的油漆、颜料和陶瓷;硫化铁常用于制造火柴的火头。
铜是另一种常见的金属元素,具有良好的导电性和导热性。
铜广泛应用于电子设备、电线、管道等领域。
铜的化合物有氧化铜(CuO)、硫化铜(CuS)等。
氧化铜常用作无机颜料、催化剂和电池材料;硫化铜可用于制备农药和矿石浮选剂。
铝是一种轻质金属元素,密度低、延展性好。
铝广泛用于飞机、汽车、建筑等领域。
铝的主要化合物有氧化铝(Al2O3)和硫化铝(Al2S3)等。
氧化铝是一种重要的工业原料,广泛用于制造陶瓷、搪瓷、耐火材料等;硫化铝用于制备染料和催化剂。
锌是一种重要的工业金属,具有抗腐蚀性好、导电性能优良等特点。
锌广泛应用于电镀、电池制造、建筑材料等领域。
锌的主要化合物有氧化锌(ZnO)和硫化锌(ZnS)等。
氧化锌常用于生产橡胶、涂料、油漆、化妆品等;硫化锌是一种重要的矿石,在锌冶炼过程中起着重要的作用。
镁是一种轻质金属元素,密度低、质轻。
镁广泛应用于轻金属合金、烟火制造、航空航天等领域。
镁的主要化合物有氧化镁(MgO)和硫化镁(MgS)等。
氧化镁是一种重要的耐火材料,广泛用于高温炉窑、电解槽等;硫化镁可用于制备染料和防腐剂。
钙是一种重要的金属元素,广泛存在于生物体内。
钙广泛应用于建筑材料、电子材料、钢铁冶炼等领域。
钙的主要化合物有氧化钙(CaO)和氯化钙(CaCl2)等。
氧化钙是一种重要的建筑材料,用于制备水泥、石灰等;氯化钙常用于融雪剂、防止水泥凝固等。

第12讲 铁铜及其化合物一 铁的位置和物理性质1.铁及其化合物间的主线Fe―→⎩⎪⎨⎪⎧FeO Fe 2O 3Fe 3O 4―→⎩⎨⎧Fe OH2Fe OH 3―→⎩⎨⎧FeSO 4·7H 2OFeCl 32.铁及其化合物间的转化关系3.铁元素的变价 (1)单质铁①生成+2价:铁与S 、H +、Cu 2+、I 2等反应生成+2价。
如:Fe +SFeS 、Fe +Cu 2+===Fe 2++Cu 。
①生成+3价:铁与Cl 2、Br 2等反应生成+3价。
如2Fe +3Cl 2=====点燃2FeCl 3。
①生成+2、+3价:铁与H 2O 、O 2反应生成Fe 3O 4。
3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
①铁与HNO 3反应:当Fe 过量生成+2价,3Fe +8H ++2NO -3===3Fe 2++2NO +4H 2O ; 当Fe 不足时生成+3价,Fe +4H ++NO -3===Fe 3++NO +2H 2O 。
(2)铁的化合物:FeO 、Fe 3O 4、Fe 2O 3、Fe(OH)2、Fe(OH)3、Fe 2+、Fe 3+等。
+2价铁具有还原性,与强氧化性物如HNO 3、Cl 2等发生氧化还原反应: 如:3FeO +10HNO 3===3Fe(NO 3)3+NO +5H 2O 。
+3价铁具有氧化性,与强还原性物质, 如:HI 、Fe 、Cu 、I -、S 2-等发生氧化还原反应,如:Fe 2O 3+6HI===2FeI 2+I 2+3H 2O,2Fe 3++Cu===2Fe 2++Cu 2+。
特别强调:①Fe 与一般酸反应生成Fe 2+,与酸的量无关,但Fe 与稀HNO 3反应时最终铁的价态与铁的量有关。
①铁与硫蒸气反应生成的是FeS 而不是Fe 2S 3;铁与碘蒸气反应生成的是FeI 2而不是FeI 3。
4.铁的氧化物特别强调:①FeO 、Fe 3O 4、Fe 2O 3与硝酸反应时均生成Fe 3+。

Fe 铜、铁及其化合物一、铁及其化合物1.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm 3,熔沸点较高。
位置:第四周期,第Ⅷ 族 2.化学性质:(1)与非金属反应 Fe+S (I 2)FeS (FeI 2) 4Fe+3O 22Fe 3O 4 2Fe+3Cl 2(Br 2)2FeCl 3弱氧化剂 Fe 3+、H +、I 2、S 、铁后的金属阳离子(置换)… 强氧化剂 Cl 2、Br 2、HNO 3、浓H 2SO 4、MnO 4-(H +) … (2)与水反应 3Fe + 4H 2O(g)Fe 3O 4 + 4 H 2 ↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O 2和CO 2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) (3) 与酸反应a.与非氧化性酸反应 Fe +2H +== Fe 2++ H 2 b.与氧化性酸反应c.常温下,铁在冷浓硫酸,浓硝酸中发生钝化d.与浓硫酸反应:2Fe +6 H 2SO 4(浓)Fe 2(SO 4)3 +3SO 2 +6 H2Oe.与稀硝酸反应:①当Fe 少量时,离子方程式为:Fe + 4H ++ NO 3-== Fe 3++NO↑+2H 2O②当Fe 过量时,,离子方程式为:3Fe+8H ++2NO 3-== 3Fe 2++2NO↑+4H 2O ③当1:4<n( Fe) :n (HNO 3)<3:8 时,此情况下,Fe 3+和Fe 2+共存。
(4)与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2++ Cu3.铁的氧化物FeO Fe 2O 3 Fe 3O 4 铁的化合价 +2 +3 +2、+3 颜色、状态黑色粉末红棕色粉末 黑色晶体 俗名 铁红 磁性氧化铁 水溶性 不溶于水 不溶于水 不溶于水氧化物类别碱性氧化物碱性氧化物Fe 2+Fe 3+与非氧化性酸反应FeO+2H + =Fe2+ +H2O Fe2O3+6H + =2Fe3+ +3H2O Fe3O4+8H + =2Fe3+ + Fe2++4H2O与还原剂反应(H2、CO、Al等) FeO+CO Fe+CO2Fe2O3+3CO2Fe+3CO23Fe3O4+8Al9Fe+4Al2O3用途用作红色油漆和涂料;赤铁矿是炼铁原料注:3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O4、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意:①FeSO4晶体中不能有 Fe3+;②配制后的FeSO4溶液中要加入少量铁粉;③配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气;实验:FeSO4溶液中加NaOH.①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色②Fe2+容易被氧化,所以FeSO4溶液要新配制.③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液.④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.化学方程式: FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4 Fe2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色)(白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl3溶液中加NaOH溶液.①现象:生成红褐色沉淀②化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe2O3粉末.化学方程式: 2Fe(OH)3Fe2O3 +3H2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。


金属元素的性质和常见化合物金属元素是化学元素中的一类,具有独特的性质和广泛的应用。
本文将探讨金属元素的一般性质、常见化合物及其应用。
一、金属元素的一般性质1. 密度大:金属元素的原子通常比非金属元素的原子大,因此金属元素的密度较大。
2. 导电性好:金属元素的电子排列松散,因此电子容易自由移动,并在外界电场作用下形成电流。
3. 导热性好:金属元素的电子容易自由移动,在受热后能迅速传递热量。
4. 可塑性高:金属元素由于具有金属键,使得金属元素之间的结构松散,因此可以轻松改变形状。
5. 有延展性:金属元素的原子间有较强的金属键,因此可以拉成线、锻成薄片或制成其它形状。
二、常见金属元素和其性质1. 铁(Fe):是最常见的金属之一,具有良好的导电性和导热性。
常见的铁化合物有氧化铁(Fe2O3)、碳酸铁(FeCO3)等。
2. 铜(Cu):是一种优良的导电金属,广泛用于电缆、电器等。
常见的铜化合物有氧化铜(CuO)、硫酸铜(CuSO4)等。
3. 铝(Al):具有较轻的质量和良好的导电性,被广泛用于制造包装材料、航空器件等。
常见的铝化合物有氧化铝(Al2O3)、硫酸铝(Al2(SO4)3)等。
4. 锌(Zn):是一种常见的防腐金属,广泛用于防腐涂层和电池。
常见的锌化合物有氧化锌(ZnO)、硫酸锌(ZnSO4)等。
5. 镍(Ni):是一种重要的合金元素,广泛用于不锈钢和电池。
常见的镍化合物有氧化镍(NiO)、硫酸镍(NiSO4)等。
三、金属元素化合物的应用1. 金属氧化物:金属氧化物广泛应用于陶瓷、建筑材料、磁性材料等。
例如,氧化铁(Fe2O3)被用于制造磁铁。
2. 金属盐类:金属盐类被广泛应用于化学工业、医药和农业等领域。
例如,硫酸铜(CuSO4)被用于植物生长调节剂和水处理剂。
3. 金属合金:金属合金是由两种或两种以上金属元素组成的材料,具有优良的机械性能和耐腐蚀性。
例如,不锈钢中加入了镍(Ni),提高了抗腐蚀能力。


铜及其化合物性质归纳铜及其化合物的性质虽然在中学化学中没有专门介绍,但它们分散在中学教材的各个章节中。
在近几年高考题中经常出现铜及其化合物的影子,为便于同学们掌握它们的性质,现归纳如下:一、铜1、原子结构:原子序数为29,位于元素周期表中第4周期、第IB族,最外层有1个电子,常见化合价有+1、+2价。
2、物理性质:纯铜呈暗红色,属有色金属,导电导热性、延展性良好,焰色反应呈绿色。
3、化学性质:铜是一种较不活泼的金属,位于金属活动性顺序表中氢原子之后。
(1)与O2的反应在空气中或O2中加热表面变黑:,利用此反应可除去混在H2、CO中的少量O2。
(2)与O2、CO2、H2O的作用在潮湿的空气中铜可生成铜绿,。
(3)与其他非金属的反应Cu在中燃烧生成棕黄色烟:;在硫蒸气里燃烧生成黑色固体:(4)与酸的反应①与稀盐酸、稀不反应;②与浓反应:③与硝酸反应:(浓)(稀)(5)与盐溶液反应:二、铜的化合物1、氧化物、C等还原:CuO是不溶于水的碱性氧化物,具有较强的氧化性,在加热时能被CO、H2,;可与酸反应:。
呈砖红色,可用于制红色玻璃,本身较稳定,但在酸液中易发生歧化反应生成Cu和。
2、(1)难溶性碱,可与酸反应:。
(2)受热易分解:(3)有弱氧化性,新制的悬浊液能氧化醛基化合物,本身被还原为,常用于醛基化合物的检验:。
(4)制备:可溶性铜盐与强碱反应:(蓝色絮状沉淀)。
3、铜盐常见的铜盐有等。
(1)颜色:无水呈棕黄色,硫酸铜晶体(,又称胆矾或蓝矾)呈蓝色,其浓溶液呈绿色,无水硫酸铜呈白色,及其溶液呈蓝色。
常用无水硫酸铜白色粉末检验水蒸气或水的存在。
(2)化学性质①水解性,其水溶液显弱酸性:。
②氧化性,与金属单质反应:。
③与强碱反应:。
④胆矾受热可失去结晶水变成白色粉末,过热时,会进一步分解出。
⑤可溶性铜盐能与HS或反应生成黑色的沉淀,它难溶于强酸,常用于的检2验。
⑥易与形成络离子。
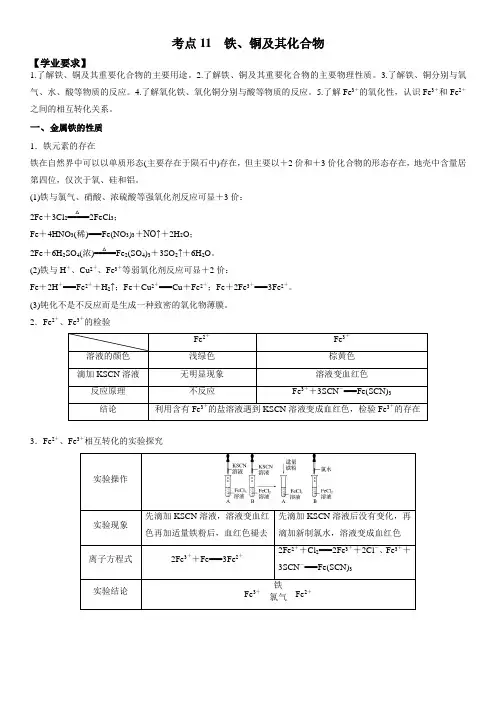
考点11 铁、铜及其化合物【学业要求】1.了解铁、铜及其重要化合物的主要用途。
2.了解铁、铜及其重要化合物的主要物理性质。
3.了解铁、铜分别与氧气、水、酸等物质的反应。
4.了解氧化铁、氧化铜分别与酸等物质的反应。
5.了解Fe 3+的氧化性,认识Fe 3+和Fe 2+之间的相互转化关系。
一、金属铁的性质1.铁元素的存在铁在自然界中可以以单质形态(主要存在于陨石中)存在,但主要以+2价和+3价化合物的形态存在,地壳中含量居第四位,仅次于氧、硅和铝。
(1)铁与氯气、硝酸、浓硫酸等强氧化剂反应可显+3价: 2Fe +3Cl 2=====△2FeCl 3;Fe +4HNO 3(稀)===Fe(NO 3)3+NO↑+2H 2O ; 2Fe +6H 2SO 4(浓)=====△Fe 2(SO 4)3+3SO 2↑+6H 2O 。
(2)铁与H +、Cu 2+、Fe 3+等弱氧化剂反应可显+2价:Fe +2H +===Fe 2++H 2↑;Fe +Cu 2+===Cu +Fe 2+;Fe +2Fe 3+===3Fe 2+。
(3)钝化不是不反应而是生成一种致密的氧化物薄膜。
2.Fe 2+、Fe 3+的检验Fe 2+Fe 3+溶液的颜色 浅绿色 棕黄色 滴加KSCN 溶液无明显现象 溶液变血红色 反应原理 不反应Fe 3++3SCN -===Fe(SCN)3结论利用含有Fe 3+的盐溶液遇到KSCN 溶液变成血红色,检验Fe 3+的存在3.Fe 2+、Fe 3+相互转化的实验探究实验操作实验现象先滴加KSCN 溶液,溶液变血红色再加适量铁粉后,血红色褪去 先滴加KSCN 溶液后没有变化,再滴加新制氯水,溶液变成血红色离子方程式2Fe 3++Fe===3Fe 2+2Fe 2++Cl 2===2Fe 3++2Cl -、Fe 3++3SCN -===Fe(SCN)3 实验结论Fe 3+铁氯气Fe 2+二、铁的重要化合物及其转化 1.铁的重要氧化物——Fe 2O 3 (1)俗名:铁红。
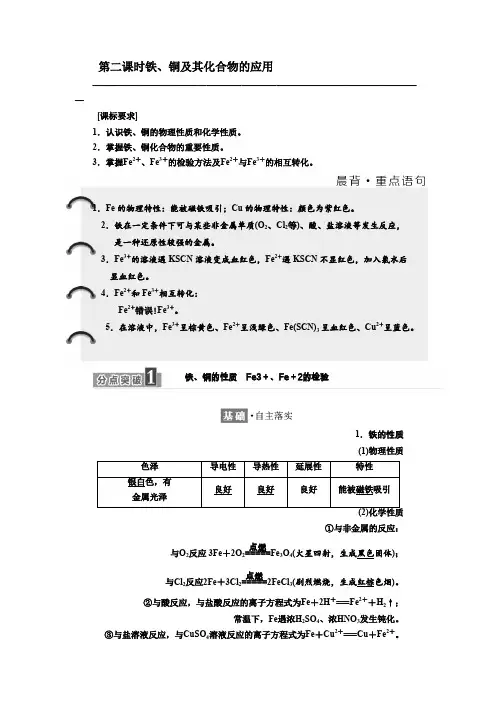
第二课时铁、铜及其化合物的应用——————————————————————————————————————[课标要求]1.认识铁、铜的物理性质和化学性质。
2.掌握铁、铜化合物的重要性质。
3.掌握Fe 2+、Fe 3+的检验方法及Fe 2+与Fe 3+的相互转化。
1.Fe 的物理特性:能被磁铁吸引;Cu 的物理特性:颜色为紫红色。
2.铁在一定条件下可与某些非金属单质(O 2、Cl 2等)、酸、盐溶液等发生反应, 是一种还原性较强的金属。
3.Fe 3+的溶液遇KSCN 溶液变成血红色,Fe 2+遇KSCN 不显红色,加入氯水后显血红色。
4.Fe 2+和Fe 3+相互转化:Fe 2+错误!Fe 3+。
5.在溶液中,Fe 3+呈棕黄色、Fe 2+呈浅绿色、Fe(SCN)3呈血红色、Cu 2+呈蓝色。
铁、铜的性质 Fe3+、Fe +2的检验1.铁的性质 (1)物理性质①与非金属的反应:);固体黑色火星四射,生成(4O 3Fe =====点燃2反应 3Fe +2O 2与O )。
色烟红棕剧烈燃烧,生成(32FeCl =====点燃2反应2Fe +3Cl 2与Cl ②与酸反应,与盐酸反应的离子方程式为Fe +2H +===Fe 2++H 2↑;常温下,Fe 遇浓H 2SO 4、浓HNO 3发生钝化。
③与盐溶液反应,与CuSO 4溶液反应的离子方程式为Fe +Cu 2+===Cu +Fe 2+。
2.铜的性质(1)物理性质紫红颜色:良好。
色;导电性、导热性和延展性:(2)化学性质①与非金属反应:与O2反应:2Cu+O2高温,2CuO;与Cl2反应:Cu+Cl2点燃,CuCl2。
(剧烈燃烧,生成棕黄色烟)②与盐溶液反应:与AgNO3溶液反应的离子方程式为Cu+2Ag+===Cu2++2Ag。
3.Fe3+、Fe2+的检验(1)检验方法(2)Fe3+与KSCN反应的离子方程式为Fe3++3SCN-===Fe(SCN)3。

铁铜化学性质概括work Information Technology Company.2020YEAR铁、铜的性质(一)铁及其化合物的性质1、铁在周期表中的位置及结构铁位于第四周期第Ⅷ族,电子排布式为:1s22s22p63s23p63d64s2原子结构示意图为在化学反应中易失去两个或三个电子形成+2或+3价:Fe―2e―=Fe2+;Fe―3e―=Fe3+2、纯铁具有银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
纯铁的抗腐蚀能力很强,通常我们所见的铁中由于含有碳等物质,抗腐蚀能力较弱,易发生电化腐蚀。
在酸性介质中发生:析氢腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H+=H2;在中性或碱性介质中发生:吸氧腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H2O+O2+4e- =4OH-3、化学性质:铁是较活泼的金属,易失去最外层和次外层的电子,常显+2、+3价,且Fe3+比Fe2+稳定。
(1)与非金属反应:铁与强氧化剂反应生成+3价铁的化合物,与弱氧化剂反应生成+2价铁的化合物。
如:3Fe+2O2Fe3O4;2Fe+3Cl22FeCl3;Fe+S FeS(2)与水反应:铁在加热至红热时能与水蒸气发生反应。
3Fe+4H2O(g)Fe3O4+4H2常温下,铁与水不起反应,但在水和空气里O2、CO2等共同作用下,铁易被腐蚀。
(3)与酸反应:非氧化性酸:Fe+2H+=Fe2++H2↑氧化性酸:常温下,铁遇浓硫酸、浓硝酸会钝化,加热条件下可发生氧化还原反应。
Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2OFe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O(4)与盐溶液反应:Fe+Cu2+=Fe2++Cu;Fe+2Fe3+=3Fe2+4、铁的重要化合物:铁的氧化物名称氧化亚铁氧化铁四氧化三铁化学式FeO Fe2O3 Fe3O4价态+2 +3 +2、+3俗名铁红磁性氧化铁名称氧化亚铁氧化铁四氧化三铁色态黑色粉末红棕色粉末黑色晶体溶解性不溶于水与HCl反应①②③与HNO3反应④⑤⑥与HI反应⑦⑧⑨特性不稳定。
铜及其化合物的性质铜是一种常见的金属元素,化学符号为Cu,原子序数为29,位于元素周期表的第4周期和d区。
在自然界中,铜以众多化合物的形式存在,如氧化物、硫化物、碳酸盐等。
铜及其化合物具有多种物理和化学性质,下面将对其进行详细介绍。
一、铜的物理性质1. 颜色:铜是一种具有金属光泽的红橙色固体。
2. 密度:铜的密度为8.96克/立方厘米,属于中等密度的金属。
3. 熔点和沸点:铜的熔点为1083℃,沸点为2567℃,属于高熔点和高沸点的金属。
4. 电导率:铜是一种非常优良的电导体,其电导率比任何其他金属都高。
因此,铜常被用于制造电器线和电线。
5. 热导率:铜是一种优良的热导体,其热导率也比大多数金属高。
因此,铜常被用于制造散热器、加热器和其他高温设备的零件。
6. 可塑性:铜是一种非常可塑的金属,可以轻易地被锤击成薄片或拉抻成细丝。
7. 韧性:铜是一种具有较高韧性的金属,它可以被制成各种各样的形状和尺寸而不会折断或破裂。
二、铜的化学性质1. 可被氧化:铜是一种容易被氧化的金属,当铜暴露在空气中时,会逐渐变成黑色的铜氧化物。
2. 不可与水反应:铜不会与水反应,因此它是一种不可溶于水的固体。
3. 可与酸反应:虽然铜不与水反应,但它会和酸发生反应。
例如,铜和稀盐酸反应会产生氢气和铜盐。
4. 可与碱反应:铜可以和碱反应,例如,铜和氢氧化钠反应会产生氢氧化铜和水。
5. 可与氧化剂反应:铜可以和氧化剂反应,例如,铜和硝酸反应会产生氮氧化物和水。
因此,在处理铜时,需要小心处理避免与氧化剂接触。
6. 不可被纯时间草酸溶解:铜不可被纯时间草酸溶解,但可以被加入氧化铜和盐酸或硝酸混合溶液中溶解。
三、铜的化合物性质1. 氧化铜(CuO):铜氧化物是一种黑色固体,具有强氧化性,可以作为催化剂、试剂和颜料使用。
2. 亚硫酸铜(CuSO3):亚硫酸铜是一种蓝色固体,主要用于制造染料、医药和农药。
3. 碳酸铜(CuCO3):碳酸铜是一种绿色粉末状物质,主要用于制造颜色明亮的油漆和颜料。
元素及其化合物的性质归纳整常见元素及其化合物的性质归纳整理第一部分金属元素一、钠及其重要化合物二、镁的性质1. 物理性质:具有银白色金属光泽,良好的导电、导热性、延展性。
密度较小,熔点较低,硬度较小2. 化学性质:三、铝及其化合物的性质 1、铝的性质①与非金属反应 4Al+3O2 点燃2 Al2O 3 ②铝热反应 2Al+Fe2O 3 高温 Al 2O3+2Fe(焊接铁轨) ③与酸反应2Al+6HCl == 2AlCl3+3H2 ↑④与碱反应2Al+2NaOH+2H2O == 2NaAlO2+3H2↑ 2、Al2O3(两性氧化物)①与酸反应Al 2O 3 +6HCl == 2AlCl3 + 3H2O Al 2O 3 + 6H+ ==2Al3+ + 3H2O ②与碱溶液反应 Al 2O 3 + 2NaOH === 2NaAlO2 + H2OAl 2O 3+ 2OH- === 2AlO2-+ H2O3、Al(OH)3(两性氢氧化物)①与酸反应Al(OH)3 +3HCl ==AlCl3 + 3H2O ②与碱反应 Al(OH)3 + NaOH===NaAlO2 + 2H2O ③受热分解 2Al(OH)34、Al(OH)3 制备AlCl 3 +3NH3·H 2O=Al(OH)3 ↓+3NH4Cl NaAlO 2 +CO 2+ 2H2O =Al(OH)3 ↓+ NaHCO 3 5、从铝土矿提取铝(优化32页)酸溶法碱溶法Al 2O 3+ 3H2O④ 电离方程式 H + + AlO2-+ H2O Al(OH)3 Al 3+ + 3 OH-四、铁及其化合物的性质 1、铁的性质物理性质:纯净的铁是光亮的银白色金属,密度大,熔沸点高,有延展性、导热性和导电性。
化学性质:①与氧化性不太强的氧化剂反应,生成+2价化合物如S .I 2.H +.Fe 3+.Cu 2+Fe +CuSO4 = Cu + FeSO4 Fe +SFeS Fe +2Fe3+ ===3 Fe2+Fe +2HCl == FeCl2 + H2↑②与强氧化剂反应,生成+3价化合物如Cl 2.Br 2.HNO 3.浓H 2SO 4(△) 等氧化为Fe 3+。
金属铁、铜、镁及其化合物的方程式(离子方程式)书写练习单质铁1、铁和盐酸反应:__________________________离子方程式:______________________2、铁和氯化铜反应:________________________ 离子方程式:_____________________3、铁和硫粉共热:_________________________________4、铁在电化学中(负极、阳极)电极反应电解质溶液是酸溶液时:________________________________________电解质溶液是碱溶液时:________________________________________5、铁的析氢腐蚀:负极反应___________________________________________正极反应___________________________________________总反应_____________________________________________6、铁的吸氧腐蚀: 负极反应___________________________________________正极反应___________________________________________总反应_____________________________________________7、铁和水蒸气在高温下反应:___________________________________________8、铁在纯氧中燃烧:________________________________9、铁在氯气中燃烧:_______________________________10、少量的铁粉和稀硝酸的离子反应______________________________________11、过量的铁粉和浓硫酸在加热条件下的离子反应___________________________________________________________________铁的氧化物1、氧化亚铁和盐酸的离子反应:_________________________________________2、氧化亚铁和浓硝酸的离子反应:________________________________________3、氧化铁和盐酸的离子反应:____________________________________________4、氧化铁和CO在高温下反应:_________________________________________5、氧化铁和HI溶液的反应:_______________________________________________离子反应方程式:_____________________________________________6、四氧化三铁和盐酸反应:_____________________________________________________离子反应方程式:_____________________________________________________7、四氧化三铁和稀硝酸反应:______________________________________________________离子反应方程式:_______________________________________________________ 8、四氧化三铁和HI溶液反应:______________________________________________________离子反应方程式:_______________________________________________________铁的氢氧化物1、向氯化亚铁溶液中加入NaOH溶液的现象__________________________________________ 相关反应方程式_________________________________________________________________2、氢氧化亚铁和盐酸反应:______________________________________________3、氯化铁和氢氧化钠溶液反应:________________________________________________4、氢氧化铁和盐酸反应:________________________________________________5、氢氧化铁中加入HI溶液的离子反应______________________________________________6、氢氧化铁受热分解:_____________________________________________________________ 铁盐1、溴(碘)化亚铁中通入足量氯气的离子反应:_________________________________________溴(碘)化亚铁中通入少量氯气的离子反应:________________________________________溴(碘)化亚铁中通入等量氯气的离子反应:________________________________________2、工业流程上将Fe2+装化为Fe3+的一般方法的离子反应_________________________________3、向硝酸亚铁溶液中加入稀硫酸的离子反应__________________________________________4、向氯化亚铁溶液中加入酸性高锰酸钾溶液的离子反应_______________________________________________________________________________ 5、简述氯化亚铁溶液加热蒸干、灼烧后的产物以及化学变化过程________________________________________________________________________________ 6、铁盐净水原理_______________________________________________________7、除氯化亚铁溶液中的Fe3+的离子反应:_______________________________________________8、用氯化铁溶液腐蚀铜电路板的离子反应:__________________________________________9、向氯化铁溶液中加入KI溶液的离子反应:__________________________________________10、向氯化铁溶液中通入SO2的离子反应:_____________________________________________11、简述高铁酸钾可用于水处理剂的作用原理_________________________________________金属铜及其化合物的方程式(离子方程式)书写练习单质铜1、铜在空气中加热的反应________________________________________________2、铜在潮湿的空气中生锈的反应__________________________________________3、铜在氯气中燃烧的反应________________________________________________4、铜和硫磺加热的反应__________________________________________________5、铜和浓硫酸加热的反应________________________________________________6、铜和浓硝酸的反应____________________________________________________7、铜和稀硝酸的反应____________________________________________________8、铜粉加入到稀硫酸中并通入O2加热的离子反应_________________________________________________9、铜粉加入到稀硫酸中并加入少量的KNO3固体的离子反应_________________________________________________10、铜粉加入到稀硫酸中并加入双氧水的离子反应__________________________________________________铜的氧化物1、氧化铜和盐酸的反应_________________________________________2、氧化铜和CO的反应_________________________________________3、氧化亚铜和盐酸的反应______________________________________氢氧化铜1、氢氧化铜和硫酸的离子反应_____________________________________2、氢氧化铜受热分解的反应________________________________________3、新制氢氧化铜碱性悬浊液氧化醛基(R—CHO)的反应______________________________________________________________铜盐1、向硫酸铜溶液中加入NaOH溶液的离子反应_________________________________2、向硫酸铜溶液中滴加浓氨水的现象和离子反应________________________________________________________________________________________________________ 最后再加入无水乙醇的现象和离子反应____________________________________ ______________________________________________________________________ 3、铜绿受热分解的反应_____________________________________________________金属镁及其化合物的方程式(离子方程式)书写练习1、单质镁在空气中燃烧的所有可能的反应______________________________________________________________________________________________________________2、单质镁投入到氯化铵溶液中的反应___________________________________________3、氮化镁和水的反应________________________________________________________4、向碳酸氢镁中加入过量的NaOH溶液的离子反应_________________________________________________________________________ 5、先向NaOH溶液中加入MgCl2溶液,然后再加入FeCl3溶液的现象和相关的离子反应_________________________________________________________________________。
《铁、铜及其化合物的性质》教学设计
(苏教版化学1)
【课程标准、教材以及学生分析】
本节内容选自江苏教育出版社教材普通高中课程标准实验教科书化学(1)专题三第二单元第二课时。
“铁、铜及其化合物的应用”知识是本专题的重点之一,通过这部分内容的学习,可以加深巩固“从自然界获取铁和铜”的知识,并为下一节“钢铁的腐蚀”的学习奠定基础,故本节教材具有承上启下的作用;本节课的知识体系打破了以往元素化合物知识学习中的“结构-性质-制备-用途”的传统模式,而是从人们熟悉的这些元素及其化合物在生产生活中懂得应用事例着手,引发学生思考,进而产生探究的欲望。
初中已经介绍了铁的物理性质和基本的化学性质,在专题2中学生已初步学习了氧化还原、离子反应等基本概念,也接触过金属钠的学习具有实验探究的经验,使学生能在教师指导下通过实验探究Fe2+、Fe3+之间的转化,来提高实验能力和实验方案设计能力以及分析归纳掌握新知识,同时启发学生运用氧化还原的观点理解转化的实质。
高一学生有很强的好奇心,尤其对化学实验充满期待和向往,因此创设教学情境,激发学生学习化学、思考化学的积极性,促使学生学习方法的改变显得尤为重要。
【教学目标】
知识与技能目标:
(1)使学生学会用化学方法检验Fe3+
(2)使学生掌握Fe2+的性质及Fe2+、Fe3+之间的相互转化
能力目标:
(1)通过学生动手探究实验,提高学生的实验操作能力及增强其实验意识,培养学生观察、分析、推理能力。
(2)能初步学会根据具体情况设计解决化学问题的实验方案,并且学习如何评价方案。
(3)通过新旧知识联系,培养学生知识迁移、扩展能力。
情感态度目标
(
1)通过以化学实验为主的多种探究活动,使学生体验科学研究的过程,激发学生学习化学的兴趣。
(2)认识化学与人类生产、生活的密切关系。
体会铁、铜及其化合物的使用对人类生产、生活及人类身体健康的重要作用。
【教学重难点】
重点:Fe2+、Fe3+之间的相互转化; Fe3+的鉴别
难点:Fe2+、Fe3+的相互转化
流程图:
【教学过程】
环节教师活动学生活动设计意图
环节一趣味实验引入课题【趣味实验导入】葡萄糖
酸亚铁口服液遇浓茶水
变黑。
图片资料:缺铁性贫血的
发病率。
缺铁性贫血患者需要补
充Fe2+,了解Fe2+在血液
中起到的重要作用。
学生观察实验
学生认识缺铁性贫血,
了解Fe2+在血液中起到
的重要作用。
通过趣味实
验,激发学生
兴趣
环节二Fe2+、Fe3+的相互转化【演示实验】教师演示实
验:FeSO
4
与NaOH反应
【思考】1、为什么氢氧
化钠上部加一层乙酸乙
酯,为什么滴管要伸入溶
液底部?2、为什么
学生观察实验
学生思考、回答
学生写方程式。
Fe2++2OH-=Fe(OH)
2
4Fe(OH)
2
+O
2
+2H
2
O=4
Fe(OH)
3
学生讨论设计实验,并
围绕Fe2+和Fe3+
相互转化的条
件探究这一主
线,通过一系
列实验,激发
学生兴趣,强
化科学探究意
【教学设计反思】
教师的教学是否有效,受多种因素影响,但其中有一个关键因素,就是学生的学习动机,也就是是否愿意学习的问题,学习动机就好像是学习的“催化剂”。
本节课在课堂教学设计中,使学生根据具体情况设计解决化学问题的实验方案,并且动手探究自己设计的实验,真正把实验的主动权交给学生,引导学生从实验中发现新问题,设计新实验,解决新问题,将探索引向深入。
这样一方面可以激发学生学习化学的兴趣,强化科学探究意识,另一方面有利于提高学生的实验操作能力及增强其实验意识。
本节课还从现实生活中提取素材大量素材,引导学生在生活中发现问题,分析问题,最后利用化学知识来解决生活中的问题。