铁及其重要化合物
- 格式:ppt
- 大小:2.77 MB
- 文档页数:14


第三节铁及其重要化合物【复习目标】1.了解铁及其重要化合物的主要性质及其应用。
2.以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应。
3.能鉴别溶液中的Fe2+、Fe3+。
【基础知识梳理】课时一铁的性质及应用一、铁的性质:1.物理性质:银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
2.化学性质:铁是较活泼的金属,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定。
(1)与非金属反应:3Fe + 2O2Fe3O42Fe + 3C122FeCl3(铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色)Fe + S FeS说明铁跟氯气、硫反应时,分别生成+2价和+3价的铁,说明氧化性:氯气>硫.(2)与水反应:①在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易被腐蚀(铁生锈).②在高温下,铁能与水蒸气反应生成H2:3Fe + 4H2O(g) Fe3O4 + 4H2(3)与酸反应:①与非氧化性酸(如稀盐酸、稀H2SO4等)的反应.例如:Fe + 2H+=Fe2++ H2↑②与氧化性酸。
a.HNO3(稀)过量时生成Fe3+:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O。
b.铁粉过量时生成Fe2+:3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2Oc.铁遇到冷的浓H2SO4、浓HNO3时,产生钝化现象,因此金属铁难溶于冷的浓H2SO4或浓HNO3中.(4)铁与盐溶液的反应①铁能与比它活动性弱的金属的盐溶液反应,置换出这种金属。
Fe+CuSO4===Cu+FeSO4。
②铁能与FeCl3溶液反应生成FeCl2。
离子方程式:2Fe3++Fe===3Fe2+。
【整合拓展】1、铁与氧化性不同的氧化剂反应,其产物中铁的化合价有什么异同?2、铁与不同量的稀硝酸反应过程理解【跟踪训练】1、下列物质可由相应的单质直接化合而成的是①FeS ②CuS ③FeCl 2 ④Al 2S 3 ⑤Fe 3O 4 ⑥Fe 2O 3A 、①③⑤B 、②③④C 、①④⑤D 、①②③④⑤2、将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是 A 、硫酸 B 、氯水 C 、硝酸锌 D 、溴水3、把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子 A 、是Fe 3+和Cu 2+ B 、是Fe 2+和Cu 2+ C 、是Fe 2+和Fe 3+ D 、只有Fe 2+4、下列图象是表示铁跟一定量硝酸反应时,铁和硝酸铁之间物质的量(mo1)的关系,其中正确的是课时2 铁的氧化物及氢氧化物二、铁的氧化物及氢氧化物1.铁的氧化物FeO Fe 2O 3(铁红)Fe 3O 4(磁性氧化铁)化合价+2+2+2、+3色、态黑色粉未红棕色粉未黑色晶体水溶性均不溶于水和H +反应FeO + 2H + = Fe 2+ + H 2O Fe 2O 3 + 6H + = 2Fe 3+ + 3H 2OFe 3O4 + 8H + = 2Fe 3+ +Fe 2+ + 4H 2O 与CO 的反应稳定性在空气中氧化为Fe 3O 4空气中稳定在空气中稳定制备高温熔融,过量的铁与O 2反应:2Fe+O 22FeO氢氧化铁加热分解2Fe(OH)3 Fe 2O 3+3H 2O铁在氧气中燃烧3Fe + 2O 2Fe 3O 4【整合拓展】Fe 3O 4中有1/3的Fe 是 价,有2/3的Fe 是 价,可写成 ,但不能认为Fe 3O 4是FeO 和Fe 2O 3的混合物,实际上是纯净物。
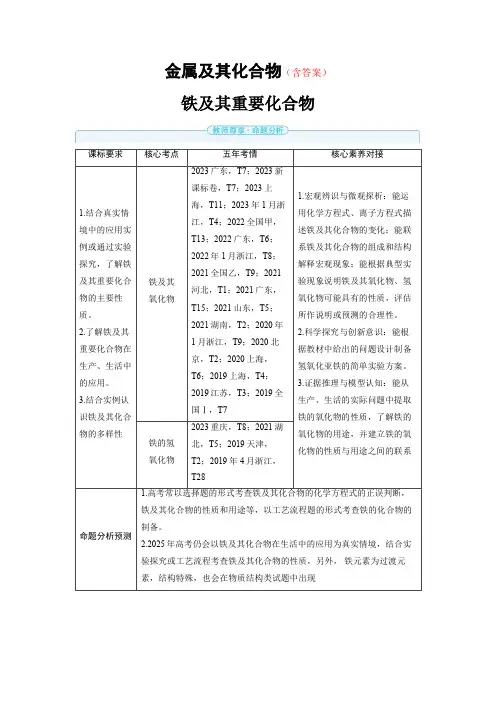
金属及其化合物(含答案)铁及其重要化合物课标要求核心考点五年考情核心素养对接1.结合真实情境中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质。
2.了解铁及其重要化合物在生产、生活中的应用。
3.结合实例认识铁及其化合物的多样性铁及其氧化物2023广东,T7;2023新课标卷,T7;2023上海,T11;2023年1月浙江,T4;2022全国甲,T13;2022广东,T6;2022年1月浙江,T8;2021全国乙,T9;2021河北,T1;2021广东,T15;2021山东,T5;2021湖南,T2;2020年1月浙江,T9;2020北京,T2;2020上海,T6;2019上海,T4;2019江苏,T3;2019全国Ⅰ,T71.宏观辨识与微观探析:能运用化学方程式、离子方程式描述铁及其化合物的变化;能联系铁及其化合物的组成和结构解释宏观现象;能根据典型实验现象说明铁及其氧化物、氢氧化物可能具有的性质,评估所作说明或预测的合理性。
2.科学探究与创新意识:能根据教材中给出的问题设计制备氢氧化亚铁的简单实验方案。
3.证据推理与模型认知:能从生产、生活的实际问题中提取铁的氧化物的性质,了解铁的氧化物的用途,并建立铁的氧化物的性质与用途之间的联系铁的氢氧化物2023重庆,T8;2021湖北,T5;2019天津,T2;2019年4月浙江,T28命题分析预测1.高考常以选择题的形式考查铁及其化合物的化学方程式的正误判断,铁及其化合物的性质和用途等,以工艺流程题的形式考查铁的化合物的制备。
2.2025年高考仍会以铁及其化合物在生活中的应用为真实情境,结合实验探究或工艺流程考查铁及其化合物的性质,另外,铁元素为过渡元素,结构特殊,也会在物质结构类试题中出现考点1铁及其氧化物1.铁(1)铁的物理性质颜色、状态导电性、导热性、延展性特性[1]银白色固体或[2]灰黑色粉末良好[3]易被磁铁吸引(2)从原子结构角度认识铁的化学性质铁元素在元素周期表中处于第[4]四周期第[5]Ⅷ族,其原子结构示意图为,最外层有2个电子,在反应中易[6]失去电子,故铁单质的化学性质活泼,有较强的[7]还原性。

导电、导热性、延展性特性良好被磁铁吸引按要求书写下列反应的方程式:常温下:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3点燃时:3Fe +2O 2Fe 3O 4=====点燃SFe +S FeS=====△ ②Fe 与水蒸气的反应:3Fe +4H 2O(g)Fe 3O 4+4H 2。
=====高温③与酸的反应:a .与非氧化性酸反应的离子方程式:Fe +2H +===Fe 2++H 2↑。
b .与氧化性酸反应:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应,但无H 2产生。
④与某些盐溶液的反应:a .与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
b .与FeCl 3溶液反应的离子方程式:Fe +2Fe 3+===3Fe 2+。
2.铁的氧化物化学式FeOFe 2O 3Fe 3O 4俗名铁红磁性氧化铁颜色状态黑色粉末红棕色粉末黑色晶体(有磁性)溶解性难溶于水难溶于水难溶于水铁的化合价+2+3+2,+3稳定性不稳定稳定稳定与H +反应的离子方程式FeO +2H +===Fe 2++H 2OFe 2O 3+6H +===2Fe 3++3H2OFe 3O 4+8H +===Fe 2++2Fe 3++4H 2O3.铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体与盐酸反应Fe(OH)2+2H +===Fe 2++2H 2OFe(OH)3+3H +===Fe 3++3H 2O 受热分解2Fe(OH)3Fe 2O 3+3H 2O ====△制法可溶性亚铁盐与碱溶液反应Fe 2++2OH -===Fe(OH)2↓可溶性铁盐与碱溶液反应Fe 3++3OH -===Fe(OH)3↓二者的关系在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)31.下列有关铁及其化合物的性质与用途具有对应关系的是A.铁粉具有还原性,可用作食品保存的抗氧化剂B.纳米Fe3O4能与酸反应,可用作铁磁性材料C.FeCl3溶液呈酸性,可用于腐蚀印刷电路板上的CuD.聚合硫酸铁能水解并形成胶体,可用于自来水的消毒【答案】A【解析】A.铁粉具有还原性,能消耗食品包装袋内的氧气,可用作食品保存的抗氧化剂,故选A;B.Fe3O4具有磁性,所以纳米Fe3O4可用作铁磁性材料,与Fe3O4能与酸反应无关,故不选B;C.FeCl3溶液可用于腐蚀印刷电路板上的Cu,是因为Fe3+能把Cu氧化为Cu2+,故不选C;D.聚合硫酸铁能水解并形成胶体,可用于净水,不能消毒,故不选D;选A。


第3课时铁的重要化合物1.铁(1)铁的存在铁元素在地壳中的含量仅次于氧、硅和铝,主要以+2和+3价化合物的形式存在。
(2)物理性质铁是银白色金属,具有金属光泽,质软,熔沸点高,具有良好的导电、导热性,可以被磁铁吸引,也可以被磁化。
铁粉呈黑色。
2.铁的氧化物(1)物理性质。
①氧化亚铁(FeO):不溶于水的黑色粉末。
②氧化铁(Fe2O3):俗称铁红,不溶于水的红棕色粉末。
③四氧化三铁(Fe3O4):俗称磁性氧化铁,不溶于水的黑色晶体.(2)化学性质.①稳定性Fe2O3、Fe3O4较稳定;FeO不稳定,受热能氧化为Fe3O4。
②与酸反应:FeO、Fe2O3是碱性氧化物,与盐酸反应的离子方程式。
FeO:FeO+2H+===Fe2++H2O;Fe2O3:Fe2O3+6H+===2Fe3++3H2O。
(3)用途:Fe2O3常用作红色油漆和涂料,赤铁矿主要成分是Fe2O3,是炼铁原料。
3.铁的氢氧化物(1)物理性质Fe(OH)2Fe(OH)3色、白色固红褐色态体固体溶解性难溶于水(2)化学性质①稳定性:Fe(OH)2在空气中易转化为Fe(OH)3,化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3;反应现象:白色沉淀迅速变为灰绿色,最终变为红褐色。
Fe(OH)3受热易发生分解,化学方程式是2Fe(OH)3错误!Fe2O3+3H2O,②与盐酸反应(离子方程式)。
Fe(OH)2:Fe(OH)2+2H+===Fe2++2H2O;Fe(OH)3:Fe(OH)3+3H+===Fe3++3H2O.(3)制备(离子方程式).制备Fe(OH)2:Fe2++2OH-===Fe(OH)2↓。
制备Fe(OH)3:Fe3++3OH-===Fe(OH)3↓。
4.铁盐和亚铁盐(1)Fe2+和Fe3+的检验。
(2)Fe2+与Fe3+的转化。
①实验及现象。
―→溶液由棕黄色变为浅绿色,离子方程式:2Fe3++Fe===3Fe2+↓―→无明显现象↓―→溶液变为红色离子方程式:2Fe2++Cl2===2Fe3++2Cl-②结论.Fe3+错误!Fe2+(3)铁盐的净水作用:向混有少量泥沙的浑水中加入少量Fe2(SO4)3(或明矾),浑水会变澄清。

考点16 铁及其重要化合物一、铁的性质1.铁的物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应: ①与O 2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃时:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应:①与非氧化性酸反应的离子方程式:Fe +2H +===Fe 2++H 2↑。
②与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
Fe 过量 3Fe+8H ++23NO -3Fe 2++2NO↑+4H 2O Fe 不足Fe+4H ++3NO -Fe 3++NO↑+2H 2O(4)与某些盐溶液的反应:①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。
二、铁的氧化物和氢氧化物 1.铁的氧化物的比较铁的氧化物 FeO Fe 2O 3 Fe 3O 4 俗称 无 铁红 磁性氧化铁 色、态 黑色粉末 红棕色粉末黑色晶体 铁的价态 +2+3 +2、+3水溶性 难溶于水 稳定性不稳定性 6FeO+O 22Fe 3O 4 稳定稳定 与非氧化性酸的反应 FeO+2H +Fe 2++H 2OFe 2O 3+6H +2Fe 3++3H 2OFe 3O 4+8H +2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +y COx Fe+y CO 2制取高温熔融,过量的铁与氧气反应 2Fe+O 22FeOFe(OH)3的分解 2Fe(OH)3Fe 2O 3+3H 2O铁在氧气中燃烧3Fe+2O 2Fe 3O 4提醒:(1)Fe 3O 4的组成可用氧化物的形式表示为FeO·Fe 2O 3,即有13的铁显+2价,23的铁显+3价; (2)Fe 3O 4与一般酸反应生成两种盐,Fe 3O 4与稀硝酸反应生成一种盐[Fe(NO 3)3]。



《铁及其重要化合物》教学设计一、设计理念在《铁及其重要化合物》的课程教学中,老师要明确教学方向,引导学生熟悉铁及其重要化合物的相关知识点。
并且在实际教学过程中,能够通过创造性实验探究教学的形式,亲身融入到铁及其重要化合物的创造性实验探究活动当中,希望能够通过铁及其重要化合物的创造性实验探究学习,形成自主探究、积极思考、创新思维的学习思想和学习习惯。
基于此设计理念,本人逐步开展了《铁及其重要化合物》的教学设计。
二、教学分析(一)内容分析在本节课中,我们主要需要让学生认知到铁的基础结构,以及铁元素所衍生的重要化合物。
基于此,本次课程主要针对铁的氧化反应产生的化合物来展开本次教学,主要围绕FeO、Fe2O3、Fe3O4,引导学生认识各类铁的氧化反应产生的化合物的不同结构、形态、作用等,这也是本次课程教学的关键所在。
(二)对象分析结合目前的学情来看,因为班上的学生已经在初中接触过基础化学,并且积累了相关的化学课程实验知识,因此对于相关化学课程实验教学创造性探究的过程和现场不太陌生。
因此,本次教学中,通过对于铁的氧化反应产生的化合物的相关实验创造性探究,不仅能够让学生们更加生动的认识到FeO、Fe2O3、Fe3O4的形成过程。
(三)教法分析本节内容涉及到的知识点多,所以,在教学方法的选择过程中,需要结合学生的实际情况来考虑。
如本次课程中,本人希望通过引导教学的形式,让学生主动探究其铁的氧化反应产生的化合物性质,那么如何来实施这一教学方法呢?就可以结合学生周边熟悉的事物来展开,比如铁锈等。
不仅如此,还可以融合分组讨论、协作共学的形式,让学生们共同自助探讨,从而有效提升其教学的新鲜度和创新度,并且也能够形成系统化、创新化的化学学习体系,为后续的课程学习奠定基础。
三、教学目标(一)知识以及技能1.进一步认知FeO、Fe2O3、Fe3O4的性质以及应用;2. 熟悉Fe(OH)3、Fe(OH)2的制备以及性质;3. 熟悉Fe3+、Fe2+的检验方法以及相互转化;4. 基于引导学和创造性实验探究,能够在实际教学中,培养学生的综合能力。

铁及其重要化合物【考情分析】1.了解铁的主要性质及其应用。
了解铁的重要化合物及其应用。
2.掌握铁及其重要化合物的制备方法。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【重点知识梳理】知识点一铁及其重要化合物的性质1.铁铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
(1)结构(2)铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
(3)铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应②与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③与酸的反应④与某些盐溶液反应Fe +Cu 2+===Fe 2++Cu 、Fe +2Fe 3+===3Fe 2+ 【归纳总结】①Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
③铁与一般氧化剂(如S 、HCl 、FeCl 3、CuSO 4、I 2等)反应时被氧化为Fe 2+,铁与强氧化剂(如Cl 2、Br 2、HNO 3、浓H 2SO 4等)反应时被氧化为Fe 3+。
④在电化学中铁作负极时电极反应式为Fe -2e -===Fe 2+。
(3)铁的冶炼冶炼原理:Fe 2O 3+3CO=====高温2Fe +3CO 2 2.铁的氧化物3.铁的氢氧化物(1)Fe(OH)2是白色絮状物,易被空气中的氧气氧化生成Fe(OH)3,颜色由白色变为灰绿色,最后变为红褐色,方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
《铁及其重要化合物》一、铁和铁的化合物的相互转化关系①③⑥Fe 3O Fe FeCl Fe(OH)3⑩关于铁的几点说明:(1)铁与氯气和硫反应的对比(2)铁和水反应:铁不和冷、热水反应,但在高温下铁粉能和水蒸气反应,反应方程式为(3)常温下,铁遇到浓硫酸或浓硝酸会钝化,阻止内部金属的继续反应。
二、铁的氧化物三、铁的氢氧化物 (1)Fe (OH )2的制备 (2)Fe (OH )受热分解2+3+五、铁三角Fe3+Fe2+Fe巩固练习1.向一定量的Fe、FeO、Fe2O3的混合物中,加入100 mL 1 mol/L的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体。
所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为()A.81.4%B.77.8%C.68.6%D.无法计算2.制印刷电路时常用氯化铁溶液作为―腐蚀液‖,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中()A.有铜无铁B.有铁无铜C.铁、铜都有D.铁、铜都无3.现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·L—1的硫酸溶液50mL,恰好完全反应。
若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为A.1.6a g B.(a-1.6) g C.(a-3.2) g D.1.6 g4.下列物质不能通过化合反应直接得到的是( )①FeCl3②FeCl2③FeS ④Al(OH)3⑤Fe(OH)3⑥Fe3O4⑦Fe(OH)2⑧Na2O⑨Na2O2⑩Na2CO3A.全部B.②④⑤⑦⑨⑩C.②③④⑤⑦⑨D.④⑦5.某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)()A.0.4mol/L B.0.6mol/L C.0.8mol/L D.1.0mol/L6.下列实验中,溶液颜色没有明显变化的是()A.向NaOH溶液中滴入几滴明矾溶液B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液C.足量Na2O2固体加入到酚酞试液中D.FeCl2溶液中滴入KSCN溶液,再滴入少量氯水7.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+ 与Fe3+的物质的量之比为()A.3:2B.3:5C.4:3D.3:48.将热的铁片分别放入下列足量的溶液中,能使溶液质量减轻的是()A.浓HNO3B.CuSO4C.FeCl3D.稀H2SO49.由FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比为21∶8,则混合物中FeO、Fe2O3和Fe3O4的物质的量之比可能是( )A.1∶2∶1B.2∶1∶1C.1∶1∶1D.2∶2∶510.下列几种物质氧化性由强到弱顺序如下: KMnO4>Cl2>FeCl3>I2. 则除去FeCl2溶液中混有的I–应选用 ( )A.KMnO4 B.Cl2 C.FeCl3 D.I211.有一白色固体粉末,可能含有NaCl、Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:(1)将该固体粉末放入足量水中得到无色溶液和白色不溶物。
铁及其重要化合物一、铁1.物理性质:银白色,有金属光泽、质软;密度是7.86g/cm 3,熔点1535℃,沸点2750℃;具有良好的延性和展性;是电和热的导体具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
2.化学性质:铁元素性质活泼,有较强的还原性,发生化学反应时可生成+2、+3两种价态的化合物。
(1)铁与非金属单质的反应 ①铁与氧气的反应Ⅰ.加热反应方程式:3Fe+2O2Fe 3O 4(剧烈燃烧,火星四射,放出大量的热,生成黑色固体物质)Ⅱ.常温下,铁在干燥的空气中很难跟氧气发生化学反应; Ⅲ.在潮湿的空气中,能跟氧气发生化学反应,生成铁锈:2Fe+O 2+2H 2O=2Fe(OH)2 ;4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 ;2Fe(OH)3=Fe 2O 3+3H 2O②铁与氯气的反应方程式:2Fe + 3Cl 22FeCl 3(铁在氯气中燃烧,生成棕黄色的烟)(注意:常、低温下,Fe 与Cl 2不易发生反应,故可用钢瓶盛贮液氯。
③铁与硫单质的反应方程式:Fe + S (2)铁与水的反应【科学探究】按图组装实验装置进行实验:操作要领先加热湿棉花部位,待形成水蒸气后再加热铁粉,以防止发生倒吸。
加热最初排出的是空气,应加热一会儿后,再将导管插入到肥皂水中。
肥皂水不宜太稀,否则吹起的氢气泡太小,点燃时难以有较大的爆鸣声。
实验结束时,先将导气管撤出,再移去酒精灯,以防止倒吸。
反应方程式:3Fe +4H 2O(g)Fe 3O4+4H 2 ;3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2(3)铁与非氧化性酸的反应方程式:Fe+2 HCl=FeCl 2+H 2↑点燃点燃△△(4)铁与氧化性酸反应:①遇冷的浓硫酸或浓硝酸钝化。
在加热条件下与浓硫酸、浓硝酸反应但无H 2产生。
②在加热条件下与浓硫酸、浓硝酸反应但无H 2产生。
与稀硝酸在常温下可以发生如下反应:Ⅰ.HNO 3 (稀)过量时生成Fe 3+:Fe +4HNO 3(稀)=Fe(NO 3)3+NO↑+2H 2O 。
铁及其重要化合物
一、铁单质
1、铁与O2常温下:加热时:
铁与Cl2反应铁与S反应:
2、铁与水蒸气反应
CuCl2溶液反应
FeCl3溶液反应
二、铁的氧化物
FeO、Fe2O3、Fe3O4分别与稀盐酸反应
FeO、Fe2O3、Fe3O4分别与氢气反应
三、Fe(OH)2、Fe(OH)3
Fe(OH)2、Fe(OH)3分别与稀盐酸反应
9、Fe(OH)3在空气中加热得到反应方程式为
Fe(OH)2在空气中加热得到隔绝空气加热得到反应方程式为
10、Fe(OH)2转化成Fe(OH)3
11、Fe(OH)3的制备
Fe(OH)2的制备(三种方法,写出操作步骤)
四、Fe2+和Fe3+
12、Fe2+分别与Cl2、H2O2、MnO4-反应的离子方程式
13、Fe3+分别于Fe、Cu、I-、SO32-反应的离子方程式
14、检验Fe3+的方法
15、检验Fe2+的方法
16、制备Fe(OH)3胶体的方法为
方程式为
五、除杂(写出所加试剂,括号里为杂质)
17、Fe2+(Fe3+)18、Fe2+(Fe3+)19、Fe2+(Cu2+)
20、Fe(Al)21、Fe2O3(Al2O3)22、Cu2+(Fe3+)。