2.2 培养细胞的生长与增殖过程
- 格式:pdf
- 大小:622.05 KB
- 文档页数:9

细胞增殖培养流程细胞增殖培养是一种常用于细胞生物学和生物工程领域的技术,通过对细胞进行适当的培养条件和营养物质供应,使细胞在体外快速增殖和繁衍。
这种技术在生物医药领域中具有重要的应用价值,可以用于细胞研究、新药筛选、组织工程等方面。
细胞增殖培养的流程通常可以分为以下几个步骤:1. 细胞的预处理细胞增殖培养的第一步是对细胞进行预处理,以确保细胞在培养过程中的生长和增殖状态良好。
预处理包括细胞的分离、洗涤和传代等步骤。
分离是将细胞从组织或培养皿中分离出来,常用的方法有胰蛋白酶消化和细胞机械分离等。
洗涤是将细胞用培养基或缓冲液洗涤去除杂质和残留的酶。
传代是将细胞从一个培养皿转移到新的培养皿中,以保持细胞的生长状态。
2. 细胞培养基的选择细胞增殖培养需要选择合适的培养基供给细胞生长所需的营养物质和生长因子。
常用的培养基有DMEM、RPMI 1640、MEM等,不同的细胞类型和研究目的需要选择不同的培养基。
培养基中还可以添加血清、抗生素和缓冲液等物质,以促进细胞的生长和增殖。
3. 细胞的接种和培养接种是将细胞均匀地分布在培养皿中,使细胞能够附着在培养皿表面并进行生长。
接种密度的选择要根据细胞类型和研究目的来确定,一般为每平方厘米约1万至10万个细胞。
接种后,培养皿需要放置在恒温培养箱中,提供适当的温度、湿度和气体环境,以促进细胞的生长和增殖。
4. 细胞的观察和记录在细胞增殖培养过程中,需要定期观察和记录细胞的生长状态和形态特征。
观察可以通过显微镜进行,可以观察细胞的形状、大小、颜色等指标。
记录可以包括细胞数量的统计、细胞密度的计算、细胞生长曲线的绘制等,以便后续的数据分析和实验设计。
5. 细胞的传代和扩增当细胞达到一定的密度和生长状态时,需要进行传代和扩增。
传代是将细胞从一个培养皿转移到新的培养皿中,以避免细胞过度生长和堆积。
扩增是指将细胞进行大规模的培养和增殖,以获得足够数量的细胞用于后续的实验和应用。

细胞培养的一般过程一、准备工作准备工作对开展细胞培养异常重要,工作量也较大,应给予足够的重视,推备工作中某一环节的疏忽可导致实验失败或无法进行。
准备工作的内容包括器皿的清洗、干燥与消毒,培养基与其他试剂的配制、分装及灭菌,无菌室或超净台的清洁与消毒,培养箱及其他仪器的检查与调试,具体内容可参阅有关文献。
二、取材在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。
如是细胞株的扩大培养则无取材这一过程。
机体取出的组织细胞的首次培养称为原代培养。
理论上讲各种动物和人体内的所有组织都可以用于培养,实际上幼体组织(尤其是胚胎组织)比成年个体的组织容易培养,分化程度低的组织比分化高的容易培养,肿瘤组织比正常组织容易培养。
取材后应立即处理,尽快培养,因故不能马上培养时,可将组织块切成黄豆般大的小块,置4℃的培养液中保存。
取组织时应严格保持无菌,同时也要避免接触其他的有害物质。
取病理组织和皮肤及消化道上皮细胞时容易带菌,为减少污染可用抗菌素处理。
由组织并分离分散细胞的方法可参阅有关文献。
三、培养将取得的组织细胞接入培养瓶或培养板中的过程称为培养。
如系组织块培养,则直接将组织块接入培养器皿底部,几个小时后组织块可贴牢在底部,再加入培养基。
如系细胞培养,一般应在接入培养器皿之前进行细胞计数,按要求以一定的量(以每毫升细胞数表示)接入培养器皿并直接加入培养基。
细胞进入培养器皿后,立即放入培养箱中,使细胞尽早进入生长状态。
正在培养中的细胞应每隔一定时间观察一次,观察的内容包括细胞是否生长良好,形态是否正常,有无污染,培养基的PH是否太酸或太碱(由酚红指示剂指示),此外对培养温度和CO2浓度也要定时检查。
一般原代培养进入培养后有一段潜伏期(数小时到数十天不等),在潜伏期细胞一般不分裂,但可贴壁和游走。
过了潜伏期后细胞进入旺盛的分裂生长期。
细胞长满瓶底后要进行传代培养,将一瓶中的细胞消化悬浮后分至两到三瓶继续培养。

体外培养细胞的生长与增殖过程-V1
体外培养细胞是生命科学研究领域中不可或缺的重要手段。
细胞在培
养基中的生长和增殖过程,被广泛用于疾病模型、药物筛选、基因工
程和组织工程方面的研究和应用。
以下是体外培养细胞的生长与增殖
过程的具体内容:
一、培养基的选择
1.基础培养基:常用的包括DMEM、RPMI1640、MEM等。
2.补充因子:用于维持细胞的生长和增殖,如FBS、B27、N2等。
3.抗生素:防止培养基被细菌、真菌等污染。
二、接种细胞
1.消化细胞:用酶或化学方法将细胞从组织或原代培养中分离出来。
2.计算细胞数目:使用细胞计数板或细胞计数仪。
3.培养皿:选择适合细胞生长的培养皿,如培养瓶、6孔板、96孔板等。
4.接种密度:根据细胞的不同特点和实验需求,选择适当的接种密度。
三、培养条件的控制
1.温度:常规为37℃。
2.气氛:常规为5% CO2/空气混合气氛。
3.液面:检查并调整液面,避免干涸和培养基变质。
4.培养时间:根据实验需求,适当调整培养时间。
四、细胞的观察与处理
1.细胞生长状态的观察:通过显微镜观察细胞形态、数量、分裂状态等。
2.细胞处理:进行细胞冻存、传代、取样等操作。
细胞在培养基中的生长与增殖是一个复杂的过程,需要仔细的控制和监测。
只有在做好基础工作、选择合适的培养条件和科学合理的实验设计之后,才能得到可靠的实验结果。

体外培养细胞的生长与增殖过程(1)
一、细胞的生长与增殖过程
细胞生长和增殖是细胞学和生物学中的重要研究内容。
细胞生长指细
胞体积增大,细胞形态变化和代谢活动的增强,是细胞分裂的前提;
细胞增殖指细胞数目的增加,是细胞分裂的结果。
二、体外培养细胞的生长与增殖
体外培养细胞是指将体内原生质体外培养至固定形态的细胞,其能够
在无机溶液和特定的营养物质条件下,维持正常的生长和增殖过程。
在体外培养的细胞中,常常可以观察到以下过程:
1. 细胞贴附和生长:细胞在培养皿上吸附,贴附并向周围扩散,经过
一段时间的培养,细胞的生长速度逐渐增加。
2. 细胞周期:细胞生长的过程不是一直进行,而是依照细胞自身的周
期进行。
一个细胞周期包括G1期、S期、G2期和M期。
其中,S期是DNA合成期,M期是有丝分裂期。
3. 细胞增殖:在适宜的培养条件下,细胞会不断地分裂,增殖数量逐
渐增多。
4. 细胞凋亡:当细胞在生长分化后达到一定阶段,其代谢均衡将失调,细胞停止生长且出现自我消亡迹象,即细胞凋亡。
三、体外培养细胞的应用价值
体外培养细胞技术是现代生命科学研究中非常重要的一部分。
它可以用于细胞生长、发育、增殖与凋亡的机制研究;提供大量、一致的细胞材料,可以用于生物工程、医学检测和药物筛选等。
同时,体外培养细胞还可以用于稳定细胞株的制备,对于生产生物制品、鉴定生物影响因素等方面也有重要的应用价值。
综上所述,体外培养细胞的生长与增殖过程是研究生物学和生命科学的重要方向,其应用价值在现代生命科学研究和工业生产中日益引人注目,具有广泛的应用前景和开发潜力。

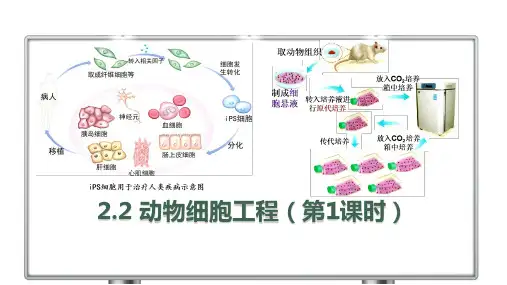
第2章细胞工程第2节动物细胞工程一、动物细胞培养1.概念:从动物体中取出相关的组织,将它分散成单个细胞,然后在适宜的培养条件下,让这些细胞生长和增殖的技术。
2.原理:细胞增殖3.地位:动物细胞工程的基础4.关键操作:原代培养和传代培养。
(一)动物细胞培养的条件1.营养(1)成分①已知成分将细胞所需的营养物质(糖类、氨基酸、无机盐、维生素等)按其种类和所需量严格配制而成的培养基,称为合成培养基。
①未知成分使用合成培养基时,通常需加入血清等一些天然成分。
(2)培养基的物理性质培养动物细胞一般使用液体培养基,也称为培养液。
2.无菌、无毒的环境①对培养液和所有培养用具进行灭菌处理;①在无菌环境下进行操作;①还需要定期更换培养液。
3.温度、pH和渗透压(1)适宜的温度:哺乳动物细胞培养的温度多以36.5±0.5①为宜。
(2)适宜的pH:多数动物细胞生存的适宜pH为7.2~7.4。
(3)适宜的渗透压:维持适宜渗透压的目的维持细胞正常的形态和功能。
4.气体环境(1)组成:动物细胞培养所需气体主要有O2和CO2。
(2)气体作用:①O2:O2是细胞代谢所必需的;①CO2:CO2的主要作用维持培养液的pH。
(二)动物细胞培养的过程①原代培养:将分瓶之前的细胞培养,即动物组织经处理后的初次培养称为原代培养。
①传代培养:将分瓶后的细胞培养称为传代培养;①细胞贴壁:大多数体外培养的细胞需要贴附于某些基质表面才能生长增殖,这类细胞往往贴附在培养瓶的瓶壁上,这种现象称为细胞贴壁;①接触抑制:当贴壁细胞生长到表面相互接触时,细胞通常会停止分裂增殖。
1.取动物组织(1)取材:动物胚胎或幼龄动物的组织、器官。
(2)取材原因:细胞分化程度低,增殖能力强,容易培养。
2.制成细胞悬液(1)制成细胞悬液的步骤:①将组织分散成单个细胞;①用培养液将细胞制成细胞悬液。
(2)将组织分散成单个细胞的原因:①从动物体取出的成块组织中,细胞与细胞靠在一起,彼此限制了生长和增殖;①能使细胞与培养液充分接触,更易进行物质交换。

细胞增殖、活化、杀伤检测方法解释说明以及概述1. 引言1.1 概述细胞增殖、活化和杀伤是细胞生物学研究中的重要课题。
随着科技的不断进步,人们对细胞行为的了解也越来越深入。
在许多领域,如医学、生物工程和药物研发等,准确检测细胞的增殖、活化和杀伤情况至关重要。
细胞增殖是指细胞数量的增加过程,在生理和病理状态下都会发生。
了解细胞增殖速度不仅可以帮助我们了解细胞生长的规律,还可以评估某些疾病如癌症的发展程度。
因此,开发可靠且准确测量细胞增殖的方法是非常关键的。
细胞活化是指刺激后细胞内代谢水平的提高。
对于一些需要评估生物材料耐受性或测试新药剂对细胞外治疗效果时,准确测定细胞是否被有效激活至关重要。
细胞杀伤是通过某种方式使得部分或全部细胞死亡。
在免疫学、毒理学等领域中,准确检测细胞杀伤效果可以帮助我们评估药物或其他物质对细胞的影响程度。
为了解决这些问题,科学家们开发了多种方法来检测细胞的增殖、活化和杀伤情况。
本文的目的是对这些方法进行详细的解释说明,并概述它们各自的优势和局限性。
1.2 文章结构本文按照以下结构展开:首先是引言部分,介绍了文章涉及的主题和目的;接下来将分别详细介绍细胞增殖、活化和杀伤检测方法;最后对各种方法进行比较,总结研究结果并展望未来的研究方向。
1.3 目的本文的目的是提供一个全面而清晰的概述,使读者能够了解不同的细胞增殖、活化和杀伤检测方法。
通过详细讨论每种方法的原理、应用范围以及其优缺点,读者可以选择适合自己研究目标和实验条件的最佳技术。
此外,本文还将对未来的研究方向进行展望,以促进该领域更深入且有针对性的探索和发展。
2. 细胞增殖检测方法细胞增殖是指细胞通过分裂和繁殖产生新的细胞的过程。
在许多研究领域,如药物筛选、癌症治疗和组织工程等,准确评估细胞增殖能力至关重要。
本节将介绍几种常用的细胞增殖检测方法。
2.1 细胞计数法细胞计数法是最传统也是最常用的一种细胞增殖检测方法之一。
该方法通过显微镜下观察并手动计数已经增殖的细胞数量来评估细胞的增长情况。



体外培养细胞的生长与增殖过程(一)体外培养细胞是现代细胞学研究的重要基础,也是医学研究的重要手段之一。
体外培养细胞的生长和增殖是一个复杂的过程,需要精细的培养条件和细致的管理。
本文将从以下几个方面介绍体外培养细胞的生长和增殖过程。
一、细胞的接种和传代体外培养细胞的生长和增殖需要一个适当的组织培养基和细胞接种。
传统的组织培养基是红细胞凝集素(RPMI-1640)或培养基199等,它们含有适量的营养成分和生长因子,可以促进细胞生长。
细胞接种需要一定的密度,通常为1×105~1×106个/ml。
传代是细胞培养过程中必不可少的一个环节。
当细胞达到一定密度时,需要将细胞分离到新的培养瓶中,以避免细胞过于拥挤而妨碍生长。
二、生长曲线体外培养细胞的生长呈S型曲线,包括四个阶段:潜伏期、对数期、瓶颈期和平台期。
潜伏期是指细胞在初始接种后的一段时间内,细胞数量没有明显变化。
对数期是指细胞增殖达到指数增长阶段,此时细胞最为活跃,速度也是最快的。
瓶颈期是指细胞数量增长缓慢并维持在一个相对稳定的水平,此时通常需要进行传代。
平台期是指细胞数量不再增加,生长停滞。
三、增殖与分化细胞的增殖是指细胞数目不断增加的过程,是体外培养细胞生长的一个重要指标。
细胞分化是指在体外条件下,细胞具有表型(形态、功能)上的变化和特化,并且达到一定稳定状态的过程。
体外培养细胞的增殖与分化是相辅相成的过程。
四、影响细胞生长的因素细胞培养过程中,细胞生长受到多种因素的影响。
其中最重要的因素是培养基成分,包括营养成分、生长因子、基质和血清等。
其次是pH 值、温度、湿度、氧气浓度和细胞密度等因素。
此外,能够滋养细胞,维护生长的关键还在于培养容器、培养条件以及细胞管理等诸多因素。
五、细胞应用体外培养细胞不仅是理解生命本质和人类疾病的基础,还能够应用于多种领域。
例如,细胞培养可用于生产生物制品,如疫苗和药物。
此外,它还可以用于细胞和分子生物学研究,包括基因工程、细胞分离和筛选技术等。

细胞的增殖细胞的增殖是生物体内细胞数量增加的过程。
细胞增殖是细胞生命周期的一个重要阶段,对于生物的生长、发育以及组织修复具有至关重要的作用。
在生命体内,细胞增殖的调控是由多种生物学过程紧密协调进行的。
细胞增殖的基本过程细胞增殖包含有丝分裂和无丝分裂两种方式。
有丝分裂是指细胞在分裂过程中有明显的纺锤体形成,包括有丝分裂期(前期、中期、后期)和有丝分裂后期。
有丝分裂的过程中,细胞核准备、染色体复制、染色体对分离、细胞质分裂等步骤依次进行,最终形成两个功能和遗传物质相同的子细胞。
而无丝分裂是指细胞在分裂时没有明显的纺锤体形成,包括裂解期和质体分裂期两个阶段。
在无丝分裂过程中,细胞的质体逐渐收缩,最终形成两个独立的细胞。
细胞增殖的调控机制细胞增殖的调控受到复杂的信号通路和调控因子影响。
在正常生理状态下,细胞增殖受到生长因子、细胞周期调控蛋白、细胞凋亡调节等多种因素的调节。
当细胞接收到适当的生长因子刺激时,会启动细胞周期并促使细胞增殖。
而在组织修复或生长发育过程中,细胞增殖也需要受到精细的调控,以确保细胞数量和功能的平衡。
细胞增殖与疾病细胞增殖异常会导致一系列疾病的发生。
比如,癌症的发生往往是由于细胞增殖受到异常调控,导致细胞无限制地增殖和扩散。
因此,研究细胞增殖的调控机制对于理解疾病的发生和防治具有重要意义。
同时,许多药物的作用机制也是通过影响细胞增殖来发挥治疗作用。
总结细胞的增殖是生命体内一项重要的生物学过程,对于生物的生长、发育和组织修复具有重要作用。
了解细胞增殖的基本过程、调控机制以及与疾病的关系,有助于深入理解生命的奥秘,并为医学研究和临床治疗提供重要的参考。
以上是关于细胞的增殖的相关介绍,希望对您有所帮助。
一、概述1.1 biogenous 类器官技术的定义1.2 biogenous 类器官技术的应用领域1.3 biogenous 类器官技术的发展历程二、 biogenous 类器官技术的原理2.1 生物原料的选择与提取2.2 细胞培养与增殖2.3 三维打印技术在生物器官制造中的应用 2.4 生物材料的修饰与改造三、 biogenous 类器官技术的制备过程3.1 生物原料的处理与准备3.2 细胞的培育与增殖3.3 三维生物打印器官的制造3.4 生物材料的修饰与改良四、 biogenous 类器官技术的优势与挑战4.1 优势4.1.1 可降低排异反应的风险4.1.2 能够定制化生物器官4.1.3 制造速度快4.2 挑战4.2.1 生物材料的选择与稳定性4.2.2 三维生物打印技术的精度和速度4.2.3 对生物器官功能的重建五、 biogenous 类器官技术的应用前景5.1 生物器官移植的发展5.2 医疗器械的革新与产业发展5.3 生物医学研究的推动六、结论6.1 biogenous 类器官技术的现状与未来发展趋势6.2 对生物器官技术的展望在现代医学技术领域,biogenous 类器官技术一直备受瞩目。
本手册将全面介绍该技术的原理、制备过程、优势与挑战以及应用前景,以期为广大医学及生物工程领域的研究人员提供参考。
一、概述1.1 biogenous 类器官技术的定义biogenous 类器官技术是指利用生物原料,通过细胞培养、生物材料修饰以及三维生物打印技术,制造人工器官或组织的一种先进技术。
1.2 biogenous 类器官技术的应用领域biogenous 类器官技术的应用领域涵盖了医疗器械领域,包括人工器官移植、体外器官辅助装置等;同时也延伸至生物医学研究领域,用来模拟和研究器官组织的生理、病理过程。
1.3 biogenous 类器官技术的发展历程biogenous 类器官技术自20世纪90年代起开始受到关注,并在随后20年中取得了飞速发展。
培养细胞的生长和增殖过程体内细胞生长在动态平衡环境中,而组织培养细胞的生存环境是培养瓶、皿或其它容器,生存空间和营养是有限的。
当细胞增殖达到一定密度后,则需要分离出一部分细胞和更新营养液,否则将影响细胞的继续生存,这一过程叫传代(Passage或Subculture)。
每次传代以后,细胞的生长和增殖过程都会受一定的影响。
另外,很多细胞特别是正常细胞,在体外的生存也不是无限的,存在着一个发展过程。
所有这一切,使组织细胞在培养中有着一系列与体内不同的生存特点。
(一)培养细胞生命期(Life Span of Culture Cells)所谓培养细胞生命期,是指细胞在培养中持续增殖和生长的时间。
体内组织细胞的生存期与完整机体的死亡衰老基本相一致。
组织和细胞在培养中生命期如何?这要看细胞的种类、性状和原供体的年龄等情况。
人胚二倍体成纤维细胞培养,在不冻存和反复传代条件下,可传30~50代,相当于150~300个细胞增殖周期,能维待一年左右的媸奔洌詈笏ダ系蛲觯ˋpoptosis)。
如供体为成体或衰老个体,则生存时间较短;如培养的为其它细胞如肝细胞或肾细胞,生存时间更短,仅能传几代或十几代。
只有当细胞发生遗传性改变,如获永生性或恶性转化时,细胞的生存期才可能发生改变。
对此以后将详述。
正常细胞培养时,不论细胞的种类和供体的年龄如何,在细胞全生存过程中,大致都经历以下三个阶段:1.原代培养(Primary Culture)期也称初代培养,即从体内取出组织接种培养到第一次传代阶段,一般持续1一4周。
此期细胞呈活跃的移动,可见细胞分裂,但不旺盛。
初代培养细胞与体内原组织在形态结构和功能活动上相似性大。
细胞群是异质的(Heterogeneous),也即各细胞的遗传性状互不相同,细胞相互依存性强。
如把这种细胞群稀释分散成单细胞,在软琼脂培养基中进行培养时,细胞克隆形成率(Cloning Efficiency)很低,即细胞独立生存性差。
细胞工程培养细胞的生长与增殖过程
1.单个细胞的生长过程
细胞周期是指一个母细
胞分裂结束后形成的细胞至
下一次再分裂结束形成两个
期
子细胞的时间,可分为G
1
、S期、G
期和M期。
培养
2
细胞单个细胞的生长过程与
体内细胞单个细胞的生长过
程相似。
2.细胞系的生长过程
原代细胞经培养传代或再培养后,便成为细胞系。
体外培养细胞的生命是有限的,传代培养的细胞最多只能传代30~50代,相当于150~300个细胞周期;国际上用于实验研究的细胞大多在10代以内冻存,这样细胞特性基本保持不变。
细胞系的生长过程原代培养期
传代期
衰退期
为新鲜组织自体内取出并在体外
培养生长至第一次传代的时期。
原代培养的细胞生长一定时间之
后,如贴附型细胞即融合成片而逐
渐铺满底物的表面,此时应将原代
细胞分开接种至2个或更多的新的
培养器皿中,即传代,此即成细胞
系。
一般有限细胞系在此期的细胞开
始时虽仍然存活,但增殖已很缓慢
并逐渐完全停止,进而细胞发生衰
退死亡。
3.每代细胞的生长过程
细胞培养过程中一代
指的是从细胞接种到分
离再培养的一段时间。
与细胞世代或倍增不同
,在细胞一代中细胞倍
增3~6次。
每代细胞生长曲线
每代细胞生长过程滞留期
指数生
长期
停止期
细胞接种后,先进入生长缓慢的滞
留阶段,包括悬浮期(游离期)和潜伏
期。
细胞贴壁后,逐渐伸展,恢复细
胞原有形态,经过一个潜伏期,才进
入生长和增殖期。
又称对数期。
此期为细胞增殖最
旺盛的阶段,细胞分裂相增多,成
倍增长,活力最佳。
又称平台期,此时细胞数量饱和,
细胞不再增殖,但仍有代谢活动。
习题
1.细胞系的生长过程包括那三个阶段?各阶段细胞有何特点?。