重碱的煅烧教学内容
- 格式:ppt
- 大小:216.50 KB
- 文档页数:29




海西州职业技术学校示范校建设项目化工专业“模块化”教学教案科目名称:无机物工艺班级: 13秋化学工艺任课教师:王秉程课程介绍海西职校化工专业教案课题:项目二纯碱的生产海西职校化工专业教案课题:项目二纯碱的生产海西职校化工专业教案课题:任务二石灰石的煅烧及灰乳的制备\海西职校化工专业教案课题:任务三认识流体输送机械由若干个弯曲的叶片组成的叶轮置于具有蜗壳通IS100-80-125型离心泵的特性曲线(1)H-q线离心泵的扬程随流量的增大V而下降。
(2)P-q线轴功率随流量的增大而提高,V流量为零时轴功率最小。
(3)η-q线当q=0时,η=0海西职校化工专业教案课题:项目四精馏海西职校化工专业教案课题:项目四精馏总物料衡算: 'n q 易挥发组分的物料衡算:'',V +1,W W ,L n m n n m q y q x q x ''+= 式中 ',V n q ,',L n q ——分别表示提馏段内每块塔板上升蒸气的摩尔流量和下降液体的摩尔流量,kmol/h ;x '海西职校化工专业教案课题:项目四液体蒸馏=+=(+ V)1RDLD海西职校化工专业教案课题:项目二非均相物系的分离【总结】这节课由于实训设备缺乏,我们只能是纸上谈兵。
但尽可能的用多种方式展示,内容简答可以从三个方面可以逐一击破,首先了解非均相物系的相海西职校化工专业教案课题:项目二非均相物系的分离操作是间歇的,每个操作周期都由装合、过滤、洗涤、卸渣、整理五个阶段组成。
特点:结构简单,过滤面积大,过滤压力高,对各种物料的适应能力强,操作简单,使用可靠。
缺点:间歇生产,生产效率低,装卸板框劳动强度大,海西职校化工专业教案课题:项目三传热【动画放映】管式的主要设备:套管式和列管式的构。

(新人教选修2)1..3纯碱的生产示范教案目标要求:了解纯碱的生产及发展过程了解体现天然碱的生产与化工生产之间的联系及体现技术的发展过程掌握路布兰法-索尔维法-联合制碱法(候氏制碱)教学过程:一、纯碱纯碱化学名为碳酸钠,俗名苏打。
无水碳酸钠是白色粉末,熔点851℃,密度2.532g/cm3,易溶于水,吸湿结块。
它是强酸弱碱盐,容易水解,水溶液呈碱性。
它常以水合物形式存在,常见如,十水合物Na2CO3·10H2O,后者是白色晶体,容易风化,是日常食用碱的主要成分。
纯碱在二氧化碳过量时,转化为碳酸氢钠Na2CO3+CO2+H2O = 2NaHCO3纯碱加热至400℃时开始分解,生成氧化钠和二氧化碳:Na2CO Na2O+CO2↑纯碱与酸类反应生成盐,并放出二氧化碳: Na2CO3+H2SO4 =Na2SO4+ CO2↑+H2O纯碱与石灰水作用生成氢氧化钠------烧碱的反应: Na2CO3+Ca(OH)2 =2NaOH+CaCO3↓纯碱与盐类起复分解反应-----氯化钠精制反应之一:Na2CO3 + CaSO4 = CaCO3↓+ Na2SO4二、氨碱法生产纯碱通入含氨的饱和食盐水中即可。
其主要反应式是1、生产碳酸氢钠和氯化铵:将CO2NH3+CO2+H2O=.NH4HCO3 、NaCl+NH4HCO3= NaHCO3+NH4Cl 。
2、制取碳酸钠:碳酸氢钠(重碱)煅烧制得纯碱;分解出二氧化碳循环使用:CO3+CO2↑+H2O 。
其反应方程式是2NaHCO3Na2(2)用食盐水洗涤煤气(废水中含氨和二氧化碳)时,可能会有白色沉淀,请用化学方程式表示、。
【师、生】(1)有白色晶体析出NaCl+NH4HCO3= NaHCO3+NH4Cl(2)NH3+CO2+H2O=NH4HCO3 NaCl+NH4HCO3= NaHCO3↓+NH4Cl3、注意的问题:(1)氨碱法中加入氨的主要作用:主要作用是让氨与二氧化碳作用NH3+CO2+H2O=.NH4HCO NaCl+NH4HCO3= NaHCO3↓NH4Cl,进而制纯碱2NaHCO3NaCO3+CO2↑+H2O2(2)氨碱法制纯碱的优缺点优点是:原料食盐和石灰石易得,产品纯度高,氨和部分二氧化碳可循环使用,制造步骤简单。

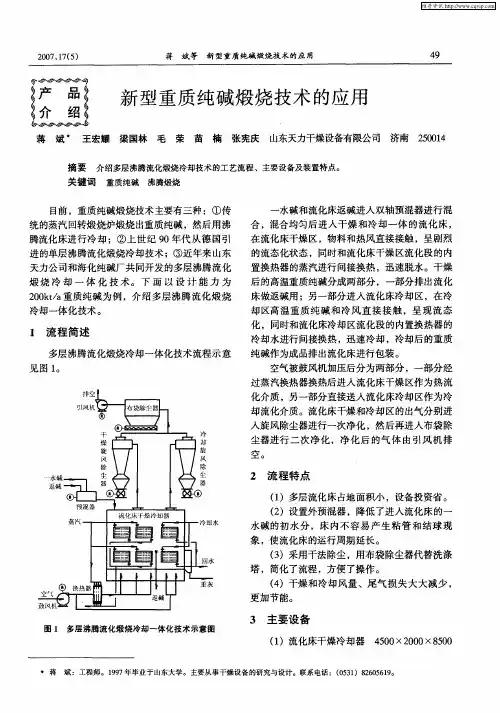
1)重碱工段工艺流程简述::由氯化铵工段来的母液Ⅱ进入蒸吸工序,母液Ⅱ被加热到31℃后进入母液Ⅱ吸氨器,吸收来自合成氨车间、氯化铵工段冷冻工序、以及本工段淡液蒸馏塔来的气氨,使母液Ⅱ的NH3的滴度升至77滴度左右,即成为氨母液Ⅱ(简称氨Ⅱ)自流入氨Ⅱ澄清槽,经澄清后,氨Ⅱ清液流入氨Ⅱ贮槽。
并用氨Ⅱ泵送至碳化工序。
而澄清槽底的沉淀物(即母液中的钙、镁)排掉,(此沉淀物即为氨Ⅱ泥)。
本工段的碳化工序由两部分组成:变换气碳化(制碱)及炉气碳化(制碱)变换气碳化(制碱)的工艺流程说明:由合成氨压缩工段送来的脱硫后的变换气,其含CO2为29.48%, H2S<50mg,压力为1.6Mpa经油分和冷却的变换气,进入碳酸化系统,从碳酸化塔(制碱塔)底部进,顶部出。
压力约1.3mpa 进入清洗塔的底部。
由清洗塔顶部排出的尾气含CO2在0.5~1.0%(本碳化系统共有六个外冷式碳酸化塔,由于外冷式碳酸化塔的连续运行时间能达90天,因此本系统不设置固定的清洗塔,6个塔并联运行,根据作业要求,以某塔为清洗塔。
),此尾气进入尾气洗涤塔,以确保本系统送出的气体能满足合成氨系统对脱碳气中微量氨和CO2的要求(含CO2 为0.5%,NH3<0.2g / Nm3),出碳化系统的尾气的压力约为1.1Mpa,回至合成氨的压缩工段。
联碱生产过程中的氨母液Ⅱ,经氨母液Ⅱ泵加压后,送入氨母液Ⅱ净化塔,由其底部取出,再进入碳酸化(清洗)塔,自上而下流经塔内,溶解碱疤,并吸收从塔底而上的变换气中的CO2(称清洗或预碳酸化过程),然后从碳酸化(清洗)塔底部取出称碳氨母液Ⅱ,用碳氨母液Ⅱ泵将其送至各碳酸化(制碱)塔的顶部,自上而下地吸收从塔底通入的变换气中的CO2,使塔内母液逐步形成过饱和并析出NaHCO3,且在塔下部与冷却水进行间壁换热降温,从而吸收更多的的CO2并逐步使NaHCO3结晶长大,制成的悬浮液,再从塔底取出,至碱液槽,流至滤碱工序经真空过滤机过滤即得重碱和母液Ⅰ。

初中化学制碱教案
一、教学目标:
1. 了解碱的性质及制碱的方法;
2. 掌握主要制碱方法的原理和实验步骤;
3. 能够理解碱的应用领域和重要性。
二、教学重点:
1. 制碱的方法;
2. 制碱的原理;
3. 实验步骤及注意事项。
三、教学难点:
1. 制碱的方法;
2. 制碱实验的步骤。
四、教学准备:
1. 实验器材:烧杯、试管、锅炉等;
2. 实验药品:氢氧化钠、氢氧化钾等;
3. 实验辅助物品:滤纸、酚酞指示剂等。
五、教学过程:
1. 导入:通过举例介绍碱的应用领域和重要性,引起学生的兴趣;
2. 学习碱的性质及制碱的方法,讲解主要制碱方法的原理;
3. 进行制碱实验,让学生亲自操作实验步骤,注意指导学生操作过程中的安全注意事项;
4. 总结实验结果,让学生归纳碱的性质及制碱方法;
5. 布置作业,巩固学生所学知识。
六、板书设计:
1. 碱的性质:碱的酸碱指示性、碱的电离产生的氢氧根离子等;
2. 制碱的方法:氢氧化钠、氢氧化钾等。
七、课后反思:
通过本节课的教学,学生能够了解碱的性质和制碱的方法,提高了他们的实验操作能力和科学素养。
同时,教师要及时总结反思教学过程中存在的问题,进一步完善教学内容,提高教学效果。

高中化学制碱工业教案教学内容:制碱工业教学目标:1. 了解制碱的生产原理和工艺流程。
2. 掌握制碱工业的重要产品、用途和应用。
3. 理解制碱生产对环境和资源的影响。
教学重点:1. 制碱的原理和工艺流程。
2. 制碱工业的重要产品和用途。
教学难点:1. 制碱工业对环境和资源的影响。
2. 制碱工业的未来发展趋势。
教学准备:1. 教材:化学教材2. 实验器材:碱性氧化物溶液、盐酸溶液、PH试纸教学步骤:第一步:引入1. 教师介绍制碱工业的概念,并与学生讨论制碱的重要性及在日常生活中的应用。
2. 引导学生思考,制碱工业如何影响我们的生活和社会。
第二步:制碱原理1. 讲解制碱的原理:碱性氧化物与水反应生成碱性溶液的过程。
2. 进行实验:将碱性氧化物溶液与盐酸溶液反应,观察产生的碱性溶液的性质。
第三步:制碱工艺流程1. 介绍制碱工业的基本流程:氯碱法、氨氯法等。
2. 对比不同工艺流程的优缺点,引导学生思考如何选择合适的生产工艺。
第四步:制碱工业产品和应用1. 讲解制碱工业的主要产品:氢氧化钠、氢氧化钾等。
2. 探讨这些产品在生活中的应用,如肥皂制造、玻璃生产等。
第五步:环境和资源问题1. 讨论制碱工业对环境和资源的影响,如废水处理、资源耗竭等问题。
2. 引导学生思考如何减少制碱工业对环境和资源的影响,提出建议和解决方案。
第六步:总结1. 回顾本节课的主要内容,强调制碱工业的重要性和影响。
2. 鼓励学生积极思考,关注制碱工业的未来发展趋势和挑战。
教学反思:通过本节课的教学,学生能够全面了解制碱工业的原理、工艺流程、产品和应用,同时深入思考制碱工业对环境和资源的影响。
在教学过程中,可以加入实验、讨论和案例分析等方式,激发学生的兴趣和潜力,培养他们的创新和探究精神。
同时,引导学生树立环保意识和资源节约意识,促进他们积极参与社会建设和可持续发展。

重质纯碱蒸汽煅烧炉与轻质纯碱蒸汽煅烧炉的区别内容摘要:论述重质纯碱蒸汽煅烧炉与轻质纯碱蒸汽煅烧炉在结构和使用工艺上的不同。
关键词:重质纯碱、轻质纯碱、蒸汽煅烧炉、蒸汽消耗。
重质纯碱是由轻质纯碱在一定的温度条件下,与水发生水合反应生成一水碳酸钠,一水碳酸钠较无水碳酸钠相比,结晶密实光滑,结晶颗粒大而均匀。
加热后脱去结晶水,其晶体仍保持原有特性,堆密度约为轻质纯碱的二倍。
在玻璃、冶金及颜料等行业得到了广泛的应用。
且在包装和储运方面较轻质纯碱更加经济。
蒸汽煅烧炉是重质纯碱(一水碳酸钠)和轻质纯碱生产过程中的关键设备,它运转的好坏直接关系整个系统的产量和产品质量的高低。
重质纯碱和轻质纯碱由于二者生产过程和物理性质的不同,使用的设备也有所差异。
重质纯碱的煅烧过程主要是脱水过程,重质纯碱脱水所需的热量,远低于轻质纯碱煅烧中游离水的蒸发和碳酸氢钠分解所需的热量。
物料停留时间也要少一些。
所以重质纯碱蒸汽煅烧炉的炉体长度要短于轻质纯碱蒸汽煅烧炉,炉体转速高,安装倾角大。
且使用的蒸汽饱和压力为 1.3~1.6Mpa即可,其单位产量加热面积相应也要小得多。
由于重质纯碱(一水碳酸钠)的晶粒大、密度大,在筒体回转加热过程中,不可能像轻质纯碱(粉尘状)一样处于悬浮状态,而是紧贴筒壁在翅片管之间流动,对炉体的回转形成较大的阻力,所以重质纯碱蒸汽煅烧炉的传动功率远大于轻质纯碱蒸汽煅烧炉。
轻质纯碱煅烧时,由于碳酸氢钠受热分解产生大量的二氧化碳气体,在许多碱厂是要回收再利用的,要求炉气浓度不低于85%,这就对炉体内与外界的密封提出很高的要求。
重质纯碱煅烧时产生的炉气主要是水蒸气,偶有回收供水合利用,要求并不高。
这样炉子与外界相通处的密封要求也不及轻质纯碱炉子的严格。
另外重质纯碱的粉尘少,炉头无需设碱尘螺旋输送机。
从水合机出来的重质纯碱(一水碳酸钠)含有一定量的游离水,加上结晶水,其含水量与滤碱机中出来的轻质纯碱的湿重碱大致相当,大约在18%~23%之间。

煅烧岗位操作规程前言操作规程是企业内部使用的一种指导生产操作的规范性文件。
它是企业建立全面质量管理体系必不可少的技术文件之一。
对于企业加强内部管理,全面推行“质量兴企”战略具有重要意义。
由于操作规程是一个企业的内部标准,因而具有行业性、适宜性、持续改进的特点。
随着公司ISO9000—2008版质量管理体系换版工作的顺利完成,全面推行该体系势在必行。
本操作规程就是在这样的背景下产生的,公司总工程师办公室本着严谨科学、通俗易懂的原则,完成了这部操作规程的编写。
同时为了力求体现该规程的适宜性,在全面征求各生产作业区技术人员、操作人员和相关各部门建议的基础上修改了操作规程并定稿。
在此对他们的辛勤劳动表示由衷的感谢!目录1 范围 (4)2 目的 (4)3 岗位说明书 (4)4 规章制度 (6)5 生产原理 (6)6 工艺流程 (7)7 主要设备一览表 (9)8 工艺指标 (10)9 煅烧系统开停车程序 (11)10 正常操作控制程序 (16)11 不正常情况处理 (20)12 岗位相关计算 (22)13 岗位存在的主要危险因素辨识 (26)14 安全环保和职业卫生危害防护 (36)15 附图、附表 (40)16 参考读物 (41)17 安全操作规程 (42)煅烧岗位操作规程1 范围本规程是公司生产装置操作控制的技术标准,凡是关系到本岗位生产控制的操作与管理均遵从此办法。
适用于本岗位的操作人员以及公司各级相关的技术人员、管理人员。
2 目的为了使生产控制有章可循,操作标准科学、合理,标准执行严肃、认真,最大程度地使生产装置保持长周期、安全、稳定运行,达到低耗、清洁、优质、高产的目的,特制定本操作规程。
3 岗位说明书单位名称:纯碱作业区煅烧岗位编号:Q/GJH GZ.14~473~2009单位名称:纯碱作业区煅烧岗位编号:Q/GJH GZ.14~474~2009单位名称:纯碱作业区刮板机岗位编号:Q/GJH GZ.³³-³³³-20094 规章制度4.1 掌握的制度●现场管理规定 /GJH GL03²002—2008…………(03-9)●巡回检查管理规定 Q/GJH GL03²003—2008…………(03-12)●作业区班组基础管理规定 Q/GJH GL03²004—2008…………(03-14)●岗位基础建设管理规定 Q/GJH GL03²005—2008…………(03-29)●责任减量考核办法 Q/GJH GL06²002—2008…………(06-4)●安全核准制度 Q/GJH GL05²005—2008…………(05-23)●进入厂区安全管理规定 Q/GJH GL05²008—2008…………(05-32)4.2 了解的制度●违反公司规章制度的罚责规定 Q/GJH GL03²011—2008… (03-49)●安全生产责任制度 Q/GJH GL05²001—2008…………(05-1)●进入受限空间作业安全管理规定 Q/GJH GL05²020—2008…(05-77)●检修安全管理制度 Q/GJH GL05²009—2008…………(05-34)●压力容器安全管理制度 Q/GJH GL05²014—2008…………(05-59)●员工考勤管理制度 Q/GJH GL14²005—2008…………(14-22)●劳动合同管理制度 Q/GJH GL14²003—2008…………(14-12)5 生产原理5.1 主要物料性质重碱:氨母液Ⅱ在碳化塔内吸收二氧化碳,使其中的NaCL和NH3转化生成NaHCO3和NH4CL,并冷却使NaHCO3结晶析出,形成NaHCO3悬浮液。
重碱车间安全技术操作规程1、范围本标准规定了重碱车间各生产岗位的开停车、设备运行、工艺指标控制、异常情况处理和设备检修等操作的安全技术。
本标准适用于重碱车间各生产岗位。
2、碳化岗位2.1、工艺流程由吸收工序送来的氨盐水进入清洗塔上部第28圈,同时从塔底通入压缩工序送来的清洗气,气液在塔内逆流接触,进行清洗和预碳化作业,塔下出卤为中和水,由联络管直接引至中和水泵进口,打至制碱塔上部第27圈。
在制碱塔内,中和水与第一圈进入的由压缩送来的下段气和从第七圈进入的中段气逆流接触进行反应生成碳酸氢钠悬浮液,经塔中下部八个冷却水箱冷却后由塔下出碱管自压至五楼出碱槽,再由碱槽流至滤过工序进行固液分离。
清洗塔尾气和制碱塔尾气由塔顶逸出经碳化尾气总管进入碳化净氨塔下部,与由盐水车间送来的精盐水逆流接触,吸收其中的氨和CO2,吸收后的溶液称为淡氨盐水,经“U”型管自流入净氨塔下部的贮桶(淡氨盐水桶)内,净氨塔顶部出来的净氨尾气放空。
碳化尾气中所夹带的液体在尾气总管上利用一上“U”型在七楼进行气液化分离,分离后的液体称碳化回卤。
碳化回卤通过“U”型管进中和水泵入口。
未分离尽的碳化回卤在入碳化尾气净氨塔之前再次分离,回卤入淡氨盐水桶。
碳化冷却水分两部分。
一部分是由给排水冷冻水岗位送来,从第一节水箱进,从第三节水箱出,返回冷冻水岗位;另一部分是由给排车车间循环水岗位送来,从第四节水箱进,从第6节或8节水箱出,返回循环水岗位。
2.2、工艺指标2.2.1、温度a.氨盐水38~45℃b.中和水36~42℃c.出碱液25~34℃d.十七圈(中温)60~72℃e.二十三圈45~60℃f.五圈≥35℃g.碳化尾气≤50℃h. 清洗、中段气35~45℃I.下段气≤46℃2.2.2、压力a.下段气总管0.294~0.353Mpab.中段气总管0.26~0.29MPac.清洗气总管0.314~0.353Mpad.尾气总管0.05~0.07MPae. 制碱塔压0.28~0.32MPaf. 清洗塔压0.26~0.30MPag. 氨盐水总管≤0.30MPah. 中和水总管≤0.40MPa2.2.3、浓度a.下段气CO2 ≥80%b.中段气、清洗气CO2≥37%50~65ttc.中和水CO2d.中和水Fe3+15mg/L≤0.008tte.冷却水含NH3f.淡氨盐水含NH≤20tt3≤0.2%h.碳化净氨尾气含NH32.2.4、质量a.碳化出碱液转化率冬季≥75%夏季≥73%b.结晶沉降时间≤200s2.3、安全操作规程2.3.1、接班前,必须穿戴好劳动保护用品。
重碱煅烧操作规程重碱煅烧是一种重要的工业化学工艺,常用于提取重碳酸钠、重碳酸锂等化学物质。
为确保操作的安全性和有效性,需要遵守以下操作规程:一、安全准备1. 组织操作人员参加相关安全培训,熟悉煅烧操作规程和应急处理措施。
2. 使用合适的个人防护装备,如防护服、防护手套、防护眼镜等。
3. 检查设备及仪器仪表的运行状态,确保其正常工作。
4. 确保操作场所通风良好,避免有毒气体积聚。
二、操作步骤1. 确定煅烧设备的工作温度范围,合理设定煅烧温度。
2. 将待煅烧的化学物质均匀分布在煅烧设备中,避免堆积过高导致温度不均匀。
3. 开始加热煅烧设备,逐渐将温度升高至设定温度,保持一段时间以实现化学物质的煅烧反应。
4. 监测煅烧设备内部的温度变化,并及时校正温度控制系统的设定值。
5. 根据煅烧反应的需要,控制煅烧设备的通风量和气氛组成,以确保反应的进行和产物的质量。
6. 煅烧结束后,将设备冷却至环境温度,将产物取出并进行必要的后续处理。
三、注意事项1. 慎用高温煅烧,避免产生有害气体的形成和爆炸危险。
2. 不得擅自调整煅烧设备的温度和通风量,避免操作失误导致事故发生。
3. 遵循配套操作手册中的操作参数和操作限度,避免设备超负荷运行或操作不当导致事故。
4. 定期检查煅烧设备的维护保养情况,发现问题及时修理或更换设备。
5. 遵循化学物质的存放和处理规程,避免溶解液溅洒、反应物泄漏等情况的发生。
6. 存储和处理煅烧设备和产物时,要防止火源接触和物理伤害,确保操作人员的安全。
7. 遵守环境保护要求,妥善处理废弃物和产生的有害气体,以减少对环境的影响。
四、应急处理1. 发生事故时,立即停止煅烧设备的运行,并确保操作人员的安全。
2. 如有火灾,使用合适的灭火器材尽快扑灭火源,并报告相关部门和调动消防人员。
3. 如有人员中毒、烫伤等伤害事件发生,立即启动应急救援措施,并及时送往医院进行治疗。
4. 事故发生后,及时进行事故调查和事故处理,总结经验教训,修正操作规程。
海西州职业技术学校示范校建设项目化工专业“模块化”教学教案科目名称:无机物工艺班级:13秋化学工艺任课教师:王秉程课程介绍海西职校化工专业教案课题:项目二纯碱的生产海西职校化工专业教案课题:项目二纯碱的生产计说明教学场景设计:随机分为5小组教学资源:多媒体教师活动教学内容备注【板书】【回顾】【提问】【举例】【强调】【幻灯片显示】【讲述】【动画放映】【总结】【说明】【思考】【导入】【证明】(以上选项可依据需要自行选择或增减)【板书】饱和盐水的精制【回顾】上节课认识了纯碱生产,一共分为六个步骤,也学习了生产纯碱的四种原料请同学们回顾。
这节课就第一步骤进行详细的讲解,板书【提问】盐水精制的目的何在?怎样达到精制的目的?【举例】自来水是怎样制成的,为什么要用自来水。
一般是把易溶的反应成不溶解的物质,可以达到除去杂质的目的。
【强调】化工管路中如果钙镁含量过高将导致管子结垢,并且如果含有大量的泥沙会降低纯碱的品质,再者会产生不必要的附属产品,这三点是我们不希望看到的。
也就是精制的目的。
石灰-纯碱法(俗称苛化法)用石灰除去盐中的反应如下【灯片显示】主要设备的原理及结构图【讲述】主要设备有,化盐桶、反应罐、澄清桶、精盐水灌、洗泥桶。
原理、结构及作用。
讲解工艺流程图及控制条件。
(含学生活动介绍)石灰乳:CaO140~160tt,石灰工段提供。
1、盐水工段(1)精盐水TCl- ≥105tt(2)精盐水浊度≤40ppm(3)精盐水Mg++ ≤0.015tt(4)精盐水Ca++ ≤0.02tt(5)废泥氯差≤5.0tt(6)精盐水温度≤42℃盐水工段应注意的问题有,为了满足原盐的溶解和盐泥的沉降速度,化盐用水一般保持在42-45℃。
另外在除钙、镁反应过程中,为了确保Mg(OH)2和CaCO3的沉降,海西职校化工专业教案课题:任务二石灰石的煅烧及灰乳的制备\海西职校化工专业教案课题:任务三认识流体输送机械设计说明教学方法:实践教学法、讨论法、归纳法。