2018高中化学每日一题热化学方程式的书写与正误判断
- 格式:doc
- 大小:86.50 KB
- 文档页数:4

引言概述:热化学方程式是描述化学反应中能量变化的重要工具。
在化学反应中,热量可以被吸收或释放,这可以通过热化学方程式来表示。
本文将介绍关于热化学方程式的书写及注意事项的继续部分。
正文内容:I. 热化学方程式的书写规则1. 方程式的表达形式a. 保留反应物和产物的化学式,以及相应的系数b. 在方程式上方标注温度和压力条件c. 用箭头表示反应的方向,左边为反应物,右边为产物2. 能量变化的表示a. 用△H表示反应的焓变b. 当反应吸热时,△H为正值;反之,△H为负值c. 可以通过△H的数值大小来判断反应的放热性质II. 热化学方程式的计算方法1. 简化的热化学方程式计算a. 根据反应物和产物的化学式,通过查找标准摩尔焓计算△Hb. 使用热化学方程式计算反应的△H值a. 对于复杂的化学反应,需要将其分解为一系列简化的反应b. 对每个简化的反应计算△H值,并根据反应的系数进行调整c. 将所有简化反应的△H值相加,得到整个反应的△H值III. 热化学方程式中的注意事项1. 化学平衡和热平衡的关系a. 化学反应在达到平衡时,热量变化趋近于零b. 热平衡可以通过热化学方程式中的△H值来判断2. 热化学方程式的温度依赖性a. △H值通常是在标准温度下给出的,所以在不同温度下需要进行修正b. 热化学方程式的△H值随温度的变化而变化,需要使用热力学公式进行修正3. 热化学方程式的实验测定a. 实验方法可以通过测量温度变化或物质的热容来确定△H值b. 实验中需控制好反应的温度和压力条件,以减小误差a. 在热化学方程式中,需要明确指定物质的状态(气态、液态、固态)b. 不同状态的物质的△H值也不同,因此需要注意IV. 热化学方程式的应用与解读1. 利用热化学方程式计算反应的放热性质a. 根据△H的数值大小,可判断反应是放热还是吸热反应b. 利用△H进行反应的能量计算,如计算反应的焓变、生成焓等2. 热化学方程式在燃烧反应中的应用a. 燃烧反应是一种常见的放热反应,可以用热化学方程式进行描述b. 通过热化学方程式计算燃烧反应的能量释放量,评估燃料的热值3. 热化学方程式在工业生产中的应用a. 利用热化学方程式计算反应的能量变化,可用于优化工业生产过程b. 通过热化学方程式可以预测反应的热效应,指导工业生产中的能量管理热化学方程式是研究化学反应能量变化的重要工具。

热化学方程式的书写及反应热的计算考点1 热化学方程式的书写(1)概念:表示参加反应的物质的量和反应热关系的化学方程式。
(2)意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
(3)书写步骤【针对训练1】1.101 kPa时,1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,反应的热化学方程式为_______________________________________________________________________。
2.0.3 mol的气态乙硼烷(分子式B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为。
3.在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为_________________________________ _______________________________________ 。
4.下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_____________________________________。
考点2 反应热计算的四种方法★★★★方法一利用盖斯定律计算反应热并书写热化学反应方程式盖斯定律:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都一样。
即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
利用盖斯定律计算反应热(ΔH)的解题流程【针对训练2】1.【2018年全国卷Ⅰ】已知:2N 2O 5(g)===2N 2O 4(g)+O 2(g) ΔH 1=-4.4 kJ·mol -12NO 2(g)===N 2O 4(g) ΔH 2=-55.3 kJ·mol -1则反应N 2O 5(g)===2NO 2(g)+12O 2(g)的ΔH = kJ·mol -1。
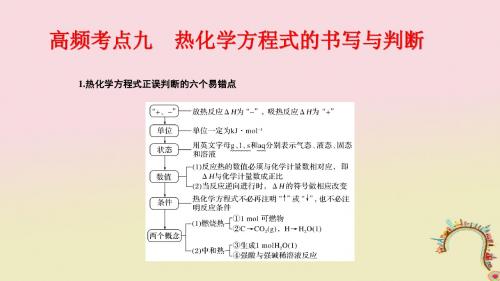

考点二 热化学方程式书写及正误判断1 热化学方程式的定义表示参加反应的物质的物质的量和反应热关系的化学方程式。
2 热化学方程式的意义不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
3 热化学方程式的书写(1)注明反应条件:反应热与测定条件(温度、压强等)有关。
绝大多数反应是在25 ℃、101 kPa 下进行的,可不注明。
(2)注明物质状态:常用s 、l 、g 、aq 分别表示固体、液体、气体、溶液。
(3)注意符号单位:ΔH 应包括“+”或“-”、数字和单位(kJ·mol -1)。
(4)注意守恒关系:①原子守恒和得失电子守恒;②能量守恒。
(ΔH 与化学计量数相对应)(5)区别于普通方程式:一般不注“↑”“↓”以及“点燃”“加热”等反应条件。
学霸巧学卡 对热化学方程式的深度理解(1)热化学方程式中各物质化学式前的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。
且化学计量数必须与ΔH 相对应,若化学计量数加倍,则ΔH 也要加倍。
(2)正反应与逆反应的反应热数值相等,符号相反。
(3)不管化学反应是可逆反应还是不可逆反应,热化学方程式中的热效应都是指物质按化学方程式完全反应时的热效应。
如2SO 2(g)+O 23(g) ΔH =-197 kJ·mol-1表示的意义为2 mol SO 2(g)和1 mol O 2(g)完全转化成2 mol SO 3(g)时放出197 kJ 的热量。
(4)对于同素异形体,除注明聚集状态外,还要注明名称。
因为同素异形体虽然构成元素相同,但属于不同物质,其本身具有的能量不同,所以反应中的ΔH 也不同。
1.思维辨析(1)CaCO 3(s)===CaO +CO 2(g) ΔH =+177.7 kJ( ) (2)C(s)+H 2O(s)===CO(g)+H 2(g)ΔH =-131.3kJ·mol -1( )(3)C(s)+12O 2(g)===CO(g) ΔH =-110.5kJ·mol -1( )(4)CO(g) +12O 2(g)===CO 2 (g)ΔH =-283 kJ·mol -1( )(5)2H 2(g)+O 2(g)===2H 2O(l)ΔH =-571.6 kJ·mol -1( )(6)500 ℃、30 MPa 下,将0.5 mol N 2(g)和1.5 mol H 2(g)置于密闭容器中充分反应生成NH 3(g),放热19.3 kJ ,其热化学方程式为:N 2(g)+3H 2(g)催化剂500 ℃、30 MPa 2NH 3(g) ΔH =-38.6 kJ·mol -1( )答案 (1)× (2)× (3)√ (4)√ (5)√ (6)×2.化学反应X 2+3Y 2===2XY 3的能量变化如图所示,该反应的热化学方程式是( )A .X 2(g)+3Y 2(g)===2XY 3(l) ΔH =2(a -b -c )kJ/molB .X 2(g)+3Y 2(g)===2XY 3(g) ΔH =2(b -a )kJ/mol C.12X 2(g)+32Y 2(g)===XY 3(l) ΔH =(b +c -a )kJ/mol D.12X 2(g)+32Y 2(g)===XY 3(g) ΔH =(a +b )kJ/mol 答案 A解析 从题图可以看出,12 mol X 2(g)和32 mol Y 2(g)断键生成1 mol X 和3 mol Y 吸收的能量为a kJ ,同时,1 mol X 和3 mol Y 形成新键生成1 mol XY 3(g)或1 mol XY 3(l)所放出的能量分别为b kJ 、(b +c ) kJ ,故12 mol X 2(g)和32 mol Y 2(g)生成1 mol XY 3(g)或1 molXY 3(l)所放出的热量分别为(b -a ) kJ 、(b +c -a ) kJ ,故对应的ΔH 分别为(a -b ) kJ/mol 、(a -b -c ) kJ/mol ,综上故选A 。

热点十 正确书写热化学方程式【必备知识规律总结】一、热化学方程式正误判断——“三查”1.检查是否标明聚集状态:固(s )、液(l )、气(g )2.检查△H 的“+”“-”是否与吸热、放热一致。
(注意△H 的“+”与“-”,放热反应为“-”,吸热反应为“+”)3.检查△H 的数值是否与反应物或生成物的物质的量相匹配(成比例)注意:⑴要注明反应温度和压强,若反应在298K 和1.013×105Pa 条件下进行,可不予注明;⑵要注明反应物和生成物的聚集状态,常用s 、l 、g 分别表示固体、液体和气体;⑶△H 与化学计量系数有关,注意不要弄错。
方程式与△H 应用分号隔开,一定要写明“+”、“-”数值和单位。
计量系数以“mol ”为单位,可以是小数或分数。
⑷一定要区别比较“反应热”、“中和热”、“燃烧热”等概念的异同。
针对性练习1.在下列各说法中,正确的是。
( B )A .△H > 0 kJ ·mol -1表示放热反应,△H < 0 kJ ·mol -1表示吸热反应B .热化学方程式中的化学计量数表示物质的量,可以是分数C .1 mol H 2SO 4与1 mol Ba(OH)2反应生成BaSO 4沉淀时放出的热叫做中和热D .1 mol H 2与0.5 molO 2反应放出的热就是H 2的燃烧热2.已知: )()(2)(2)(2224g CO l O H g O g CH ++,13.890-⋅=∆mol kJ H )()(2)(2222g O g H l O H +,16.517-⋅-=∆mol kJ H ,则等质量的氢气和甲烷分别燃烧后,放出的热量之比约是( C )A .1:3.4B .1:1.7C .2.3:1D .4.6:13.实验室用4mol SO 2与2mol O 2进行下列反应: 2SO 2(g)+O 2(g) 2SO 3(g);ΔH=―196.64KJ/mol ,当放出314.624KJ 热量时,SO 2的转化率为 ( A )A .40%B .50%C .80%D .90%4.已知在25℃、101kPa 下,1gC 8H 18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。

热化学方程式的书写与正误判断高考频度:★★★★☆ 难易程度:★★★☆☆典例在线下列对H 2(g)+Cl 2(g)===2HCl(g) ΔH (298 K)=-184.6 kJ·mol -1的叙述最完整的是A .1分子H 2和Cl 2反应,放出热量184.6 kJB .1 mol H 2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJC .在101 kPa 、25 ℃的条件下,1 mol H 2(g)和1 mol Cl 2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJD .在101 kPa 、25 ℃的条件下,1 mol H 2(g)和1 mol Cl 2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ 参考答案】C【试题解析】反应方程式中ΔH 的值与具体化学反应相对应,在反应中各物质前的化学计量数不再表示粒子数目,只表示物质的“物质的量”,A 错误;在描述反应时应说明外界条件,而B 中没有温度和压强,B 错误;ΔH <0时,反应放热而非吸热,D 错误。
解题必备1.氢气与碘蒸气化合反应的能量(或热量)变化,可用下式表示:H 2(g)+I 2(g)200101kPa ℃2HI(g)ΔH = −14.9 kJ·mol −1,它与化学方程式H 2+I22HI 相比较而言,其特点为(1)指明了反应时的温度和压强:若在25 ℃、101 kPa 时进行的反应,可以不注明。
(2)用括号注明了各物质反应时的状态:s(固体)、l(液体)、g(气体)、aq(溶液)。
(3)在方程式的右边注明了ΔH 的数值、正负号及单位。
2.热化学方程式的概念及意义(1)热化学方程式是表示参加反应物质的量和反应热的关系的化学方程式。
(2)热化学方程式的意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化,还说明了物质的量与能量之间的数量关系。
考点二热化学方程式的书写【考点定位】本考点考查热化学方程式的书写,理解热化学方程式所表达的意义,学会书写热化学方程式,明确书写要点及注意事项。
【精确解读】1.定义:表明反应放出或吸收的热量的化学方程式叫做热化学方程式;2.意义:热化学方程式不仅表示了化学反应中的物质变化,也表明了化学反应中的能量变化;3.热化学方程式的书写①要注明温度、压强,但中学化学中所用的△H数据一般都是25℃、101kPa下的数据,因此可不特别注明.②必须注明△H的“+”与“—”.“+”表示吸收热量,“—”表示放出热量.③要注明反应物和生成物的聚集状态.g表示气体,l表示液体,s 表示固体,热化学方程式中不用气体符号或沉淀符号.④热化学方程式各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数.因此热化学方程式中化学计量数可以是整数也可以是分数.⑤热化学方程式的数值与化学计量数有关,对于相同的物质反应,当化学计量数不同,其△H也不同.当化学计量数加倍时,△H也加倍.当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反.⑥对于化学式形式相同的同素异形体,还必须在化学是后面标明其名称.如C(s,石墨)⑦可逆反应的反应热指的是反应物完全反应后放出或吸收的热量,不是达到平衡时的.【精细剖析】1.对于热化学方程式的书写和正误判断均结合热化学方程式和普通化学方程式的区别进行分析,区别可以归纳为:①热化学方程式包含物质变化和能量变化,普通化学方程式只有物质变化;②热化学方程式需标明反应的温度和压强.对于25℃,101kPa时进行的反应可不注明.普通化学方程式不需要;③热化学方程式需要标明各物质的状态;④热化学方程式的化学计量数可以是整数或分数,普通化学方程式只能为整数。
【典例剖析】根据热化学方程式S(l)+O2(g)═SO2(g)△H=-293。
23kJmol-1,分析下列说法中正确的是()A.1mol固体S单质燃烧放出的热量大于293.23 kJB.1mol气体S单质燃烧放出的热量小于293.23 kJC.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和【答案】C【变式训练】铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景.实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ 热量,则下列有关该反应的热化学方程式书写正确的是() A.2FeCO3(s)+O2(g)=Fe2O3(s)+2CO2(g) △H=-130 KJ/mol B.4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol C.4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260 KJ/mol D.4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=+130 KJ/mol 【答案】C【解析】每生成160g固体铁红的物质的量为:160g=1mol,放出130kJ160g/mol热量,所以生成2mol氧化铁放出的热量为260KJ,所以热化方程式为:4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol,故答案为C。
考点二热化学方程式的书写与正误判断[题组训练·考能]题组一热化学方程式的正误判断型1.下列热化学方程式书写正确的是()。
A.2SO2+O2V2O5500 ℃2SO3ΔH=-kJ·mol-1B.H2(g)+12O2(g)===H2O(l)ΔH=-kJ·mol-1C.2H2(g)+O2(g)===2H2O(l)ΔH=-kJD.C(s)+O2(g)===CO2(g)ΔH=+kJ·mol-1解析选项A中的热化学方程式未注明物质的状态;选项C中ΔH的单位错误;选项D是放热反映,ΔH应小于0。
答案 B2.(2014·吉林六校联考)化学反映N2+3H2高温、高压催化剂2NH3的能量转变如图所示,该反映的热化学方程式是()。
A.N2(g)+3H2(g)2NH3(l)ΔH=2(a-b-c)kJ·mol-1B.N2(g)+3H2(g)2NH3(g)ΔH=2(b-a)kJ·mol-1N2(g)+32H2(g)NH3(l)ΔH=(b+c-a)kJ·mol-1N2(g)+32H2(g)NH3(g)ΔH=(a+b)kJ·mol-1解析通过图分析可知,由12mol N2(g)+32mol H2(g)到生成到1 mol NH3(l)的三阶段为:①吸收能量a kJ;②放出能量b kJ;③放出能量c kJ,故可得热化学方程式:12N2(g)+32H2(g)NH3(l)ΔH=(a-b-c)kJ·mol-1,扩大化学计量数后取得A。
答案 A3.(2013·宝鸡二检)燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。
下列说法正确的是()。
A.通常状况下,1 g氢气燃烧生成液态水时放出kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l)ΔH=-kJ·mol-1B.已知:H2(g)+F2(g)===2HF(g)ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol 氟气反映生成2 mol液态氟化氢放出的热量小于270 kJC.500 ℃、30 MPa下,将mol N2和mol H2置于密闭的容器中充分反映生成NH3(g),放热kJ,其热化学方程式为N2(g)+3H2(g)催化剂高温、高压2NH3(g)ΔH=-kJ·mol-1D.已知:①C(s,石墨)+O2(g)===CO2(g)ΔH=-kJ·mol-1②C(s,金刚石)+O2(g)===CO2(g)ΔH=-kJ·mol-1,则C(s,金刚石)===C(s,石墨)ΔH =-kJ·mol-1解析表示氢气燃烧热的热化学方程式中H2(g)的化学计量数应为1,A错;气体变成液体时要放出能量,所以1 mol氢气与1 mol氟气反映生成2 mol 液态氟化氢放出的热量大于270 kJ,B错;此反映为可逆反映,故投入mol 的氮气和mol氢气,最终参加反映的氮气必然小于mol,因此1 mol N2完全反映放出的热量应大于kJ,则热化学方程式中ΔH应小于-kJ·mol-1,不是通常状况时ΔH应标明确所处状况,选项C不正确;D中由②-①可知正确。
热化学方程式的书写热化学方程式是描述化学反应中热能变化的方程式。
在化学反应中,化学键的形成和断裂会伴随着能量的吸收或释放。
热化学方程式通过表示反应的能量变化,可以帮助我们了解反应的热力学特性。
热化学方程式通常以一个标准形式表示,其中包括反应物、生成物和热能变化。
反应物写在方程式的左边,生成物写在方程式的右边,热能变化写在方程式的顶部或底部,用ΔH表示。
热能变化可以表示为吸热反应(ΔH>0)或放热反应(ΔH<0)。
为了更清晰地理解热化学方程式的书写,我们可以以一个实际的化学反应为例进行解释。
例如,我们可以考虑乙烯燃烧的反应:C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g) + 热能在这个反应中,乙烯(C2H4)和氧气(O2)是反应物,二氧化碳(CO2)和水(H2O)是生成物。
热能的变化可以通过实验测量得到。
如果实验表明该反应是放热反应,我们可以将热能变化表示为一个负值,例如-100 kJ/mol。
因此,乙烯燃烧的热化学方程式可以写成:C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g) + (-100 kJ/mol)这个热化学方程式告诉我们,每摩尔的乙烯燃烧会释放100千焦的热能。
热化学方程式的书写对于研究化学反应的热力学性质非常重要。
通过测量反应的热能变化,我们可以了解反应的放热或吸热性质,并计算出反应的热力学参数,如焓变(ΔH)。
热化学方程式还可以帮助我们预测反应的方向和速率。
在实际应用中,热化学方程式常用于计算化学反应的热平衡常数。
热平衡常数描述了反应在特定温度下达到平衡时反应物和生成物的浓度之比。
通过热化学方程式中的热能变化和热平衡常数,可以计算出反应的标准焓变(ΔH°),从而进一步了解反应的热力学性质。
热化学方程式是描述化学反应中热能变化的方程式。
通过书写热化学方程式,我们可以清晰地表示反应的热能变化,并进一步研究反应的热力学特性。
2017-2018学年高中化学每日一题热化学方程式的书写与判断新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学每日一题热化学方程式的书写与判断新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学每日一题热化学方程式的书写与判断新人教版的全部内容。
热化学方程式的书写与判断高考频度:★★★★☆难易程度:★★★☆☆典例在线铍是一种高效率的火箭燃料,燃烧时放出巨大的能量,每千克铍完全燃烧放出的热量为62 700 kJ。
则铍燃烧的热化学方程式正确的是A.Be+12O2BeO ΔH=-564。
3kJ·mol-1B.Be(s)+12O2(g)BeO(s) ΔH=+564。
3 k J·mol-1C.Be(s)+12O2(g)BeO(s)ΔH=—564。
3kJ·mol—1D.Be(s)+12O2(g)BeO(s)ΔH=-564.3 kJ【参考答案】C【试题解析】根据题意,1 mol Be完全燃烧放出的热量为62 700 kJ÷(1 000÷9) mol=564。
3 kJ·mol-1。
根据热化学方程式的书写规则可知,必须注明反应物和生成物的状态,A 错误;反应为放热反应,ΔH〈0,B错误;ΔH的单位常用“kJ·mol—1”或kJ/mol,D错误。
【备注】掌握热化学方程式书写中的易错点,明确命题者的命题意图,有利于同学们快速、准确地判断热化学方程式的正误.热化学方程式正误判断中常见的错误:(1)漏写物质的状态;(2)忽视反应热ΔH的正、负号;(3)错写或漏写ΔH的单位;(4)化学计量数与ΔH不匹配。
热化学方程式的书写与正误判断
高考频度:★★★★☆ 难易程度:★★★☆☆
典例在线
下列对H 2(g)+Cl 2(g)===2HCl(g) ΔH (298 K)=-184.6 kJ·mol -1
的叙述最完整的是
A .1分子H 2和Cl 2反应,放出热量184.6 kJ
B .1 mol H 2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ
C .在101 kPa 、25 ℃的条件下,1 mol H 2(g)和1 mol Cl 2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ
D .在101 kPa 、25 ℃的条件下,1 mol H 2(g)和1 mol Cl 2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ 参考答案】C
【试题解析】反应方程式中ΔH 的值与具体化学反应相对应,在反应中各物质前的化学计量数不再表示粒子数目,只表示物质的“物质的量”,A 错误;在描述反应时应说明外界条件,而B 中没有温度和压强,B 错误;ΔH <0时,反应放热而非吸热,D 错误。
解题必备
1.氢气与碘蒸气化合反应的能量(或热量)变化,可用下式表示:H 2(g)+I 2(g)
200101k P a ℃
2HI(g)
ΔH = −14.9 kJ·mol −1,它与化学方程式H 2+I
22HI 相比较而言,其特点为
(1)指明了反应时的温度和压强:若在25 ℃、101 kPa 时进行的反应,可以不注明。
(2)用括号注明了各物质反应时的状态:s(固体)、l(液体)、g(气体)、aq(溶液)。
(3)在方程式的右边注明了ΔH 的数值、正负号及单位。
2.热化学方程式的概念及意义
(1)热化学方程式是表示参加反应物质的量和反应热的关系的化学方程式。
(2)热化学方程式的意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化,还说明了物质的量与能量之间的数量关系。
例如:
H 2(g)+1
2O 2(g)===H 2O(l) ΔH =-285.8 kJ·mol -1
表示的意义是在25 ℃、101 kPa 下,
1
1 mol气态H2与
mol气态O2反应生成1 mol液态水时,放出的热量是285.8 kJ。
2
3.热化学方程式的书写方法要求
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)在方程式右端注明热量的变化:吸热反应,ΔH>0;放热反应,ΔH<0。
(3)要注明反应物和生成物的聚集状态。
(4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。
(5)化学计量数改变,ΔH要相应改变;逆反应的ΔH数值与正反应的相等、符号相反。
学霸推荐
1.热化学方程式C(s)+H2O(g)=== CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
2.下列热化学方程式或叙述正确的是
A.1 mol液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ热量:N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ热量:2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ·mol-1
1
O2(g)===H2O(l) ΔH=-286 kJ·mol-1,则2H2O(l)===2H2(g)+O2(g) C.已知:H2(g)+
2
ΔH=+572 kJ·mol−1
D.已知:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
3.下列热化学方程式书写正确的是
A.2SO2+O22SO3ΔH=-196.6 kJ·mol-1
1
B.H2(g)+
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
2
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=== CO2(g) ΔH=+393.5 kJ·mol-1
4.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。
已知H—H、H—O和O=O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,下列热化学方程式正确的是
1
O2(g) ΔH=-485 kJ·mol-1
A.H2O(g)===H2(g)+
2
1
B.H2O(g)===H2(g)+
O2(g) ΔH=+485 kJ·mol-1
2
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
答案
1.【答案】C
【解析】依据反应热的概念,反应热表示按照热化学方程式中化学计量数的物质的量反应时,吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示:1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,并吸收131.3 kJ的热量。
特别要指明各物质的状态。
2.【答案】C
3.【答案】B
【解析】A项中反应物和生成物都未标明聚集状态;C项中ΔH的单位不正确;D项中为放热反应,ΔH符号应为“-”。
4.【答案】D
【解析】根据题中所给数据,可以计算出2 mol H2和1 mol O2完全反应生成2 mol H2O(g)产生的焓变是436 kJ·mol-1×2+495 kJ·mol-1-463 kJ·mol-1×4=-485 kJ·mol-1,所以该过程的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1,D正确。
海鲜水果同吃会腹痛
鱼、虾、蟹等海产品中含有丰富的蛋白质和钙等营养素,而水果中含有较多的鞣酸,如果吃完海产品后,马上吃水果,不但影响人体对蛋白质的吸收,而且海鲜中的钙离子还会与水果中的鞣酸相结合,形成难溶的钙的化合物,会对胃肠道产生刺激,甚至引起腹痛、恶心、呕吐等。
因此吃完海产品后,最好间隔2小时以上再吃水果。